Скорость кристаллизации металла зависит от
Обновлено: 05.07.2024
Цель занятия: изучить механизм и кинетику процесса кристаллизации; макроструктуру металлических слитков; влияние условий кристаллизации на структуру и механические свойства металла.
сформировать компетенции ПК1.2-1.3
Время на выполнение работы: 2ч
Оборудование, технические средства и инструменты:
1. Журнал для практических работ;
2. Компьютер для подключения к сети Интернет;
3. Мультимедийная доска;
4. Альбом микроструктур;
5. Презентация по теме.
Ход практического занятия:
1. Ознакомиться с основными сведениями по теме работы.
2. Изучить и зарисовать микроструктуру чугунов.
3. Указать на рисунке фазы, объяснить их образование.
4. Оформить отчет по работе.
Кристаллизация – это процесс перехода вещества из жидкого состояния в твердое, кристаллическое. В расплавленном металле нет дальнего порядка: расстояния между атомами не являются постоянными, объемы с упорядоченным расположением атомов то возникают, то снова исчезают (рис. 1, а). В процессе кристаллизации устанавливается дальний порядок: атомы располагаются на определенных расстояниях по каждому пространственному направлению, образуя кристаллическую решетку (рис. 1, б). Такое упорядоченное расположение возникает за счет равновесия сил притяжения и отталкивания между атомами и соответствует минимуму энергии взаимодействия атомов в металле.
Рисунок 1 - Расположение атомов в жидком (а) и твердом (б) металле
Процесс кристаллизации может идти самопроизвольно, а может вызываться какими-то искусственными причинами.
Самопроизвольно идут только те термодинамические процессы, которые приводят к уменьшению свободной энергии системы. (Свободная энергия F – это изменяемая часть полной энергии системы.) С повышением температуры металла его свободная энергия как в жидком, так и в твердом состоянии снижается, но с разной скоростью: свободная энергия жидкого металла снижается быстрее (рис. 2). Поэтому кривые зависимости свободной энергии от температуры пересекаются при какой-то температуре TS . При любой температуре ниже TS меньшим уровнем свободной энергии обладает твердый металл, поэтому, если охладить расплав до температуры T 1 TS , начнется кристаллизация. И наоборот, при температурах выше TS устойчиво жидкое состояние, поскольку жидкий металл имеет меньший уровень свободной энергии. Значит, нагрев до T 2 > TS приведет к плавлению.
Рисунок 2- Зависимости свободной энергии металла от температуры
Температура TS , при которой свободная энергия металла в твердом и жидком состоянии одинакова, называется теоретической температурой кристаллизации. При этой температуре жидкость и кристаллы находятся в равновесии, ни плавление, ни кристаллизация до конца не идут.
Чтобы кристаллизация осуществилась, необходимо некоторое переохлаждение относительно теоретической температурой кристаллизации. В таком случае образование кристаллов дает выигрыш в свободной энергии, что и является стимулом процесса. Поэтому на самом деле кристаллизация всегда происходит при температуре ниже TS . Реальная температура кристаллизации T Р всегда меньше теоретической. Разность между теоретической и реальной температурой кристаллизации называется степенью переохлаждения Δ T :
Δ T = TS – T Р .
Измеряя температуру металла в процессе кристаллизации, можно получить кривую охлаждения (рис. 3). Это график в координатах «температура – время». На этой кривой имеется горизонтальный участок, соответствующий переходу металла из жидкого состояния в твердое. Постоянная температура на этом участке поддерживается за счет выделения скрытой теплоты кристаллизации.
Рисунок 3 - Кривая охлаждения расплавленного металла
Степень переохлаждения при кристаллизации не является постоянной величиной. Она увеличивается с увеличением скорости охлаждения металла. В реальных заводских условиях изготовления отливок степень переохлаждения обычно не превышает 20–30 ° , но для очень чистых металлов может достигать нескольких сотен градусов.
Механизм процесса кристаллизации можно представить в виде двух элементарных процессов:
1) Образование в жидкости центров кристаллизации (зародышей, мельчайших твердых частиц).
2) Рост кристаллов из образовавшихся зародышей.
Скорости этих элементарных процессов зависят от степени переохлаждения Δ T или скорости охлаждения металла V. Эта зависимость показана на рис. 4.
Как уже говорилось, в большинстве случаев процессы кристаллизации металла на металлургических заводах, в литейных цехах происходят при сравнительно небольших степенях переохлаждения (левая часть графика на рис. 4).Из приведенной на рис. 4 зависимости видно, что при малых скоростях охлаждения и малых степенях переохлаждения (например, Δ T 1 и V1) получается небольшая скорость образования зародышей (с.з.1). Следовательно, в кристаллизующейся жидкости образуется небольшое число центров кристаллизации и из них вырастает небольшое число кристаллов, что приводит к появлению крупнозернистой структуры после затвердевания металла. Схематически это показано на рис. 5.
Рисунок 4 - Зависимость скорости процесса кристаллизации от степени переохлаждения
Рисунок 5 - Кристаллизация при медленном охлаждении:
а – начало процесса; б – окончание процесса
Если же кристаллизация происходит при больших скоростях охлаждения и больших степенях переохлаждения (Δ T 2 , V2), то в жидкости образуется большое количество центров кристаллизации (с.з.2) и из них, соответственно, вырастает большое число кристаллов. Металл при этом получается мелкозернистый (рис. 6).
Рисунок 6 - Кристаллизация при быстром охлаждении:
Столкновение растущих кристаллов приводит к потере ими правильной огранки. Такие потерявшие правильную форму кристаллы называются зернами.
При очень маленькой скорости охлаждения (крайняя левая точка на
рис. 4) может возникнуть один-единственный центр кристаллизации, из которого вырастет один кристалл (монокристалл). Необходимые в электронике монокристаллы полупроводников выращивают путем очень медленного вытягивания затравки из расплава.
При огромных скоростях охлаждения (крайняя правая точка на рис. 4) достигаются такие большие степени переохлаждения, что тепловое движение атомов в металле замедляется, атомы не успевают образовать дальний порядок, выстроиться в кристаллическую решетку. Жидкое, неупорядоченное состояние металла оказывается как бы «замороженным». Металл становится твердым, но не имеет кристаллического строения. Это аморфный металл или металлическое стекло. Аморфные металлы широко применяются в современной аудиотехнике благодаря уникальным магнитным свойствам.
Поскольку структура металла определяет его свойства, рассмотренные закономерности кристаллизации могут быть использованы для формирования необходимых свойств металла при отливке деталей.
Мелкозернистый металл обладает более высоким сопротивлением деформации и большей вязкостью. Дело в том, что границы зерен являются барьером для развития деформации и для роста трещины. В мелкозернистом металле суммарная поверхность зерен в единице объема больше, чем в крупнозернистом. Поэтому и сопротивление мелкозернистого металла деформированию и разрушению больше. Чтобы разрушить металл с мелким зерном требуется затратить больше энергии.
Поэтому при отливке деталей, испытывающих значительные нагрузки при эксплуатации, целесообразно проводить процесс кристаллизации при высокой скорости охлаждения, чтобы получить мелкозернистую структуру. Если необходимую скорость кристаллизации обеспечить не удается (в отливках большой массы), то для измельчения зерна в жидкий металл вводят небольшие добавки примесей в виде мелких нерастворимых в расплаве частиц, увеличивая тем самым число центров кристаллизации. Такой процесс называется модифицированием, а вводимые добавки – модификаторами.
В качестве модификаторов обычно применяются мелкие частицы карбидов, оксидов (Сr7С3, VC, ТiC, Al2О3 и др.) и некоторые вещества, облегчающие образование зародышей в жидкости (В, Mg и др.). Измельчению зерна способствует также вибрация кристаллизующегося металла.
Следует иметь в виду, что при получении отливок затвердевание металла в форме происходит с разными скоростями охлаждения в различных ее частях. Скорость охлаждения уменьшается от стенки формы к центральной ее части, при этом меняется и направление теплоотвода в местах роста кристаллов. В результате полученный слиток имеет неодинаковое строение по сечению, а значит, и разныесвойства (рис. 7). Поверхностный слой будет мелкозернистый (т.е., с высокими механическими свойствами), центральная часть слитка – крупнозернистая.
Рисунок 7 - Характерные зоны слитка:
1 – корка (зона мелких по-разному ориентированных кристаллов);
2 – зона столбчатых кристаллов, растущих в направлении,
обратном направлению теплоотвода;
3 – зона крупных, произвольно ориентированных кристаллов;
4 – усадочная раковина в верхней части слитка.
Размер этих зон существенно меняется в зависимости от состава металла и условий кристаллизации.
Порядок выполнения работы
1. Ознакомится с основными сведениями по теме работы.
2. Изучить и зарисовать макроструктуру слитка металла. Указать на рисунке зоны кристаллизации, объяснить их образование.
3. Оформить отчет по работе
Содержание отчета
2. Основные положения по теме работы (кратко).
3. Описание отдельных стадий кристаллизации с необходимыми пояснениями, зарисовками.
4. Анализ и выводы.
Контрольные вопросы
1. Что является движущей силой процесса кристаллизации?
2. Каков механизм кристаллизации металла?
3. Что такое степень переохлаждения?
4. Почему структура слитка неодинакова по сечению?
5. Как влияет скорость охлаждения при кристаллизации на структуру металла?
6. Как можно получить мелкозернистый металл?
7. Как влияет структура металла на механические свойства?
8. Почему свойства крупнозернистого и мелкозернистого металла различны?
Итоговое выступление преподавателя/подведение итогов:
Оформление результатов работы
Оформить отчёт о проделанной работе, который должен содержать исчерпывающие текстовые ответы на поставленные вопросы с решениями, пояснениями, результатами решения.
Сформулировать выводы по результатам работы.
Сдать и защитить работу.
Список рекомендуемой литературы
Учебники и учебные пособия:
Основные источники:
1. Заплатин В.Н., Ю.И. Сапожников, А.В. Дубов, Е.М. Духнеев Основы материаловедения(металлообработка): учебник для студ. учреждений сред. проф. образования; под ред. В.Н. Заплатина. – М.: Издательский центр «Академия», 2017. - 272с.
2. Соколова Е.Н. Материаловедение: Лабораторный практикум: учеб. пособие для студ. учреждений сред. проф. образования / Е.Н. Соколова, А.О. Борисова, Л.В, Давыденко. – 3-е изд., стер. – М.: Издательский центр «Академия», 2016. - 128с.
3. Стуканов, В. А. Материаловедение: учеб. пособие для СПО / В. А. Стуканов. - М.: ИД "ФОРУМ": ИНФРА - М, 2014. - 368 с. –Профессиональное образование.
Дополнительные источники:
1. Марочник сталей и сплавов.2016
2. Моряков О.С. Материаловедение: учебник для студ. учреждений сред. проф. образования / О.С. Моряков. – 3-е изд., перераб. – М.: Издательский центр «Академия»,2015. - 288с.
3. А.И. Самохоцкий: Металловедение Учебник для техникумов: - М.: Металлургия, 1990. – 416с.
4. Солнцев, Ю. П. Материаловедение: учебник для СПО / Ю. П. Солнцев, С. А. Вологжанина. - 3-е изд., стереотип. - М.: Изда. центр "Академия", 2009. - 493 с. - Среднее профессиональное образование.
5. Черепахин А.А. Технология обработки материалов: учебник. – М.: Издательство «Академия»,2009. – 496с. – Серия: Среднее профессиональное образование.
6. Чумаченко Ю.Т., Чумаченко Г.В. Материаловедение: учебник. – Ростов – на – Дону: Издательство «Феникс»,2005. – 320с. – Серия: Среднее профессиональное образование.
Интернет-ресурсы:
Кристаллизация. Строение слитка
Процесс перехода из жидкого или газообразного состояния металла в твердое, в результате чего образуется кристаллическая решетка и возникают кристаллы, называется кристаллизацией. Для начала кристаллизации расплава его надо охладить ниже температуры кристаллизации.
Процесс кристаллизации складывается из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые называются зародышами или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров. Модель кристаллизации металла, по мере роста времени пребывания ниже температуры кристаллизации, представлена схемой процесса кристаллизации (рис. 2.13). При этом каждый возникающий центр кристаллизации формирует, впоследствии, зерно поликристалла (рис. 2.12,е), что и объясняет поликристаллическую структуру подавляющего большинства используемых металлов и сплавов. Рост кристалла заключается в том, что к поверхности зародышей присоединяются все новые и новые атомы металла. Сначала образовавшиеся кристаллы растут свободно, затем при столкновении растущих кристаллов их дальнейший рост продолжается только там, где есть свободный доступ к расплаву. В результате кристаллы (зерна в поликристалле) имеют произвольную геометрическую форму.
Процесс кристаллизации можно охарактеризовать двумя параметрами: числом центров кристаллизации (ЧЦК), образующихся в единицу времени в единице объема, и скоростью роста кристаллов (СРК). Эти параметры зависят от величины степени переохлаждения относительно температуры кристаллизации, а, следовательно, от скорости охлаждения при кристаллизации металла.
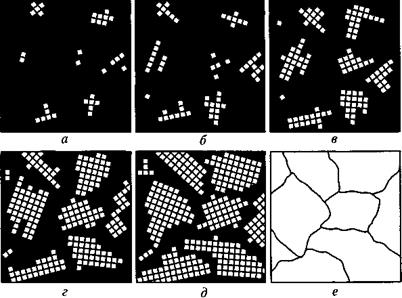
Р и с. 2.13. Схема процесса кристаллизации:
а – е – изменение структура по мере роста времени охлаждения
Величина зерен также зависит от условий кристаллизации и, прежде всего, от скорости охлаждения металла. Чем больше скорость охлаждения металла, тем больше величина ЧЦК по сравнению с СРК и, следовательно, тем меньшего размера получаются зерна. Мелкое зерно при затвердевании металла можно сформировать за счет создания дополнительных искусственных центров кристаллизации. Для этого в расплавленный металл вводят специальные вещества, называемые модификаторами. Процесс искусственного измельчения размеров зерен получил название модифицирование.
В большинстве случаев при литье слитков и отливок в реальных условиях реализуется дендритный рост кристаллов. Из зародышей вырастают древовидные кристаллиты - дендриты (с греч. Δένδρον - дерево). Впервые дендритные кристаллы в стальных слитках были выявлены и подробно описаны в 1870 - 1880 годах Д.К. Черновым.
При дендритной кристаллизации зародыши развиваются с разными скоростями в разных направлениях кристаллической решетки. Причины этого в анизотропии физических свойств и, следовательно, разных скоростях кристаллизации в разных направлениях формирующегося кристалла или направленности теплоотвода. В результате образуются ветви - оси дендрита 1-го порядка, расходящиеся от центра кристаллизации под определенными углами (рис. 2.14). При дальнейшем развитии кристаллизации от осей 1-го порядка под определенным углом к ним начинают расти поперечные ветви - оси 2-го порядка, а от них - оси 3-го порядка и т. д. В металлическом расплаве формируется остов древовидной формы будущего кристаллита (зерна). Остающаяся часть расплава между дендритными ветвями кристаллизуется, постепенно наслаиваясь на ветви.
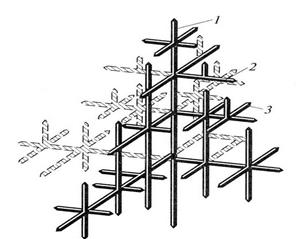
Р и с. 2.14. Схема дендрита:
1,2,3, - оси дендрита первого, второго и третьего порядков соответственно
Размеры дендритных ветвей зависят только от одного фактора - скорости охлаждения в интервале температур кристаллизации. Закристаллизовавшийся дендрит - литое зерно, выросшее из одного зародыш, центра, с той же кристаллографической ориентировкой. Соседние ветви дендритов могут быть разориентированы на несколько градусов, из-за их изгибов и смещения при кристаллизации. Дендритное строение литых зерен металлов и, в особенности, сплавов хорошо выявляется при травлении микрошлифов и просмотре их с помощью светового микроскопа (рис. 2.15).
При заливке жидкого металла в форму и последующей кристаллизации получается слиток, отдельные зоны которого отличаются микроструктурой. Схема строения металлического слитка приведена на рис. 2.16 и 2.17.

Р и с. 2.15. Дендритное строение зерна литого сплава алюминия ×500
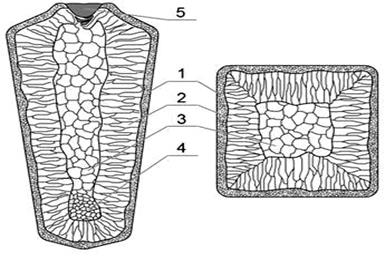
Р и с. 2.16. Схема строения слитка в продольном (слева) и поперечном (справа) сечениях:
1 - наружная мелкозернистая корка; 2 - зона столбчатых кристаллов; 3 - зона крупных равноосных кристаллов; 4 - конус осаждения; 5 - усадочная раковина

Р и с. 2.17. Структура поперечного сечения слитка с характерными
зонами: I - наружная мелкозернистая корка, II - зона столбчатых кристаллов,
III - зона крупных равноосных кристаллов ×100
Структура литого слитка состоит из трех основных зон. Первая зона - наружная мелкозернистая корка 1, состоящая из неориентированных мелких кристаллов - дендритов. При первом соприкосновении со стенками изложницы (форма, куда заливают жидкий металл) в тонком прилегающем слое жидкого металла возникают большое переохлаждение, ведущее к образованию большого количества центров кристаллизации. В результате корка получает мелкозернистое строение.
Вторая зона слитка - зона столбчатых кристаллов 2. После образования самой корки условия теплоотвода меняются, градиент температур в прилегающем слое жидкого металла резко уменьшается и, следовательно, уменьшается степень переохлаждения стали. В результате из-за небольшого числа центров кристаллизации начинают расти в направлении теплоотвода столбчатые кристаллы.
Третья зона слитка - зона крупных равноосных кристаллов 3. В центре слитка уже нет определенной направленности отвода тепла. В результате образуется крупная равноосная структура.
Образование конуса осаждения в нижней части слитка (зона 4) обычно объясняют опусканием на дно изложницы кристаллов, зародившихся в объеме жидкого металла у фронта затвердевания, а также обломившихся под действием потоков жидкого металла непрочных ветвей столбчатых кристаллов. Это опускание происходит вследствие разности плотности затвердевшего и жидкого металла.
Жидкий металл имеет больший объем, чем закристаллизовавшийся, поэтому залитый в форму металл в процессе кристаллизации уменьшается в объеме, что приводит к образованию пустот, называемых усадочными раковинами 5. Верхняя часть слитка с усадочной раковиной отрезается.
В слитках сплавов выявляется неоднородность химического состава. Такая неоднородность называется ликвацией.
Ликвация может быть зональная (различная концентрация элементов по зонам сечения слитка), гравитационная (образуется в результате разницы в удельных весах твердой и жидкой фазы, а также при кристаллизации несмешивающихся жидких фаз), дендритная (более тугоплавкие и чистые элементы преимущественно формируют оси 1 порядка, менее тугоплавкие - 2 и 3 порядка, а самые легкоплавкие и содержащие примеси - заполняют межосное пространство).
Теоретические основы процесса кристаллизации металлов
Процесс образования кристаллов называется кристаллизацией. Визуальное изучение кристаллизации металлов сопряжено с техническими трудностями. Поскольку законы кристаллизации растворов солей и расплавленных металлов сходны, изучение процесса кристаллизации можно проводить на растворах солей.
Согласно законам термодинамики, устойчивым состоянием при определённых внешних условиях будет то состояние, которое обладает меньшим уровнем свободной энергии. Под свободной энергией понимают часть внутренней энергии, которая может быть превращена в работу. При изменении внешних условий (например, при понижении температуры) любая система самопроизвольно стремится к состоянию с наименьшим уровнем свободной энергии.

Рис. 2.1. Изменение свободной энергии жидкого Gж и твёрдого Gт состояния в зависимости
от температуры: Ткр − фактическая температура кристаллизации, То − теоретическая
(равновесная) температура кристаллизации и плавления, ΔТ − степень переохлаждения,
Тпл − фактическая температура плавления, ΔТ ' − степень перегрева
С изменением температуры свободная энергия жидкого Gж и твёрдого Gт состояния изменяется по разным законам (рис. 2.1). При высоких температурах жидкое состояние обладает меньшей свободной энергией, поэтому металл при этих температурах находится в жидком состоянии (области III, IV). При охлаждении металл достигнет температуры Т0, при которой свободные энергии жидкого и твёрдого состояния равны. Эта температура Т0 носит название теоретической (равновесной) температуры кристаллизации при охлаждении и температуры плавления при нагреве.
При Т0 процесс кристаллизации протекать не может. Для развития процесса кристаллизации надо создать условия, при которых свободная энергия твёрдого состояния будет меньше, чем свободная энергия жидкого состояния. Это возможно лишь при охлаждении ниже Ткр, т. е. ниже теоретической температуры кристаллизации на некоторую величину ΔТ. В области II металл при охлаждении продолжает оставаться в жидком состоянии, поскольку разность (Gж – Gт) невелика и температура не достигла критического значения Ткр при котором твёрдое состояние обладает меньшей свободной энергией. При достижении Ткр разность (Gж – Gт) увеличивается, поэтому оставаться дальше в жидком состоянии металл не может, и при этой температуре в металле самопроизвольно начинается процесс кристаллизации.
В области I (рис. 2.1) металл будет находиться в твердом состоянии. Температура Ткр носит название фактической температуры кристаллизации, а разность между теоретической и фактической температурами степенью переохлаждения. Таким образом, кристаллизация может протекать лишь в условиях переохлаждения ниже теоретической температуры кристаллизации.
Для развития процесса плавления необходима некоторая степень перегрева:
где Тпл – фактическая температура плавления.
Д. К. Чернов ещё в 1878 году показал, что кристаллизация складывается из двух элементарных процессов (рис. 2.2). Первый процесс заключается в образовании из жидкого раствора мельчайших кристаллических частиц-зародышей или центров кристаллизации. Интенсивность этого процесса определяется числом зародышей ЧЗ, возникающих в единице объёма (1 мм 3 ) за единицу времени (1 с). Второй процесс состоит в росте кристаллов из зародышей. Интенсивность этого процесса определяется скоростью кристаллизации (СК) – линейным перемещением грани кристалла (в миллиметрах) в единицу времени (1 с).

Рис. 2.2. Последовательные этапы процесса кристаллизации
Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов. В месте соприкосновения кристаллов рост отдельных их граней прекращается и развиваются не все, а только некоторые грани кристаллов. В результате кристаллы не имеют правильной геометрической формы и называются кристаллитами или зернами.
Процессы образования зародышей и роста кристаллов протекают одновременно, причём интенсивность их зависит от степени переохлаждения. При данной степени переохлаждения величины ЧЗ и СК – постоянные в течение всего времени процесса кристаллизации.
Размер полученных кристаллов N зависит от соотношения ЧЗ и СК при данной степени переохлаждения и выражается формулой
где α − коэффициент пропорциональности.
При малой степени переохлаждения ΔТ1 (рис. 2.3) кристаллы после затвердевания будут крупными, так как ЧЗ мало, а СК велика. При большой степени переохлаждения ΔТ2 кристаллы будут мелкими, так как кристаллизация в этом случае идёт при почти той же СК, что и в первом случае, но при значительно большем ЧЗ.
Таким образом, изменяя степень переохлаждения, можно получить кристаллы разной величины.

Рис. 2.3. Зависимость ЧЗ и СК от степени переохлаждения при кристаллизации металлов
Степень переохлаждения зависит от скорости охлаждения. Чем больше скорость охлаждения, тем больше степень переохлаждения и мельче кристаллы. В реальных условиях затвердевания больших масс металла на процесс кристаллизации, размер и форму кристаллов оказывают влияние и другие факторы: твёрдые взвешенные тугоплавкие частицы примесей, инородные тела, газовые включения, теплоёмкость самого металла, направление отвода тепла, конвекционные потоки в жидком металле, температура заливаемого металла и формы, способы заливки, состояние поверхности изложницы (формы) и другие.
Форма растущих кристаллов определяется не только условиями их столкновений между собой, но и составом сплава, наличием примесей и условиями охлаждения. В большинстве случаев при кристаллизации металлов механизм образования кристаллов носит так называемый дендритный характер.
Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях решетки, которые имеют наибольшую плотность упаковки атомов (минимальное межатомное расстояние). В этих направлениях образуются длинные ветви будущего кристалла − так называемые оси первого порядка (I на рис. 2.4).

Рис. 2.4. Схема дендритного роста кристалла
В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называют осями второго порядка (II), от осей второго порядка растут оси третьего порядка (III) и т. д.
По мере кристаллизации образуются оси более высокого порядка (четвертого, пятого, шестого и т. д.), которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
Если жидкого металла не хватает для заполнения межосных пустот, то древовидная форма кристаллов сохраняется. Такие дендриты можно обнаружить в усадочных раковинах и на свободной поверхности слитков. Если жидкого металла достаточно для заполнения межосного пространства, то образуются крупные кристаллы, вытянутые в направлении главного теплоотвода. Такие кристаллы называются столбчатыми.
При равномерном теплоотводе, а также при большом числе зародышей, кристаллы растут с одинаковой скоростью по всем направлениям и вырастают равнооcными.
Процесс кристаллизации слитка спокойной стали (рис. 2.5а) начинается у стенок изложницы и последовательно продвигается к центру слитка.


Рис. 2.5. Строение стального слитка: а – реальный слиток стали;
б – схема строения слитка: 1 – мелкие равноосные кристаллы; 2 – столбчатые кристаллы;
3 – крупные равноосные кристаллы
У стенок изложницы (рис. 2.5б) образуется зона 1 − зона мелких равноосных, беспорядочно направленных кристаллов. Мелкие кристаллы получаются благодаря быстрому охлаждению ещё холодной стенкой прилегающих слоев жидкой стали.
Поэтому кристаллизация здесь идёт при большой степени переохлаждения, при большом числе зародышей. Кристаллы получаются равноосными, беспорядочно направленными, потому что оси первого порядка растут перпендикулярно неровностям внутренней поверхности изложницы. Растущие кристаллы сталкиваются между собой и образуют зону мелких дезориентированных кристаллов.
Следующая зона 2 − зона столбчатых крупных кристаллов, главная ось которых перпендикулярна стенке изложницы. Кристаллы получаются крупными, так как в этой зоне скорость охлаждения меньше, чем в зоне 1, потому что тепло отводится не холодной стенкой, а через зону 1 и уже нагревшуюся стенку изложницы. Кристаллизация идёт с меньшей степенью переохлаждения и с меньшим числом зародышей.
Кристаллы вытянуты главной осью перпендикулярно стенке изложницы, так как в этом направлении идет главный теплоотвод. В центре слитка образуется зона 3 − зона крупных равноосных кристаллов. В этой части слитка скорость охлаждения меньше, чем в зонах 1 и 2, поэтому кристаллизация идет при малой степени переохлаждения, при малом числе зародышей. Кристаллы этой зоны получаются равноосными, произвольно ориентированными, так как отвод тепла идет во всех направлениях с одинаковой скоростью. Скелетом этих крупных кристаллов являются дендриты (рис. 2.5а).
Кристаллизация солей
В данной работе студенты изучают процесс кристаллизации четырёх солей: нитрата свинца Рb(NO3)2, хлорида аммония NH4Cl, дихромата калия К2Сr2O7 (хромпик), хлорида натрия NaCl (поваренная соль), вызванный испарением растворителя.
Водные растворы этих солей приготавливаются почти насыщенными с тем, чтобы незначительное испарение воды привело их к состоянию перенасыщения и выделению кристаллов.
Наблюдение за процессом кристаллизации солей производится с помощью биологического микроскопа, работающего по принципу проходящего света (рис. 2.6). Лучи от естественного источника света, отразившись от зеркала микроскопа, проходят через отверстие предметного столика, предметное стекло, каплю соли и попадают в объектив. Полученное в объективе изображение капли увеличивается им и окуляром. Пройдя через окуляр, лучи попадают в глаз наблюдателя. Наблюдение за кристаллизацией капель в этой работе проводится при увеличении, но более чем
в 100 раз.
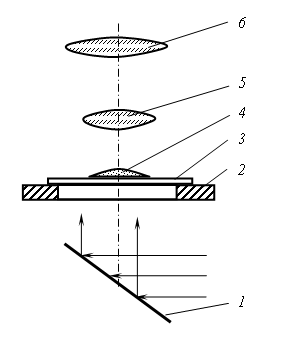
Рис. 2.6. Схема хода лучей в биологическом микроскопе:
1 – зеркало; 2 – предметный столик; 3 – предметное стекло; 4 – капля соли; 5 – объектив; 6 – окуляр
Порядок выполнения работы
1. Глядя в окуляр, вращать зеркало микроскопа, добиваясь яркого освещения (получить светлое поле).
2. Предметное стекло с нанесенной на него каплей соли установить на предметный столик так, чтобы капля была в центре отверстия предметного столика.
3. Произвести грубую настройку на фокус, для чего смотреть одним глазом в окуляр и, держа второй глаз открытым, вращать винт грубой подачи, поднимая тубус до тех пор, пока не появится изображение капли.
4. Вращением микрометрического винта произвести тонкую настройку на фокус.
5. Перемещать предметное стекло по предметному столику, наблюдая за кристаллизацией сначала у краёв капли, а затем в центре капли.
6. По мере появления кристаллов производить зарисовку в журнал, передавая при этом особенности их строения.
7. Исследование начинать с капли нитрата свинца, так как его кристаллизация идёт аналогично кристаллизации слитка спокойной стали.
Наибольшее испарение возникает у краёв капли, так как тут уровень жидкости наименьший, а концентрация соли раньше, чем в других местах, достигает предела насыщения. Здесь образуются мелкие равноосные кристаллы. Они настолько мелкие, что при используемом в данной работе увеличении каждый кристалл невиден, и эта зона чаще всего просматривается в виде тонкой тёмной линии (рис. 2.7).
Затем начинают образовываться крупные, вытянутые нормально к краям капли столбчатые кристаллы. Здесь кристаллизация идёт при большой скорости и ограниченном числе зародышей.
В последнюю очередь кристаллизация идёт в центре капли, где образуются крупные кристаллы, имеющие форму дендритов.
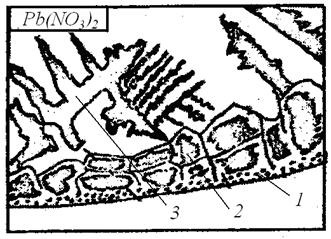
Рис. 2.7. Строение затвердевшей капли раствора нитрата свинца:
1 – мелкие равноосные кристаллы, 2 – крупные вытянутые кристаллы, 3 – дендриты
3. Контрольные вопросы
1. На рис. 2.1 укажите:
· теоретическую температуру кристаллизации (плавления) металла;
· фактическую температуру кристаллизации (плавления) металла;
· необходимое условие, при котором начнётся процесс кристаллизации (процесс плавления) металла;
·а) жидком при охлаждении;
б) твёрдом при охлаждении;
в) твёрдом при нагреве;
г) жидком при нагреве.
2. На рис. 2.3 укажите, при какой величине переохлаждения металл закристаллизуется наиболее крупнозернистым (наиболее мелкозернистым).
3. Укажите среду закристаллизовавшегося раствора соли: а) Рb(NO3)2,
б) NH4Cl; в) К2Сr2O7; г) NaCl. Объясните особенности её строения.
4. Укажите форму и схему строения закристаллизовавшейся капли водного раствора соли, схожую со структурой слитка спокойной стали. Объясните особенности ее строения.
Лекция "Кристаллизации металлов. Методы исследования металлов"по дисциплине "Основы материаловедения"
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1.
Рис.3.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная илитеоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называетсяфактической температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения ():
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждени).
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 3.2.
Рис.3.2. Кривая охлаждения чистого металла
– теоретическая температура кристаллизации;
. – фактическая температура кристаллизации.
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.3.
Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.
Рис.3.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.3.4.
Рис.3.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.3.5).
Рис. 3.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 3.6).
Рис. 3.6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.
Условия получения мелкозернистой структуры
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
По механизму воздействия различают:
1. Вещества не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
Строение металлического слитка
Схема стального слитка, данная Черновым Д.К., представлена на рис.3.7.
Рис. 3.7. Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелкозернистая структура.
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 3.8). Растут дендриты с направлением, близким к направлению теплоотвода.
Рис.3.8. Схема дендрита по Чернову Д.К.
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией.
З оны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называетсятранскристаллизацией.
Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка.
В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка)
Методы исследования металлов: структурные и физические
Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
Определение химического состава.
Используются методы количественного анализа.
1. Если не требуется большой точности, то используют спектральный анализ.
Спектральный анализ основан на разложении и исследовании спектра электрической дуги или искры, искусственно возбуждаемой между медным электродом и исследуемым металлом.
Зажигается дуга, луч света через призмы попадает в окуляр для анализа спектра. Цвет и концентрация линий спектра позволяют определить содержание химических элементов.
Используются стационарные и переносные стилоскопы.
2. Более точные сведения о составе дает рентгеноспектральный анализ.
Проводится на микроанализаторах. Позволяет определить состав фаз сплава, характеристики диффузионной подвижности атомов.
Изучение структуры.
Различают макроструктуру, микроструктуру и тонкую структуру.
1. Макроструктурный анализ – изучение строения металлов и сплавов невооруженным глазом или при небольшом увеличении, с помощью лупы.
Осуществляется после предварительной подготовки исследуемой поверхности (шлифование и травление специальными реактивами).
Позволяет выявить и определить дефекты, возникшие на различных этапах производства литых, кованных, штампованных и катанных заготовок, а также причины разрушения деталей.
Устанавливают: вид излома (вязкий, хрупкий); величину, форму и расположение зерен и дендритов литого металла; дефекты, нарушающие сплошность металла (усадочную пористость, газовые пузыри, раковины, трещины); химическую неоднородность металла, вызванную процессами кристаллизации или созданную термической и химико-термической обработкой; волокна в деформированном металле.
2. Микроструктурный анализ – изучение поверхности при помощи световых микроскопов. Увеличение – 50…2000 раз. Позволяет обнаружить элементы структуры размером до 0,2 мкм.
Образцы – микрошлифы с блестящей полированной поверхностью, так как структура рассматривается в отраженном свете. Наблюдаются микротрещины и неметаллические включения.
Для выявления микроструктуры поверхность травят реактивами, зависящими от состава сплава. Различные фазы протравливаются неодинаково и окрашиваются по разному. Можно выявить форму, размеры и ориентировку зерен, отдельные фазы и структурные составляющие.
Кроме световых микроскопов используют электронные микроскопы с большой разрешающей способностью.
Изображение формируется при помощи потока быстро летящих электронов. Электронные лучи с длиной волны (0,04…0,12 ) ·10 -8 см дают возможность различать детали объекта, по своим размерам соответствующе межатомным расстояниям.
Просвечивающие микроскопы. Поток электронов проходит через изучаемый объект. Изображение является результатом неодинакового рассеяния электронов на объекте. Различают косвенные и прямые методы исследования.
При косвенном методе изучают не сам объект, а его отпечаток – кварцевый или угольный слепок (реплику), отображающую рельеф микрошлифа, для предупреждения вторичного излучения, искажающего картину.
При прямом методе изучают тонкие металлические фольги, толщиной до 300 нм, на просвет. Фольги получают непосредственно из изучаемого металла.
Растровые микроскопы. Изображение создается за счет вторичной эмиссии электронов, излучаемых поверхностью, на которую падает непрерывно перемещающийся по этой поверхности поток первичных электронов. Изучается непосредственно поверхность металла. Разрешающая способность несколько ниже, чем у просвечивающих микроскопов.
3. Для изучения атомно-кристаллического строения твердых тел (тонкое строение) используются рентгенографические методы, позволяющие устанавливать связь между химическим составом, структурой и свойствами тела, тип твердых растворов, микронапряжения, концентрацию дефектов, плотность дислокаций.
Физические методы исследования
1. Термический анализ основан на явлении теплового эффекта. Фазовые превращения в сплавах сопровождаются тепловым эффектом, в результате на кривых охлаждения сплавов при температурах фазовых превращений наблюдаются точки перегиба или температурные остановки. Данный метод позволяет определить критические точки.
При нагреве металлов и сплавов происходит изменение объема и линейных размеров – тепловое расширение. Если изменения обусловлены только увеличением энергииколебаний атомов, то при охлаждении размеры восстанавливаются. При фазовых превращениях изменения размеров – необратимы.
Метод позволяет определить критические точки сплавов, температурные интервалы существования фаз, а также изучать процессы распада твердых растворов.
3 .Магнитный анализ.
Используется для исследования процессов, связанных с переходом из паромагнитного состояния в ферромагнитное (или наоборот), причем возможна количественная оценка этих процессов.
Лекция 4
Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией. Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией.
Процесс кристаллизации состоит из двух одновременно идущих процессов - зарождения и роста кристаллов. Кристаллы могут зарождаться самопроизвольно (самопроизвольная кристаллизация) или расти на имеющихся готовых центрах кристаллизации (несамопроизвольная кристаллизация).
Самопроизвольная кристаллизация
Самопроизвольная кристаллизация обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением термодинамического потенциала G. С повышением температуры термодинамический потенциал вещества как в твердом, так и в жидком состоянии уменьшается, что показано на рисунке.
Изменение термодинамического потенциала в зависимости от температуры для металла в твердом и жидком состояниях
Температура, при которой термодинамические потенциалы вещества в твердом и жидком состояниях равны, называется равновесной температурой кристаллизации. Кристаллизация происходит в том случае, если термодинамический потенциал вещества в твердом состоянии будет меньше термодинамического потенциала вещества в жидком состоянии, т. е. при переохлаждении жидкого металла до температур ниже равновесной. Плавление - процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Разница между реальными температурами плавления и кристаллизации называется температурным гистерезисом.
Поскольку жидкий металл с присущим ему ближним порядком в расположении атомов обладает большей внутренней энергией, чем твердый со структурой дальнего порядка, при кристаллизации выделяется теплота. Между теплотой и температурой кристаллизации Тк существует определенная связь. Так как при равновесной температуре кристаллизации термодинамические потенциалы в жидком и твердом состояниях равны, то
Рекомендуемые материалы
Параметр ΔS = Q/TK характеризует упорядоченность в расположении атомов при кристаллизации. В зависимости от сил межатомной связи теплота кристаллизации для различных металлов изменяется от 2500 Дж/моль (Na, К и др.) до 20000 Дж/моль (W и др.).
Когда кристаллизуется чистый элемент, отвод теплоты, происходящий вследствие охлаждения, компенсируется теплотой кристаллизации. В связи с этим на кривой охлаждения, изображаемой в координатах температура-время, процессу кристаллизации соответствует горизонтальный участок:

Кривые охлаждения металла
При большом объеме жидкого металла выделяющаяся при кристаллизации теплота повышает температуру практически до равновесной (кривая а); при малом объеме металла выделяющейся теплоты недостаточно, вследствие чего кристаллизация происходит с переохлаждением по сравнению с равновесной температурой (кривая б).
Разница между равновесной (Ts) и реальной (Тn) температурой кристаллизации называется степенью переохлаждения ΔT. Степень переохлаждения зависит от природы металла. Она увеличивается с повышением чистоты металла и с ростом скорости охлаждения. Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30 °С; при больших скоростях охлаждения она может достигать сотен градусов.
Степень перегрева при плавлении металлов, как правило, не превышает нескольких градусов.
В жидком состоянии атомы вещества вследствие теплового движения перемещаются беспорядочно. В то же время в жидкости имеются группировки атомов небольшого объема, в пределах которых расположение атомов вещества во многом аналогично их расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и вновь появляются в жидкости. При переохлаждении жидкости некоторые из них, наиболее крупные, становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами). Образованию зародышей способствуют флуктуации энергии, т. е. отклонения энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения. Размер образовавшегося зародыша зависит от величины зоны флуктуации.
Появление центров изменяет термодинамический потенциал системы ΔGобщ. С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал уменьшается на VΔGυ (G1), с другой стороны, он увеличивается вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем на величину, равную Sσ (G2):

где V-объем зародыша; S-поверхность зародыша; σ-удельное поверхностное натяжение на границе кристалл-жидкость; ΔGυ-удельная разность термодинамических потенциалов при переходе жидкости в кристаллическое состояние.
Изменение термодинамического потенциала при образовании зародышей в зависимости от их размера
Если принять, что зародыш имеет форму куба с ребром А, то общее изменение термодинамического потенциала
Отсюда следует, что графическая зависимость изменения термодинамического потенциала от размера зародыша имеет максимум при некотором значении А, названном критическим. Зародыши с размером больше критического вызывают уменьшение ΔGобщ. и поэтому являются устойчивыми, способными к росту. Зародыши, имеющие размер меньше критического, нестабильны и растворяются в жидкости, поскольку вызывают увеличение ΔGобщ.
Скорость процесса и окончательный размер кристаллов при затвердевании определяются соотношением скоростей роста кристаллов и образования центров кристаллизации. Скорость образования зародышей измеряется числом зародышей, образующихся в единицу времени в единице объема; скорость роста - увеличением линейного размера растущего кристалла в единицу времени. Оба процесса связаны с перемещениями атомов и зависят от температуры. Графическая зависимость скорости образования зародышей и скорости их роста от степени переохлаждения представлена на рисунке.

Изменение скорости образования зародышей (с. з.) и скорости роста кристаллов (с. р.) в зависимости от степени переохлаждения
Для металлов, которые в обычных условиях кристаллизации не склонны к большим переохлаждениям, как правило, характерны восходящие ветви кривых. Это значит, что при равновесной температуре, когда степень переохлаждения равна нулю, скорость образования зародышей и скорость роста также равны нулю, т. е. кристаллизации не происходит. При небольших степенях переохлаждения, когда велик зародыш критического размера, а скорость образования зародышей мала, при затвердевании формируется крупнокристаллическая структура. Небольшие степени переохлаждения достигаются при заливке жидкого металла в форму с низкой теплопроводностью (земляная, шамотовая) или в подогретую металлическую форму. Увеличение переохлаждения происходит при заливке жидкого металла в холодные металлические формы, а также при уменьшении толщины стенок отливки. Поскольку при этом скорость образования зародышей увеличивается более интенсивно, чем скорость их роста, получаются более мелкие кристаллы.
Несамопроизвольная кристаллизация
В реальных условиях процессы кристаллизации и характер образующейся структуры в значительной мере зависят от имеющихся готовых центров кристаллизации. Такими центрами, как правило, являются тугоплавкие частицы неметаллических включений, оксидов, интерметаллических соединений, образуемых примесями. К началу кристаллизации центры находятся в жидком металле в виде твердых включений. При кристаллизации атомы металла откладываются на активированной поверхности примеси, как на готовом зародыше. Такая кристаллизация называется несамопроизвольной или гетерогенной. При несамопроизвольной кристаллизации роль зародышей могут играть и стенки формы.
Наличие готовых центров кристаллизации приводит к уменьшению размера кристаллов при затвердевании. Эффект измельчения структуры значительно увеличивается при соблюдении структурного и размерного соответствия примесной фазы с основным металлом, которое способствует сопряжению их кристаллических решеток.
В жидком металле могут присутствовать и растворенные примеси, которые также вызывают измельчение структуры. Адсорбируясь на поверхности зарождающихся кристаллов, они уменьшают поверхностное натяжение на границе раздела жидкость - твердая фаза и линейную скорость роста кристаллов. Это способствует уменьшению Акр и появлению новых зародышей, способных к росту. Примеси, понижающие поверхностное натяжение, называют поверхностно-активными.
Получение монокристаллов
Большое научное и практическое значение имеют монокристаллы. Монокристаллы отличаются минимальными структурными несовершенствами. Получение монокристаллов позволяет изучать свойства металлов, исключив влияние границ зерен. Применение в монокристаллическом состоянии германия и кремния высокой чистоты дает возможность использовать их полупроводниковые свойства и свести к минимуму неконтролируемые изменения электрических свойств.
Монокристаллы можно получить, если создать условия для роста кристалла только из одного центра кристаллизации. Существует несколько методов, в которых использован этот принцип. Важнейшими из них являются методы Бриджмена и Чохральского.
Метод Бриджмена (рис. а) состоит в следующем: металл, помещенный в тигель с коническим дном 3, нагревается в вертикальной трубчатой печи 1 до температуры на 50-100 °С выше температуры его плавления. Затем тигель с расплавленным металлом 2 медленно удаляется из печи. Охлаждение наступает в первую очередь в вершине конуса, где и появляются первые центры кристаллизации. Монокристалл 4 вырастает из того зародыша, у которого направление преимущественного роста совпадает с направлением перемещения тигля. При этом рост других зародышей подавляется. Для непрерывного роста монокристалла необходимо выдвигать тигель из печи со скоростью, не превышающей скорость кристаллизации данного металла.

Схемы установок для выращивания монокристаллов
Метод Чохральского (рис. б) состоит в вытягивании монокристалла из расплава. Для этого используется готовая затравка 2 - небольшой образец, вырезанный из монокристалла по возможности без структурных дефектов. Затравка вводится в поверхностный слой жидкого металла 4, имеющего температуру чуть выше температуры плавления. Плоскость затравки, соприкасающаяся с поверхностью расплава, должна иметь кристаллографическую ориентацию, которую желательно получить в растущем монокристалле 3 для обеспечения наибольших значений тех или иных свойств. Затравку выдерживают в жидком металле для оплавления и установления равновесия в системе жидкость-кристалл. Затем затравку медленно, со скоростью, не превышающей скорости кристаллизации, удаляют из расплава. Тянущийся за затравкой жидкий металл в области более низких температур над поверхностью ванны кристаллизуется, наследуя структуру затравки. Для получения симметричной формы растущего монокристалла и равномерного распределения примесей в нем ванна 5 с расплавом вращается со скоростью до 100 об/мин, а навстречу ей с меньшей скоростью вращается монокристалл.
Диаметр растущего монокристалла зависит от скорости выращивания и температуры расплава. Увеличение скорости выращивания ведет к выделению большей теплоты кристаллизации, перегреву расплава и уменьшению диаметра монокристалла, и, наоборот, уменьшение скорости выращивания приводит к уменьшению количества теплоты кристаллизации, понижению температуры расплава и увеличению диаметра монокристалла.
Аморфное состояние металлов
При сверхвысоких скоростях охлаждения из жидкого состояния диффузионные процессы настолько замедляются, что подавляется образование зародышей и рост кристаллов. В этом случае при затвердевании образуется аморфная структура. Материалы с такой структурой получили название аморфные сплавы или металлические стекла.
Аморфное состояние обеспечивает металлическим материалам свойства, значительно отличающиеся от свойств соответствующих материалов с кристаллической структурой. Так, аморфные магнитомягкие материалы характеризуются прямоугольной петлей гистерезиса, высокой магнитной проницаемостью и очень малой коэрцитивной силой. При этом магнитные свойства материала малочувствительны к механическим воздействиям на него.

Получены аморфные материалы и с высокой магнитной энергией. Удельное электрическое сопротивление аморфных металлических материалов в 2 — 3 раза выше, чем у аналогичных сплавов с кристаллической структурой. Аморфные металлические материалы удачно сочетают высокие прочность, твердость и износостойкость с хорошей пластичностью и коррозионной стойкостью. Большое практическое значение имеет также и возможность получения аморфных металлов в виде ленты, проволоки диаметром несколько микрометров непосредственно при литье, минуя такие дорогостоящие операции, как ковка, прокатка, волочение, промежуточные отжиги, зачистки, травление.
На рисунке показана связь характерных графиков изменения свободной энергии возможных фаз при трех определенных температурах t1, t2, t3 с диаграммой состояния. При температуре t2 между точками а и b в термодинамическом равновесии сосуществуют две фазы: жидкий раствор состава ха и твердый раствор состава xb. Значения свободных энергий этих растворов соответствуют точкам a' и b'. Для более точного построения линий ликвидус и солидус необходимо иметь несколько графиков для интервала температур между t1и t3.
Термодинамическое обоснование диаграммы состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях
Полиморфизм

Ряду веществ свойственны не одна, а две и более структур, устойчивых при различных температурах и давлениях. Такие структуры называются полиморфными модификациями, или полиморфными формами. Полиморфные модификации принято обозначать греческими буквами. Модификацию, устойчивую при низких температурах, обозначают буквой α, а при более высоких - β. Полиморфизм весьма распространенное явление.
Железо, титан, кобальт, олово, углерод, сегнетоэлектрики, кварц и многие другие материалы могут существовать в различных полиморфных модификациях.
Естественно, полиморфные, модификации отличаются между собой не только структурой, но и свойствами. Например, α-олово, устойчивое ниже 13° С, является хрупким полупроводником, а β-олово— весьма вязкий металл.

При полиморфизме особо резкие изменения свойств наблюдаются при изменении не только структуры, но и типа химической.
Полиморфизм играет в материаловедении и технологии важную практическую роль. Переводя материал из одной полиморфной модификации в другую, можно управлять его свойствами. Например, практически освоено получение алмазов из графита нагревом его под давлением 100000 атм. до температур примерно 2000° С.
Читайте также:
