Смесь равных количеств гидроксида и карбоната металла
Обновлено: 27.09.2024
Смесь гидроксида и карбоната кальция обработали некоторым количеством разбавленной соляной кислоты. При этом смесь полностью растворилась и выделилось 11.2 л газа (н. у.). Полученный раствор упарили досуха, при этом выделилось еще 5.6 л газа (н. у.), масса сухого остатка составила 136 г. Определите массу гидроксида кальция в исходной смеси,
Решение:
Vm = 22,4 л;
V(CO2) = 11,2 л + 5,6 л = 16,8 л;
M(CaCl2) = 111 г/моль;
М [Ca(OH)2] = 74 г/моль;
m(CaCl2) = 136 г;
m[Ca(OH)2] = ?
Ca(OH)2 2HCl = CaCl2 + 2H2O;
CaCO3 + 2HCl = CaCl2 + 2H2O + CO3.
Из уравнений реакций вытекает, что в обоих случаях образуется 1 моль CaCl2 при взаимодействии 1 моля Ca(OH)2 и 1 моля CaCO3, и только при реакции 1 моля карбоната кальция выделяется 1 моль углекислого газа. Значит, n(CO2) = n(CaCO3).
Рассчитаем количество, выделившегося СО2, получим:
n(CO2) = V(CO2)/Vm = 16,8/22,4 = 0,75 моль.
Тогда
n(CaCO3) = n(CO2) = 0,75 моль.
Определим общее количество CaCl2, получим:
n(общ.) (CaCl2) = m(CaCl2)/M(CaCl2) = 136/111 = 1,225 моль.
Теперь рассчитаем количество Ca(OH)2, получим:
n[Ca(OH)2] = n(общ.) (CaCl2) - n(CO2) = 1,225 - 0,75 = 0,475 моль.
Отсюда
m[Ca(OH)2] = n[Ca(OH)2] * M[Ca(OH)2] = 0,475 моль * 74 г/моль = 35,15 г.
Ответ: m[Ca(OH)2] = 35,15 г.
Здравствуйте. Очень странно что 5,6 л газа вы приняли за углекислый газ. Как может он получиться при выпаривании воды из раствора??
Иван Бузан Мудрец (10747) Ответ получился? Если да, то все верно. Странности здесь нет, все просто - распалась угольная кислота. Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода: СО2*Н2О = Н2СО3, арастворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода: СО2*Н2О = СО2 + Н2О. Это равновесие при повышении температуры сдвигается вправо и образуется свободный СО2. И на заметку - гидрат диоксида углерода образуется тогда когда часть СО2 связывается с водой: СО2 + Н2О = СО2*Н2О, вот гидрат диоксида углерода то и дает дополнительное выделение газа при выпаривании раствора. PS: Такие подробности в школьном курсе (да и на первом курсе института) не рассматриваются. Вы просто не знаете, что творится с валентностью, а также с луноходами.
Иван Бузан Мудрец (10747) Если бы была дана только масса полученной соли (СаCl2), то задача бы решалась через составление математических уравнений. Так как дан объем газа, выделившегося при реакции карбоната с кислотой, то задача решается последовыательным рассчетом количеств веществ. Значит условие задачи некорректно, адолжно быть так: "Смесь гидроксида и карбоната кальция обработали некоторым количеством разбавленной соляной кислоты. Полученный раствор упарили досуха, масса сухого остатка составила 136 г. Определите массу гидроксида кальция в исходной смеси.". Тут все просто: составляем математическиеуравнения и рассчитываем количество реагенто. А так как дан объем выделившегося газа, то, естественно, рассчитываем реагенты реакции карбоната и кислоты - определяем по газу количество прореагировавшегося карбоната.
решите задачу по химии, пож
Смесь равных количеств гидроксида и карбоната металла
РазделыДополнительно

Задача по химии - 1366
Рассчитайте массовые доли компонент смеси, состоящей из гидрата карбоната аммония, карбоната калия и гидрофосфата аммония, ёсли известно, что из 38,4 г этой смеси получили 8,8 г оксида углерода (IV) и 6,8 г газообразного аммиака.
Задача по химии - 1367
Смесь равных количеств гидроксида и карбоната металла, имеющего в этих соединениях степень окисления +2, прокалили. Масса твердого остатка оказалась больше массы выделившегося газа (при $15^ < \circ >C$) в 3,273 раза. К получившемуся твердому остатку добавили в 15,0 раз большую массу 3,65%-ной соляной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
Задача по химии - 1368
Смесь неона с хлороводородом и смесь сероводорода с пропаном имеют при одинаковых условиях одинаковую плотность. Вычислите область допустимых значений для объемной доли неона в первой смеси.
Задача по химии - 1369
К 15,0 мл раствора $Na[Cr(OH)_<4>]$ с концентрацией 0,0600 моль/л добавляли по каплям раствор, содержащий смесь азотной и соляной кислот. Установлено, что максимальная масса осадка образовалась при добавлении 6,00 мл раствора. Чему станет равна масса осадка, если добавить еще 6,00 мл раствора смеси кислот?
Задача по химии - 1370
В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25,0%?
Задача по химии - 1372
Смесь двух изомеров, один из которых является ароматическим спиртом, а другой - гомологом фенола, при обработке избытком натрия образует 560 мл (н.у.) газа. Такая же смесь такой же массы может вступить во взаимодействие с 2,00 мл раствора гидроксида натрия с концентрацией 10,0 моль/л. Вычислите массовые доли веществ в исходной смеси.
Задача по химии - 1371
Вычислите массовую долю соли в растворе, полученном при добавлении избытка основного карбоната меди $(CuOH)_<2>CO_$, к 10,0%-ному раствору азотной кислоты.
Задача по химии - 1373
К раствору, содержащему 40,55 г смеси сульфата алюминия и одного из хлоридов железа, добавляли постепенно концентрированный раствор щелочи. Максимальная масса осадка оказалась равной 20,1 г. При добавлении избытка щелочи масса осадка уменьшилась до 4,50 г и перестала изменяться при добавлении еще большего избытка. Установите, какой хлорид железа находился в исходной смеси.
Задача по химии - 1374
Выведите формулу соединения, содержащего 25 % водорода и 75 % углерода.
Задача по химии - 1375
При полном сгорании 2,66 г некоторого вещества образовалось 1,54 г оксида углерода (IV) и 4,48 г оксида серы (IV). Плотность пара этого вещества по воздуху равна 2,62. Выведите истинную формулу этого вещества.
Задача по химии - 1376
Выведите истинную формулу органического соединения, содержащего 40,03 % $C$, 6,67 % $H$ и 53,30 % $O$. Молярная масса данного соединения равна 180 г/моль.
Задача по химии - 1377
Какую массу алюминия необходимо взять для восстановления железа из 464 г железной окалины?
Задача по химии - 1378
Рассчитайте объем углекислого газа (н. у.), который необходимо пропустить через известковую воду для осаждения карбоната кальция массой 50г.
Задача по химии - 1379
К раствору, содержащему 37,6 г азотнокислой меди, прибавили железных опилок массой 5,6 г. Рассчитайте, останется ли в растворе нитрат меди после окончания химической реакции.
Задача по химии - 1380
Вычислите, какое количество нитрита натрия образуется при прокаливании 1 кг чилийской селитры, содержащей 85 % $NaNO_<3>$.
Пособие-репетитор по химии
2. Происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Оксид и гидроксид цинка – свойства и методы получения.
Цинк расположен в побочной подгруппе II группы таблицы Д.И.Менделеева. Его электронная формула 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 . Цинк является d-элементом, проявляет в соединениях единственную степень окисления +2 (т.к. третий энергетический уровень в атоме цинка полностью заполнен электронами). Являясь амфотерным элементом с преобладанием металлических свойств, в соединениях цинк чаще входит в состав катиона, реже – аниона. Например,
Предполагают, что название цинка происходит от древнегерманского слова «цинко» (белый, бельмо). В свою очередь, это слово восходит к арабскому «харасин» (металл из Китая), что указывает на место выработки цинка, завезенного в средние века в Европу из Китая.
Ф и з и ч е с к и е с в о й с т в а
Цинк – металл белого цвета; на воздухе покрывается оксидной пленкой, и его поверхность тускнеет. На холоде это довольно хрупкий металл, но при температуре 100–150 °С цинк легко обрабатывается, образует сплавы с другими металлами.
Х и м и ч е с к и е с в о й с т в а
Цинк – металл средней химической активности, однако он более активен, чем железо. Цинк после разрушения оксидной пленки проявляет следующие химические свойства.
Zn + NaCl нет реакции.
В п р и р о д е цинк встречается в виде соединений, важнейшими из которых являются сфалерит, или цинковая обманка (ZnS), смитсонит, или цинковый шпат (ZnCO3), красная цинковая руда (ZnO).
В промышленности д л я п о л у ч е н и я цинка производят обжиг цинковой руды с целью получения оксида цинка, который затем восстанавливают углеродом:
К важнейшим соединениям цинка относятся его о к с и д (ZnO) и г и д р о к с и д (Zn(OH)2). Это кристаллические вещества белого цвета, проявляют амфотерные свойства:
Оксид цинка можно получить окислением цинка, разложением гидроксида цинка или обжигом цинковой обманки:
Гидроксид цинка получают реакцией обмена между раствором соли цинка и щелочи:
ZnCl2 + 2NaOH (недостаток) = Zn(OH)2 + 2NaCl.
Эти соединения н а д о з а п о м н и т ь: цинковая обманка (ZnS), цинковый купорос (ZnSO4•7H2O).
Тест по теме «Цинк и его соединения»
1. Сумма коэффициентов в уравнении реакции цинка с очень разбавленной азотной кислотой:
а) 20; б) 22; в) 24; г) 29.
2. Цинк из концентрированного раствора карбоната натрия вытесняет:
а) водород; б) угарный газ;
в) углекислый газ; г) метан.
а) сульфатом меди и хлором;
б) оксидом кальция и медью;
в) гидросульфатом натрия и цинком;
г) гидроксидом цинка и гидроксидом меди.
4. Плотность 27,4%-го раствора гидроксида натрия составляет 1,3 г/мл. Молярная концентрация щелочи в этом растворе составляет:
а) 0,0089 моль/мл; б) 0,0089 моль/л;
в) 4 моль/л; г) 8,905 моль/л.
5. Для получения гидроксида цинка необходимо:
а) по каплям приливать раствор гидроксида натрия к раствору хлорида цинка;
б) по каплям приливать раствор хлорида цинка к раствору гидроксида натрия;
в) прилить избыток раствора гидроксида натрия к раствору хлорида цинка;
г) по каплям добавлять раствор гидроксида натрия к раствору карбоната цинка;
6. Исключите «лишнее» соединение:
7. Сплав меди и цинка массой 24,12 г обработали избытком разбавленной серной кислоты. При этом выделилось 3,36 л газа (н.у.). Массовая доля цинка в этом сплаве равна (в %):
а) 59,58; б) 40,42; в) 68,66; г) 70,4.
а) соляной кислоты; б) азотной кислоты;
в) гидроксида калия; г) сульфата алюминия.
9. Углекислый газ объемом 16,8 л (н.у.) был поглощен 400 г 28%-го раствора гидроксида калия. Массовая доля вещества, находящегося в растворе, составляет (в %):
а) 34,5; б) 31,9; в) 69; г) 63,7.
10. Масса образца карбоната цинка, в котором содержится 4,816•10 24 атомов кислорода, равна (в г):
а) 1000; б) 33,3; в) 100; г) 333,3.
Ключ к тесту
Задачи и упражнения на амфотерные металлы
Цепочки превращений
Цинк —> оксид цинка —> гидроксид цинка —> сульфат цинка —> хлорид цинка —> нитрат цинка —> сульфид цинка —> оксид цинка —> цинкат калия.
2. Оксид алюминия —> тетрагидроксоалюминат калия —> хлорид алюминия —> гидроксид алюминия —> тетрагидроксоалюминат калия.
3. Натрий —> гидроксид натрия —> гидрокарбонат натрия —> карбонат натрия —> гидроксид натрия —> гексагидроксохромат(III) натрия.
4. Хром —> хлорид хрома(II) —> хлорид хрома(III) —> гексагидроксохромат(III) калия + бром + гидроксид калия —> хромат калия —> дихромат калия —> оксид хрома(VI).
5. Сульфид железа(II) —> X 1 —> оксид железа(III) —> X 2 —> сульфид железа(II).
6. Хлорид железа(II) —> А —> Б —> В —> Г —> Д —> хлорид железа(II) (все вещества содержат железо; в схеме только три окислительно-восстановительные реакции подряд).
7. Хром —> Х 1 —> сульфат хрома(III) —> Х 2 —> дихромат калия —> Х 3 —> хром.
У р о в е н ь А
1. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-го раствора серной кислоты (плотность – 1,14 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите состав исходного сплава и объем газа (н.у.), выделившегося при растворении сплава.
Ответ. 57,6% Mg; 42,4% Al; 1,34 л H2.
2. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите состав исходной смеси.
Пусть (Ca) = x моль, (Al) = 4y моль.
Тогда: 40x + 4•27y = 18,8.
По условию задачи:
По уравнению реакции:
(СH4) = 3/4(Al) = 3y моль,
x + 3y = 0,5.
x = 0,2, y = 0,1.
(Al) = 4•0,1 = 0,4 моль.
В исходной смеси:
m(Ca) = 0,2•40 = 8 г,
(Ca) = 8/18,8 = 0,4255, или 42,6%;
m(Al) = 0,4•27 = 10,8 г,
(Al) = 10,8/18,8 = 0,5744, или 57,4%.
Ответ. 42,6% Ca; 57,4% Al.
3. При взаимодействии 11,2 г металла VIII группы периодической системы с хлором образовалось 32,5 г хлорида. Определите металл.
Ответ. Железо.
4. При обжиге пирита выделилось 25 м 3 сернистого газа (температура 25 °С и давление 101 кПа). Вычислите массу образовавшегося при этом твердого вещества.
5. При прокаливании 69,5 г кристаллогидрата сульфата железа(II) образуется 38 г безводной соли. Определите формулу кристаллогидрата.
Ответ. Гептагидрат FeSO4•7H2O.
6. При действии избытка соляной кислоты на 20 г смеси, содержащей медь и железо, выделился газ объемом 3,36 л (н.у.). Определите состав исходной смеси.
Ответ. 58% Cu; 42% Fe.
У р о в е н ь Б
1. Какой объем 40%-го раствора гидроксида калия (плотность – 1,4 г/мл) следует добавить к 50 г 10%-го раствора хлорида алюминия для того, чтобы первоначально выпавший осадок полностью растворился?
Ответ. 15 мл.
2. Металл сожгли в кислороде с образованием 2,32 г оксида, для восстановления которого до металла необходимо затратить 0,896 л (н.у.) угарного газа. Восстановленный металл растворили в разбавленной серной кислоте, полученный раствор дает синий осадок с красной кровяной солью. Определите формулу оксида.
3. Какой объем 5,6 М раствора гидроксида калия потребуется для полного растворения 5 г смеси гидроксидов хрома(III) и алюминия, если массовая доля кислорода в этой смеси равна 50%?
Ответ. 9,3 мл.
4. К 14%-му раствору нитрата хрома(III) добавили сульфид натрия, полученный раствор отфильтровали и прокипятили (без потери воды), при этом массовая доля соли хрома уменьшилась до 10%. Определите массовые доли остальных веществ в полученном растворе.
5. Смесь хлорида железа(II) с дихроматом калия растворили в воде и подкислили раствор соляной кислотой. Через некоторое время к раствору по каплям добавили избыток раствора гидроксида калия, выпавший осадок отфильтровали и прокалили до постоянной массы. Масса сухого остатка равна 4,8 г. Найдите массу исходной смеси солей, учитывая, что массовые доли хлорида железа(II) и дихромата калия в ней относятся как 3:2.
Ответ. 4,5 г.
6. 139 г железного купороса растворили в воде при температуре 20 °С и получили насыщенный раствор. При охлаждении этого раствора до 10 °С выпал осадок железного купороса. Найдите массу выпавшего осадка и массовую долю сульфата железа(II) в оставшемся растворе (растворимость сульфата железа(II) при 20 °С равна 26 г, а при 10 °С – 20 г).
1. Серебристо-белое легкое простое вещество А, обладающее хорошей тепло- и электропроводностью, реагирует при нагревании с другим простым веществом В. Образующееся твердое вещество растворяется в кислотах с выделением газа С, при пропускании которого через раствор сернистой кислоты выпадает осадок вещества В. Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – Al, В – S, C – H2S.
2. Имеются два газа – А и В, молекулы которых трехатомны. При добавлении каждого из них к раствору алюмината калия выпадает осадок. Предложите возможные формулы газов А и В, учитывая, что эти газы бинарны. Напишите уравнения реакций. Как химическим путем можно различить эти газы?
3. Нерастворимое в воде соединение А бурого цвета при нагревании разлагается с образованием двух оксидов, один из которых – вода. Другой оксид – В – восстанавливается углеродом с образованием металла С, вторым по распространенности в природе среди металлов. Идентифицируйте вещества, напишите уравнения реакций.
4. Соль А образована двумя элементами, при обжиге ее на воздухе образуются два оксида: В – твердый, бурого цвета, и газообразный. Оксид В вступает в реакцию замещения с серебристо-белым металлом С (при нагревании). Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – FeS2, В – Fe2O3, C – Al.
* Знак +/– означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
Учебно-методическое пособие
Знать: аллотропные модификации углерода, зависимость их свойств от строения кристаллической решетки; важнейшие свойства и применение углерода, оксидов углерода, угольной кислоты, карбонатов, кремния, оксидов кремния, кремниевой кислоты; состав и получение строительных материалов – стекла, цемента, бетона, керамики, условия их рационального хранения и использования; качественную реакцию на карбонат-ион; способы обнаружения углекислого газа.
Уметь: давать характеристику подгруппе элементов на основе строения атомов и положения элементов в периодической системе; описывать химические свойства изученных веществ уравнениями реакций; определять на практике карбонат-ион и углекислый газ; решать комбинированные задачи.
Основные понятия: адсорбция, десорбция, адсорбент, известковая вода, известковое молоко, карбиды, силициды, кремниевый ангидрид, керамика.
Алмаз «Горняк»
(найден в Якутии)
Хризотил-асбест
(разновидность силиката магния)
Контрольные вопросы
1. Какова валентность углерода в соединениях? Почему?
2. Какие аллотропные формы образует углерод?
3. В чем различие свойств графита и алмаза? Почему свойства этих веществ так различны?
4. Почему активированный уголь способен к адсорбции?
5. Что называется адсорбцией? Где применяется это свойство?
6. В какие реакции может вступать углерод? Напишите уравнения реакций.
7. Какие оксиды образует углерод?
8. Как устроена молекула монооксида углерода, какой в ней тип химической связи?
9. Как можно получить оксид углерода(II)? Приведите уравнение химической реакции.
10. Каковы физические свойства угарного газа?
11. В какие реакции может вступать монооксид углерода? Приведите уравнения химических реакций.
12. Где применяется оксид углерода(II)?
13. Как влияет угарный газ на живой организм? Как уберечься от отравления им?
14. Как устроена молекула диоксида углерода, какой в ней тип химической связи?
15. Как можно получить СО2? Составьте уравнение реакции.
16. Каковы физические свойства углекислого газа?
17. Какие реакции возможны для диоксида углерода? Приведите соответствующие уравнения реакций.
18. Как образуются средние и кислые соли в реакциях СО2 с щелочами? Напишите уравнения реакций.
19. Как распознать углекислый газ? Напишите уравнение качественной реакции на СО2.
20. Почему СО2 не поддерживает горения и дыхания?
21. Каково расположение атомов в молекуле угольной кислоты?
22. Какой тип химической связи между атомами в молекуле угольной кислоты?
23. Как можно получить угольную кислоту? Приведите уравнение реакции.
24. Как диссоциирует угольная кислота? Сильный ли это электролит?
25. Как происходит гидролиз карбоната натрия в растворе? Напишите уравнение реакции.
26. Какова окраска лакмуса в растворе угольной кислоты? Почему?
27. Какие соли может образовывать угольная кислота? Приведите примеры формул веществ.
28. Какие соли угольной кислоты встречаются в природе и как они называются?
29. Какие карбонаты получают в промышленности?
30. Каковы физические свойства солей угольной кислоты?
31. Как ведут себя карбонаты при нагревании? Напишите уравнения реакций.
32. Что происходит с гидрокарбонатами при нагревании?
33. Какие другие реакции (кроме разложения) возможны для карбонатов?
34. Какова качественная реакция на карбонаты? Напишите уравнение реакции.
35. Опишите строение атома кремния.
36. Каковы возможные степени окисления кремния в его соединениях?
37. Каковы физические свойства кремния?
38. Как можно получить чистый кремний? Составьте уравнение реакции.
39. Какие реакции возможны для кремния? Напишите уравнения реакций.
40. Как взаимодействует кремний с щелочами? Составьте уравнение реакции.
41. Где применяется кремний?
42. Какой оксид образует кремний? В каком виде оксид кремния встречается в природе?
43. Почему диоксид кремния твердый и тугоплавкий?
44. Каковы химические свойства диоксида кремния? Напишите уравнения реакций.
45. Где применяется диоксид кремния?
46. Какова простейшая формула кремниевой кислоты?
47. Как можно получить кремниевую кислоту? Приведите уравнение реакции.
48. Каковы физические свойства кремниевой кислоты?
49. Как получают силикаты? Напишите уравнения реакций.
50. Каковы химические свойства силикатов? Составьте уравнения реакций.
51. Где применяется кремниевая кислота?
52. Где применяются силикаты?
53. Какие материалы производит силикатная отрасль промышленности?
54. Что является сырьем для производства стекла?
55. Как можно изменить свойства стекла?
56. Где применяется стекло?
57. Где применяются изделия из керамики?
58. Что служит сырьем при производстве цемента?
59. Где применяется цемент?
60. Какие элементы составляют семейство углерода?
61. Как изменяются свойства элементов в подгруппе углерода с увеличением заряда ядра атома? Почему?
62. Где применяют элементы семейства углерода?
6.1. Решение задач по теме «Подгруппа углерода»
Задача 1. При обработке 3,8 г смеси карбоната и гидрокарбоната натрия соляной кислотой образовалось 896 мл газа
(н. у.). Какой объем соляной кислоты (массовая доля – 20%, плотность – 1,1 г/см 3 ) был израсходован и каков состав исходной смеси?
Решение
1. Расчет количества вещества:
(CO2) = 0,896 (л)/22,4 (л/моль) = 0,04 моль.
Обозначим через х количество вещества газа СО2, выделившегося в реакции Na2CO3 c cоляной кислотой. Тогда
(CO2), выделившегося при реакции NaHCO3 c HCl, равно (0,04 – х) моль. Напишем уравнения реакций:
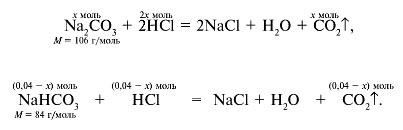
2. Составим запись для определения количественного состава смеси:
106х + 84•(0,04 – х) = 3,8, отсюда х = 0,02 моль;
3. Рассчитаем объем кислоты. В реакции с Na2CO3 расходуется 0,04 моль HCl, а в реакции с NaНCO3 – 0,02 моль HCl.
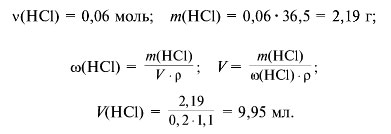
Ответ. 9,95 мл кислоты HCl; 2,12 г Na2CO3 и 1,68 г NaНCO3.
Задача 2. Какой объем углекислого газа необходимо пропустить (н. у.) через раствор массой 80 г с массовой долей растворенного вещества гидроксида бария 5% для получения гидрокарбоната бария?
1. Составим уравнение реакции:
2. Рассчитаем количества веществ исходных соединений, вступивших в реакцию:
(Ва(ОН)2) = 4/171 = 0,0234 моль;
3. Рассчитаем объем газа:
Задача 3. Через известковую воду пропустили 1 л смеси оксидов углерода(II) и (IV). Выпавший осадок отфильтровали и высушили, масса осадка составила 2,45 г. Установите содержание газов в исходной смеси в процентах по объему
(н. у.).
1. Запишем уравнения реакций:
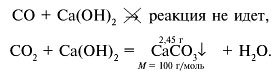
2. Рассчитаем количество вещества СО2:
3. Рассчитаем объемы и объемные доли () газов в смеси:
V(СО) = 1 – 0,5488 = 0,4512 л, (СО) = 45,12%.
Ответ. Объемные доли (СО2) = 54,88%; (СО) = 45,12%.
Задания для самоконтроля
1. С какими веществами будет реагировать оксид углерода(IV): гидроксид натрия, вода, карбонат магния, хлорид натрия, оксид кальция, гидроксид меди(II), уголь, известковая вода? Напишите уравнения возможных реакций.
2. В одной пробирке дан раствор карбоната натрия, а в другой – сульфата натрия. В каждую пробирку добавили раствор хлорида бария и в обоих случаях наблюдали выпадение белого осадка. Как определить, в какой пробирке находится карбонат? Составьте молекулярные и ионные уравнения реакций.
3. Объясните окислительно-восстановительные процессы, показав переходы электронов методом электронного баланса:
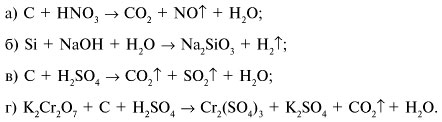
4. Запишите уравнения реакций следующих превращений:
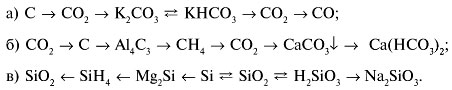
5. При действии избытка соляной кислоты на образец доломита МgСО3•СаСО3 массой 50 г выделяется 11,2 л углекислого газа (н. у.). Определите массовую долю примесей в данном образце доломита.
6. Известно, что при горении угля выделяется 402 кДж/моль, а при обжиге известняка поглощается 180 кДж/моль теплоты. Используя эти данные, определите массу угля (содержащего 0,98 массовой доли углерода), необходимого для разложения 1 кг известняка, содержащего 5% примесей.
7. 1,68 л смеси оксидов углерода(II) и (IV) пропустили при комнатной температуре через 50 мл раствора гидроксида натрия с концентрацией 2 моль/л, после чего содержание щелочи в растворе уменьшилось вдвое. Определите состав исходной смеси газов в процентах по массе и объему.
8. Газ, полученный при полном восстановлении 16 г оксида железа(III) с помощью угарного газа, пропущен через 98,2 мл 15%-го раствора гидроксида калия (плотность – 1,14 кг/дм 3 ). Сколько литров оксида углерода(II) израсходовано
(н. у.)? Каковы состав и масса образовавшейся соли?
Ответ. 6,72 л СО, 30 г КНСО3.
7. Общие свойства металлов
Знать: положение металлов в периодической системе химических элементов Д.И.Менделеева; строение и физические свойства металлов; нахождение металлов в природе; общие химические свойства металлов; виды коррозии и способы защиты от нее; электролиз как окислительно-восстановительный процесс и его применение; классификацию сплавов, состав некоторых сплавов, их свойства и применение; сущность и значение электрохимического ряда напряжений металлов.
Уметь: давать характеристику металлам на основании положения элементов в периодической системе и строения атомов; характеризовать физические свойства металлов; составлять уравнения реакций, отражающих общие свойства металлов; составлять схемы и уравнения электролиза расплавов и растворов солей и щелочей; решать типовые и комбинированные задачи.
Основные понятия: металлическая связь, металлическая кристаллическая решетка, гальванический элемент, электрохимический элемент, коррозия, электролиз, электроэкстрация, электролитическое рафинирование металлов, гальванопластика, гальваностегия, сплавы.
Реакции металлов с кислотами
Активные металлы могут реагировать с кислотами с выделением водорода (реакции замещения).
Малоактивные металлы водород из кислот не вытесняют.
Реакции металлов
с разбавленными кислотами
1. Каково значение металлов в жизни человека?
2. Каковы особенности строения атомов металлов?
3. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева?
4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп?
5. В каких формах могут находиться металлы в природе?
6. Как можно получить металлы из их соединений?
7. Как устроена кристаллическая решетка металлов?
8. Каковы физические свойства металлов?
9. Как ведут себя атомы металлов в химических реакциях и почему?
10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях?
11. Расскажите об электрохимическом ряде напряжений металлов.
12. Перечислите реакции, в которые могут вступать металлы.
13. Как связаны химические активности атомов металлов и ионов металлов?
14. Пары какого металла смертельно опасны? Опишите признаки отравления.
15. Что такое коррозия металла и как уберечь от нее металл?
16. Перечислите щелочные металлы. Почему они так называются?
17. Каковы особенности строения атомов щелочных металлов?
18. Как можно получить щелочные металлы?
19. Каковы физические свойства щелочных металлов?
20. Какие оксиды и пероксиды получаются при окислении щелочных металлов?
21. Какова степень окисления щелочного металла в соединении? Почему?
22. Как образуется гидрид щелочного металла? Какова степень окисления водорода в нем?
23. Как реагирует щелочной металл с раствором соли?
24. Как окрашивают пламя атомы и ионы щелочных металлов?
25. Какие реакции характерны для щелочных металлов?
26. Какие химические связи образуют щелочные металлы с неметаллами?
27. Как взаимодействует пероксид натрия с углекислым газом?
28. Где применяются щелочные металлы?
29. Какой из щелочных металлов наиболее активен и почему?
30. Как надпероксид КО2 взаимодействует с СО2? Напишите уравнение реакции.
7.1. Электролиз расплавов
Катод – восстановитель, на нем происходит процесс приема электронов катионами металлов.
Анод – окислитель, на нем происходит процесс отдачи электронов анионами кислотных остатков или гидроксид-ионами.
В случае окисления ионов ОН – составляется схема:
Электролиз расплавов солей.
(Алгоритм 30.)
Задание 1. Составьте схему электролиза расплава бромида натрия.
Задание 2. Составьте схему электролиза расплава сульфата натрия.
Электролиз расплавов щелочей.
(Алгоритм 31.)
Задание 1. Составьте схему электролиза расплава гидроксида натрия.
7.2. Электролиз растворов
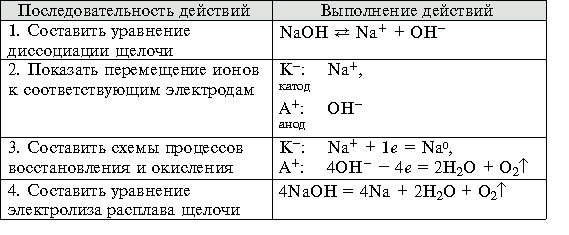
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при пропускании через электролит электрического тока. При электролизе катод является восстановителем, т. к. отдает электроны, а анод – окислителем, т. к. принимает электроны от анионов.
Электролиз раствора хлорида меди(II)
Для выбора наиболее вероятного процесса на катоде и аноде при электролизе растворов с использованием инертного (нерастворимого) анода (например, графита, угля, платины, иридия) используют следующие правила.
1. На аноде образуются:
а) при электролизе растворов, содержащих анионы F – , –, , OH – , – O2;
б) при окислении анионов Сl – , Вr – , I – – соответственно Сl2, Вr2, I2.
2. На катоде образуются:
а) при электролизе растворов, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , – Н2;
б) если ионы расположены в ряду напряжений правее водорода – металлы;
в) если ионы расположены в ряду напряжений между Аl 3+ и H + , то на катоде могут протекать конкурирующие процессы – восстановление как металлов, так и водорода;
г) если водный раствор содержит катионы различных металлов, то их восстановление протекает в порядке уменьшения величины стандартного электродного потенциала (справа налево по ряду напряжений металлов).
В случае использования активного (растворимого) анода (из меди, серебра, цинка, никеля, кадмия) анод сам подвергается окислению (растворяется) и на катоде кроме катионов металла соли и ионов водорода восстанавливаются катионы металла, полученные при растворении анода.
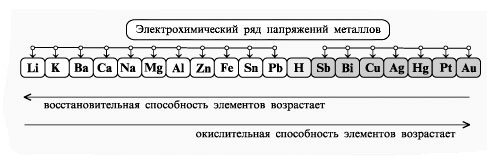
Восстановительные свойства металлов удобно сравнивать, используя электрохимический ряд напряжений, в который включен и водород. Восстановительная способность элементов в этом ряду уменьшается слева направо, в этом же направлении увеличивается окислительная способность соответствующих катионов.
Электролиз водного раствора соли.
(Алгоритм 32.)
Задание 1. Составьте схему электролиза водного раствора хлорида натрия с использованием инертных электродов.
Задание 2. Составьте схему электролиза водного раствора сульфата меди(II) с использованием инертных электродов.
Электролиз водного раствора щелочи.
(Алгоритм 33.)
Задание 1. Составьте схему электролиза водного раствора гидроксида натрия.
1. Составьте схемы электролиза:
а) расплавов хлорида кальция, гидроксида калия, сульфата лития;
б) водных растворов хлорида магния, сульфата калия, нитрата ртути(II).
2. Какие реакции практически осуществимы:
3. На стальной крышке поставлена медная заклепка. Что раньше разрушится – крышка или заклепка? Почему?
4. Имеется изделие из железа, покрытое защитной пленкой из олова (луженое железо). Что будет происходить при нагревании такого изделия на воздухе? Напишите уравнения протекающих реакций.
5. Какой объем водорода (н. у.) выделится при погружении в воду 20 г изделия из сплава натрия, калия и меди в массовом отношении 1:1:2?
6. Рассчитайте массу 9,8%-го раствора серной кислоты, которая потребуется для растворения четырех гранул цинка, если масса каждой гранулы 0,2 г.
7. Рассчитайте, какой будет массовая доля гидроксида калия в растворе, если металлический калий массой 3,9 г растворить в воде объемом 80 мл.
8. При электролизе сульфата некоторого металла на аноде выделилось 176 мл кислорода (н. у.), а на катоде за то же время – 1 г металла. Сульфат какого металла был взят?
9. Железная пластинка массой 18 г опущена в раствор сульфата меди(II). Когда она покрылась медью, ее масса стала равной 18,2 г. Какая масса железа перешла в раствор?
10. Железная пластинка массой 5 г опущена на некоторое время в 50 мл 15%-го раствора сульфата меди(II), плотность которого 1,12 г/см 3 . После того как пластину вынули, ее масса оказалась равной 5,16 г. Какова масса сульфата меди(II) в оставшемся растворе?
Читайте также:
