Соединение металлов формула название применение
Обновлено: 19.05.2024
Название «щелочные металлы» произошло от их способности в реакциях с водой образовывать щелочи — основания, растворимые в воде. Слово «выщелачивать» славянского происхождения. В переводе оно означает «растворять».
Щелочными называют металлы IA группы таблицы Менделеева. Их шесть: литий, натрий, рубидий, калий, цезий, франций. По внешнему виду они представляют собой металлы серебристо-белого цвета, за исключением цезия — он золотисто-желтый. Основные физические свойства простых веществ:
- пластичность;
- мягкость;
- невысокая плотность;
- высокая химическая активность;
- легкая окисляемость;
- электропроводность;
- теплопроводность;
- легкоплавкость.
В связи со способностью быстро окисляться, т.е. вступать в реакцию с кислородом и другими веществами, в природе они встречаются в форме соединений.
Соли щелочных металлов окрашивают пламя спиртовки в различные цвета:
В отличие от этих двух представителей, литий, рубидий, цезий не встречаются в природе часто. Следовательно, они относятся к группе редких металлов. Франций — искусственно полученный элемент, отличающийся радиоактивностью.
Калий и натрий являются участниками водно-солевого, а также кислотно-щелочного баланса организма человека. Эти элементы важны для циркуляторных процессов крови, деятельности энзимов. Для жизнедеятельности растений особенно важен калий.
Щелочные металлы имеют валентность, равную единице (степень окисления +1).
Поскольку данная группа элементов в системе Менделеева следует непосредственно за инертными газами, у атомов щелочных металлов появляется новый энергетический уровень, на котором содержится один электрон. Электронная конфигурация — ns1.
Поскольку любой атом стремится приобрести конфигурацию инертного газа, атомы щелочных металлов способны легко отдать валентные электроны и проявлять восстановительные свойства. Этот факт свидетельствует о невысоких значениях энергии ионизации их атомов, а также о низких значениях электроотрицательности.
Сверху вниз по группе наблюдается увеличение радиуса атомов, снижение электроотрицательности, увеличение восстановительных свойств простых веществ.
Какие элементы относятся к щелочным металлам
Перечень щелочных металлов:
- литий — Li;
- натрий — Na;
- калий — K;
- рубидий — Rb;
- цезий — Zs;
- франций — Fr.
Они занимают IA группу в Периодической системе Д. И. Менделеева.
Электронная формула, в какую группу входят
Строение атомов щелочных металлов, которые расположены в IA группе, можно свести к таблице следующего вида:
В роли окислителей в таких взаимодействиях участвуют простые и сложные вещества. Это могут быть неметаллы, органические соединения, кислоты, соли, оксиды.
Каждый элемент взаимодействует индивидуально.
Оксид в качестве продукта образовывается только в реакциях лития:
4 L i + O 2 = 2 L i 2 O
В случае с натрием в ходе реакции образуется пероксид, а с калием, рубидием, цезием — надпероксид:
2 N a + O 2 = N a 2 O 2
- К реакциям с простыми веществами относится образование галогенидов:
2 N a + C l 2 = 2 N a C l
Рассматривая взаимодействие с H2, S, P, C, Si, необходимо знать, что для протекания данных реакций необходимо нагревание.
Литий реагирует с азотом при комнатной температуре.
- Реакции с водой протекают у щелочных металлов по-разному: литий — спокойно, всплывая на поверхность жидкости, натрий реагирует более активно с образованием пламени, калий, цезий и рубидий реагируют со взрывом. В общем виде
2 M + 2 H 2 O = 2 M O H + H 2 (М – металл)
- В два этапа протекают реакции с кислотами. Металл сначала вступает в реакцию с водой, а после, в момент образования щелочи, она реагирует с разбавленной кислотой и нейтрализуется. Такие реакции часто протекают со взрывом, поэтому на практике проводятся редко.
- В результате реакции с аммиаком образуются амиды:
2 L i + 2 N H 3 = 2 L i N H 2 + H 2
- Взаимодействие с этанолом, фенолами, в ходе которого щелочные металлы замещают атомы водорода в гидроксильной группе ОН этих соединений:
2 N a + 2 C 2 H 5 O H = 2 C 2 H 5 O N a + H 2
- Щелочные металлы могут использоваться для восстановления других металлов, к примеру, алюминия:
3 N a + A l C l 3 = A l + 3 N a C l
Физические свойства щелочных металлов объясняются металлической связью в кристаллической решетке. Для них характерен металлический блеск, отличная ковкость, пластичность, тепло- и электропроводность.
Самым твердым из всей группы является литий, а самая высокая плотность у цезия. Некоторые физические свойства щелочных металлов в сравнении представлены в следующей таблице:
Из таблицы следует, что все элементы получили свое применение благодаря низким температурам плавления (кипения). Их значения снижаются по мере увеличения порядкового номера в Периодической системе Менделеева.
Все металлы, за исключением лития, настолько мягки, что их можно разрезать ножом или на специальном оборудовании раскатать в лист фольги.
Еще одно свойство, которое имеет практическое значение в промышленности — низкая плотность. Плотность лития, натрия и калия ниже плотности воды.
Указанные физические свойства обусловлены слабой связью электронов внешних слоев с атомами щелочных металлов. Поэтому энергия ионизации атомов невысокая, и они при взаимодействии друг с другом образуют металлическую связь.
В периодической таблице в начале каждого периода стоит элемент с низкой температурой плавления (щелочной металл). По мере увеличения порядковых номеров в периоде слева направо этот показатель сначала увеличивается к середине периода (IV А группа), где расположены элементы, образующие преимущественно атомные кристаллические решетки (C, Si).
Затем в конце периода температуры плавления снова уменьшаются, поскольку в VII-VIII группах расположены элементы, простые вещества которых характеризуются молекулярными кристаллическими решетками (галогены, благородные газы).
Меры предосторожности при работе с ними
Из-за высокой химической активности работа со щелочными металлами должна осуществляться с большой осторожностью. Для их хранения выделяются отдельные емкости, которые запаивают и помещают в них слой вазелинового масла или керосина. Тогда предотвращается взаимодействие с воздухом, в частности с кислородом, и исключается горение.
На каждом предприятии, где осуществляются работы с этими химическими элементами и их соединениями, разрабатываются специальные правила безопасности и меры предосторожности, исключающие наступление аварийных ситуаций и производственных травм.
Все сотрудники перед получением допуска к работе должны пройти обязательный производственный инструктаж, который бывает предварительный (перед началом работы) и периодический (через равные промежутки времени — ежеквартально, ежегодно). Они включают качественное изучение требований нормативных документов по безопасности труда и производственному нормированию.
Сотрудники на своих рабочих местах должны находиться в защитной спецодежде, быть оснащены средствами индивидуальной защиты (для органов зрения, дыхания, кожных покровов).
Поскольку растворы щелочных металлов — щелочи, их воздействие на кожу может привести к ожогам и раздражениям. Щелочи при попадании брызг в глаза могут спровоцировать отторжение ветвей глазного нерва и вызвать полную слепоту.
Выше описана возможность бурной реакции металлов с кислородом вплоть до взрыва. Поэтому рабочие места укомплектовываются средствами пожаротушения, которые периодически проходят технические проверки своей исправности. Щелочные металлы нельзя тушить водой, так как они вступают в реакцию с ней.
Натрий и калий можно тушить аргоном и азотом. Аргон эффективнее, поскольку существенно тяжелее воздуха. Литий продолжает гореть в атмосфере азота и диоксида углерода. Для тушения горящего лития разработаны специальные порошковые составы Вексон-D3 на основе различных флюсов и графита с гидрофобизирующими добавками.
С соблюдением техники безопасности проводится и утилизация отходов после работы. Они подвергаются нейтрализации с применением специальных составов, разрешенных для применения компетентными органами.
Получение простых веществ, где применяются
Чистый натрий можно получать путем электролиза расплава хлорида натрия с графитовыми электродами, обладающими инертностью. Поскольку в таком расплаве имеются ионы Na и Cl, в ходе электролиза на катоде восстанавливаются катионы натрия до металлического натрия, а на аноде — окисляются анионы хлора до газообразного хлора.
Соединения щелочных металлов и их применение
Из всей периодической системы большая часть элементов представляет группу металлов. Щелочные, щелочноземельные, амфотерные, переходные, радиоактивные - их очень много. Все металлы играют огромную роль не только в природе и биологической жизни человека, но и в различных отраслях промышленности. Не зря ведь XX век был назван "железным".

Металлы: общая характеристика
Все металлы объединяются общими химическими и физическими свойствами, по которым их легко отличить от неметаллических веществ. Так, например, строение кристаллической решетки позволяет им быть:
- проводниками электрического тока;
- хорошими теплопроводниками;
- ковкими и пластичными;
- прочными и блестящими.
Конечно, среди них есть и различия. Одни металлы блестят серебристым цветом, другие - более матовым белым, третьи - вообще красным и желтым. Также отличия есть и в показателях тепло- и электропроводности. Однако все равно эти параметры - общие для всех металлов, в то время как у неметаллов больше различий, нежели схожести.
По химической природе все металлы - восстановители. В зависимости от условий реакции и конкретных веществ могут выступать и в роли окислителей, однако редко. Способны образовывать многочисленные вещества. Химические соединения металлов встречаются в природе в огромном количестве в составе руды или полезных ископаемых, минералов и прочих пород. Степень окисления металлов всегда положительная, может быть постоянной (алюминий, натрий, кальций) или переменной (хром, железо, медь, марганец).
Многие из них получили широкое распространение в качестве строительных материалов, используются в самых разных отраслях науки и техники.

Химические соединения металлов
Среди таковых следует назвать несколько основных классов веществ, которые являются продуктами взаимодействия металлов с другими элементами и веществами.
- Оксиды, гидриды, нитриды, силициды, фосфиды, озониды, карбиды, сульфиды и прочие - бинарные соединения с неметаллами, чаще всего относятся к классу солей (кроме оксидов).
- Гидроксиды - общая формула Ме +х (ОН)х.
- Соли. Соединения металлов с кислотными остатками. Могут быть разными:
- средние;
- кислые;
- двойные;
- основные;
- комплексные.
4. Соединения металлов с органическими веществами - металлорганические структуры.
5. Соединения металлов друг с другом - сплавы, которые получаются разными способами.
Варианты соединения металлов
Вещества, в которых одновременно могут находиться два разных металла и более, подразделяются на:
- сплавы;
- двойные соли;
- комплексные соединения;
- интерметаллиды.
Способы соединения металлов между собой также варьируются. Например, для получения сплавов используют метод расплавления, смешения и затвердевания полученного продукта.
Интерметаллиды образуются в результате прямых химических реакций между металлами, нередко происходящих со взрывом (например, цинк и никель). Для таких процессов нужны особые условия: температура очень высокая, давление, вакуумность, отсутствие кислорода и прочие.

Двойные соли и комплексные соединения могут сформироваться при сливании растворов исходных веществ, а также при их сплавлении.
Изготовление изделий из металлов подразумевает также их соединение между собой. Для этого используют такие способы, как:
- сварка (газовая, электрическая и так далее);
- пайка разными видами припоев;
- резьба;
- заклепывание.
Главное условие - это создать такое изделие, которое сможет быть устойчивым к коррозии и в котором не будет швов и примесей, щелей.
Щелочными называются элементы, расположенные в первой группе главной подгруппе периодической системы. Их всего 6, и открыты они были практически все одновременно с небольшим временным интервалом. В форме простых веществ в природе данные элементы не встречаются.
Вследствие высокой химической активности работать с ними очень тяжело и опасно. Поэтому пришлось потрудиться, чтобы выделить их в чистом виде. Гораздо раньше людьми начали использоваться различные соединения щелочных металлов. Некоторые из них были известны еще с древности и не потеряли важности и актуальности сегодня. Они используются в технике, строительстве, медицине, пищевой отрасли, химической промышленности, металлургии, машиностроении, сельском хозяйстве и многих других разделах народного хозяйства. Основные из них рассмотрим подробнее.
Виды соединения щелочных металлов с другими металлами относятся к группам:
- интерметаллических соединений;
- комплексных соединений;
- двойных солей.

Оксиды
Из всех щелочных металлов при сгорании в кислороде нормальный оксид способен давать только литий. Остальные же проявляют чрезмерную активность, поэтому формируют пероксиды Ме2О2. Из пероксидов действием простого металла можно получить оксид нормального вида Ме2О. Кислородные соединения щелочных металлов имеют разную окраску.
- Оксид лития, калия и натрия - белые кристаллические порошки.
- Рубидий - желтая окраска оксида.
- Цезий - оранжевая.
Основная область применения - химическая промышленность. Оксиды щелочных металлов реагируют с водой, образуя важные соединения - щелочи. Этим свойством и обусловлено название данной группы элементов. Соединения щелочных металлов - оксиды - лишь часть от общей массы значимых и важных веществ, в состав которых входят эти элементы.
Гидроксиды (щелочи)
Соединения щелочных металлов с гидроксогруппой называют щелочами, или гидроксидами. Все они - очень едкие вещества, способные легко разрушать практически любой материал. Особенно это касается животных тканей. Поэтому работать с щелочами следует крайне осторожно, на месте контакта с кожей может возникнуть глубокий химический ожег.
Самым известным веществом среди щелочей является каустическая сода, или гидроокись натрия. Данное соединение известно еще с древних времен, где оно добывалось из золы растений и использовалось для мыловарения и стирки белья. Химическая формула - NaOH. Сегодня едкий натр производится огромными количествами в каждой стране, так как без его участия не обходится практически ни одна отрасль производства. Он используется:
- в нефтеперерабатывающей промышленности;
- в косметической и парфюмерной;
- в химических синтезах;
- для производства чистящих и моющих средств, абразивных материалов;
- в кожевенной и текстильной промышленности и других областях.
Другие металлы из группы щелочных формируют не столь важные и распространенные щелочи. Более-менее значимым является лишь гидроксид калия - КОН, который известен как едкое кали.

Такие соединения щелочных металлов, как соли, являются не только практически востребованными веществами, но и присутствуют в организме живых существ, поддерживая их нормальную жизнеспособность.
Самой главной солью является, безусловно, хлорид натрия. Это обычная поваренная соль, которая есть у каждого дома и которой не придают особого значения вследствие большой распространенности. Однако если представить, что она вдруг исчезнет, мало кто обрадуется последствиям. Несоленую пищу есть сложно, к тому же это наносит непоправимый вред здоровью, так как в организм не поступают ионы натрия, нужные для работы сердца и сосудов.
Также важные соединения щелочных металлов - это карбонаты. Особенно карбонат и бикарбонат натрия, который в простонародье называется содой. Его используют при производстве стекла, для изготовления моющих средств. Содой можно спокойно чистить посуду. Она обладает хорошими дезинфицирующими, обеззараживающими, очищающими и отбеливающими свойствами. Широко используется в пищевой промышленности, особенно в кондитерском деле и хлебопечении. С ее помощью варят мыло, создают стиральные порошки.
Сода, соль, каустик - все это соединения щелочных металлов в природе. Они существуют в чистом виде, формируя залежи, либо входят в состав продуктов сгорания тех или иных веществ. Иногда их получают лабораторным способом. Но всегда эти вещества важны и ценны, так как окружают человека и формируют его быт.
Соединения щелочных металлов и их применение не ограничиваются только натрием. Также распространены и популярны в отраслях хозяйства такие соли, как:
- хлорид калия; (нитрат калия);
- карбонат калия;
- сульфат.
Все они являются ценными минеральными удобрениями, используемыми в сельском хозяйстве.
Щелочноземельные металлы - соединения и их применение
К данной категории относятся элементы второй группы главной подгруппы системы химических элементов. Их постоянная степень окисления +2. Это активные восстановители, легко вступающие в химические реакции с большинством соединений и простых веществ. Проявляют все типичные свойства металлов: блеск, ковкость, тепло и электропроводность.

Самыми важными и распространенными из них являются магний и кальций. Бериллий проявляет амфотерность, барий и радий относятся к редким элементам. Все они способны формировать следующие типы соединений:
- интерметаллические;
- оксиды;
- гидриды;
- бинарные соли (соединения с неметаллами);
- гидроксиды;
- соли (двойные, комплексные, кислые, основные, средние).
Рассмотрим самые важные соединения с практической точки зрения и их области применения.
Соли магния и кальция
Такие соединения щелочноземельных металлов, как соли, имеют важное значение для живых организмов. Ведь именно соли кальция являются источником этого элемента в организме. А без него невозможно нормальное формирование скелета, зубов, рогов у животных, копыт, волос и шерстного покрова и так далее.
Так, самой распространенной солью щелочноземельного металла кальция является карбонат. Его другие названия:
Используется не только как поставщик ионов кальция в живой организм, но и как стройматериал, сырье для химических производств, в косметической промышленности, стекольной и так далее.
Такие соединения щелочноземельных металлов, как сульфаты, тоже имеют важное значение. Например, сульфат бария (медицинское название "баритовая каша") используется в рентгенодиагностике. Сульфат кальция в виде кристаллогидрата - это гипс, который содержится в природе. Он используется в медицине, строительстве, штамповке слепков.
Фосфоры из щелочноземельных металлов
Эти вещества известны еще со Средних веков. Раньше их называли люминофорами. Это название встречается и сейчас. По своей природе данные соединения - это сульфиды магния, стронция, бария, кальция.

При определенной обработке они способны проявлять фосфоресцирующие свойства, причем свечение очень красивое, от красного до ярко-фиолетового. Это применяется при изготовлении дорожных знаков, спецодежды и прочих вещей.
Комплексные соединения
Вещества, которые включают в себя два и более разных элементов металлической природы, - комплексные соединения металлов. Чаще всего они представляют собой жидкости, обладающие красивыми и разноцветными окрасками. Используются в аналитической химии для качественного определения ионов.
Такие вещества способны образовывать не только щелочные и щелочноземельные металлы, но и все остальные. Бывают гидроксокомплексы, аквакомплексы и другие.
Соединения железа. Железо: физические и химические свойства
Первые изделия из железа и его сплавов были найдены при раскопках и датируются примерно 4 тысячелетием до нашей эры. То есть еще древние египтяне и шумеры использовали метеоритные месторождения данного вещества, чтобы изготовлять украшения и предметы быта, а также оружие.

Сегодня соединения железа различного рода, а также чистый металл - это самые распространенные и применяемые вещества. Не зря XX век считался железным. Ведь до появления и широкого распространения пластика и сопутствующих материалов именно это соединение имело для человека решающее значение. Что представляет собой данный элемент и какие вещества образует, рассмотрим в данной статье.
Химический элемент железо
Если рассматривать строение атома, то в первую очередь следует указать его местоположения в периодической системе.
- Порядковый номер - 26.
- Период - четвертый большой.
- Группа восьмая, подгруппа побочная.
- Атомный вес - 55,847.
- Строение внешней электронной оболочки обозначается формулой 3d 6 4s 2 . - Fe.
- Название - железо, чтение в формуле - "феррум".
- В природе существует четыре стабильных изотопа рассматриваемого элемента с массовыми числами 54, 56, 57, 58.
Химический элемент железо имеет также около 20 различных изотопов, которые не отличаются стабильностью. Возможные степени окисления, которые может проявлять данный атом:
Важное значение имеет не только сам элемент, но и его различные соединения и сплавы.
Физические свойства
Как простое вещество, железо физические свойства имеет с ярко выраженным металлизмом. То есть это серебристо-белый с серым оттенком металл, обладающий высокой степенью ковкости и пластичности и высокой температурой плавления и кипения. Если рассматривать характеристики более подробно, то:
- температура плавления - 1539 0 С;
- кипения - 2862 0 С;
- активность - средняя;
- тугоплавкость - высокая;
- проявляет ярко выраженные магнитные свойства.
В зависимости от условий и различных температур, существует несколько модификаций, которые образует железо. Физические свойства их различаются от того, что разнятся кристаллические решетки.
- Альфа-форма, или феррит, существует до температуры в 769 0 С.
- От 769 до 917 0 С - бета-форма.
- 917-1394 0 С - гамма-форма, или аустенит.
- Свыше 1394 0 С - сигма-железо.

Все модификации имеют различные типы строения кристаллических решеток, а также отличаются магнитными свойствами.
Химические свойства
Как уже упоминалось выше, простое вещество железо проявляет среднюю химическую активность. Однако в мелкодисперсном состоянии способно самовоспламеняться на воздухе, а в чистом кислороде сгорает сам металл.
Коррозионная способность высокая, поэтому сплавы данного вещества покрываются легирующими соединениями. Железо способно взаимодействовать с:
- кислотами;
- кислородом (в том числе воздухом);
- серой;
- галогенами;
- при нагревании - с азотом, фосфором, углеродом и кремнием;
- с солями менее активных металлов, восстанавливая их до простых веществ;
- с острым водяным паром;
- с солями железа в степени окисления +3.
Очевидно, что, проявляя такую активность, металл способен образовывать различные соединения, многообразные и полярные по свойствам. Так и происходит. Железо и его соединения чрезвычайно разнообразны и находят применение в самых разных отраслях науки, техники, промышленной деятельности человека.
Распространение в природе
Природные соединения железа встречаются довольно часто, ведь это второй по распространенности элемент на нашей планете после алюминия. При этом в чистом виде металл встречается крайне редко, в составе метеоритов, что говорит о больших его скоплениях именно в космосе. Основная же масса содержится в составе руд, горных пород и минералов.

Если говорить о процентном содержании рассматриваемого элемента в природе, то можно привести следующие цифры.
- Ядра планет земной группы - 90%.
- В земной коре - 5%.
- В мантии Земли - 12%.
- В земном ядре - 86%.
- В речной воде - 2 мг/л.
- В морской и океанской - 0,02 мг/л.
Самые распространенные соединения железа формируют следующие минералы:
- магнетит;
- лимонит или бурый железняк;
- вивианит;
- пирротин;
- пирит;
- сидерит;
- марказит;
- леллингит;
- миспикель;
- милантерит и прочие.
Это еще далеко не полный список, ведь их действительно очень много. Кроме того, широко распространены различные сплавы, которые создаются человеком. Это тоже такие соединения железа, без которых сложно представить современную жизнь людей. К ним относятся два основных типа:
Также именно железо является ценной добавкой в составе многих никелевых сплавов.
Соединения железа (II)
К таковым относятся такие, в которых степень окисления образующего элемента равна +2. Они достаточно многочисленны, ведь к ним можно отнести:
- оксид;
- гидроксид;
- бинарные соединения;
- сложные соли;
- комплексные соединения.
Формулы химических соединений, в которых железо проявляет указанную степень окисления, для каждого класса индивидуальны. Рассмотрим наиболее важные и распространенные из них.
- Оксид железа (II). Порошок черного цвета, в воде не растворяется. Характер соединения - основный. Способен быстро окисляться, однако и восстанавливаться до простого вещества может также легко. Растворяется в кислотах, образуя соответствующие соли. Формула - FeO.
- Гидроксид железа (II). Представляет собой белый аморфный осадок. Образуется при реакции солей с основаниями (щелочами). Проявляет слабые основные свойства, способен быстро окисляться на воздухе до соединений железа +3. Формула - Fe(OH)2.
- Соли элемента в указанной степени окисления. Имеют, как правило, бледно-зеленую окраску раствора, хорошо окисляются даже на воздухе, приобретая темно-бурый цвет и переходя в соли железа 3. Растворяются в воде. Примеры соединений: FeCL2, FeSO4, Fe(NO3)2.

Практическое значение среди обозначенных веществ имеют несколько соединений. Во-первых, хлорид железа (II). Это главный поставщик ионов в организм человека, больного анемией. Когда такой недуг диагностируется у пациента, то ему прописывают комплексные препараты, в основе которых лежит рассматриваемое соединение. Так происходит восполнение дефицита железа в организме.
Во-вторых, железный купорос, то есть сульфат железа (II), вместе с медным используется для уничтожения сельскохозяйственных вредителей на посевах. Метод доказывает свою эффективность уже не первый десяток лет, поэтому очень ценится садоводами и огородниками.
Соль Мора
Это соединение, которое представляет собой кристаллогидрат сульфата железа и аммония. Формула его записывается, как FeSO4*(NH4)2SO4*6H2O. Одно из соединений железа (II), которое получило широкое применение на практике. Основные области использования человеком следующие.
- Фармацевтика.
- Научные исследования и лабораторные титриметрические анализы ( для определения содержания хрома, перманганата калия, ванадия).
- Медицина - как добавка в пищу при нехватке железа в организме пациента.
- Для пропитки деревянных изделий, так как соль Мора защищает от процессов гниения.
Есть и другие области, в которых находит применение это вещество. Название свое оно получило в честь немецкого химика, впервые обнаружившего проявляемые свойства.
Вещества со степенью окисления железа (III)
Свойства соединений железа, в которых оно проявляет степень окисления +3, несколько отличны от рассмотренных выше. Так, характер соответствующего оксида и гидроксида уже не основный, а выраженный амфотерный. Дадим описание основным веществам.
- Оксид железа (III). Порошок мелкокристаллический, красно-бурого цвета. В воде не растворяется, проявляет свойства слабо кислотные, больше амфотерные. Формула: Fe2O3.
- Гидроксид железа (III). Вещество, выпадающее в осадок при действии щелочами на соответствующие соли железа. Характер его выраженный амфотерный, цвет буро-коричневый. Формула: Fe(OH)3.
- Соли, в состав которых входит катион Fe 3+ . Таких выделено множество, за исключением карбоната, так как происходит гидролиз и выделяется углекислый газ. Примеры формул некоторых солей: Fe(NO3)3, Fe2(SO4)3, FeCL3, FeBr3 и прочие.

Среди приведенных примеров с практической точки зрения важное значение имеет такой кристаллогидрат, как FeCL3*6H2O, или шестиводный хлорид железа (III). Его применяют в медицине для остановки кровотечений и восполнения ионов железа в организме при анемии.
Девятиводный сульфат железа (III) используется для очистки питьевой воды, так как ведет себя как коагулянт.
Соединения железа (VI)
Формулы химических соединений железа, где оно проявляет особую степень окисления +6, можно записать следующим образом:
Все они имеют общее название - ферраты - и обладают схожими свойствами (сильные восстановители). Также они способны обеззараживать и обладают бактерицидным действием. Это позволяет использовать их для обработки питьевой воды в промышленных масштабах.
Очень важными в аналитической химии и не только являются особые вещества. Такие, которые образуются в водных растворах солей. Это комплексные соединения железа. Наиболее популярные и хорошо изученные из них следующие.
- Гексацианоферрат (II) калия K4[Fe(CN)6]. Другое название соединения - желтая кровяная соль. Используется для качественного определения в растворе иона железа Fe 3+ . В результате воздействия раствор приобретает красивую ярко-синюю окраску, так как формируется другой комплекс - берлинская лазурь KFe 3+ [Fe 2+ (CN)6]. Издревле использовалась как краситель для ткани.
- Гексацианоферрат (III) калия K3[Fe(CN)6]. Другое название - красная кровяная соль. Используется как качественный реагент на определение иона железа Fe 2+ . В результате образуется синий осадок, имеющий название турнбулева синь. Также использовалась, как краситель для ткани.

Железо в составе органических веществ
Железо и его соединения, как мы уже убедились, имеют большое практическое значение в хозяйственной жизни человека. Однако, помимо этого, его биологическая роль в организме не менее велика, даже наоборот.
Существует одно очень важное органическое соединение, белок, в состав которого входит данный элемент. Это гемоглобин. Именно благодаря ему происходит транспорт кислорода и осуществляется равномерный и своевременный газообмен. Поэтому роль железа в жизненно важном процессе - дыхании - просто огромна.

Всего внутри организма человека содержится около 4 грамм железа, которое постоянно должно пополняться за счет потребляемых продуктов питания.
Химические свойства металлов и их соединений
Щелочные металлы — общая характеристика, строение атомов, физические и химические свойства
Щелочные металлы — металлы, расположенные в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (в 1 группе в длиннопериодной форме ПСХЭ).
К щелочным металлам относят:
- литий Li;
- натрий Na;
- калий K;
- цезий Cs;
- рубидий Rb;
- франций Fr.
Внешний энергетический уровень щелочных металлов обладает следующей электронной конфигурацией: n s 1 . На внешнем энергетическом уровне расположен 1 s-электрон. Таким образом, для щелочных металлов типичной является степень окисления в соединениях +1.
В ряду L i - N a - K - R b - C s - F r , согласно Периодическому закону, можно выявить следующие закономерности:
- увеличение атомного радиуса;
- усиление металлических свойств;
- ослабление неметаллических свойств;
- снижение степени электроотрицательности.
Общие физические свойства щелочных металлов:
- металлическая кристаллическая решетка у твердого вещества;
- высокая теплопроводность;
- высокая электропроводимость;
- низкие температуры кипения;
- низкие температуры плавления;
- небольшие показатели плотности.
Щелочные металлы являются мягкими веществами с серебристой окраской. На свежем срезе можно наблюдать характерный блеск.
Высокая химическая активность щелочных металлов при контакте с водой, кислородом, в некоторых случаях с азотом ( L i ) , объясняет наличие особых требований к режиму хранения. Материалы помещают под слой керосина. Перед проведением химического опыта от щелочного металла отделяют фрагмент необходимого размера с помощью скальпеля под слоем керосина. Затем в атмосфере аргона удаляют с металлической поверхности продукты, образованные при его реакции с воздухом. После этого фрагмент перемещают в резервуар для проведения реакций.
Одним из ключевых свойств щелочных металлов является высокая степень активности при взаимодействии с водой.
Относительно спокойная реакция без взрыва наблюдается при контакте лития с водой:
2 L i + 2 H 2 O ⟶ 2 L i O H + H 2 ↑ 2 L i + 2 H 2 O ⟶ 2 L i O H + H 2 ↑
Аналогичный химический процесс с натрием сопровождается горением пламенем желтого цвета и небольшим взрывом. Калий проявляет большую активность по сравнению с натрием. При такой реакции происходит сильный взрыв, а пламя приобретает фиолетовую окраску.
Щелочные металлы взаимодействуют с кислородом. В результате горения щелочных металлов в воздушной среде образуются вещества различного состава. Компонентный набор продуктов реакции определяется активностью металла.
Горение лития в воздушной среде приводит к образованию оксида стехиометрического состава:
4 L i + O 2 ⟶ 2 L i 2 O 4 L i + O 2 ⟶ 2 L i 2 O
Натрий горит на воздухе, что сопровождается синтезом пероксида N a 2 O 2 с небольшой добавкой в виде надпероксида N a O 2 :
2 N a + O 2 ⟶ N a 2 O 2 2 N a + O 2 ⟶ N a 2 O 2
Продукты, образованные в процессе горения калия, рубидия и цезия, включают в состав, как правило, надпероксиды:
K + O 2 ⟶ K O 2 K + O 2 ⟶ K O 2
R b + O 2 ⟶ R b O 2 R b + O 2 ⟶ R b O 2
C s + O 2 ⟶ C s O 2 C s + O 2 ⟶ C s O 2
Синтезировать оксиды натрия и калия можно путем повышения температуры смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствии кислорода:
2 N a + 2 N a O H ⟶ 2 N a 2 O + H 2 ↑ 2 N a + 2 N a O H ⟶ 2 N a 2 O + H 2 ↑
2 N a + N a 2 O 2 ⟶ 2 N a 2 O 2 N a + N a 2 O 2 ⟶ 2 N a 2 O
3 K + K O 2 ⟶ 2 K 2 O 3 K + K O 2 ⟶ 2 K 2 O
Кислородные соединения щелочных металлов обладают уникальной особенностью. Закономерно с увеличением радиуса катиона щелочного металла повышается степень устойчивости кислородных соединений, в состав которых входят пероксид-ион ( О 2 ) 2 - и надпероксид-ион ( О 2 ) - .
Тяжелые щелочные металлы способны формировать достаточно устойчивые озониды Э О 3 . Кислородные соединения щелочных металлов обладают различной окраской, интенсивность которой повышается от Li до Cs:
Проявление пероксидами и надпероксидами свойств сильных окислителей:
N a 2 O 2 + 2 N a I + 2 H 2 S O 4 ⟶ I 2 + 2 N a 2 S O 4 + 2 H 2 O N a 2 O 2 + 2 N a I + 2 H 2 S O 4 ⟶ I 2 + 2 N a 2 S O 4 + 2 H 2 O
Интенсивное взаимодействие пероксидов и надпероксидов с водой, что сопровождается формированием гидроксидов:
N a 2 O 2 + 2 H 2 O ⟶ 2 N a O H + H 2 O 2 N a 2 O 2 + 2 H 2 O ⟶ 2 N a O H + H 2 O 2
2 K O 2 + 2 H 2 O ⟶ 2 K O H + H 2 O 2 + O 2 ↑ 2 K O 2 + 2 H 2 O ⟶ 2 K O H + H 2 O 2 + O 2 ↑
Щелочные металлы вступают в химические реакции со многими неметаллами. В процессе нагрева вещества формируют соединения с водородом. В результате образуются гидриды. Щелочные металлы могут взаимодействовать со следующими веществами:
- галогены;
- сера;
- азот;
- фосфор;
- углерод;
- кремний.
В результате таких химических реакций образуются соответственно:
- галогениды;
- сульфиды;
- нитриды;
- фосфиды;
- карбиды;
- силициды.
2 N a + H 2 ⟶ 2 N a H 2 N a + H 2 ⟶ 2 N a H
2 N a + C l 2 ⟶ 2 N a C l 2 N a + C l 2 ⟶ 2 N a C l
2 K + S ⟶ K 2 S 2 K + S ⟶ K 2 S
6 L i + N 2 ⟶ 2 L i 3 N 6 L i + N 2 ⟶ 2 L i 3 N
Последняя реакции протекает при комнатной температуре.
2 L i + 2 C ⟶ L i 2 C 2 2 L i + 2 C ⟶ L i 2 C 2
При повышении температуры происходят химические реакции щелочных металлов с другими металлами. Продуктами данной реакции являются соединения металлов — интерметаллиды.
Активно протекает взаимодействие щелочных металлов с кислотами. Процесс сопровождается взрывом.
Растворение щелочных металлов в жидком аммиаке и его производных — аминах и амидах:
2 N a + 2 N H 3 ⟶ 2 N a N H 2 + H 2 ↑ 2 N a + 2 N H 3 ⟶ 2 N a N H 2 + H 2 ↑
Растворяясь в жидком аммиаке, щелочной металл утрачивает электрон, который сольватируется молекулами аммиака и окрашивает раствор в голубой цвет. Образованные в результате амиды достаточно просто разлагаются водой, что приводит к образованию щелочи и аммиака:
K N H 2 + H 2 O ⟶ K O H + N H 3 ↑ K N H 2 + H 2 O ⟶ K O H + N H 3 ↑
Щелочные металлы вступают в химические реакции с органическими веществами.
При взаимодействии щелочных металлов со спиртами образуются алкоголяты. Если вещество контактирует с карбоновыми кислотами, продуктом реакции являются соли.
2 N a + 2 C H 3 C H 2 O H ⟶ 2 C H 3 C H 2 O N a + H 2 ↑ 2 N a + 2 C H 3 C H 2 O H ⟶ 2 C H 3 C H 2 O N a + H 2 ↑
2 N a + 2 C H 3 C O O H ⟶ 2 C H 3 C O O N a + H 2 ↑ 2 N a + 2 C H 3 C O O H ⟶ 2 C H 3 C O O N a + H 2 ↑
Щелочные металлы распознают по окраске пламени спиртовки, если в него вносить их соединения. По причине небольших потенциалов ионизации щелочных металлов при нагреве металла или его соединений в пламени происходит ионизация атомов. В результате пламя приобретает определенную окраску:
Соединения щелочных металлов, примеры
Получение гидроксидов щелочных металлов связано с применением электролитических способов. Самым крупнотоннажным является получение гидроксида натрия с помощью реакции электролиза концентрированного водного раствора поваренной соли:
2 N a C l + 2 H 2 O ⟶ H 2 ↑ + C l 2 ↑ + 2 N a O H 2 N a C l + 2 H 2 O ⟶ H 2 ↑ + C l 2 ↑ + 2 N a O H
катод: 2 H + + 2 e ⟶ H 2 ↑ 2 H + + 2 e ⟶ H 2 ↑
анод: 2 C l - - 2 e ⟶ C l 2 ↑ 2 C l - - 2 e ⟶ C l 2 ↑
В прошлом для получения щелочи применяли реакцию обмена:
N a 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 N a O H N a 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 N a O H
Продуктом данной реакции является щелочь с большой концентрацией соды N a 2 C O ) 3 .
Гидроксиды щелочных металлов представляют собой гигроскопичные вещества с белой окраской, водные растворы которых являются сильными основаниями.
Гидроксиды щелочных металлов, как и все основания, вступают в химические реакции с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
2 L i O H + H 2 S O 4 ⟶ L i 2 S O 4 + 2 H 2 O 2 L i O H + H 2 S O 4 ⟶ L i 2 S O 4 + 2 H 2 O
2 K O H + C O 2 ⟶ K 2 C O 3 + H 2 O 2 K O H + C O 2 ⟶ K 2 C O 3 + H 2 O
K O H + A l ( O H ) 3 ⟶ K [ A l ( O H ) 4 ] K O H + A l ( O H ) 3 ⟶ K [ A l ( O H ) 4 ]
Если нагреть гидроксиды щелочных металлов, то вещества возгоняются без разложения. Исключение составляет гидроксид лития, который аналогично гидроксидам металлов главной подгруппы II группы, в процессе прокаливания разлагается на оксид и воду:
2 L i O H ⟶ L i 2 O + H 2 O 2 L i O H ⟶ L i 2 O + H 2 O
Гидроксид натрия используют в производстве твердого мыла и других веществ:
- моющих средств синтетического состава;
- волокон искусственного происхождения;
- органических соединений таких, как фенол.
Ценным продуктом, в состав которого входит щелочной металл, является сода N a 2 C O 3 . Большую часть от объемов мирового производства соды получают с помощью методики Сольве. Данный метод был изобретен в начале XX столетия. Принцип технологии заключается в следующем: водный раствор N a C l с добавлением аммиака насыщают углекислым газом при температуре 26—30 °C. В результате синтезируют гидрокарбонат натрия с низкой степенью растворимости, который получил название питьевой соды:
N a C l + N H 3 + C O 2 + H 2 O ⟶ N a H C O 3 ↓ + N H 4 C l N a C l + N H 3 + C O 2 + H 2 O ⟶ N a H C O 3 ↓ + N H 4 C l
С целью нейтрализовать кислотную среду, которая формируется при пропускании углекислого газа через раствор, добавляют аммиак. Таким образом, получают гидрокарбонат-ион ( H C O 3 ) - , который требуется для того, чтобы продукт выпал в осадок. После того, как отделяется питьевая сода, раствор с хлоридом аммония нагревают с известью и выделяют аммиак, что позволяет вернуть его в зону реакции:
2 N H 4 C l + C a ( O H ) 2 ⟶ 2 N H 3 ↑ + C a C l 2 + 2 H 2 O 2 N H 4 C l + C a ( O H ) 2 ⟶ 2 N H 3 ↑ + C a C l 2 + 2 H 2 O
Аммиачный способ производства соды характеризуется наличием единственного отхода в виде хлорида кальция. Данное вещество остается в растворе и обладает ограниченным применением.
С помощью прокаливания гидрокарбоната натрия можно получить кальцинированную, или стиральную, соду Na_CO_ и диоксид углерода, который используют в синтезе гидрокарбоната натрия:
2 N a H C O 3 ⟶ N a 2 C O 3 + C O 2 ↑ + H 2 O 2 N a H C O 3 ⟶ N a 2 C O 3 + C O 2 ↑ + H 2 O
Большую часть произведенной соды потребляют предприятия стекольной промышленности.
Гидрокарбонат калия K H C O 2 по сравнению с малорастворимой кислой солью N a H C O 3 хорошо растворяется в воде. По этой причине карбонат калия, или поташ, K 2 C O 3 получают путем химической реакции углекислого газа с раствором гидроксида калия:
Поташ активно применяют в производстве стекла и жидкого мыла.
Литий является единственным из всех щелочных металлов, для которого не получен гидрокарбонат. Данное обстоятельство объясняется слишком маленьким радиусом иона лития, не позволяющим ему удерживать достаточно крупный ион ( H C O 3 ) - .
Оксиды щелочных металлов, за исключением лития, получают исключительно косвенными методами. В процессе натрий взаимодействует с окислителями в расплаве.
Получение оксида натрия путем реакции натрия с нитратом натрия в расплаве:
Взаимодействие натрия с пероксидом натрия:
Химическая реакция между натрием и расплавом щелочи:
Получение оксида лития путем разложения гидроксида лития:
Оксиды щелочных металлов по описанию являются типичными основными оксидами. Соединения взаимодействуют со следующими веществами:
- кислотные оксиды;
- амфотерные оксиды;
- кислоты;
- вода.
Взаимодействие оксида натрия с оксидом фосфора (V):
Реакция оксида натрия с амфотерным оксидом алюминия:
При взаимодействии оксидов щелочных металлов с кислотами образуются средние и кислые соли (с многоосновными кислотами). К примеру, оксид калия вступает в химическую реакцию с соляной кислотой, что сопровождается образованием хлорида калия и воды:
Можно наблюдать активное взаимодействие оксидов щелочных металлов с водой. Продуктом такой реакции являются щелочи. К примеру, оксид лития взаимодействует с водой, что сопровождается образованием гидроксида лития:
Окисление оксидов щелочных металлов кислородом (за исключением оксида лития) происходит так, что оксид натрия окисляется до пероксида, оксиды калия, рубидия и цезия — до надпероксида. К примеру, уравнение реакции:
Получение и применение щелочных металлов
Существует несколько основных способов получения щелочных металлов:
- электролиз расплавов галогенидов;
- электролиз расплавов гидроксидов;
- восстановление из галогенидов.
Получить щелочные металлы можно с помощью электролиза расплавов их галогенидов. Это основной способ получения данных веществ. Как правило, применяют хлориды, которые образуют природные минералы:
2 L i C l ⟶ 2 L i + C l 2 ↑ 2 L i C l ⟶ 2 L i + C l 2 ↑
катод: L i + + e ⟶ Li L i + + e ⟶ Li
В некоторых случаях оправдано получение щелочных металлов с помощью электролиза расплавов их гидроксидов (гидроксиды зачастую имеют более низкие температуры плавления):
4 N a O H ⟶ 4 N a + 2 H 2 O + O 2 ↑ 4 N a O H ⟶ 4 N a + 2 H 2 O + O 2 ↑
катод: N a + + e ⟶ Na N a + + e ⟶ Na
анод: 4 O H - - 4 e ⟶ 2 H 2 O + O 2 ↑ 4 O H - - 4 e ⟶ 2 H 2 O + O 2 ↑
Щелочной металл удается восстановить из соответствующего хлорида или бромида кальцием, магнием, кремнием и другими восстановителями в процессе повышения температуры в вакуумной среде до 600—900 °C:
2 M C l + C a ⟶ 2 M ↑ + C a C l 2 2 M C l + C a ⟶ 2 M ↑ + C a C l 2
С целью задать химической реакции нужное направление необходимо удалить образованный свободный щелочной металл (M) с помощью отгонки. Таким же способом восстанавливают цирконий из хромата. Известно, что получить натрий можно, если восстановить его из карбоната углем при температуре в 1000 °C с добавлением известняка.
В связи с тем, что щелочные металлы в электрохимическом ряду напряжений расположены слева от водорода, электролитическое получение их из водных растворов солей не представляется возможным. В таком случае продуктами реакции являются соответствующие щелочи и водород.
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
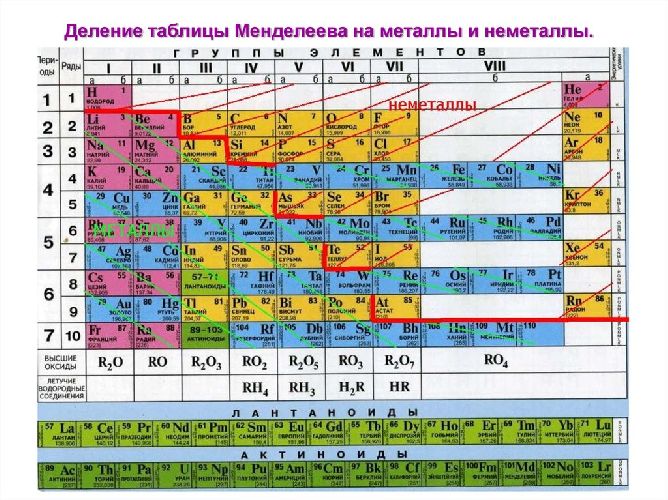
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Читайте также:
