Соединение металлов и их применение
Обновлено: 04.10.2024
§ 50.3. Применение и биологическая роль металлов В-групп и их соединений
Применение металлов и их соединений
Из материала § 43 и § 49 вы уже знаете практическое применение сплавов на основе меди на примере бронзы и латуни, какую огромную роль играет производство сплавов железа—чугуна и стали для нужд машино-, станко-, тракторо-, приборо- и судостроения, в строительстве, производстве бытовой техники и сантехнического оборудования, железнодорожного транспорта.
Рассмотрим области использования других металлов В-групп , а также их соединений.
Хром. Этот металл находит применение в металлургии как легирующий компонент при получении специальных сталей и других сплавов. Нержавеющие стали, содержащие до 23 % хрома, устойчивы к коррозии и действию высоких температур. Их используют в химической и нефтяной промышленности для производства различных аппаратов. Хромомолибденовые и никельмолибденовые стали необходимы для изготовления брони, стволов орудий.
Благодаря блеску, устойчивости к коррозии, износостойкости защитно-декоративные покрытия из хрома применяют на стадии финишной обработки деталей автомобилей, велосипедов, инструмента, а также для восстановления изношенных деталей машин. Различные хроматы используют для подготовки тканей к крашению. Хроматы вводят в состав лаков и красок, чтобы придать им окраску. Хромовые квасцы используют для выделки кож. Очень твёрдый и тугоплавкий порошок оксида хрома(III) Сr2O3 применяют в составе полирующих средств, для приготовления красок, как катализатор в ряде органических реакций, как компонент керамики.
Марганец. Около 90 % марганца применяют в металлургии для легирования сталей. Он придает сплавам коррозионную стойкость, вязкость и твёрдость. Например, марганцевую сталь, содержащую 12–15 % марганца, используют для изготовления железнодорожных рельсов. Из сплава манганина (83 % Сu, 13 % Мn, 4 % Ni) делают проволоку для катушек сопротивления, так как электрическая проводимость такой проволоки почти не меняется с температурой.
Оксид марганца(IV) MnO2 применяют в качестве катализатора, окислителя в химических источниках тока, для обесцвечивания стекла и в производстве спичек.
KМnO4 используется в качестве реагента в аналитической химии. На окислительном действии перманганата калия основано его применение в качестве наружного препарата, обладающего противомикробными свойствами.
Серебро. Из этого драгоценного металла изготавливают ювелирные изделия, столовые приборы. Благодаря высокой электропроводности и устойчивости к коррозии серебро применяют как материал контактов электротехнических изделий. Серебро входит в состав припоев — легкоплавких сплавов с медью, оловом. В химической промышленности серебро используют в качестве катализатора в реакциях окисления, например при производстве формальдегида из метанола.
Бромид серебра(I) с добавками его хлорида или йодида — основной компонент галоидосеребряных фотоматериалов для записи голограмм и результатов рентгенологических исследований в медицинской диагностике.
Серебро входит в состав некоторых медицинских препаратов (колларгол, протаргол) из-за своего бактерицидного действия.
Медь. Благодаря исключительно высокой электро- и теплопроводности, около 40 % всей добываемой меди используется для изготовления электрических проводов и кабелей, различных соединительных устройств, например печатных плат в электроприборах, кредитных карточках, изделиях электронной техники. Из меди изготавливают нагревательные аппараты.
Сплав меди с оловом, бронзу, благодаря её коррозионной стойкости, устойчивости к истиранию используют в машиностроении для изготовления трущихся деталей, в авиации, судостроении, изготовлении скульптур, памятников, домашней утвари, люстр. Из латуни, сплава меди с цинком, отличающейся также коррозионной устойчивостью, пластичностью, декоративным внешним видом, изготавливают детали машин, приборов и различного оборудования, в том числе сантехнического, различные трубы и змеевики, фурнитуру, посуду, ювелирные изделия.
Широкое применение находят сплавы меди с никелем (мельхиор), меди с марганцем и небольшой добавкой никеля (манганин), меди с цинком и никелем (нейзильбер). Они обладают стойкостью к атмосферной коррозии. Мельхиор применяют в судо- и аппаратостроении, изготовлении медицинского инструмента. Манганин нужен для изготовления электроизмерительных приборов. Нейзильбер востребован в производстве деталей точных приборов, медицинских инструментов.
Оксид меди(II) CuO применяют в стекольной промышленности для окраски стёкол и эмалей, как окислитель в органическом анализе. Сульфат или хлорид меди(II) — основной компонент процесса электрохимического осаждения медных покрытий. Медный купорос применяют в сельском хозяйстве для уничтожения вредителей растений, в медицине как антисептическое и вяжущее средство для наружного применения.
Цинк. Цинковыми покрытиями защищают изделия из стали от коррозии. Цинк входит в состав сплавов с медью, алюминием и магнием. Большое количество цинка расходуется на изготовление анодов гальванических элементов.
Цинковый купорос ZnSО4 ∙ 7H2О применяют для крашения тканей, в медицине, для электролитического получения цинка. Оксид цинка ZnO используют в производстве автомобильных шин, а также в изготовлении белой масляной краски (цинковые белила).
Титан. Этот металл по внешнему виду похож на полированную сталь. Химически он достаточно активен, однако из-за образования на его поверхности плотной оксидной плёнки титан более стоек к коррозии, чем нержавеющая сталь. Он также жаростоек, устойчив к действию морской воды и к ряду агрессивных химических сред (азотная кислота, царская водка и др.). Это позволяет использовать его для изготовления химической аппаратуры, подводных лодок.
Плотность титана ( 4,5 г/см 3 ) в 1,7 раза больше плотности алюминия, но титан в 3 раза прочнее алюминия. Это открывает перспективы применения титана в качестве конструкционного материала для двигателей и корпусов летательных аппаратов.
Часто говорят, что титан — металл хирургов. Из него изготавливают вживляемые в организм человека прочные и лёгкие протезы и имплантаты. Благодаря прочной оксидной плёнке на поверхности титан устойчив в агрессивных средах организма человека, не вызывает аллергии, а ткани вокруг титановых протезов и имплантатов не воспаляются.
Оксид титана(IV) используют при изготовлении тугоплавкого стекла, глазури, эмали, керамики, термостойкой лабораторной посуды, а также для приготовления белой масляной краски — титановых белил. Полупроводниковые свойства диоксида титана делают возможным его применение в газовых сенсорах, в ряде каталитических окислительно-восстановительных процессов, для фотокаталитической очистки воды.
Кристаллы титаната бария ВаТiO3 обладают особенными электрическими свойствами, и поэтому из них изготавливают чувствительные элементы в ультразвуковой и гидроакустической аппаратуре.
Никель. Это серебристо-белый металл, обладает ферромагнитными свойствами, довольно пластичен. Компактный никель химически малоактивен. При обычных условиях покрывается тонкой плёнкой NiO, которая защищает его от действия воздуха и воды. Эти свойства определяют области применения никеля.
Никель — важный компонент конструкционных, нержавеющих и жаропрочных сталей, входит в состав константана, используемого в приборостроении. Из жаропрочных никелевых сплавов, содержащих до 80 % никеля, делают лопатки турбин и детали камер сгорания реактивных двигателей летательных аппаратов и многие детали в атомных реакторах. Никель — основной компонент постоянных магнитов.
Широкое применение нашли защитно-декоративные покрытия из никеля и его сплавов с фосфором или бором на изделиях из металлов, полимеров, стекла, керамики. Дисперсный никель используют как катализатор во многих химико-технологических процессах получения водорода, гидрирования или восстановления водородом органических соединений.
Сульфат и хлорид никеля применяют в гальванотехнике для осаждения никелевых покрытий.
4. Применение металлов и их сплавов
О том, что свойства металлов меняются при их сплавлении, стало известно ещё в древности. \(5\) тысяч лет тому назад наши предки научились делать бронзу — сплав олова с медью. Бронза по твёрдости превосходит оба металла, входящие в её состав.
Свойства чистых металлов, как правило, не соответствуют необходимым требованиям, поэтому практически во всех сферах человеческой деятельности используют не чистые металлы, а их сплавы.
Сплав — это материал, который образуется в результате затвердения расплава двух или нескольких отдельных веществ.
В состав сплавов кроме металлов могут входить также неметаллы, например, такие как углерод или кремний.
Добавляя в определённом количестве примеси других металлов и неметаллов, можно получить многие тысячи материалов с самыми разнообразными свойствами, в том числе и такими, каких нет ни у одного из составляющих сплав элементов.
- механически прочнее и твёрже,
- со значительно более высокой или низкой температурой плавления,
- устойчивее к коррозии,
- устойчивее к высоким температурам,
- практически не менять своих размеров при нагревании или охлаждении и т. д.
Например, чистое железо — сравнительно мягкий металл. При добавлении в железо углерода твёрдость его существенно возрастает. По количеству углерода, а следовательно, и по твёрдости, различают сталь (содержание углерода менее \(2\) % по массе), чугун (\(С\) — более \(2\) % ). Но не только углерод изменяет свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам делает сталь намного более твёрдой, добавка марганца делает сплав износостойким, а ванадия — прочным.
Сплавы, используемые для изготовления различных конструкций, должны быть прочными и легко обрабатываемыми.
Такие сплавы железа, как стали, отличаются высокой прочностью и твёрдостью. Их можно ковать, прессовать, сваривать.
Чугуны используют для изготовления массивных и очень прочных деталей. Например, раньше из чугуна отливали радиаторы центрального отопления, канализационные трубы, до сих пор изготавливают котлы, перила и опоры мостов. Изделия из чугуна изготавливаются с применением литья.
Сплавы алюминия, используемые в конструкциях, наряду с прочностью должны отличаться лёгкостью. Дюралюминий, силумин — сплавы алюминия, они незаменимы в самолёто-, вагоно- и кораблестроении.
Для улучшения ударопрочности, коррозионной стойкости, износоустойчивости сплавы легируют — вводят специальные добавки. Добавка марганца делает сталь ударопрочной. Чтобы получить нержавеющую сталь, в состав сплава вводят хром.
Инструментальные сплавы предназначены для изготовления режущих инструментов, штампов и деталей точных механизмов. Такие сплавы должны быть износостойкими и прочными, причём при разогревании их прочность не должна существенно уменьшаться. Таким требованиям отвечают, например, нержавеющие стали, которые прошли специальную обработку (закалку).
Для придания необходимых свойств инструментальные стали, как правило, легируют вольфрамом, ванадием или хромом.
Сплавы служат незаменимым материалом при изготовлении особо чувствительных и высокоточных приборов, различного рода датчиков и преобразователей энергии.
Например, на изготовление сердечников трансформаторов и деталей реле идёт сплав никеля. Отдельные детали электромоторов изготавливаются из сплавов кобальта.
Сплав никеля с хромом — нихром, отличающийся высоким сопротивлением — используется для изготовления нагревательных элементов печей и бытовых электроприборов.
Из сплавов меди в электротехнической промышленности и в приборостроении наиболее широкое применение находят латуни и бронзы.
Латуни незаменимы при изготовлении приборов, деталью которых являются запорные краны. Такие приборы используются в сетях подачи газа и воды.
Главным востребованным свойством легкоплавких сплавов является заданная низкая температура плавления. Это свойство, в частности, используется для пайки микросхем. Кроме того, эти сплавы должны иметь определённую плотность, прочность на разрыв, химическую инертность, теплопроводность.
Легкоплавкие сплавы производят из висмута, свинца, кадмия, олова и других металлов. Такие сплавы используют в термодатчиках, термометрах, пожарной сигнализации, например, сплав Вуда. А также в литейном деле для производства выплавляемых моделей, для фиксации костей и протезирования в медицине.
Сплав натрия с калием (температура плавления \(–\)\(12,5\) °С) используется как теплоноситель для охлаждения ядерных реакторов.
 |  |
| Рис. \(7\). Припой (сплав для паяния) имеет невысокую температуру плавления | Рис. \(8\). Легкоплавкие сплавы незаменимы в датчиках пожарной сигнализации |
Применение в чистом виде драгоценных металлов в ювелирном деле не всегда оправдано и целесообразно из-за их дороговизны, физических и химических особенностей.
Для придания ювелирным изделиям из золота большей твёрдости и износостойкости используются сплавы с другими металлами.
Самая лучшая добавка — это серебро (понижает температуру плавления) и медь (повышает твёрдость). Чистое золото используют очень редко, так как оно слишком мягкое, легко деформируется и царапается.
Из сплавов золота с \(10–30\) % других благородных металлов (платины или палладия) изготавливают форсунки лабораторных приборов, а из сплава с \(25–30\) % серебра — ювелирные изделия и электрические контакты.

Оловянная бронза (сплав меди с оловом) — один из первых освоенных человеком сплавов металлов. Она обладает большей, по сравнению с чистой медью, твёрдостью, прочностью и более легкоплавка. Бронзы успешно применяют для получения сложных по конфигурации отливок, включая художественное литьё. Классической маркой бронзы является колокольная бронза.
Одно из новых направлений в искусстве — производство художественных литых изделий из чугуна. Литые изделия из чугуна существенно превосходят по качеству кованые изделия.
Чугун — металл гораздо более хрупкий и не такой ковкий, как сталь. Но даже из такого, казалось бы, грубого материала можно получать настоящие произведения литейного искусства способом литья, например, такие как литые лестницы или решётки на окна. Такие изделия подвержены лишь поверхностной коррозии и не требуют тщательного ухода.
Получение металлов и их применение
Несмотря на то что все чаще в промышленности и быту используются искусственно созданные материалы, отказаться от применения металлов пока не представляется возможным. Они обладают уникальным сочетанием свойств, а сплавы позволяют максимально использовать их потенциал. В каких областях происходит получение и применение металлов?
Характеристика группы элементов
Под металлами понимают совокупность неорганических химических веществ, обладающих характерными свойствами. Как правило, они включают следующее:
- высокая теплопроводность;
- пластичность, относительная легкость механической обработки;
- сравнительно высокая температура плавления;
- хорошая электропроводность;
- характерный "металлический" блеск;
- роль восстановителя в реакциях;
- высокая плотность.
Разумеется, не все элементы этой группы обладают всеми этими свойствами, например, ртуть при комнатной температуре жидкая, галлий плавится от тепла человеческих рук, а висмут вряд ли можно назвать пластичным. Но в общем и целом все эти черты прослеживаются в совокупности металлов.

Внутренняя классификация
Металлы условно делят на несколько категорий, каждая из которых объединяет элементы, наиболее близкие друг другу по различным параметрам. Различают следующие группы:
- щелочные - 6;
- щелочноземельные - 4;
- переходные - 38;
- легкие - 7;
- полуметаллы - 7;
- лантаноиды - 14+1;
- актиноиды - 14+1;
Вне групп остается еще два: бериллий и магний. Таким образом, на данный момент из всех открытых элементов 94 ученые относят к металлам.
Кроме того, стоит упомянуть, что есть и другие классификации. Согласно им, отдельно рассматриваются благородные, металлы платиновой группы, постпереходные, тугоплавкие, черные и цветные и т. д. Такой подход имеет смысл лишь при определенных целях, так что удобнее использовать общепринятую классификацию.

История получения
Человечество на протяжении всего своего развития было тесно связано с обработкой и использованием металлов. Помимо того что они оказались наиболее распространенными элементами, из них можно было изготавливать различные изделия лишь с помощью механической обработки. Поскольку навыков работы с рудой еще не было, сначала речь шла лишь об использовании самородков. Сначала это был мягкий металл, давший название медному веку, сменившему каменный. В этот период был разработан метод холодной ковки. В некоторых цивилизациях стала возможной выплавка. Постепенно люди освоили получение цветных металлов, таких как золото, серебро, олово.
Позднее на смену медному пришел бронзовый век. Он продлился примерно 20 тысячелетий и стал переломным моментом для человечества, поскольку именно в этот период стало возможным получать сплавы. Происходит постепенное развитие металлургии, совершенствуются способы получения металлов. Однако в 13-12 вв. до н. э. произошел так называемый бронзовый коллапс, который положил начало железному веку. Это предположительно произошло из-за истощения запасов олова. А свинец и ртуть, открытые в это время, не смогли стать заменой бронзе. Так что людям предстояло развивать получение металлов из руд.

Следующий период продлился относительно недолго - меньше тысячелетия, но оставил яркий след в истории. Несмотря на то что железо было известно гораздо раньше, оно почти не применялось из-за своих недостатков по сравнению с бронзой. Кроме того, последнюю было гораздо проще получить, в то время как выплавка руды была более трудоемким занятием. Все дело в том, что самородное железо встречается довольно редко, так что неудивительно, что отказ от бронзы происходил настолько медленно.
Значение навыков выделения металлов
По аналогии с тем, как предок человека впервые изготовил орудие труда, привязав острый камень к палке, переход к новому материалу оказался настолько же грандиозен. Основные преимущества металлических изделий состояли в том, что их было легче сделать, а также существовала возможность починки. Камень же не обладает пластичностью и ковкостью, так что любые орудия из него можно было сделать только заново, отремонтировать их не получалось.
Таким образом, именно переход к использованию металлов привел к дальнейшему совершенствованию орудий труда, появлению новых предметов быта, украшений, изготовить которые было ранее невозможно. Все это дало толчок техническому прогрессу и заложило фундамент для развития металлургии.

Современные методы
Если в древности людям было знакомо лишь получение металлов из руд, либо они могли довольствоваться самородками, то в настоящее время существуют и другие способы. Они стали возможными благодаря развитию химии. Таким образом, появилось два основных направления:
- Пирометаллургия. Она начала свое развитие раньше и связана с высокими температурами, необходимыми для обработки материала. Современные технологии в этой области позволяют также использование плазмы.
- Гидрометаллургия. Это направление занимается извлечением элементов из руд, отходов, концентратов и т. д. с помощью воды и химических реактивов. Например, крайне распространен способ, предполагающий получение металлов электролизом, также довольно популярен метод цементации.
Есть и еще одна интересная технология. Получение драгоценных металлов высокой чистоты и с минимальными потерями стало возможно именно благодаря ей. Речь об аффинаже. Этот процесс - один из видов рафинирования, то есть постепенного отделения примесей. Например, в случае с золотом используется насыщение расплава хлором, а платину растворяют в минеральных кислотах с последующим выделением реагентами.
Кстати, получение металлов электролизом чаще всего применяется, если выплавка или восстановление экономически невыгодны. Именно так происходит с алюминием и натрием. Есть и более инновационные технологии, делающие возможных получение цветных металлов даже из достаточно бедных руд без значительных затрат, но речь об этом пойдет чуть позднее.

О сплавах
Большая часть металлов, известных в древности, не всегда отвечала некоторым потребностям. Коррозия, недостаточная твердость, ломкость, хрупкость, недолговечность - у каждого элемента в чистом виде есть свои недостатки. Поэтому стало необходимо найти новые материалы, объединяющие в себе преимущества известных, то есть найти способы получения сплавов металлов. На сегодняшний день существует два основных метода:
- Литье. Расплав смешанных компонентов охлаждается и кристаллизуется. Именно этот способ позволил получить первые образцы сплавов: бронзу и латунь.
- Прессование. Смесь порошков подвергается высокому давлению, а потом спекается.
Дальнейшее совершенствование
В последние десятилетия наиболее перспективным кажется получение металлов с применением биотехнологий, в первую очередь с помощью бактерий. Уже стало возможным извлечение из сульфидного сырья меди, никеля, цинка, золота, урана. Ученые надеются подключить микроорганизмы к таким процессам, как выщелачивание, окисление, сорбции и осаждение. Кроме того, крайне актуальной является проблема очистки глубоких сточных вод, для нее тоже пытаются найти решение, предполагающее участие бактерий.

Применение
Без металлов и сплавов была бы невозможна жизнь в том виде, в котором она сейчас известна человечеству. Высотные дома, самолеты, посуда, зеркала, электроприборы, автомобили и многое другое существует лишь благодаря далекому переходу людей от камня к меди, бронзе и железу.
Из-за своей исключительной электро- и теплопроводности металлы используются в проводах и кабелях самого различного назначения. Золото применяется для изготовления неокисляемых контактов. Благодаря своей прочности и твердости металлы широко используются в строительстве и для получения самых разных конструкций. Еще одна область применения - инструментальная. Для изготовления рабочей, например, режущей части часто используются твердые сплавы и специальные виды стали. Наконец, благородные металлы высоко ценятся как материал для ювелирных изделий. Так что областей применения предостаточно.

Интересное о металлах и сплавах
Использование этих элементов настолько широко и имеет такую длинную историю, что неудивительно возникновение различных курьезных ситуаций. Их и просто пару любопытных фактов и стоит привести напоследок:
Соединения щелочных металлов и их применение
Из всей периодической системы большая часть элементов представляет группу металлов. Щелочные, щелочноземельные, амфотерные, переходные, радиоактивные - их очень много. Все металлы играют огромную роль не только в природе и биологической жизни человека, но и в различных отраслях промышленности. Не зря ведь XX век был назван "железным".

Металлы: общая характеристика
Все металлы объединяются общими химическими и физическими свойствами, по которым их легко отличить от неметаллических веществ. Так, например, строение кристаллической решетки позволяет им быть:
- проводниками электрического тока;
- хорошими теплопроводниками;
- ковкими и пластичными;
- прочными и блестящими.
Конечно, среди них есть и различия. Одни металлы блестят серебристым цветом, другие - более матовым белым, третьи - вообще красным и желтым. Также отличия есть и в показателях тепло- и электропроводности. Однако все равно эти параметры - общие для всех металлов, в то время как у неметаллов больше различий, нежели схожести.
По химической природе все металлы - восстановители. В зависимости от условий реакции и конкретных веществ могут выступать и в роли окислителей, однако редко. Способны образовывать многочисленные вещества. Химические соединения металлов встречаются в природе в огромном количестве в составе руды или полезных ископаемых, минералов и прочих пород. Степень окисления металлов всегда положительная, может быть постоянной (алюминий, натрий, кальций) или переменной (хром, железо, медь, марганец).
Многие из них получили широкое распространение в качестве строительных материалов, используются в самых разных отраслях науки и техники.

Химические соединения металлов
Среди таковых следует назвать несколько основных классов веществ, которые являются продуктами взаимодействия металлов с другими элементами и веществами.
- Оксиды, гидриды, нитриды, силициды, фосфиды, озониды, карбиды, сульфиды и прочие - бинарные соединения с неметаллами, чаще всего относятся к классу солей (кроме оксидов).
- Гидроксиды - общая формула Ме +х (ОН)х.
- Соли. Соединения металлов с кислотными остатками. Могут быть разными:
- средние;
- кислые;
- двойные;
- основные;
- комплексные.
4. Соединения металлов с органическими веществами - металлорганические структуры.
5. Соединения металлов друг с другом - сплавы, которые получаются разными способами.
Варианты соединения металлов
Вещества, в которых одновременно могут находиться два разных металла и более, подразделяются на:
- сплавы;
- двойные соли;
- комплексные соединения;
- интерметаллиды.
Способы соединения металлов между собой также варьируются. Например, для получения сплавов используют метод расплавления, смешения и затвердевания полученного продукта.
Интерметаллиды образуются в результате прямых химических реакций между металлами, нередко происходящих со взрывом (например, цинк и никель). Для таких процессов нужны особые условия: температура очень высокая, давление, вакуумность, отсутствие кислорода и прочие.

Двойные соли и комплексные соединения могут сформироваться при сливании растворов исходных веществ, а также при их сплавлении.
Изготовление изделий из металлов подразумевает также их соединение между собой. Для этого используют такие способы, как:
- сварка (газовая, электрическая и так далее);
- пайка разными видами припоев;
- резьба;
- заклепывание.
Главное условие - это создать такое изделие, которое сможет быть устойчивым к коррозии и в котором не будет швов и примесей, щелей.
Щелочными называются элементы, расположенные в первой группе главной подгруппе периодической системы. Их всего 6, и открыты они были практически все одновременно с небольшим временным интервалом. В форме простых веществ в природе данные элементы не встречаются.
Вследствие высокой химической активности работать с ними очень тяжело и опасно. Поэтому пришлось потрудиться, чтобы выделить их в чистом виде. Гораздо раньше людьми начали использоваться различные соединения щелочных металлов. Некоторые из них были известны еще с древности и не потеряли важности и актуальности сегодня. Они используются в технике, строительстве, медицине, пищевой отрасли, химической промышленности, металлургии, машиностроении, сельском хозяйстве и многих других разделах народного хозяйства. Основные из них рассмотрим подробнее.
Виды соединения щелочных металлов с другими металлами относятся к группам:
- интерметаллических соединений;
- комплексных соединений;
- двойных солей.

Оксиды
Из всех щелочных металлов при сгорании в кислороде нормальный оксид способен давать только литий. Остальные же проявляют чрезмерную активность, поэтому формируют пероксиды Ме2О2. Из пероксидов действием простого металла можно получить оксид нормального вида Ме2О. Кислородные соединения щелочных металлов имеют разную окраску.
- Оксид лития, калия и натрия - белые кристаллические порошки.
- Рубидий - желтая окраска оксида.
- Цезий - оранжевая.
Основная область применения - химическая промышленность. Оксиды щелочных металлов реагируют с водой, образуя важные соединения - щелочи. Этим свойством и обусловлено название данной группы элементов. Соединения щелочных металлов - оксиды - лишь часть от общей массы значимых и важных веществ, в состав которых входят эти элементы.
Гидроксиды (щелочи)
Соединения щелочных металлов с гидроксогруппой называют щелочами, или гидроксидами. Все они - очень едкие вещества, способные легко разрушать практически любой материал. Особенно это касается животных тканей. Поэтому работать с щелочами следует крайне осторожно, на месте контакта с кожей может возникнуть глубокий химический ожег.
Самым известным веществом среди щелочей является каустическая сода, или гидроокись натрия. Данное соединение известно еще с древних времен, где оно добывалось из золы растений и использовалось для мыловарения и стирки белья. Химическая формула - NaOH. Сегодня едкий натр производится огромными количествами в каждой стране, так как без его участия не обходится практически ни одна отрасль производства. Он используется:
- в нефтеперерабатывающей промышленности;
- в косметической и парфюмерной;
- в химических синтезах;
- для производства чистящих и моющих средств, абразивных материалов;
- в кожевенной и текстильной промышленности и других областях.
Другие металлы из группы щелочных формируют не столь важные и распространенные щелочи. Более-менее значимым является лишь гидроксид калия - КОН, который известен как едкое кали.

Такие соединения щелочных металлов, как соли, являются не только практически востребованными веществами, но и присутствуют в организме живых существ, поддерживая их нормальную жизнеспособность.
Самой главной солью является, безусловно, хлорид натрия. Это обычная поваренная соль, которая есть у каждого дома и которой не придают особого значения вследствие большой распространенности. Однако если представить, что она вдруг исчезнет, мало кто обрадуется последствиям. Несоленую пищу есть сложно, к тому же это наносит непоправимый вред здоровью, так как в организм не поступают ионы натрия, нужные для работы сердца и сосудов.
Также важные соединения щелочных металлов - это карбонаты. Особенно карбонат и бикарбонат натрия, который в простонародье называется содой. Его используют при производстве стекла, для изготовления моющих средств. Содой можно спокойно чистить посуду. Она обладает хорошими дезинфицирующими, обеззараживающими, очищающими и отбеливающими свойствами. Широко используется в пищевой промышленности, особенно в кондитерском деле и хлебопечении. С ее помощью варят мыло, создают стиральные порошки.
Сода, соль, каустик - все это соединения щелочных металлов в природе. Они существуют в чистом виде, формируя залежи, либо входят в состав продуктов сгорания тех или иных веществ. Иногда их получают лабораторным способом. Но всегда эти вещества важны и ценны, так как окружают человека и формируют его быт.
Соединения щелочных металлов и их применение не ограничиваются только натрием. Также распространены и популярны в отраслях хозяйства такие соли, как:
- хлорид калия; (нитрат калия);
- карбонат калия;
- сульфат.
Все они являются ценными минеральными удобрениями, используемыми в сельском хозяйстве.
Щелочноземельные металлы - соединения и их применение
К данной категории относятся элементы второй группы главной подгруппы системы химических элементов. Их постоянная степень окисления +2. Это активные восстановители, легко вступающие в химические реакции с большинством соединений и простых веществ. Проявляют все типичные свойства металлов: блеск, ковкость, тепло и электропроводность.

Самыми важными и распространенными из них являются магний и кальций. Бериллий проявляет амфотерность, барий и радий относятся к редким элементам. Все они способны формировать следующие типы соединений:
- интерметаллические;
- оксиды;
- гидриды;
- бинарные соли (соединения с неметаллами);
- гидроксиды;
- соли (двойные, комплексные, кислые, основные, средние).
Рассмотрим самые важные соединения с практической точки зрения и их области применения.
Соли магния и кальция
Такие соединения щелочноземельных металлов, как соли, имеют важное значение для живых организмов. Ведь именно соли кальция являются источником этого элемента в организме. А без него невозможно нормальное формирование скелета, зубов, рогов у животных, копыт, волос и шерстного покрова и так далее.
Так, самой распространенной солью щелочноземельного металла кальция является карбонат. Его другие названия:
Используется не только как поставщик ионов кальция в живой организм, но и как стройматериал, сырье для химических производств, в косметической промышленности, стекольной и так далее.
Такие соединения щелочноземельных металлов, как сульфаты, тоже имеют важное значение. Например, сульфат бария (медицинское название "баритовая каша") используется в рентгенодиагностике. Сульфат кальция в виде кристаллогидрата - это гипс, который содержится в природе. Он используется в медицине, строительстве, штамповке слепков.
Фосфоры из щелочноземельных металлов
Эти вещества известны еще со Средних веков. Раньше их называли люминофорами. Это название встречается и сейчас. По своей природе данные соединения - это сульфиды магния, стронция, бария, кальция.

При определенной обработке они способны проявлять фосфоресцирующие свойства, причем свечение очень красивое, от красного до ярко-фиолетового. Это применяется при изготовлении дорожных знаков, спецодежды и прочих вещей.
Комплексные соединения
Вещества, которые включают в себя два и более разных элементов металлической природы, - комплексные соединения металлов. Чаще всего они представляют собой жидкости, обладающие красивыми и разноцветными окрасками. Используются в аналитической химии для качественного определения ионов.
Такие вещества способны образовывать не только щелочные и щелочноземельные металлы, но и все остальные. Бывают гидроксокомплексы, аквакомплексы и другие.
Соединения: назначение, виды соединений. Примеры, достоинства, недостатки видов соединений
Машины и станки, оборудование и бытовая техника - все эти механизмы в своей конструкции имеют множество деталей. Их качественное соединение – гарантия надежности и безопасности при работе. Какие виды соединений бывают? Их характеристики, достоинства и недостатки рассмотрим подробнее.
Классификация
Различные виды соединений можно поделить на две основные группы. Первая из которых по принципу действия:
- Подвижные. Детали могут производить движение относительно друг друга.
- Неподвижные. Обе части детали жестко закреплены между собой.
В свою очередь, каждый вид предыдущей классификации может осуществляться двумя способами соединения:
- Разъемное. Применяется, когда требуется периодическая замена деталей, сборка и разборка механизма в целом. Это следующие виды соединений: резьбовое (при помощи ходовых болтов), зубчатое, шпоночное и пр.
- Неразъемное. Такие соединения можно демонтировать только с помощью механического воздействия, при котором происходит разрушение сопряженных частей. Какие это виды соединений? Среди них - сварка, склейка, клепание, развальцовка, опрессовка, посадка с натягом, сшивание, кернение и т. д.
Итак, давайте рассмотрим подробнее основные виды соединений деталей.
Резьбовой метод
Старый и давно испытанный вариант крепления. Для него используются следующие элементы: болты, винты, шпильки, винтовые стяжки и прочие. Крепление осуществляется за счет резьбы на крепеже и в отверстии детали.

Спиральные выступы на стержне и в технологическом отверстии деталей называют резьбой. Рассмотрим основные крепежные изделия:
- Болт представляет собой резьбовой стержень, на одном конце которого находится крепежная головка. Ее форма бывает шестигранной, квадратной, круглой и т. д.
- Винт отличается от предыдущего изделия тем, что на головке располагается прорезь (шлиц) под отвертку. Он бывает шестигранным, прямым, крестовым и т. д. По типу головки изделия бывают потайными, цилиндрическими, полукруглыми, полупотайными.
- Шпилька – стержень с резьбой на обоих концах. В отличие от предыдущих вариантов не имеет головки.
- Установочная шпилька на одном конце имеет шлиц.
- Гайка – призма со сквозным отверстием или заглушенным с одной стороны.
К этим метизам выпускаются шайбы: плоская, пружинная, деформируемая. Такая фиксация применяется повсеместно.
Шпоночное
Шпонки фиксируют вал с деталями, которые передают вращение и колебание. Конструкция таких элементов может быть призматическая, клиновая, сегментная, тангенциальная. Такой крепеж образует следующие виды соединений:
- Ненапряженные осуществляются с помощью призматических сегментных шпонок. При сборке нет предварительного напряжения.
- Напряженные производятся тангенциальными и сегментными шпонками. При сборке появляется монтажное напряжение. Используются для сложных механизмов.
Зубчатые (шлицевые) соединения
Крепление происходит за счет выступающих зубьев на валу и углубления под них в ступице.

Здесь выделяют три варианта фиксации по жесткости: легкая, средняя, высокая. Отличие состоит в количестве и высоте зубьев. Оно лежит в диапазоне 6-20 штук. Форма зубьев:
- Треугольные маловостребованы. Используются для небольших неподвижных валов и с малым вращательным моментом.
- Прямобочные. Центрируются по боковым граням, по внутреннему и наружному диаметру.
- Эвольвентные. Применяются для больших валов.
Где используются эти виды? Назначение соединений такого плана – передача вращающего момента. Наиболее известное применение – электроинструменты.
Мы рассмотрели разъемные крепления. Далее изучим основные виды соединений неразъемных.
Сварочное
Чем они особенны? Такие виды соединений образуются за счет нагрева и наплавления материала в месте крепления с образованием сварного шва. Это сцепление считается одним из самых распространенных.

- Сварка электродугой. Можно выделить три основных подвида: автоматическая под флюсом (отличается высокой производительностью и качеством, используется в массовом производстве), полуавтоматическая под флюсом (используется для коротких прерывистых швов), ручная (пониженная скорость производительности, качество зависит напрямую от опыта сварщика).
- Контактная сварка. Применяется на массовом производстве для тонколистного металла. Шов выполняется нахлесточный.
Один из популярных вариантов крепления представлен на фото.

Пайка
В отличие от сварки в момент пайки поверхность металла не нагревается до температуры оплавления. Роль связующего выполняет расплавленный припой, который имеет более низкую температуру плавления.

Такой способ сцепления применяется для малых деталей. Связано это с ограничением зазора между поверхностями частей.
Клеевые соединения
Для такого крепления не требуется разогрев поверхностей.
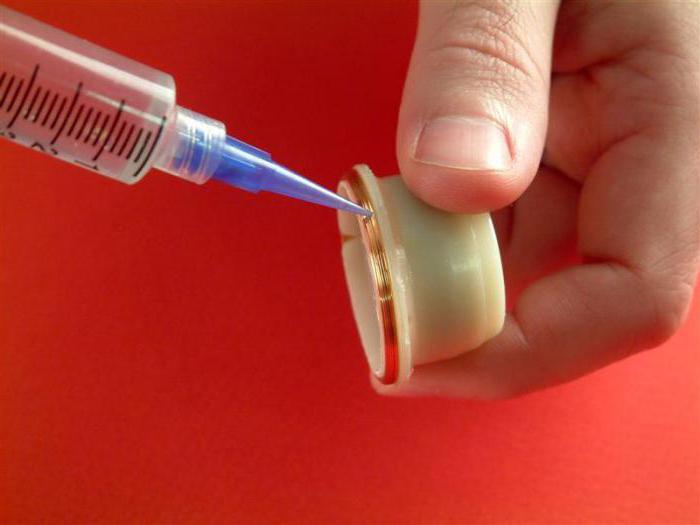
Под каждый вид металла подбирается свой клей, который обеспечит плотное сцепление. Для таких операций детали подготавливаются. Поверхность шлифуется, обезжиривается, наносится специальная грунтовка, после этого производят операцию по склеиванию. Применяемые составы отличаются дополнительными свойствами и адгезией к различным поверхностям.
Клепочная фиксация
Этот способ сцепления применяется в основном для соединения листового металла и фасонных профилей. Технологическое отверстие в поверхностях осуществляют сверлением, далее вставляется клепка.

За счет механического воздействия стержень и головка деформируются, заполняют и фиксируют отверстие. Такую операцию производят ручным и механизированным способом. Клепками фиксируют материал, не поддающийся сварным работам, пайке, склеиванию, и к деталям, где надо оттянуть разрушающий процесс.
Соединения с натягом
Производится подгонкой посадочных мест деталей. Сцепка происходит за счет силы трения. В основном этот вид считается неразъемным. Но это условно. В практике все же производят демонтаж и замену деталей.
Достоинства, недостатки видов соединений
Каждый крепеж отличается своими характеристиками. Рассмотрим все варианты с точки зрения преимуществ и недостатков:
- Резьбовое. Выдерживает большие нагрузки, надежное сцепление, широкий ассортимент изделий, легкость монтажа и демонтажа, возможность применять механизацию, невысокая стоимость. Недостатки: повышенное количество концетратов напряжения, снижает сопротивляемость.
- Шпоночное. Несложная конструкция, легкий монтаж и демонтаж. Недостатки: паз для шпона за счет уменьшения сечения вала и ступицы ослабляет их. Также это происходит за счет концентраций напряжений кручений и изгиба. Трудоемкий процесс изготовления крепежа.
- Зубчатое. Образует хорошее сцепление и точное направление осевого перемещения, передает больший вращающий момент, меньшее количество деталей, надежность при реверсивных и динамических нагрузках, меньшее ослабление вала, уменьшение длины ступицы. Недостатки: повышенная цена, сложная технология производства.
- Сварочное. Невысокая стоимость работ, соединение получается герметичным и плотным, применение автоматизированных процессов, возможность работы с толстым профилем. Недостатки: при ручной сварке качество зависит напрямую от квалификации работника, деформация поверхности деталей при нагреве, низкая надежность при вибрациях и ударных воздействиях.
- Пайка. Нет деформации поверхностей деталей, высокая точность, возможность распайки. Недостатки: сложный процесс подготовки оснований, должен обеспечиваться минимальный зазор.
- Клеевое. Невысокая стоимость, не происходит ослабление рабочего сечения, возможность комбинированного использования с другими видами креплений, герметичность стыка, повышает антикоррозийные свойства шва, устойчивость к воздействию воды, химии, температурным перепадам, простата технологии нанесения. Недостатки: тщательная подготовка основания, при неправильном подборе состава могут снижаться прочностные характеристики.
- Клепочное. Возможность применения к материалам, которые не поддаются сварке, надежность, препятствует появлению усталостных трещин. Недостатки: трудоемкость, материалоемкость, при процессе появляется деформация поверхностей деталей из-за механического воздействия.
- Соединения с натягом. Конструкция достаточно проста, хорошее расположение деталей относительно друг друга, выдерживает большие нагрузки. Недостатки: непростая сборка, прочность рассеивается под воздействием вибраций и колебаний.
Как видно, каждый вид имеет свои преимущества и недостатки. Учитывая эти факторы, подбирают оптимальные виды крепежа в каждом конкретном случае. Рассмотрим, где применяются различные соединения.
Виды соединений. Примеры применения
Резьбовое, клеевое, сварное соединения встречаются повсеместно в любой отрасли. Например, строительной, мебельной, в тяжелой промышленности и так далее. Шпоночные и шлицевые фиксации широко используется в электроинструментах, оборудовании, машиностроении. Соединения с натягом устанавливаются на валы зубчатых колец, червячные колеса. Пайка часто применяется в работе с электронными системами, где требуется максимальная точность. Клепочное применяется для сшивания листов тонкого металла. Однако, как показано на последнем фото, при помощи заклепок можно скрепить достаточно крупные швеллера. Это лишь незначительный список применения отдельных вариантов крепления.
Можно сказать, что с техническим прогрессом технология сцепления бурно развивается, а это значит, что будут появляться новые виды соединений деталей. Современный мир наполнен агрегатами, машинами и механизмами. От того, насколько прочно закреплены детали, зависят качество и срок службы узлов. Также важно, чтобы соединение не искажало форму изделия и не вносило дополнительных изменений в конструкцию. Поэтому оно должно соответствовать технологическим нормам. Если их соблюдать, то количество аварийных ситуаций на предприятиях сократится в разы, а сами агрегаты прослужат очень долго.
Читайте также:
