Соединения металлов с серой называются
Обновлено: 28.09.2024
Сера – шестнадцатый элемент Периодической таблицы. Обозначение – S от латинского «sulfur». Расположена в третьем периоде, VIА группе. Относится к неметаллам. Заряд ядра равен 16.
Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов.
Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния, Наконец, соединения серы содержатся в организмах растений и животных.
Общее содержание серы земной коре составляет приблизительно 0,1%.
Атомная и молекулярная масса серы
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) – во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Значения атомной и молекулярной масс серы совпадают; они равны 32,059.
Аллотропия и аллотропные модификации серы
Сера существует в виде двух аллотропных модификаций – ромбической и моноклинной.
При обычных давлениях сера образует хрупкие кристаллы желтого цвета, плавящиеся при 112,8 o С; плотность равна 2,07 г/см 3 . Она нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде желтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис.1). Эта модификация серы называется ромбической.
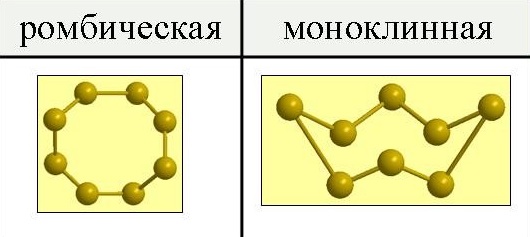
Рис. 1. Аллотропные модификации серы.
Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрыты изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы. Эта модификация серы называется моноклинной. Она имеет плотность 1,96 г/см 3 , плавится при 119,3 o С и устойчива только при температуре выше 96 o С.
Изотопы серы
Известно, что в природе сера может находиться в виде четырех стабильных изотопов 32 S, 33 S, 34 S и 36 S. Их массовые числа равны 32, 33, 34 и 36 соответственно. Ядро атома изотопа серы 32 S содержит шестнадцать протонов и шестнадцать нейтронов, а изотопов 33 S, 34 S и 36 S– такое же количество протонов, семнадцать, восемнадцать и двадцать нейтронов соответственно.
Существуют искусственные изотопы серы с массовыми числами от 26-ти до 49-ти, среди которых наиболее стабильным является 35 S с периодом полураспада равным 87 суток.
Ионы серы
На внешнем энергетическом уровне атома серы имеется шесть электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 4 .
В результате химического взаимодействия сера может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
Молекула и атом серы
Молекула серы одноатомна — S. Приведем некоторые свойства, характеризующие атом и молекулу серы:
Энергия ионизации атома, эВ
Радиус атома, нм
Примеры решения задач
| Задание | Какая масса серы потребуется для получения сульфида алюминия Al2S3 массой 30 г? В каких условиях может быть получен этот сульфид из простых веществ? |
| Решение | Запишем уравнение реакции получения сульфида серы: |
Вычислим количество вещества сульфида алюминия (молярная масса – 150 г/моль):
Согласно уравнению реакции n(Al2S3) : n(S) = 1:3, значит:
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Химия: нужна Характеристику серы по пунктам:
1)Положение элемента в переодической системе:
а) порядковый номер
б) период, ряд
в) группа, подгруппа
г) относительная атомная масса
2)Формула соединений:
а) оксида
б) гидроксида (основания или кислоты)
в) летучего водородного соединения (для неметаллов)
3)Химический характер, его доказательство:
а) кислотный: кислотный оксид+щелочь=соль+вода; кислота+основание=соль+вода
б) основный: основный оксид+кислота=соль+вода; основание+кислота=соль+вода
в) амфотерный (а+в)
4)Вравнение с соседями
а) по периоду б) по группе (металл с неметаллами сравнивать нельзя)

Вот картинка, все кроме 2-го
1)
а) атомный номер - 16 - это есть в таблице;
б) третий период, ну и ряд тоже третий;
в) группа VI, подгруппа главная, т. е. VIa;
г) атомная масса - 32г/моль (видимо, самый распространённый изотопчег - сера-32);
2)
а) образует два оксида - оба, понятное дело, кислотные - SO2 и SO3. В первом сера +4, во втором - +6;
б) оба оксида - солеобразующие, т. е. каждому соответствует по гидроксиду. Значит, первому соответствует H2SO3 - сернистая кислота, а второму - H2SO4 - серная кислота;
в) образует одно (зато какое! :D ) водородное соединение - H2S - сероводород.
3)
а) оба оксида - кислотные, реагируют со щелочами, например: SO2+2NaOH=Na2SO3+H2O; SO3+2NaOH=Na2SO4+H2O. Соотв. им кислоты тоже не против нейтрализоваться щёлочью: H2SO3+2KOH=K2SO3+2H2O; H2SO4+2KOH=K2SO4+2H2O.
4)
а) сравнение с соседями по периоду: согласно Периодическому закону, в периодах слева направо усиливаются неметаллические свойства, усиливаются окислительные свойства, уменьшается атомный радиус. Значит, справа от серы должен стоять типичный неметалл - и он там стоит - это хлор Cl, третий элемент по значению электроотрицательности, соотв. ему простое вещество проявляет сильные окислительные свойства. Саму серу хлор также может окислить, например, в SCl4. Слева от серы должен стоять менее активный - но всё же неметалл. Это фосфор - P, действительно чуть менее электроотрицательный, чем сера, элемент. Оксиды и гидроксиды обоих элементов - и хлора, и фосфора, проявляют кислотный характер, а водородные соединения являются восстановителями. Оксиды хлора и его гидроксиды являются сильными окислителями. P2O5 (P4O10 - то же самое) является не только окислителем, но и сильным водоотнимающим средством, как, кстати, и H2SO4, и SO3.
б) Выше серы стоит кислород О, а под серой - селен Se. Все элементы VIа гр. называются халькогенами. Понятно, что неметаллические, окислительные свойства в периоде ослабевают. Кислород является значительно более сильным окислителем, чем сера: это второй по значению ЭО элемент. Саму серу он окисляет до SO2 (горение) и даже до SO3 (на катализаторе) . В отличие от серы, кислород редко проявляет положительные ст. ок. и не образует сильных кислот в положительных ст. ок. Зато водородное соединение кислорода намного более распространено, чем то же соединение серы. Селен относится к полуметаллам. Он гораздо менее, чем сера, электроотрицателен. Зато он образует кислоту, намного сильнее, чем серная - H2SeO4, которая реагирует даже с золотом (кислотные свойства гидрокисдов усиливаются в группах сверху вниз) . Селен, как и сера, находится в твёрдом состоянии, но его температура плавления несколько больше.
Соединения серы
Сероводород H2S – это бинарное летучее водородное соединение соединение с серой. H2S — бесцветный ядовитый газ, с неприятным удушливым запахом тухлых яиц. При концентрации > 3 г/м 3 вызывает смертельное отравление.
Сероводород тяжелее воздуха и легко конденсируется в бесцветную жидкость. Растворимость в воде H2S при обычной температуре составляет 2,5.
В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода представляет собой сцепленные между собой атомы H-S-H с валентным углом 92,1 о .

Качественная реакция для обнаружения сероводорода
Для обнаружения анионов S 2- и сероводорода используют реакцию газообразного H2S с Pb(NO3)2:
Влажная бумага, смоченная в растворе Pb(NO3)2 чернеет в присутствии H2S из-за получения черного осадка PbS.
Химические свойства серы
H2S является сильным восстановителем
При взаимодействии H2S с окислителями образуются различные вещества — S, SО2, H2SO4
- Взаимодействие с кислотами-окислителями:
- Взаимодействие со сложными окислителями:
- Сероводородная кислота H2S двухосновная кислота и диссоциирует по двум ступеням:
1-я ступень: H2S → Н + + HS —
2-я ступень: HS — → Н + + S 2-
H2S очень слабая кислота, несмотря на это имеет характерные для кислот химические свойства. Взаимодействует:
- с малоактивными металлами (Аg, Си, Нg) при совместном присутствии окислителей:
- с некоторыми солями сильных кислот, если образующийся сульфид металла нерастворим в воде и в сильных кислотах:
Реакция с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Сульфиды
Получение сульфидов
- Непосредственно из простых веществ:
S + Fe → FeS
- Восстановление сульфатов при прокаливании с углем:
Физические свойства сульфидов
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости в воде и кислотах сульфиды классифицируют на:
- растворимые в воде — сульфиды щелочных металлов и аммония;
- нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
- нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
- гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
По цвету сульфиды можно разделить на:
Химические свойства сульфидов
Обратимый гидролиз сульфидов
- Хорошо растворимыми в воде являются сульфиды щелочных металлов и аммония, но в водных растворах они в значительной степени подвергаются гидролизу. Реакция среды — сильнощелочная:
S 2- + H2O → HS — + ОН —
- Сульфиды щелочно-земельных металлов и Mg, при взаимодействии с водой подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов (Cr2S3, Fe2S3, Al2S3) подвергаются необратимому гидролизу, полностью разлагаясь в водных растворах:
Нерастворимые сульфиды гидролизу не подвергаются
NiS + HСl ≠
- Некоторые из сульфидов растворяются в сильных кислотах:
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
- Сульфиды обладают восстановительными свойствами и вступают в реакции с окислителями:
- Окислительный обжиг сульфидов является важной стадией переработки сульфидного сырья в различных производствах
Взаимодействия сульфидов с растворимыми солями свинца, серебра, меди являются качественными на ион S 2− :
Оксид серы (IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Способы получения сернистого газа
- Окисление серы, сероводорода и сульфидов кислородом воздуха:
- Действие высокой температуры на сульфиты (термическое разложение):
- Действие сильных кислот на сульфиты:
- Взаимодействие концентрированной H2SO4 с восстановителями, например с неактивными металлами:
Физические свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
Химические свойства сернистого газа
SO2 – типичный кислотный оксид. За счет того, что сера находится в промежуточной степени окисления (+4) SO2 может проявлять свойства как окислителя так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
- Как кислотный оксид, SO2 вступает в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
- При взаимодействии с окислителями SO2проявляет восстановительные свойства. При этом степень окисления серы повышается:
Обесцвечивание раствора перманганата калия KMnO4 является качественной реакцией для обнаружения сернистого газа и сульфит-иона
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Способы получения серного ангидрида
- SO3 можно получить из SO2путем каталитического окисления последнего кислородом:
- Разложением сульфата железа (III):
Физические свойства серного ангидрида
При обычных условиях SO3 представляет собой бесцветную жидкость с характерным резким запахом. На воздухе SO3 «дымит» и сильно поглощает влагу.
SO3 – тяжелее воздуха, хорошо растворим в воде.
Химические свойства серного ангидрида
Оксид серы (VI) – это кислотный оксид.
- Хорошо поглощает влагу и реагирует с водой образуя серную кислоту:
- Как кислотный оксид, SO3взаимодействует с щелочами и основными оксидами, образуются средние или кислые соли:
SO3 + MgO → MgSO4 (при сплавлении):
SO3 + ZnO = ZnSO4
- SO3проявляет сильные окислительные свойства, так как сера в находится в максимальной степени окисления (+6).
Вступает в реакции с восстановителями:
- При растворении в концентрированной серной кислоте образует олеум (раствор SO3 в H2SO4).
Сернистая кислота (H2SO3)
Способы получения сернистой кислоты
При растворении в воде SO2 образует слабую сернистую кислоту, которая сразу частично разлагается:
Физические свойства сернистой кислоты
Сернистая кислота H2SO3 – двухосновная кислородсодержащая кислота. При обычных условиях неустойчива.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.

Химические свойства сернистой кислоты
Общие свойства кислот
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
Соли сернистой кислоты, сульфиты и гидросульфиты
Способы получения сульфитов
Соли сернистой кислоты получаются при взаимодействии SO2 с щелочами и оксидами щелочных и щелочноземельных металлов:
Физические свойства сульфитов
Сульфиты щелочных металлов и аммония растворимы в воде, сульфиты остальных металлов — нерастворимы или не существуют.
Гидросульфиты металлов хорошо растворимы в Н2O, а некоторые из них, такие как Ca(HSO3)2 существуют только в растворе.
Химические свойства сульфитов
Cернистая кислота – двухосновная, образует нормальные (средние) соли — сульфиты Mex(SO3)y и кислые соли — гидросульфиты Me(HSO3)x.
- Водные растворы сульфитов подвергаются гидролизу. Реакция среды – щелочная(окрашивают лакмус в синий цвет):
Реакции, протекающие без изменения степени окисления:
- Нормальные сульфиты в водных растворах, при избытке SO2, переходят в гидросульфиты:
- Ионно-обменные реакции с другими солями, протекающие с образованием нерастворимых сульфитов:
Сульфиты, также как и SO2, могут быть как восстановителями, так и окислителями, т.к. атомы серы в анионах находятся в промежуточной степени окисления +4
- Окисление водных растворов сульфитов, и гидросульфитов до сульфатов:
- Твердые сульфиты при хранении на воздухе также медленно окисляются до сульфатов:
- При нагревании сухих сульфитов с активными восстановителями (С, Mg, Al, Zn) сульфиты превращаются в сульфиды:
- При нагревании сухих сульфитов до высоких температур сульфиты диспропорционируют, превращаются в смесь сульфатов и сульфидов:
Серная кислота (H2SO4)
Способы получения серной кислоты
В промышленности серную кислоту производят из серы, сульфидов металлов, сероводорода и др.
Наиболее часто серную кислоту получают из пирита FeS2.
Основные стадии получения серной кислоты включают:
1.Обжиг пирита в кислороде в печи для обжига с получением сернистого газа:
2. Очистка полученного сернистого газа от примесей в циклоне, электрофильтре.
3. Осушка сернистого газа в сушильной башне
4. Нагрев очищенного газа в теплообменнике.
5. Окисление сернистого газа в серный ангидрид в контактном аппарате:
6. Поглощение серного ангидрида серной кислотой в поглотительной башне – получение олеума.

Физические свойства, строение серной кислоты
При обычных условиях серная кислота – тяжелая бесцветная маслянистая жидкость, хорошо растворимая в воде. Максимальная плотность равна 1,84 г/мл
При растворении серной кислоты в воде выделяется большое количество теплоты. Поэтому, по правилам безопасности в лаборатории при приготовлении разбавленного раствора серной кислоты во избежание разбрызгивания необходимо наливать серную кислоту в воду тонкой струйкой по стеклянной палочке при постоянном перемешивании. Но не наоборот!
Валентность серы в серной кислоте равна VI.
Качественные реакции для обнаружения серной кислоты и сульфат ионов
Для обнаружения сульфат-ионов используют реакцию с растворимыми солями бария. В результате взаимодействия, образуется белый кристаллический осадок сульфата бария:
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота, образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
- Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени и достаточно по второй ступени:
Характерны все свойства кислот:
- Реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами и аммиаком:
- Вытесняетболее слабые кислоты из их солей в растворе (карбонаты, сульфиды и др.) и летучие кислоты из их солей (кроме солей HBr и HI):
- Концентрированная серная кислота реагирует с твердыми солями, например нитратом натрия, хлорида натрия.
Разбавленная серная кислота взаимодействует с металлами, расположенными в ряду напряжения металлов до водорода. В результате реакции образуются соль и водород:
Концентрированная серная кислота — сильный окислитель. Реакция с металлами протекает без вытеснения водорода из кислоты. В зависимости от активности металла образуются различные продукты реакции:
- Активные металлы и цинк при обычной температуре с концентрированной серной кислотой образуют соль, сероводород (или серу) и воду:
- Металлы средней активности с концентрированной H2SO4 образуют соль, серу и воду:
- Такие металлы, как железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании, при удалении оксидной пленки реакция возможна.
- Неактивные металлы восстанавливают концентрированную серную кислоту до сернистого газа:
- В реакциях с неметаллами концентрированная серная кислота также проявляет окислительные свойства:
- Концентрированная серная кислота широко используется в химических процессах как водоотнимающий агент, т.к. проявляет сильное водоотнимающее действие. В органической химии ее используют при получении спиртов, простых и сложных эфиров, альдегидов и т.д.
Соли серной кислоты, сульфаты, гидросульфаты
Способы получения солей серной кислоты
Сульфаты можно получить при взаимодействии серной кислоты с металлами, оксидами, гидроксидами (см. Химические свойства серной кислоты). А также при взаимодействии с другими солями, если продуктом реакции является нерастворимое соединение.
Физические свойства солей серной кислоты
Кристаллы разного цвета. Многие средние и кислые сульфаты растворимы в воде. Плохо растворяются или не растворяются в воде сульфаты многозарядных щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца.
Средние сульфаты щелочных металлов термически устойчивы. Кислые сульфаты щелочных металлов при нагревании разлагаются.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
KАl(SO4)2 x 12H2O – алюмокалиевые квасцы.
Химические свойства солей серной кислоты
Разложение сульфатов на различные классы соединений в зависимости от металла, входящего в состав соли.
Сера относится к семейству p-элементов. Электронная конфигурация серы [Ne]3s 2 3p 4 . Для серы характерно наличие трех степеней окисления «-2», «+4» и «+6».
Для получения серы используют реакцию Вакенродера (1) или получают ее неполным окислением сероводорода (2):
Из-за наличия нескольких степеней окисления сера способна проявлять и окислительные (в реакциях с металлами) и восстановительные (в реакциях с сильными окислителями) свойства:
Fe 0 -2e = Fe 2+ — процесс окисления (восстановитель)
S 0 +2e = S 2- — процесс восстановления (окислитель)
S 0 – 4e = S 4+ — процесс окисления (восстановитель)
O2 0 + 2e = 2O 2- — процесс восстановления (окислитель)
Сера взаимодействует с концентрированными растворами кислот (растворяется в них) и со щелочами (диспропорционирует):
Сероводород. Сероводородная кислота. Сульфиды
При нагревании серы с водородом происходит обратимая реакция в результате которой выделяется сероводород – бесцветный газ с запахом тухлых яиц, ядовитый и плохо растворимый в воде:
Однако, выход сероводорода в этой реакции невелик и для его получения чаще всего используют реакцию действия разбавленных кислот на сульфиды (соли сероводородной кислоты):
Водный раствор сероводорода – очень слабая кислота, диссоциация которой протекает в две ступени:
В связи с этим, для сероводородной кислоты характерна способность к образованию солей двух видов – средних – сульфидов (кислотный остаток — S 2- ) и кислых – гидросульфидов (кислотный остаток — HS — ).
Сероводородная кислота – сильный восстановитель, т.к. сера, входящая в состав этого вещества, находится в низшей степени окисления и способна повысить её до «+4» или «+6», поэтому состав продуктов реакции определяется силой и количеством окислителя:
Для сульфидов, как для солей образованных слабой кислотой, характерна способность к гидролизу. Сульфиды металлов, стоящих в ряду активности левее железа, растворимы в сильных кислотах:
Качественной реакцией на H2S и растворимые в воде сульфиды является:
S 2- + Pb 2+ = PbS↓ (осадок черного цвета)
Оксид серы (IV). Сернистая кислота
В степени окисления «+4» сера образует оксид, которому соответствует кислота. Оксид серы (IV) представляет собой газообразное вещество (сернистый газ) без цвета, но обладающее резким запахом, хорошо растворимое в воде.
Выделяют промышленные и лабораторные способы получения оксида серы (IV). Так, в промышленности (1), его получают при обжиге сульфидов, а в лаборатории (2) – при действии сильных кислот на сульфиты:
В водном растворе оксида серы (IV) возможно одновременное существование нескольких химических равновесий:
Образующаяся в результате сернистая кислота (H2SO3) является двухосновной, поэтому способна к образованию двух типов солей – средних — сульфитов (кислотный остаток SO3 2 ) и кислых — гидросульфитов (кислотный остаток HSO2 — ).
Для оксида серы (IV), сернистой кислоты и её солей характерны химические свойства, которые можно разделить на 3 группы: кислотно-основные реакции (1), реакции окисления (2) и реакции восстановления (2):
Качественная реакция на SO2 и сульфиты – обесцвечивание раствора перманганата калия:
Оксид серы (VI). Серная кислота
Оксид серы (VI) представляет собой бесцветную жидкость, которую получают окислением оксида серы (IV) кислородом в присутствии катализатора (V2O 5):
Оксид серы (VI) хорошо растворим в воде (образуется серная кислота) и в 100%-ной серной кислоте (образуется олеум):
Серная кислота представляет собой тяжелую вязкую жидкость, которая хорошо смешивается с водой в любых отношениях. Водный раствор серной кислоты – сильная кислота. Поскольку H2SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO4 2- ) и кислые – гидросульфиты (кислотный остаток HSO4 — ).
При взаимодействии с металлами (как, стоящими в ряду активности до водорода, так и после него) серная кислота восстанавливается до оксида серы (IV):
Разбавленная серная кислота окисляет только металлы, стоящими в ряду активности до водорода:
Качественной реакцией на серную кислоту и растворимые сульфаты является образование осадка сульфата бария – осадка белого цвета, нерастворимого в щелочах и кислотах:
| Задание | Осуществите ряд превращений S→H2S→SO2→SO3→H2SO4 |
| Решение | Получение сероводорода из серы осуществляют путем её восстановления водородом: |
Оксид серы (IV) из сероводорода получают путем его окисления кислородом:
Чтобы получить оксид серы (VI) из оксида серы (IV) необходимо окислить оксид серы (IV) кислородом:
Оксид серы (VI) типичный кислотный оксид, который при взаимодействии с водой образует кислоту, поэтому, для того, чтобы получить серную кислоту из оксида серы (VI) необходимо пропустить его через воду:
| Задание | При взаимодействии серы с концентрированной азотной кислотой (массовая доля 60%, плотность раствора 1,27 г,мл) образовалась серная кислота и оксид азота (II) объемом 67,2 л (н.у.). Вычислите массу серы и объем раствора азотной кислоты, вступивших в реакцию. |
| Решение | Запишем уравнение реакции: |
Найдем количество вещества оксида азота:
моль.
Вычислим массу серы:
Для расчета объема азотной кислоты необходимо знать её количество. По уравнению реакции для образования 2 моль оксида азота (II) необходимо 2 моль азотной кислоты:
Определим массу азотной кислоты:
Вычислим массу раствора азотной кислоты, зная массовую долю HNO3 в растворе. По определению:
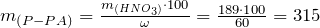
(г).
Определим объем раствора 60 %-ной азотной кислоты, необходимый для взаимодействия:
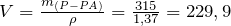
(мл).
Читайте также:
