Соединения металлов в природе
Обновлено: 07.07.2024
В организме человека находятся 81 химический элемент из 92, встречающихся в природе. Организм человека состоит на 60% из воды, 34% приходится на органические вещества и 6% - на неорганические.
Человеческий организм - сложная химическая лаборатория. Трудно себе представить, но ежедневно наше самочувствие, настроение и даже аппетит могут зависеть от минеральных веществ. Без них бесполезными оказываются витамины, невозможны синтез и распад белков, жиров и углеводов.
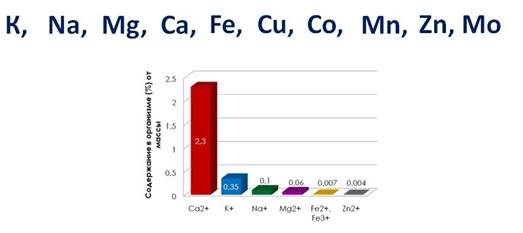
Например, если вес человека составляет 70 кг, то в нем содержится (в граммах): кальция - 1700, калия - 250, натрия - 70, магния - 42, железа - 5, цинка - 3.
Очевидно, что металлы необходимы клеткам тела человека для нормальной жизнедеятельности. Как избыток, так и недостаток металлов оказывает отрицательное влияние на организм, а некоторые металлы могут оказывать на него токсичное действие.
Роль химических элементов.
Земную кору составляют сравнительно небольшое число химических элементов. Около ½ масса земной коры приходится на кислород. Более ¼ - на кремний. Всего 18 элементов; O, Si, AL , Fe , Ca , K , Mg , H , Ti , C , Cv , P , U , Mn , F , Ba , Na , K составляют 99,8% массы земной коры. Из них на 8 элементов приходится 98% - это O, Si, AL , Fe , Ca , K , Mg , Na . Тогда как в живых организмах 6 элементов – это O, S, C , P , Н, N на их долю приходится 97,4% массы организмов. Эти элементы называют органогенами.
С химической точки зрения отбор элементов при формировании организма сводится к отбору тех из них, которые способны к образованию прочных, но в то же время и лабильных связей. Эти связи должны легко подвергаться как гомолитическому (О2 --- О + О ) так и гетеролитическому (Н2О == О +2Н ) разрыву, а также циклизации (6 С --О). Именно поэтому органоген №1 в живой материи – это углерод. Атомы кислорода и водорода гораздо менее лабильны, но и они образуют устойчивую среду для соединений остальных элементов – это воду, тем самым обеспечивают протекание окислительно-восстановительных процессов. Атомы неметаллов (N,P,S) и металлов (Fe, Cu, Mg ) отличаются особой лабильностью в образовании различных химических связей. Такие как Si и AL составляющие большую часть земной коры в живых организмах играют второстепенную роль. Теперь дадим им характеристику.
Значение металлов в живых организмах?
Железо. Содержание его в организме. Он входит в состав гемоглобина, является кофактором каталозы – фермента разрушающего пероксид водорода и оберегающего клетки от его повреждающего действия. При недостатке железа нарушается азотистый, жировой и жировой обмен, развивается анемия. У растений заболевание хлороз – обесцвечивание листьев. Ежедневная потребность железа около 12мг.
Кальций потребность для взрослых 0,8 -1г, для детей 0,6 -0,9 г в сутки.
Кальций основной компонент костей. Ионы кальция передают возбуждение на мышечное волокно, вызывая ее сокращение, увеличивает силу сердечных сокращений, повышает фагоцитарную функцию лейкоцитов, активизирует защитную функцию белков, кальций влияет на проходимость сосудов – без этого элемента жиры, липиды и холестерин осели бы на стенках сосудов и закупорили бы их. Он способствует выведению из организма тяжелых металлов. Ионы кальция обеспечивают постоянство осмотического давления крови. Он способствует свертыванию крови при ранениях. В растениях он играет большую роль в работе устьиц. Обмен кальция и его поступления в кость регулируется витамином Д.
При недостатке кальция происходит вымывание его из костей, образуются камни в костях. Никотин, кофеин, алкоголь являются одним из причин недостатка кальция, т.к. способствуют его интенсивному выведению мочой. Недостаток в кальции вызывает увеличение свертываемости крови, уменьшению усвояемости цинка, клетками костной ткани, появление остеоартрита, катаракты, артериального давления.
Калий и натрий элементы биотоков. Так ли это?
Калий участвует в формировании костной ткани, участвует в поддержании нормальной проницаемости наружных мембран, для образования ряда ферментов, для поддержания сердечного ритма, участвует в работе нервной ткани. В человеческом организме до 0,25г. Суточная потребность 2-5г.
Натрий. Суточная потребность 0,1 -3,3 г. Натрий входит внутренний и внешний слой мембраны клетки для возникновения электрического мембранного биопотенциала.
При недостатке натрия возникают колики, судороги, нарушения кровообращения, слабость снижение давления, может быть обморок.
Металлы необходимые для жизнедеятельности человека?
В небольших количествах входит Mn, Co, Ni, Cn, Zn , AL , Cv , Ux потребность колеблется от 300мг до 0,2 мг в сутки. Цинк входит в состав ферментов. Содержание его в человеческом теле 2-3г. Используется для приготовления глазных капель, кожных мазей.
Марганец. Содержание его в человеческом теле 12-20мг. Недостаток его сказывается на рост длинных костей, на мышечный тонус, на образование хрящевой ткани.
Кобальт. Содержание 4-10мг. Он участвует в синтезе мышечных белков, нервных волокон, на усвоение кальция и фосфора, способствует включению иона железа в молекулу гемоглобина. Способствует углеводному обмену.
Никель. Содержание 14мг. В небольших количествах активирует пищеварительные ферменты. Много его в табачном дыме. В больших количествах он притупляет работу пищеварительных ферментов, влияет на зрение (кератины, керато-коньюктивиты). Влияет на работу кроветворительных органов.
Тяжелые металлы и почему они опасны?
Тяжелые металлы способны соединятся белком довольно прочно, нарушать тем самым работу ферментов.
Hg – энергично соединяется с группами HS – сосредотачивается в почках нарушает их работу – отеки.
Кадмий – задерживается в почках, печени, поджелудочной железе и щитовидной, нарушая тем самым их работу.
Свинец – вызывает сильнейшее отравление, поражение десен, заболевание почек, нервной системы.
Талий – поражение десен, выпадение волос, нарушается работа желудочно-кишечного тракта, нервной системы, почки.
Хром – в основном через органы дыхания ПДК – 0,0001мг/л. Соединяется с белками содержащими железо, белками печени, костного мозга, легких, вызывая рак легких и различные аллергии.
Название химического элемента
Биологическая роль в клетке
Для аэробных организмов служит окислителем в ходе клеточного дыхания, обеспечивая клетку энергией.
Участвует в свертывании крови, участвует в формировании костей и зубов, позвоночников и скелетов беспозвоночных.
Участвует в проведении нервного импульса. Поддерживает осмотическое давление в клетках
Металлы в природе. Способы получения металлов

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлы в природе. Способы получения металлов"
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».

За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.

В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.

Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑

Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
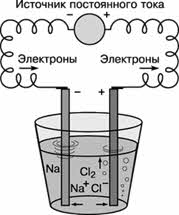
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
"Металлы в природе. Общие способы получения металлов"
Презентация предназначена для учащихся 9 класса, ее можно использовать при изучение темы "Металлы", а так же при подготовке к ОГЭ. В презентации рассматривается вопрос о нахождении металлов в природе и общих способах получения металлов - прирометаллургии, гидрометаллургии, электрометаллургии и микробиологической способе.
Содержимое разработки

Металлы в природе.
Общие способы получения металлов.
Презентация к уроку. 9 класс .Химия. Антонова Ирина Павловна . Учитель химии и биологии МБОУ СОШ№8

ЦЕЛЬ УРОКА :
- Познакомиться с природными соединениями металлов и с самородными металлами; получить понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов, продемонстрировать лабораторные способы получения металлов и ознакомиться с промышленным производством металлов.
РАСПРОСТРАНЕННОСТЬ МЕТАЛЛОВ В ПРИРОДЕ
Процентное содержание металлов в морской воде:
В ПРИРОДЕ МЕТАЛЛЫ МОГУТ ВСТРЕЧАТЬСЯ
Железный метеорит




KCl • MgCl 2 • 6H 2 O


СУЛЬФАТЫ, ФОСФАТЫ, КАРБОНАТЫ

Черная- получение
железа и его
сплавов (сталь, чугун)
Цветная- получение
остальных металлов
и их сплавов

- Восстановление металлов из руд при высоких температурах с помощью восстановителей.
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO 3 = CuO + CO 2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО 2 = 2ZnО + 2SО 2

Пирометаллургия
Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO 2
Водородотермия:
Cr 2 O 3 + H 2 → Cr + H 2 O
Металлотермия:
Fe 2 O 3 + Al → Fe + Al 2 O 3

- Получение металлов израстворових солей.
- Перевод нерастворимого соединения в раствор:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuSO 4 + Fe = FeSO 4 + Cu.
2NaCl → 2Na + Cl 2
MgBr 2 → Mg + Br 2
- Микробиологические методы получения металлов.

-82%
Получение металлов. Нахождение их в природе
Этот видеофрагмент даёт возможность учащимся вместе с путешественником побывать в местах, где были найдены самые большие самородки металлов, он расскажет о распространённости металлов в земной коре, о некоторых исторических фактах, касающихся металлов, а также о рудах и минералах. Вместе с ним ребята побывают на дне водоёма и увидят отложения металлов, смогут представить себя в роли геолога и сравнить такие минералы, как красный, бурый и магнитный железняк. Путешественник расскажет им об основных методах получения металлов и затронет некоторые вопросы охраны окружающей среды, связанные с получением металлов.

Конспект урока "Получение металлов. Нахождение их в природе"
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки. Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг. Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.

А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.
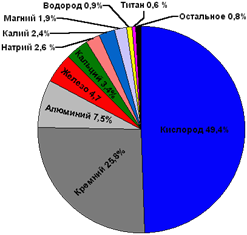
Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.
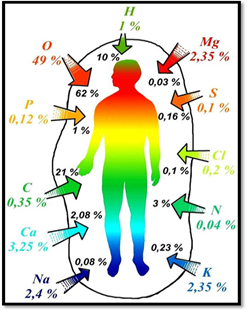
К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Химический состав
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки, густо усеивающие дно. Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой». В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.
Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.
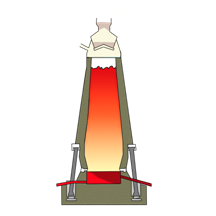
Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
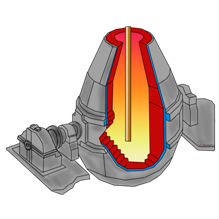
Для получения некоторых металлов в качестве восстановителя используют водород.

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.

Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.

При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Презентация по химии на тему: "Нахождение металлов и их соединений в природе"

Тысячи лет ходили люди по алюминию и, счищая с обуви налипшую глину, даже не догадывались, что в ней ценный металл. Да, алюминий входит в состав обыкновенной глины.
Каменный топор первобытного человека содержал алюминий. Дома из кирпича содержат алюминий. Любуясь драгоценными камнями - синим сапфиром, красным рубином - многие не догадываются,что это просто алюминий с кислородом.
Узнали об этом металле в 1825 г. Первоначально он ценился выше золота и применялся для изготовления ювелирных изделий. Члены царской семьи были удостоены чести пользоваться алюминиевыми вилками и ложками на банкете, устроенном императором Франции Наполеоном III.
Сегодня его называют «крылатым металлом».

Царь-Ко́локол —Отлит в 1735 году из бронзы (сплав меди с оловом) русскими мастерами Иваном Маториным и Михаилом Маториным на Пушечном дворе по указу императрицы Анны Иоанновны.
Его масса 200 тонн, высота 6.14 метра, диаметр 6.6 метра. Во время пожара 1737 года от Царь-колокола отвалился кусок массой 11.5 тонн. К сожалению никто не услышал звон этого гиганта.
Царь-Пу́шка — отлита из бронзы в 1586 году русским мастером Андреем Чоховым на Пушечном дворе во времена правления царя Фёдора Ивановича. Масса 40 тонн, длина 5.3 метра, калибр 89 см. В боях пушка не участвовала и осталась памятником высокого мастерства русских оружейников на территории Московского Кремля.

Натрий и калий вплоть до XIX века не были открыты, хотя соединения этих металлов наши предки знали давно.
Древний человек использовал поваренную соль (хлорид натрия).
В Ветхом завете упоминается вещество «НЕТЕР», используемое как моющее средство. Очевидно – это сода.
Для обозначения соды, арабские алхимики употребляли терин «натрон». Очевидно от него и произошло современное названия металла - натрий

А задумывался ли кто–нибудь из вас, что было бы, если всё железо исчезло на Земле и не осталось бы ни одного грамма этого элемента? «… На улицах стоял бы ужас разрушения: ни рельсов, ни автомобилей не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без живительного металла. Человек прекратил бы своё существование, лишившись трёх граммов железа в своем теле и крови. Потерять пять тысячных своего веса было бы для него смертью». Писал академик А.Ферсман

«Если путь твой к познанию мира ведет,-
Как бы ни был он долог и труден - вперед!»
II этап урока: Проверка усвоения пройденного материала

Вопросы для повторения
1. Как по электронной формуле быстро определить местоположение металла в периодической таблице?
2. Как по электронной формуле определить принадлежность металла к определенному семейству?
НОМЕР ГУППЫ
НОМЕР ПЕРИОДА
СЕМЕЙСТВО d-ЭЛЕМЕНТОВ
СЕМЕЙСТВО p-ЭЛЕМЕНТОВ
НОМЕР ГУППЫ
НОМЕР ПЕРИОДА

3. Почему из 109 химических элементов периодической таблицы 87 приходится на долю металлов?
На внешнем энергетическом уровне у металлов находится 1-3 электрона. Такое строение имеют элементы I-III групп главных подгрупп и все элементы побочных подгрупп.
Почему металлы легко окисляются? Как называется величина, необходимая для отрыва внешнего электрона от атома?
Металлы легко окисляются, т.к. их валентные электроны слабо связаны с ядром.
Величина, необходимая для отрыва внешнего электрона от атома называется энергией ионизации

«Нахождение металлов и их соединений в природе»
Изучить основные месторождения руд металлов на территории Казахстана, привести в систему знания о способах получения металлов.
Продолжить развитие умений и навыков работы с картой полезных ископаемых Казахстана.
Закрепить умения и навыки в написании окислительно-восстановительных реакций.
Продолжить развитие навыков творчества, самостоятельного изучения материала по заданному алгоритму, работы в группах, развития экологической культуры.

III этап урока: Изучение нового материала
Самостоятельная работа учащихся с учебником
по теме:
«Металлы в природе»
Содержание металлов в земной коре.
Природные соединения металлов.
Запасы руд металлов на территории Казахстана.

Задание
1 группа
Fe
2 группа
Cu
3 группа
K, Ca
4 группа
Al
Содержание
металла
в земной коре.
Природные
соединения
металла
Запасы руд металла на территории Казахстана
5,1%
Fe2O3
Красный железняк
Fe3O4
Магнитный железняк
Лисаковское,
Соколово -
Сарбайское
4,7∙10-3%
СuS Ковеллин
Сu2S Халькозин
(медный блеск)
Жезказган,
Карсапкай
3,6% Са
2,6% К
СаСО3
Мел, мрамор, известняк
Са 3(РО4)2
КСl
Шилишайское
месторождение,
г. Тараз
8,1%
Аl2О3
Корунд
Аl2О3∙ nН2О
Боксит
Костанайская Актюбинская области
Заполнить таблицу «Металлы в природе»

Li К Са Na Mg Al Zn Cr Fe Ni Sn Pb (Н2) Сu Hg Ag Pt Au
Хлориды, сульфаты, Оксиды, сульфиды Природные кристаллы
карбонаты, силикаты Самородки
Т.К. основная масса металлов встречается в виде оксидов (основные оксиды), то их получают восстановлением углём и оксидом углерода (II), водородом, алюминием.

Самостоятельная работа учащихся
«Получение металлов из их оксидов»
Написать окислительно-восстановительные реакции получения
металлов из их оксидов, показать переход электронов.
1 группа
Fe
e
2 группа
Cu
3 группа
Zn
4 группа
Mn
Fe2O3 + СО→
CuO + Н2 →
ZnO + C→
МnО2 + Аl →
Fe2O3 + 3СО→ 2Fe + 3СО2
CuO + Н2 → Cu + Н2О
ZnO + C→ Zn + CО
3МnО2 + 2Аl →3Мn + 2Аl2O3

Восстановление меди
из оксида водорода
Алюмотермия
Просмотр видеоопытов из коллекции.

Рефлексия
1. В виде каких соединений металлы встречаются в природе?
2. Какие вещества используют в качестве восстановителей металлов из их оксидов?
3. Почему данный способ получения металлов считают экологически чистым процессом?
Краткое описание документа:
Разработка урока "Нахождение металлов и их соединений в природе" для учащихся 10 класса естественно-математического направления. Урок интегрированный (химия-география), направлен на развитие функциональной грамотности учащихся, их информационной компетентности, навыков самостоятельной работы в группах. При работе учащиеся могут пользоваться картой полезных ископаемых, справочниками по химии. Результаты работы оформляются в виде таблицы. На уроке используется проблемный и исследовательский методы обучения, мозговой "штурм". Руководит работой группы спикер который распределяет задания среди участников группы, для экономии времени, повышения плотности урока и его темпа.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
