Способы получения металлического кальция
Обновлено: 04.10.2024
Металлический кальций является ценным промышленным продуктом, значительная часть которого реализуется за рубежом. Производя! металлический кальций методом электролиза расплава.
Сырьем для электролиза служит расплав хлорида кальция СаС12. При проведении процесса на аноде выделяется хлор:
2СГ - 2е = С12 (11.50)
На катоде происходит образование металлического кальция:
Са2+ + 2е = Са (11.51)
В процессе электролиза для повышения полноты реакции в электролитическую ванну добавляют медь. После электролиза получают медно-кальциевый сплав с содержанием кальция 62 — 65 %, что недостаточно для применения продукта в промышленности, поэтому проводят дистилляцию кальция из сплава.
Отделение кальция от меди основано на большой разнице упругости паров меди и кальция при одинаковой температуре и давлении. В результате при нагревании один металл возгоняется, а другой остается в расплаве.
Дистилляцию сплава проводят в роторной печи при температуре 1 000—1 080 °С в течение 4,0 —4,5 ч. В результате получают кальций чистотой 99,5 %. Этот продукт используют в промышленности.
В процессе электролиза на аноде выделяется газообразный продукт С12. Хлор является тяжелым и очень токсичным газом. Его содержание в воде регламентируется значением ПДК 0,00001 мг/л, в воздухе ПДКсе хлора равно 0,03 мг/л. Газ обладает большой вязкостью и имеет тенденцию накапливаться в небольших углублениях на поверхности почвы, где происходит его концентрирование.
Перед выбросом в атмосферу газ проходит очистку, в процессе которой хлор абсорбируют раствором извести Са(ОН)2.
Абсорбцию проводят в горизонтальном абсорбере. После абсорбции отходящие газы выбрасывают в атмосферу через трубу высотой 200 м.
Отходом процесса абсорбции до последнего времени была пульпа с соотношением Ж:Т = 3: 1. В состав пульпы входили хлорид кальция, гидроксид кальция и вода.
В России разработана и внедрена безотходная технология производства металлического кальция. В основе разработок использован принцип организации безотходных производств. Отходы процесса перерабатывают до получения продукта, который может быть применен в самом производстве. Организованы замкнутые водооборотные циклы.
По разработанной технологии отходящие газы перерабатывают на товарный хлорид кальция, который используют в качестве сырья для получения основного продукта — металлического кальция. При внедрении этой технологии общее количество отходов сократилось на 95 — 96 %. Все сточные воды используют в замкнутых циклах на производстве, а количество твердых выбросов уменьшилось на 90 %.
Таким образом реализуется безотходная экологически чистая технология производства металлического кальция, в котором сырьем являются отходящие газы стадии электролиза (хлорвоздуш- ная смесь) и известковое молоко.
На рис. 11.27 приведена функциональная схема производства металлического кальция по безотходной технологии.
Технологический процесс включает несколько стадий: электролиз и дистилляция металлического кальция; приготовление растворов гашеной извести; очистка отходящих газов основного производства; первая стадия очистки пульпы; вторая стадия очистки пульпы; сушка СаС12.
В новой технологии стадия электролиза осталась без изменений. Продуктами электролиза являются металлический кальций и отходящие газы, содержащие хлор.
Однако если в качестве сырья ранее использовали покупной товарный хлорид кальция, то по новой технологии для проведения электролиза применяют хлорид кальция, полученный после переработки пульпы.
Очистку отходящих газов от хлора проводят с применением гашеной извести. Получение гашеной извести является изученным процессом. Он основан на взаимодействии оксида кальция СаО с водой с образованием раствора Са(ОН)2. Отходящие газы и раствор извести направляют на абсорбцию.
Рис. 11.27. Функциональная схема получения металлического кальция по безотходной технологии
образуется пульпа, которая раньше в качестве отхода производства удалялась в отвал.
Технология переработки пульпы на товарный продукт — хлорид кальция, используемый в качестве сырья в производстве основного продукта, является новой инженерной разработкой.
Рассмотрим этот процесс более подробно.
Первая стадия очистки пульпы. Для получения товарного хлорида кальция, пригодного в процессе электролиза, пульпа должна пройти дополнительные операции очистки и концентрирования.
После очистки отходящих газов от хлора получают пульпу состава, г/л: хлорид кальция СаС12 — 250—350, оксид кальция СаО — 6 — 20, хлорит кальция Са(С102)2 — 1.
Целью первой стадии является нейтрализация раствора и разрушение хлорита, а также очистка от механических примесей. Пульпу сливают в емкость, в которую добавляют соляную кислоту до значения pH 10,0— 10,8. Контроль за процессом нейтрализации ведут визуально, не допуская пенообразоваиия на поверхности пульпы. Диапазон устанавливаемых значений pH отвечает нейтрализации избыточного количества известкового молока до остаточной концентрации 1 — 5 г/л.
После прекращения подачи соляной кислоты происходит перемешивание раствора в течение 30 мин для установления стабильного значения pH. За процессом проводится постоянный ана-
литический контроль. По истечению времени раствор направляют на фильтрацию.
Фильтрацию осуществляют в целях удаления из раствора твердой фракции (песка, глины, взвесей гидроксидов и других примесей). Работа фильтр-пресса состоит из последовательных операций: собственно фильтрация; отжим осадка; промывка осадка; отжим осадка от промывной воды; просушка воздухом; выгрузка осадка.
Продолжительность процесса фильтрации 2,5 ч.
Осадок после проведения первой фильтрации является отходом производства, и его вывозят на полигон. Количество твердой фазы не превышает 3 — 6% общей массы используемых веществ.
Промывные воды, полученные на первой стадии очистки пульпы, используют в процессе приготовления раствора гашеной извести на стадии абсорбции.
Вторая стадия очистки пульпы. После первой фильтрации раствор переливают в другую емкость и проводят вторичную обработку соляной кислотой для снижения остаточной концентрации гидроксида кальция. Нейтрализацию Са(ОН)2 проводят до остаточной концентрации 0,05 — 0,2 г/л, что соответствует pH 8,0 — После прекращения подачи соляной кислоты проводят перемешивание раствора в течение 30 мин. Обработанный раствор подают на вторую фильтрацию. Процесс фильтрации аналогичен процессу, описанному ранее. Средняя скорость фильтрации 12—16 м3/ч. Продолжительность процесса 3,5—4 ч.
Стадия концентрирования и получения сухого хлорида кальция. Технология процесса сушки хлорида кальция разработана впервые и состоит из двух операций: концентрирования раствора хлорида кальция и получения твердого продукта и его сушки.
Концентрирование раствора хлорида кальция. Раствор хлорида кальция (второй фильтрат) с содержанием продукта -350 г/л передают на стадию концентрирования. Все промывные и сточные воды, полученные в этой и последующих операциях, собирают и используют в технологических процессах на стадиях приготовления раствора известкового молока, очистки отходящих газов и т. д. Концентрирование раствора происходит в пенном скруббере. Концентрация хлорида кальция повышается с 350 до 600 г/л. Скруббер представляет собой полый цилиндрический аппарат (рис. 11.28), в верхнюю часть аппарата подается раствор хлорида кальция, в нижнюю часть — сушильный агент. В качестве сушильного агента используют отходящие газы, образующиеся на стадии сушки. Тем
пература газов на входе в скруббер — 160—180 °С. Газы из сушильной башни после первичной очистки в циклонах от порошка хлорида кальция проходят через слой раствора на рабочей решетке пенного скруббера, где практически полностью очищаются от твердых частиц СаС12 и после этого выбрасываются в атмосферу.
При контакте раствора хлорида кальция с отработанным сушильным агентом его концентрация повышается за счет растворения находящихся в газе твердых остатков и частичного упаривания раствора. Обогащенный раствор хлорида кальция с рабочих решеток пенного скруббера самотеком стекает в емкость, откуда насосами подается в сушильную башню.
Стадия сушки и получения твердого хлорида кальция. Процесс получения порошка хлорида кальция заключается в высушивании капель раствора в потоке сушильного агента. Нагретый газ подается в верхнюю часть сушильной башни с температурой 320 — 360 °С. В поток газа в зону сушки, расположенную в самой широкой части аппарата, воздушными инжекторными форсунками впрыскивается раствор хлорида кальция. За время нахождения в зоне сушки из капель раствора образуются кристаллы безводного хлорида кальция, которые оседают на поверхности внутреннего конуса, называемого «юбкой» аппарата, и по ней стекают в нижний конус к разгрузочному люку.
Отработанный сушильный агент, содержащий мелкую фракцию порошка хлорида кальция, через воздуховоды, расположенные под внутренним конусом башни, поступает в циклопы па первичную очистку. После этого сушильный агент подается в пенный скруббер.
Порошок хлорида кальция из конусов башни и циклонов через разгрузочные люки системой шнеков подается на узел загрузки
1— патрубок слива раствора; 2— смотровой люк; 3 — верхний технологический люк; 4— расширитель; 5— брызгоотбой- ник; 6— решетка брызгоотбойника; 7— патрубок подачи раствора; 8 — рабочая решетка; 9— нижний технологический люк
транспортных контейнеров и направляется на склад готовой продукции или в отделение электролиза.
Полученный твердый продукт используется как исходное сырье для производства электролитического хлорида кальция.
Предложенная и внедренная замкнутая схема производства металлического кальция является экологически чистым процессом. Она позволяет полностью устранить сбросы сточных вод, представляющие собой концентрированные солевые растворы, на 90 % сокращает выбросы твердых веществ и на 80 % уменьшает потребление сырья при сохранении мощности. Проект соответствует требованиям ISO.
Кальций – полезные свойства и особенности металла
Этот химический элемент жизненно важен в буквальном смысле: из него состоят наши кости и зубы. Кальций – это также морские раковины, цветные мелки, сталактиты и сталагмиты в пещерах.

Что представляет собой
Кальций – это химический элемент периодической системы Д. И. Менделеева под №20. Мягкий серебристо-белый металл блестит, но затем тускнеет под пленкой-оксидом.
Состоит из шести стабильных изотопов, при этом 97% состава приходится на Ca40.
Относится к щелочноземельным металлам.
Международное обозначение – Calcium (Ca).
История
Применение кальциевых минералов – мрамора, гипса, известняка – исчисляется тысячелетиями.

Гипс
Чистый металл первым в истории получил британский химик Гемфри Дэви (1808 год). Для этого он применил электролиз к смеси из оксида ртути и мокрой гашеной извести. Получив амальгаму, отделил ртуть.
Он же предложил латинское название элемента: calcis означает мягкий камень, известка.
Физико-химические характеристики
Кальций представлен двумя модификациями кубической решетки: с гране- и объемноцентрированной структурой.

Металл наделен многими достоинствами: пластичен, режется ножом, обрабатывается прессованием, прокаткой.
Химические свойства проявляются при нагревании:
- Взаимодействие с горячей водой приводит к образованию водородного «фонтана». Но реакция проходит без взрывов или горения.
- Взаимодействует с кислотами, неметаллами, образуя соединения.
- Даже при комнатной температуре во влажном микроклимате покрывается пленкой.
Нагреваясь в кислороде либо на воздухе, кальций, его растворимые соли горят. Пламя получается красно-оранжевым. По цвету его легко отличить от других металлов.

Кальций в атмосфере аргона
Химическая активность вещества зашкаливает. Для устранения этого недостатка металл хранят в керосине, растопленном парафине либо закупоренном сосуде.
Уникальные свойства кальция как металла проявляются при усилении давления.
Под давлением он ведет себя как полупроводник, затем как металл, потом подобно сверхпроводнику. По проводимости в разы превосходит все химические элементы (например, ртуть – вшестеро).
Присутствие в природе
Кальций – третий по распространенности в земной коре среди металлов, пятый среди всех элементов. Четвертый по количеству минералов (385).
Однако высокая химическая активность исключает присутствие элемента в свободном виде:
- Это компонент минералов и соединений. Самые распространенные минералы – гипс, кальцит, алебастр, флюорит, апатит, доломит.
Вещество с формулой СаСО3 – обычный мел.
- Щелочноземельный металл обнаружен в каменных метеоритах – как почти ненаходимые на земле сульфиды.
Тонна земной коры содержит 32,7 кг кальция, литр морской воды – 410 мг.
Из морской воды кальций как строительный материал вытаскивают моллюски, кораллы.
Концентрацией кальция в составе определяется степень жесткости воды.
Технология получения
Конечный продукт промышленного производства – металлический кальций.

Металлический Кальций
Получение металла проходит двумя методами:
- Электролиз. Расплавляют CaCl2, задействуя медно-кальциевый анод. Из полученного медно-кальциевого сплава (2:1) отгоняют металл.
- Алюминотермия. Прокаливается смесь CaO и порошковый алюминий. Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Для обоих способов получения металла требуется вакуум и 960-1900°С.
Единственный производитель кальция в Европе – Чепецкий механический завод. Его открыли в 1949 году для нужд отечественной урановой промышленности. Уже тогда СССР отработал процесс восстановления урана кальцием. Сегодняшний ассортимент шире.
Где используется
Утилитарные характеристики металла обусловили сферы применения.

Применение Кальция
Промышленность
Львиная доля продукции металлургических комбинатов достается промышленному комплексу.
Здесь миссия кальция многогранна:
- Восстановление редкоземельных, тугоплавких элементов из соединений. Речь о хроме, никеле, меди, тории, уране.
- Удаление серы из бензина, керосина, других нефтепродуктов.
- Раскисление стали и сплавов цветных металлов.
- Получение антифрикционных сплавов.
- Очистка электровакуумных приборов от воздуха, других газов.
- Обезвоживание органических растворителей.
Металл используется при производстве аккумуляторных батарей, подшипников, оболочек кабелей.
Наука
Изотоп Ca-48 – материал с высоким КПД для производства сверхтяжелых элементов.
Кальцием восстанавливают уран.
С его помощью ученые пополняют таблицу Менделеева.
Другие сферы
Кальциевые материалы нашли применение на бытовом уровне:
- Строительный материал (известняк, гипс, мрамор).
- Сырье при производстве гипса, включая медицинский.
- Дезинфектор (хлорка).
- Мелки для рисования.
- Аптечные препараты, БАДы (особенно с витамином D).
Эстетично выглядящие образцы (флюорит, кальцинит, мрамор) попадают в минералогические коллекции.
Биологическое влияние
Кальций – важный для биологических организмов макроэлемент (1,6-2,1% по массе): он есть в растениях, организме животных, человека.
Жизненные процессы
Макроэлемент аккумулируется костями и зубами.
Известь (карбонат кальция) – строительный материал ракушек, кораллов, яичной скорлупы, накипи в чайнике.
Вещество задействовано в следующих процессах:
- Свертывание крови.
- Сокращение мышц.
- Секреция гормонов.
Тело человека массой 60 кг содержит полтора килограмма кальция.
Достаточное количество металла критично для детей и подростков: их скелет растет каждую минуту. У младенцев может проявиться рахитичность.
Питание
Макроэлемент поступает в организм во время еды. В детском возрасте продукт номер один – молоко.
Рацион взрослых разнообразнее. Веществом насыщены продукты всех групп:
- Цельнозерновой хлеб, гречка.
- Морепродукты, рыба (особенно мягкие кости).
- Бобовые.
- Орехи, свежий кунжут.
- Листовой салат, укроп, петрушка, спаржа.
Всасыванию кальция содействует лактоза, препятствуют кофе, углеводы, пальмовое масло, животные жиры (кроме сала).
Нормы
Суточная потребность в макроэлементе определяется возрастом (г):
| Возраст (лет) | Количество кальция (мг) |
| 0-6 | 1490 |
| 7-9 | 750 |
| 10-12 (мальчики) | 910 |
| 10-12 (девочки) | 1250 |
| 13-19 | 1250 |
| 20-49 | 1050 |
| 49+ | 1150-1350 |
Беременным и кормящим матерям требуется повышенная норма вещества.
Симптомы нехватки/переизбытка
Дефицит металла в организме проявляется многопланово:
- судороги, онемение конечностей, суставная боль;
- тахикардия;
- гипертония;
- расслоение, ломкость ногтей.
На ментальном плане это депрессия, нервозность.
Хроническая нехватка макроэлемента ведет к хрупкости костей (остеопорозу).
Об избытке макроэлемента сигнализируют отвращение к еде, неутолимая жажда, расстройство ЖКТ (тошнота, рвота), повышенное мочеотделение, слабость.
Избыток вещества опасен: организм «цементируется».
Максимальная суточная доза кальция для взрослых – 2,5 г.
На российском рынке представлена промышленная и аптечная продукция.
Цены на промышленный кальций (руб. / кг):
- металлический – 450;
- кусковой (чистота: 99,82%) – 1500;
- хлористый технический – 47;
- хлористый пищевой – 95.
Аптечный сегмент представлен отечественной и зарубежной продукцией. Упаковка глюконата кальция (10 таблеток) российского производства стоит 15-25 руб., препарата «Кальций-Д3 Никомед» – 300 – 700 руб.
О возможности получения металлического кальция различными восстановителями

Исследована возможность получения металлического кальция различными термическими методами, а именно — методом диссоциации карбида кальция в вакууме, с помощью газовых восстановителей и металлотермическим восстановлением оксида кальция. Показано, что применение газовых восстановителей или диссоциация карбида кальция при температурах ниже 1750 0 С не позволяет получить металлический кальций. Алюминотермическое восстановление сопровождается хорошей смачиваемостью алюминием поверхности оксида, однако не является оптимальным по себестоимости восстановителя. Критерий смачиваемости положен в основу выбора металла восстановителя.
Ключевые слова:кальций; восстановление оксида кальция; диссоциация карбида кальция; вакуумная печь; алюминотермическое и металлотермическое восстановление.
В мире и, прежде всего, в КНР как главном поставщике кальция, его получение основано на процессе восстановления оксида кальция алюминием [1]. В Российской Федерации этот способ пока не нашел своего промышленного воплощения. Поскольку для нужд металлургической промышленности на первый план выходит не чистота получаемого кальция, а его стоимость, нами исследовалась возможность получения кальция металлотермическим, в том числе, алюминотермическим, а также альтернативными методами, связанными с проведением нагрева в вакууме.
Процессы получения кальция проводились на вакуумной дистилляционной электропечи ВОж-16–22 (рис.1) в состав электропечи помимо основных компонентов входили:
- нагревательный блок из углерод-углеродного композиционного материала (УУКМ) различной плотности;
- охлаждаемый водой конденсатор паров кальция;
- в вакуумной системе предусмотрен мембранный насос, позволяющий проводить откачку паров воды при относительно низких температурах.

Рис. 1. Вакуумная дистилляционная печь ВОж-16–22
Используемая в работе измерительная аппаратура:
- рентгеновская съемка (РФА) проведена на дифрактометре ДРОН-3 в CuKα;
- растровая электронная микроскопия (РЭМ) проведена на электронном микроскопе FEI Quanta 600 FEG с приставкой энергодисперсионного рентгеновского микроанализа EDAX;
- массу образцов измеряли на лабораторных электронных весах AJH-620CE.
Используемые в работе материалы: оксид и карбид кальция, алюминий марки АПВ, кремний технический КР00, ферросилиций ФС75, ацетилен марки Б, аргон газообразный высшего сорта и диоксид углерода газообразный.
Возможность получения металлического кальция как продукта диссоциации карбида кальция была проверена при проведении нагревов в вакууме 1 Па. На рис.2 показана зависимость выхода кальция от температуры при постоянной выдержке — 3 час.
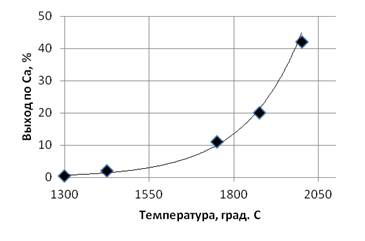
Рис. 2. Выход кальция при дистилляции карбида кальция в зависимости от температуры при постоянном давлении 1 Па и времени выдержки 3 час.
Как видно из представленных данных, заметный выход кальция соответствует температуре 1750 0 С. Это не совпадает с расчетными данными работы [2], в которой приведены результаты термодинамических оценок реакции диссоциации карбида кальция с поправкой на изотерму Ван-Гоффа.
В соответствие с этими оценками температура начала диссоциации при давлении 100 Па должна составлять 1526 0 С, а при давлении 10 Па — 1286 0 С. Причиной такого несоответствия, видимо, является то обстоятельство, что при выводе уравнения изотермы Ван-Гоффа предполагается гомогенность системы, в которой происходит химическая реакция (наличие пара кальция и твердых углерода и карбида кальция делает систему гетерогенной), а также, то, что каждый участник реакции есть идеальный газ (очевидно, в рассматриваемой системе — это не так). Также вызывает большие сомнения принципиальная возможность применения стандартных термодинамических расчетов, например, по алгоритму Темкина — Шварцмана, для реальных необратимых термических процессов, сопровождаемых испарением, образованием и растворением промежуточных соединений, изменением межфазных границ.
Образующийся при диссоциации CaC2 углерод обладает низкой эрозионной стойкостью и требует применения специальных мер, предотвращающих распыление и последующее осаждение продуктов износа в местах электрических вводов в герметичный объем, а также исключающих попадание частиц углерода в откачную систему. Как показали прямые эксперименты, при скорости откачки (скорости напуска воздуха) более 50 Па/с в диапазоне давлений > 30 кПа происходит «разброс» углерода по рабочему пространству печи, а, следовательно, возникает опасность его попадания в систему откачки и на диэлектрические вводы.
Следовательно, применение прямой диссоциации карбида кальция требует проведение процесса в области высоких температур (выше 1750 0 С); время откачки и напуска воздуха при этом будет составлять до 1 часа. При стоимости карбида кальция 60–65 руб./кг [3] получение кальция из такого сырья при существующих ценах на кальций вряд ли рентабельно.
Эксперименты с газообразными восстановителями (C2H2–10 кПа + Ar — 24 кПа с диссоциацией ацетилена) или CO2 (наличие в печи нагревательного блока из УУКМ приводит к образованию CO по реакции Будуара) показали отсутствие восстановления оксида кальция, как при постоянной атмосфере газа-восстановителя, так и при проведении циклического режима.
Наличие в составе оксида кальция заметного количества карбоната кальция (в отечественном сырье доля карбоната кальция в оксиде достигает 15–20 масс. %), а тем более применение двуокиси углерода в печи с нагревателями из углеродного материала приводит к выходу из строя нагревателя. На рис.3 показано разрушение электрического контакта нагревателя печи после проведения экспериментов с CO2. Между секцией нагревателя и токоподводом образовалась магистральная трещина.

Рис. 3. Разрушение углеродного нагревателя печи ВОж-16–22 после проведения экспериментов с CO2.
В настоящее время единственным методом металлотермического получения кальция, применяемым в промышленности, является способ алюминотермического восстановления оксида кальция. Для гетерогенной системы CaO — Al (расплав) — Ca (газ) при прочих равных параметрах кинетика восстановления определяется размерами межфазной границы раздела.
При алюминотермическом (АПВ) восстановлении в составе шихты были идентифицированы следующие фазы: 3CaO*Al2O3, 12CaO*7Al2O3 и Al2Ca. На рис.4 показана микроструктура шихты после проведения алюминотермического восстановления (температура 1350 О С, выдержка в течение 3 час. при остаточном давлении 1 Па). Обращает на себя внимание наличие ярко выраженных линейных структурных элементов толщиной 10 2– 10 3 нм (рис.4, а,б — съемка с поверхности).
Состав этих структурных элементов, точнее, соотношение содержания кальция к алюминию (рис.5.) не позволяет «приписать» линейные структурные элементы ни к одной из идентифицированных фаз: в них «завышено» количество алюминия.

Рис. 4. Микроструктура брикета после алюминотермического восстановления во вторичных и обратно рассеянных электронах (а) и во вторичных электронах (б,в): а,б — съемка с внешней поверхности образца; в –съемка с поверхности излома.

Рис. 5. Элементный состав линейной структуры брикета после проведения алюминотермического восстановления.
Если предположить, что измеренная величина состава связана с раствором Al2Ca — Al4Ca, имеющим область гомогенности более 10 % Ca (раствор на базе Al2Ca в приблизительном соотношении интерметаллидов 75:25), то это устраняет «противоречие» между результатами РФА и РЭМ.
Линейные размеры составляют 200–500 мкм, что близко к размеру фракций CaO. В то же время съемка с поверхности излома образца не выявила наличие подобных структурных элементов (рис.4, в). Поверхности съемки отличаются условиями смачиваемости.
Вблизи светлой границы (рис.6.) — смесь алюминатов кальция 3CaO*Al2O3, 12CaO*7Al2O3.
Рис. 6. Элементный состав вблизи светлой границы после проведения алюминотермического восстановления.
Проведенные эксперименты дают основание полагать, что смачиваемость восстановителем межфазной границы играет значительную роль в металлотермическом восстановлении оксида кальция. Поскольку одной из основных статей расхода при проведении алюминотермического восстановления является стоимость алюминия, были проведены эксперименты по изучению возможности замены алюминия более дешевым восстановителем.
В качестве восстановителей применяли технический кремний Кр00, ферросилиций ФС 75 в различных отношениях с порошком вторичного алюминия АПВ. При применении железа в его составе присутствовали 1,2–2,0 % Si и 0,4–0,7 % Mn.
Порошки смешивали с оксидом кальция в массовом соотношении 80 % оксида и 20 % металла-восстановителя с последующим прессованием в брикеты. В табл. 1 показаны составы восстановителей (ат. %) и величина выхода по кальцию. При выбранном режиме (температура 1350 О С, выдержка в течение 3 час. при остаточном давлении 1 Па) восстановитель находится в жидком состоянии; в табл.1 также указана температура ликвидуса восстановителя [4].
Состав исследованных восстановителей оксида кальция и выход кальция
Кальций

Кальций (Ca от лат. Calcium ) — элемент второй группы (по старой классификации — главной подгруппы второй группы), четвёртого периода, с атомным номером 20. Простое вещество кальций — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. Впервые получен в чистом виде Г. Дэви в 1808 году.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Изотопы
- 2.2 В горных породах и минералах
- 2.3 Миграция в земной коре
- 2.4 В биосфере
![Кальций]()
История и происхождение названия
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Гемфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием.
Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Нахождение в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности (3-е среди металлов) после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л .
Изотопы
Кальций встречается в природе в виде смеси шести изотопов: 40 Ca, 42 Ca, 43 Ca, 44 Ca, 46 Ca и 48 Ca, среди которых наиболее распространённый — 40 Ca — составляет 96,97 %. Ядра кальция содержат магическое число протонов: Z = 20 . Изотопы 40
20 Ca 20
и 48
20 Ca 28
являются двумя из пяти существующих в природе дважды магических ядер.Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48 Ca, самый тяжёлый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), испытывает двойной бета-распад с периодом полураспада (4,39 ± 0,58)⋅10 19 лет .
В горных породах и минералах
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
![Кальций]()
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Осадочная порода, состоящая в основном из скрытокристаллического кальцита — известняк (одна из его разновидностей — мел). Под действием регионального метаморфизма известняк преобразуется в мрамор.
Миграция в земной коре
В естественной миграции кальция существенную роль играет «карбонатное равновесие», связанное с обратимой реакцией взаимодействия карбоната кальция с водой и углекислым газом с образованием растворимого гидрокарбоната:
(равновесие смещается влево или вправо в зависимости от концентрации углекислого газа).
Огромную роль играет биогенная миграция.
В биосфере
Соединения кальция находятся практически во всех животных и растительных тканях (см. ниже). Значительное количество кальция входит в состав живых организмов. Так, гидроксиапатит Ca5(PO4)3OH, или, в другой записи, 3Ca3(PO4)2·Ca(OH)2 — основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. В живых тканях человека и животных 1,4—2 % Ca (по массовой доле); в теле человека массой 70 кг содержание кальция — около 1,7 кг (в основном в составе межклеточного вещества костной ткани).
Получение
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75—80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C 4CaO + 2Al → CaAl2O4 + 3Ca
Физические свойства
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α -Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм ), выше устойчив β -Ca с кубической объемно-центрированной решеткой типа α -Fe (параметр a = 0,448 нм ). Стандартная энтальпия ΔH 0 перехода α → β составляет 0,93 кДж/моль .
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются).
![Кальций]()
Химические свойства
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло-серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca 2+ /Ca 0 −2,84 В , так что кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, хлором, бромом, йодом) кальций реагирует при обычных условиях:
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком («кирпично-красным»). С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Кроме получающихся в этих реакциях фосфида кальция Ca3P2 и силицида кальция Ca2Si, известны также фосфиды кальция составов CaP и CaP5 и силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
Ион Ca 2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, йодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат CaC2O4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция CaCO3, кислый карбонат кальция (гидрокарбонат) Ca(HCO3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а в тех местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
Так в природе происходит перенос больших масс веществ. В результате под землёй могут образоваться огромные карстовые полости и провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет вре́менную жёсткость воды. Вре́менной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает CaCO3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Применение
Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудно восстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом применяются в некоторых видах аккумуляторных батарей и при производстве подшипников. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов. Чистый металлический кальций широко применяется в металлотермии при получении редкоземельных элементов.
Кальций широко применяется в металлургии для раскисления стали наряду с алюминием или в сочетании с ним. Внепечная обработка кальцийсодержащими проволоками занимает ведущее положение в связи с многофакторностью влияния кальция на физико-химическое состояние расплава, макро- и микроструктуры металла, качество и свойства металлопродукции и является неотъемлемой частью технологии производства стали. В современной металлургии для ввода в расплав кальция используется инжекционная проволока, представляющая из себя кальций (иногда силикокальций или алюмокальций) в виде порошка или прессованного металла в стальной оболочке. Наряду с раскислением (удалением растворенного в стали кислорода) использование кальция позволяет получить благоприятные по природе, составу и форме неметаллические включения, не разрушающиеся в ходе дальнейших технологических операций.
Изотоп 48 Ca — один из эффективных и употребительных материалов для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева. Это связано с тем, что кальций-48 является дважды магическим ядром, поэтому его устойчивость позволяет ему быть достаточно нейтроноизбыточным для лёгкого ядра; при синтезе сверхтяжёлых ядер необходим избыток нейтронов.
Биологическая роль
Кальций — распространённый макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10 −4 ммоль/л , в межклеточных жидкостях около 2,5 ммоль/л .
Потребность в кальции зависит от возраста. Для взрослых в возрасте 19—50 лет и детей 4—8 лет включительно дневная потребность (RDA) составляет 1000 мг , а для детей в возрасте от 9 до 18 лет включительно — 1300 мг в сутки . В подростковом возрасте потребление достаточного количества кальция очень важно из-за интенсивного роста скелета. Однако по данным исследований в США всего 11 % девочек и 31 % мальчиков в возрасте 12—19 лет достигают своих потребностей. В сбалансированной диете большая часть кальция (около 80 %) поступает в организм ребёнка с молочными продуктами. Оставшийся кальций приходится на зерновые (в том числе цельнозерновой хлеб и гречку), бобовые, апельсины, зелень, орехи. Всасывание кальция в кишечнике происходит двумя способами: через клетки кишечника (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Усвоению кальция препятствуют некоторые животные жиры (включая жир коровьего молока и говяжий жир, но не сало) и пальмовое масло. Содержащиеся в таких жирах пальмитиновая и стеариновая жирные кислоты отщепляются при переваривании в кишечнике и в свободном виде прочно связывают кальций, образуя пальмитат кальция и стеарат кальция (нерастворимые мыла). В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция, снижение минерализации костей и снижение косвенных показателей их прочности у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула, уменьшением его частоты, а также более частым срыгиванием и коликами.
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки (около 340 г сыра Эдам).
Читайте также: