Способы защиты металлов от коррозии кратко
Обновлено: 18.05.2024
Люди используют множество различных материалов, список которых будет иметь огромную длину. Металлы относятся к наиболее распространенным материалам, которые используются повсеместно и для разных целей. Металлов также существует огромное количество (если считать сплавы), у всех у них есть как свои плюсы, так и минусы. Одним из главных минусов является коррозия, которая разрушает металлы. Мы называем это «ржавлением». И в этой статье мы подробно поговорим о причинах коррозии, о том, какие металлы подвержены ей больше всего и самое главное - как их защитить от этого. А если не хотите читать теорию, то переходите сразу в третий раздел нашего материала.
Коротко о коррозии
Мы не будем подробно вдаваться в химические процессы, но некоторые основные моменты знать стоит. В том числе и мифы. Во-первых, стоит сказать, что собственно коррозии подвержены прежде всего черные металлы: сталь, чугун, железо. Цветные металлы не ржавеют, по крайней мере, так считает большинство. На самом деле, цветные металлы также могут разрушаться, другое дело, что делают они это медленно или только в определенных условиях. То есть, там, где от стали через 50 лет уже ничего не останется, медь все еще сохранится. Кроме того, коррозия происходит не только из-за контакта с водой (это популярное заблуждение на самом деле), существуют и другие виды.
Любой тип коррозии происходит из-за определенных химических реакций, а взаимодействовать между собой могут разные вещества. Какие-то металлы или сплавы будут активно ржаветь в воде, другие на воздухе, для третьих требуется кислая среда, четвертые разрушаются в среде электролитов (это называется электрохимической ржавчиной). И это далеко не все варианты, но по понятным причинам нас интересует как защитить металлы в привычных для нас условиях, где они контактируют с водой или воздухом.

Также каждый металл имеет свои особенности. Например, у стали выделяют сразу несколько типов поражения ржавчиной: поверхностная, глубинные трещины, проникновение вглубь детали и т.д. В любом случае, если металл теоретически подвержен коррозии, то его пытаются защитить от нее. Методы есть разные, как по стоимости, так и по надежности. В некоторых случаях защиты вообще нет, поэтому нам часто попадаются ржавые железяки. Это обусловлено множеством факторов, прежде всего экономическими.
Типы защиты от появления ржавчины (о чем мы подробно поговорим дальше) бывают разные. Есть как фундаментальные (добавление различных материалов), так и такие, которые со временем могут пропасть (защитные покрытия). Второй вариант чаще всего дешевле, поэтому и применяется чаще. И именно поэтому зачастую и возникает вопрос, как и чем защитить изделие из металла от коррозии при том, что защитный слой уже поврежден. Ничего сложного (и дорого здесь нет), главное действовать быстро и не ждать, пока ржавчина проникнет вглубь металла.
Способы защиты от коррозии
Способы защиты можно разделить на две большие группы: промышленные и бытовые. Разумеется, в нашей статье мы в первую очередь будем делать упор на бытовые способы, так как, скорее всего, люди, которые используют промышленные способы, такие статьи просто не читают. Тем не менее, рассказать об этом стоит. К промышленным способам относятся следующие:
Пассивация металлов. При этом способе металл (или его поверхность) переводят в состояние, которое препятствует появлению коррозии (оно называется неактивным или пассивным). Чаще всего это делают с помощью добавления легирующих присадок, таких как хром, никель и т.д. Например, во всем известную нержавеющую сталь добавляется хром.
Нанесение защитных лакокрасочных покрытий, которые препятствуют контакту металла с внешней средой. Это, пожалуй, один из самых распространенных способов в виду своей дешевизны и простоты. Минус в том, что при повреждении лакокрасочного покрытия, металл начнет ржаветь.
Защитное покрытие может быть в виде слоя другого металла, который устойчив к коррозии не вступает в реакцию с другим металлом. Такое покрытие будет надежнее, но и стоимость станет выше.
Это основные промышленные способы, но существует и множество других, которые применяются реже: термообработка, фаолитирование, ингибирование, изменение окружающей среды и т.д.
Бытовые же способы по большей части представляют собой различные защитные покрытия. Это могут быть как лакокрасочные материалы, так и специальные антикоррозийные средства. Здесь есть просто огромное разнообразие и об этом мы подробно поговорим ниже. Существуют даже преобразователи ржавчины, которые наносят на уже поврежденные участки металлической детали. Они способы частично восстановить поврежденный участок, но степень восстановления зависит от уровня повреждений.

Бытовые антикоррозийные средства
Сегодня существует довольно много антикоррозийных составов, которые могут очень сильно отличаться по своей цене. Разница в стоимости объясняется прежде всего их долговечностью, надежностью и другими свойствами, которые обусловлены химическим составом. Если не учитывать небольшие различия в составах между разными средствами, то можно выделить не так уж и много типов антикоррозийных средств бытового назначения. При их выборе руководствуются не только составом, но и будущими условиями эксплуатации, что зачастую является самым важным факторов.
Классифицируют их по разному, например, краски делят по типу связывающей основы, где выделяют алкидные, эпоксидные и акриловые. Также они разделяются на две большие группы: обычные и термостойкие, которые способны выдерживать высокие температуры и не терять свои свойств. Также у них есть и другие параметры, такие как скорость высыхания, срок службы и т.д. Помимо красок можно выделить следующие группы антикоррозийных средств:
Пасты и смазки, которые производят на основе минеральных масел с добавлением воска или парафина. В зависимости от типа металла в них могут добавлять и другие вещества, например, в смазки для изделий из стали добавляют щелочь. Смазки и пасты используются преимущественно для защиты металлических изделий при их длительной транспортировки. Они обеспечивают отличную защиту, но для изделий из металла, которые эксплуатируются ежедневно они не подходят, так как их устойчивость даже к небольшим механическим воздействиям очень низкая.
Резиновые защитные антикоррозийные покрытия можно отнести как к промышленным, так и к бытовым. Суть в нанесении покрытия из эбонита или резины, которое может иметь совершенно разные характеристики. Например, широкий температурный диапазон эксплуатации, ее способность выдерживать нагрузки разных видов (растягивающие, ударные и т.д.), мягкость. Чаще всего подобные антикоррозийные покрытия делают еще на этапе производства.
Полимерные покрытия это достаточно большой класс, который сделан на основе полиэтилена, поливинилхлорида и других синтетических материалов. Как и в предыдущем случае, этот вариант используется чаще всего при производстве, но есть и бытовое применение.
В быту чаще всего приходится использовать лакокрасочные средства. Самыми распространенными являются алкидные эмали, в том числе и отечественного производства. Но сегодня подобные антикоррозийные составы выпускают даже в спреях, что является одним из самых удобных вариантов с точки зрения эксплуатации. Их легко наносить, можно создать равномерный слой и защитить даже самые труднодоступные местах.
Также стоит отметить, что для действительно надежной защиты используют не только собственно защитные покрытия, но и грунтовку, которая проникает в структуру металла и обеспечивает более внушительную защиту. Про них вы можете прочитать в этом материале, здесь же скажем, что использование грунтовок это всегда дополнительные расходы (а хорошие стоят дорого), но если нужно действительно надежно защитить металл, то их использование можно считать обязательным. Есть и средства для удаления ржавчины.

Популярные вопросы
В заключение ответим на несколько распространенных вопросов, которые чаще всего задают по теме защиты металла от коррозии.
В чем разница между горячим и холодным цинкованием?
Разница в самом процессе. С точки зрения потребителя принципиальной разницы нет, оба варианта будут хорошей защитой от ржавчины. Также заметим, что изделия, которые защитили с помощью холодного цинкования являются ремонтопригодными, кроме того, данный метод можно использовать не только на производстве.
От чего зависит срок защиты металла?
Факторов здесь много. Во-первых, это само защитное покрытие, во-вторых, его устойчивость к внешним воздействием. Любопытно, что в разных случаях наиболее важными могут быть разные факторы. Большинство лакокрасочных покрытий являются самыми недолговечными, срок защиты обычно от 3 до 5 лет.
Что такое патина и является ли она коррозией?
Патина - это пленка, которая образуется на поверхности изделий из меди или ее сплавов. Ее появление не относится к коррозийным покрытиям, наоборот, это получается своего рода защитный слой, который со временем образуется от естественных причин.
Возможно ли остановить процесс коррозии?
Это возможно при помощи специальных составов, о которых мы писали выше. Но, конечно, все зависит от степени ржавления металла, если все слишком запущенно, то уже никакие средства не помогут. Это не значит, что это изделия нельзя использовать, все зависит от того, где его применяют. И это не значит, что если металл уже подвергся коррозии, то его не нужно защищать.
А чем красить ржавый металл?
Средств существует очень много, про них можно даже отдельную статью написать, но если коротко, то можно использовать лакокрасочные материалы, которые содержат в своем составе преобразователи ржавчины.
Что лучше, отечественные средства или импортные?
Однозначно ответить нельзя, все зависит от конкретного средства, его состава и т.д. Разумеется, покупая продукцию известных брендов (вроде Weicon) вы гарантированно получите хороший результат, но за это придется заплатить больше. Но и это не значит, что более дешевые средства будут работать хуже.
Коррозия и защита металлов
1. Общие сведения. Классификация коррозии. Современные коррозионностойкие конструкционные сплавы
Коррозией металлов называют самопроизвольное разрушение металлических конструкций вследствие их химического или электрохимического взаимодействия с окружающей средой.
Коррозионный процесс протекает на границе двух фаз: металл– окружающая среда, т. е. является гетерогенным процессом.
Коррозия металлов наносит огромный ущерб практически любой отрасли промышленности. Потери от коррозии можно разделить на две группы: прямые и косвенные.
Прямые потери складываются в основном из потерь непосредственно самого металла вследствие коррозии.
Косвенные потери огромны и обусловлены расходами, связанными с отказом в работе оборудования, его простоем, со стоимостью ремонта и заменами деталей оборудования, с утечками нефти, газа через повреждения в трубопроводах и т. п.
С химической точки зрения металлы являются восстановителями. Они легко отдают валентные электроны и образуют положительно заряженные ионы. Во всех соединениях они проявляют только положительные степени окисления. Многие металлы, например, железо, хром, марганец, имеют переменные степени окисления. Восстановительные свойства металлов различны и определяются их стандартным электродным потенциалом. В табл. 1 приведены электродные потенциалы для металлов.
По своей химической активности и положению в ряду стандартных потенциалов металлы делятся на три группы:
- активные – от Li до Al включительно – вытесняют водород из воды и растворов кислот;
- средней активности – от Mn до Pb включительно – вытесняют водород из растворов кислот;
- неактивные – стоящие в ряду после водорода – не вытесняют водород из растворов кислот.
Все эти металлы могут самопроизвольно окисляться. Следовательно, основной причиной коррозии металлов в атмосфере или других средах является их термодинамическая нестабильность. Степень
термодинамической нестабильности металла зависит от его природы, характера коррозионной среды и конкретных условий.
Таблица 1. Ряд стандартных электродных потенциалов металлов
способности (М n+ )
способности (М о )
Основной причиной, вызывающей коррозионное разрушение металлов и сплавов, является протекание на их поверхности электрохимических или химических реакций.
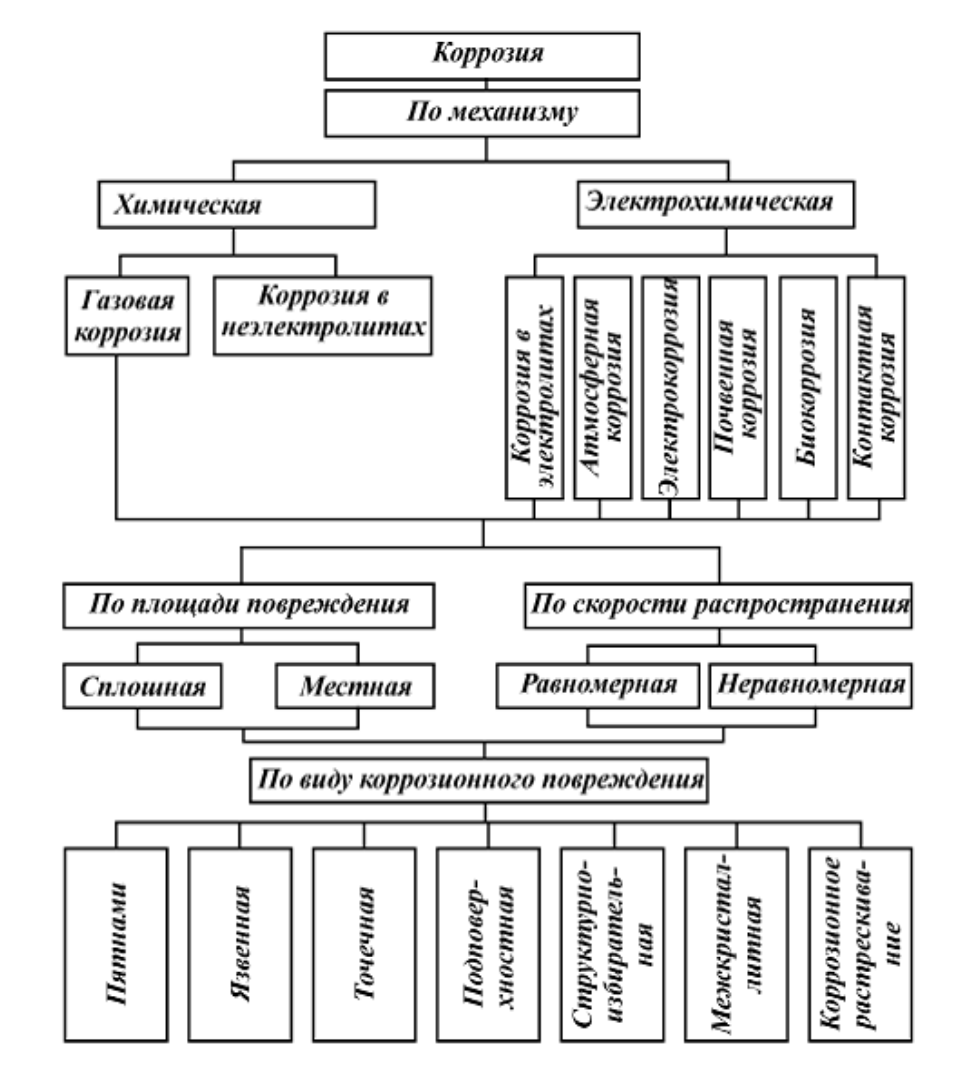
В зависимости от характера этих реакций и механизма протекания, все коррозионные процессы делят на два вида:
- химической коррозией называют процессы, протекающие при непосредственном химическом взаимодействии между металлом и агрессивной средой и не сопровождающиеся возникновением электрического тока;
- электрохимической коррозией называют процессы взаимодействия металлов с водными растворами электролитов, сопровождающиеся возникновением в системе электрического тока, то есть упорядоченным передвижением электронов и ионов от одного участка металла к другому.
По условиям протекания коррозии, различают несколько видов коррозии:
- газовую – коррозию в газах при высоких температурах;
- атмосферную – коррозию в воздухе или влажном газе;
- жидкостную – коррозию в жидкой среде (в растворах неэлектролитов и электролитов);
- подземную – коррозию в почвах и грунтах;
- биокоррозию – коррозию под влиянием жизнедеятельности микроорганизмов;
- структурную – коррозию, связанную со структурной неоднородностью металла;
- коррозию блуждающими токами;
- контактную – электрохимическую коррозию, вызванную контактом металлов, имеющих разные электродные потенциалы в данном электролите;
- щелевую – коррозию в щелях и зазорах между металлами;
- под напряжением – коррозию при одновременном воздействии коррозионной среды и механических напряжений;
- коррозионную кавитацию – разрушение металла, вызванное одновременным коррозионным и ударным воздействием внешней среды.
По характеру коррозионных разрушений различают следующие виды коррозии:
- сплошную, или общую, коррозию, охватывающую всю поверхность металла, находящуюся под воздействием коррозионной среды. Она бывает: равномерной, неравномерной, избирательной;
- местную коррозию, охватывающую отдельные участки металла. Она бывает: точечной (питтинг), сквозной, язвенной и др.
2. Методы защиты металлов от коррозии
Для защиты металлов от коррозии применяются различные методы: легирование металлов, обработка коррозионной среды, электрохимическая защита, нанесение металлических и неметаллических покрытий.
Легирование металлов позволяет получать коррозионностойкие сплавы, превосходящие по стойкости основной металл. Примерами могут служить сплавы меди (латунь и бронза), ее легирование алюминием для повышения коррозионной стойкости в атмосферных условиях; легирование стали хромом и никелем с целью создания хромоникелевых сплавов.
Обработку коррозионной среды выполняют с целью уменьшения ее агрессивного воздействия на металл. Однако такая обработка целесообразна при небольших объемах электролитов. Обработка среды заключается во введении в среду ингибиторов коррозии или в уменьшении содержания деполяризатора в электролитах.
Ингибиторы коррозии, введенные в коррозионную среду в малых количествах, полностью предотвращают коррозию металлов или значительно снижают ее скорость. В зависимости от характера среды ингибиторы выступают как замедлители кислотной или щелочной коррозии, коррозии в нейтральных растворах, в неводных средах. В основном, ингибиторы являются органическими соединениями.
Электрохимическая защита подразделяется на катодную и анодную защиту. Катодная защита подразделяется на защиту внешним током и протекторную защиту.
Механизм защиты внешним током (рис. 1) сводится к тому, что за счет внешней катодной поляризации защищаемому металлу навязывают потенциал, при котором его коррозия замедляется. Суть этого способа заключается в том, что защищаемую конструкцию подсоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу подсоединяют электрод, которым может являться металлолом, а именно отрезок стальной трубы, рельсы и т. п. (рис. 1).
Протекторная защита (рис. 2) состоит в том, что к защищаемой конструкции подсоединяют металл или сплав, электродный потенциал которого более электроотрицателен, чем потенциал металла защищаемой конструкции. В качестве протекторов обычно используют цинк или сплавы цинка с алюминием. Иногда применяют сплавы на основе магния. Протекторы применяют для защиты металлических конструкций от коррозии в морской воде, других нейтральных коррозионных средах, а также в почве.
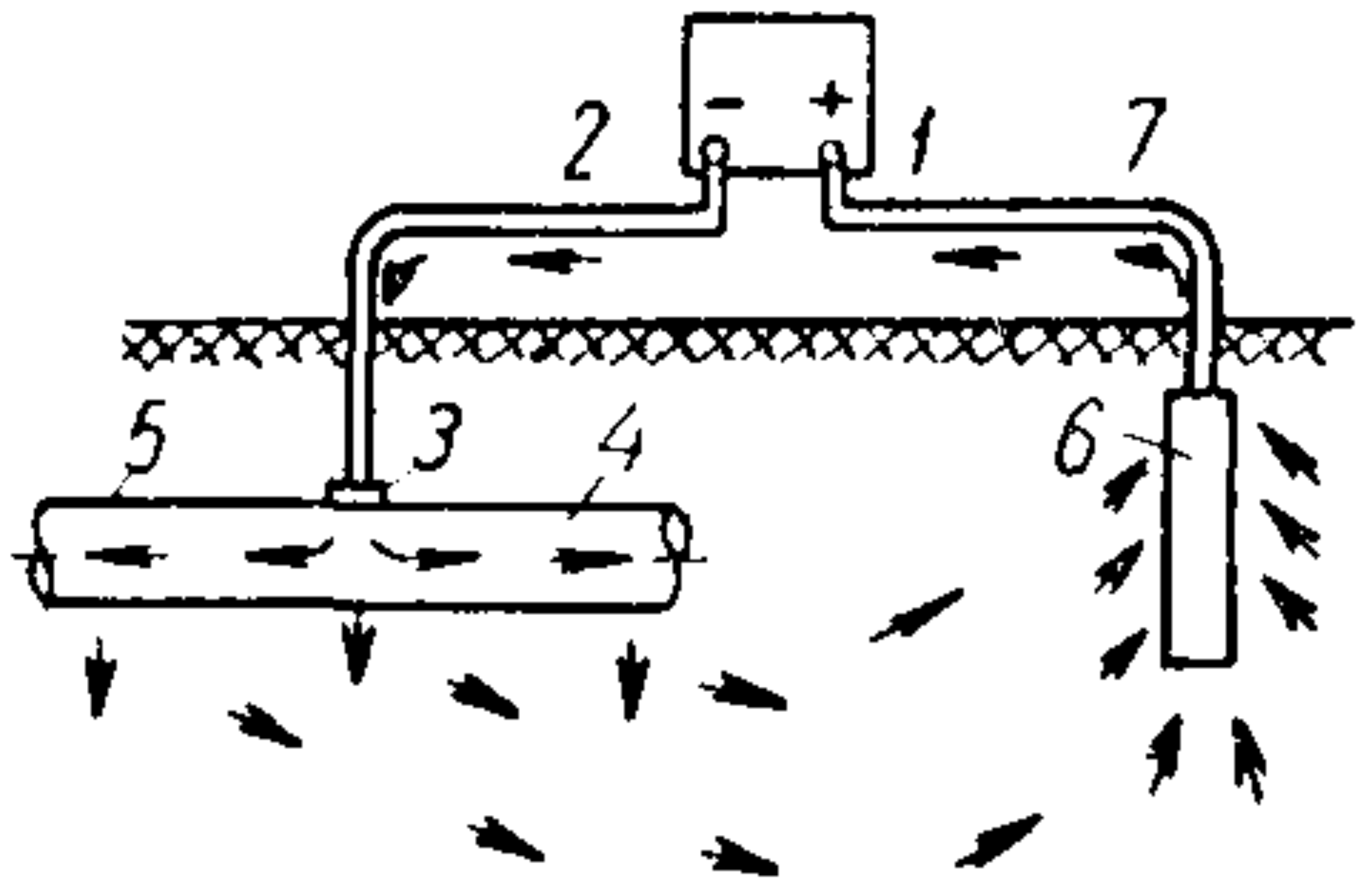
Рис. 1. Схема катодной защиты внешним током: 1 – источник постоянного тока; 2 – соединительный провод; 3 – пункт дренажа; 4 – защищаемая труба; 5 – изолирующее покрытие; 6 – анодное заземление; 7 – соединительный провод
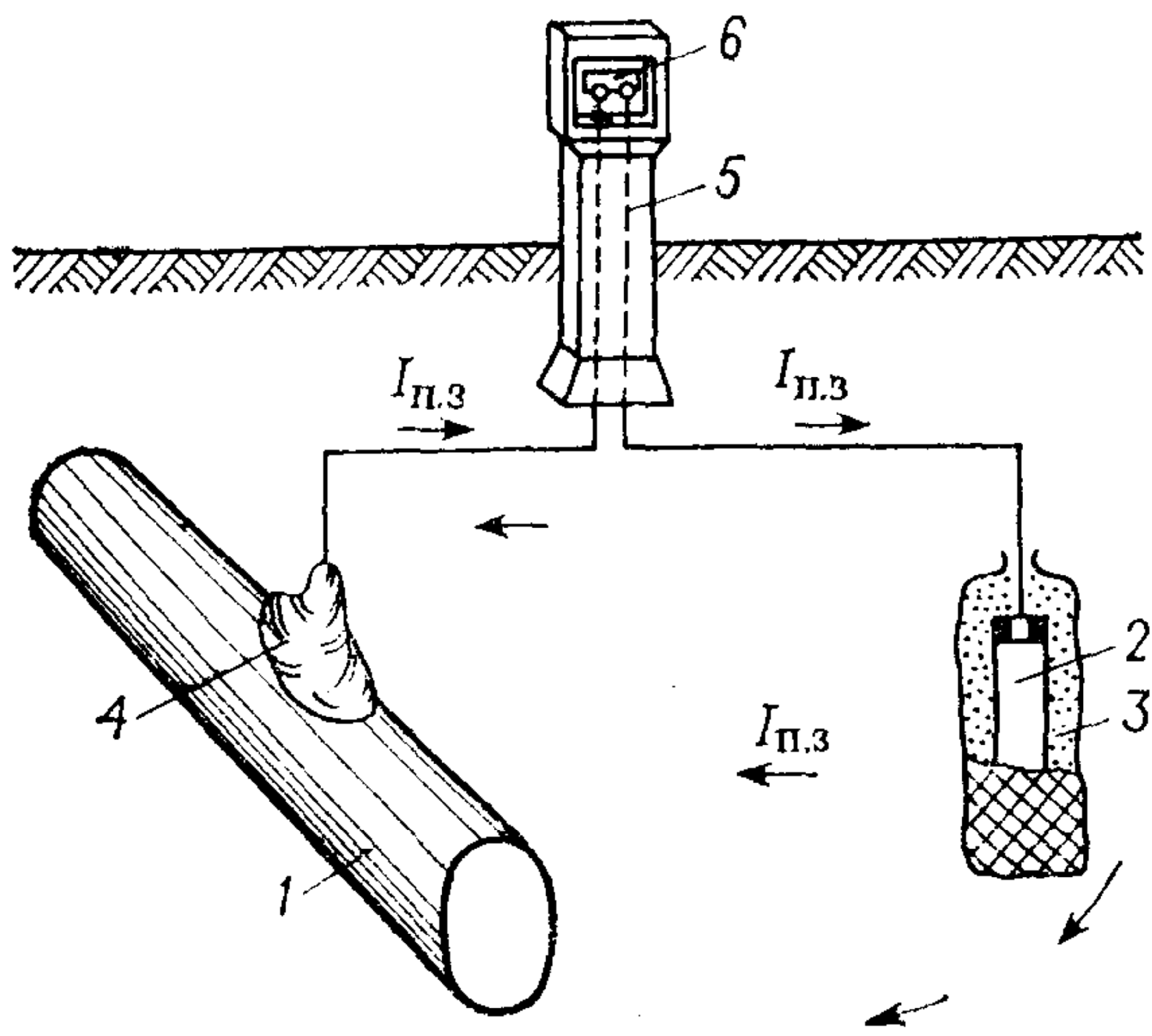
Рис. 2. Схема протекторной защиты: 1 – подземная стальная конструкция; 2 – протектор–магниевый сплав; 3 – заполнитель; 4 – электрический контакт; 5 – контрольно-измерительный вывод; 6 – закороченные клеммы; Iп.з – сила тока протекторной защиты
Защита металлическими и неметаллическими покрытиями. Для защиты металлов от коррозии используют различные виды покрытий: металлические, лакокрасочные и полимерные покрытия и покрытия, образованные в результате химической или электрохимической обработки поверхности металла. Роль любого покрытия сводится в основном к изоляции металла от внешней среды.
Выбор типа покрытия зависит от условий, в которых следует использовать металл. Для защиты изделий, не подвергающихся механическим воздействиям и применяющимся в сухих жилых помещениях, обычно бывает достаточно однослойного лакокрасочного покрытия или соответствующей химической обработки поверхности металла: оксидирования или фосфатирования. Для защиты металлических конструкций (железнодорожные мосты, подъемные краны и т. п.), а также железнодорожных вагонов, наружных деталей автомобилей, велосипедов и др., подвергающихся воздействию влажной атмосферы, применяют сложные по составу и способу нанесения лакокрасочные покрытия.
3. Коррозионностойкие металлы и сплавы
Под понятием коррозионностойкие металлы и сплавы понимают конструкционные материалы, которые в агрессивных коррозионных средах обладают достаточной коррозионной стойкостью и жаростойкостью и могут быть использованы без специальных средств противокоррозионной защиты.
При этом коррозионная стойкость конструкционного материала заключается не только в сохранении его основной массы, но и выполнении функциональных нагрузок самой металлической конструкцией.
Характеристика степени термодинамической стабильности различных металлов приближенно может быть сделана по величине стандартных электродных потенциалов: чем более электроотрицателен потенциал металла, тем он активнее (табл. 2).
Таблица 2. Стандартные электродные потенциалы
Величины электродных потенциалов –0,414 В и +0,815 В представляют собой значения равновесных потенциалов водородного и кислородного электродов в нейтральной среде.
Некоторые металлы, например, железо, алюминий, титан, хром, никель, относительно устойчивы благодаря наступлению пассивного состояния. Пассивное состояние поверхности металла нарушается при наличии в растворе некоторых активных ионов (ионы хлора, брома, фтора) и, наоборот, усиливается при наличии окислителей. Часть металлов устойчива вследствие возникновения малорастворимых и достаточно плотных пленок на поверхности из продуктов коррозии. Некоторые металлы коррозионностойки из-за отсутствия примесей, образующих эффективные катоды, так как наличие загрязнений может привести к образованию коррозионных микрогальванических элементов.
Теория коррозионностойкого легирования металлов, устойчивых к электрохимической коррозии, основывается на учении о контролирующих факторах коррозии – омическом, катодном и анодном торможении процесса коррозии.
На основе этих факторов разработаны три направления повышения коррозионной устойчивости сплавов:
- Создание сплавов, образующих более совершенный защитный слой продуктов коррозии на своей поверхности. В металл вводят компоненты, способствующие образованию плотной защитной пленки на поверхности металла. Торможение коррозии достигается как за счет увеличения омического сопротивления, так и за счет экранирующего слоя, тормозящего доставку к металлической поверхности веществ, необходимых для протекания катодного процесса или удаление продуктов электродной реакции. Например, при легировании железа медью наступает пассивное состояние железа, но этот метод имеет ограниченное применение, так как при электрохимической коррозии трудно достичь полного экранирования поверхности.
- Уменьшение катодной активности металлов. Защитные свойства металлов повышаются вследствие уменьшения площади микрокатодов или увеличения на них перенапряжения выделения водорода, т. е. происходит торможение катодного процесса. При легировании железа сурьмой, висмутом, мышьяком увеличивается перенапряжение выделения водорода.
- Снижение анодной активности металлов. Защитные свойства металлов повышаются в результате уменьшения активности анодной фазы путем введения компонентов, повышающих или термодинамическую устойчивость сплава, или его пассивность. Повышение коррозионной стойкости, например, стали, достигается легированием ее хромом; хромом и никелем; хромом, никелем и небольшими добавками палладия.
Какой из приведенных методов повышения коррозионной устойчивости сплавов надежнее и перспективнее, можно определить, исходя из конкретных условий.
При кислотной коррозии в восстановительных средах с выделением водорода и в отсутствии возможности повышения склонности к пассивированию весьма полезными могут оказаться методы уменьшения катодной активности сплавов или повышения термодинамической устойчивости анодной фазы. В условиях возможности установления пассивного состояния, наоборот, совершенно неэффективны методы снижения катодной активности, а окажутся полезными все методы, снижающие анодную активность сплавов.
При возможности установления пассивного состояния сплава эффективен метод введения активных катодов. Однако этот метод окажется вредным, если по условиям коррозии (восстановительная среда, наличие ионов хлора) установление стойкого пассивного состояния невозможно.
Повышение коррозионной стойкости металлов в кислотах достигается кислотостойким легированием. Коррозия металлов в кислотах с неокисляющимся анионом (разбавленная серная кислота, соляная кислота) протекает, в основном, с водородной деполяризацией. При коррозии в окисляющих кислотах (азотная кислота, концентрированная серная кислота) основным катодным процессом является восстановление аниона кислоты.
Коррозионную стойкость сплавов в окисляющих кислотах можно повысить, вводя легкопассивирующиеся металлы, например, хром. Сталь, легированная хромом, имеет повышенную стойкость в азотной кислоте. Стойкость металлов в кислотах, в которых возможно наступление пассивного состояния, повышается также в результате легирования металлами, являющимися эффективными катодами. Так, легирование стали типа Х18Н10 палладием повышает стойкость сплава в серной кислоте.
Для повышения коррозионной стойкости в неокисляющих кислотах сплавы легируют молибденом и медью. Кислотостойкость молибдена объясняется его склонностью к пассивированию и образованию защитных пленок.
Кислотостойкость меди связана с ее термодинамической устойчивостью в условиях коррозии с водородной деполяризацией. При коррозии легированных медью сплавов их поверхность обогащается медью вследствие ее более высокой коррозионной стойкости.
Коррозия. Виды и способы защиты от коррозии
Коррозия – это процесс самопроизвольного разрушения металлов, сплавов и других материалов – бетонов, цементов в результате физико-химического взаимодействия с окружающей средой.
Среда, в которой происходит разрушение металлов, называется коррозионной. Химические соединения, образующиеся в результате коррозии, называются продуктами коррозии. Способность металлов сопротивляться коррозии воздушной среды называется коррозионной стойкостью.
Коррозия материалов является одной из важных мировых проблем. Практика показывает, что только прямые безвозвратные потери металла от коррозии составляют 10…12% всей производимой стали, при этом суммарный ущерб в промышленных странах достигает 4-5% от национального дохода. Ведь корродирует не только черный металл ( сталь, чугун, железо и некоторые его сплавы ), но и бетон, дерево, камень, даже полимеры.
Наиболее интенсивная коррозия наблюдается в зданиях и сооружениях химических производств, что объясняется действием различных газов, жидкостей и мелкодисперсных частиц непосредственно на строительные конструкции, оборудование и сооружения, а также проникновением этих агентов в грунты и действием их на фундаменты. Агрессивному воздействию подвержено до 75% строительного фонда. Коррозия металла приводит к ослаблению конструктива и, как следствие, снижению безопасности эксплуатации сооружений.

По характеру самого процесса коррозию разделяют на две основные группы: химическую и электрохимическую.
Химическая коррозия протекает в не электролитах – жидкостях, не проводящих электрического тока и в сухих газах при высокой температуре.
Электрохимическая коррозия происходит в электролитах и во влажных газах и характеризуется наличием двух параллельно идущих процессов: окислительного (растворение металлов) и восстановительного (выделение металла из раствора).
По внешнему виду коррозию различают: пятнами, язвами, точками, внутрикристаллитную, подповерхностную.
По характеру коррозионной среды различают следующие основные виды коррозии: газовую, атмосферную, жидкостную и почвенную.
Газовая коррозия происходит при отсутствии конденсации влаги на поверхности. На практике такой вид коррозии встречается при эксплуатации металлов при повышенных температурах.
Атмосферная коррозия относится к наиболее распространенному виду электрохимической коррозии, так как большинство металлических конструкций эксплуатируются в атмосферных условиях. Коррозия, протекающая в условиях любого влажного газа, также может быть отнесена к атмосферной коррозии.
Жидкостная коррозия в зависимости от жидкой среды бывает кислотная, щелочная, солевая, морская и речная. По условиям воздействия жидкости на поверхность металла эти виды коррозии получают добавочные характеристики : с полным и переменным погружением, капельная, струйная. Кроме того, по характеру разрушения различают коррозию равномерную и неравномерную.
По степени воздействия на металлы коррозионные среды делятся на неагрессивные, слабоагрессивные, среднеагрессивные и сильноагрессивные.
В атмосферных условиях железо и сталь подвергаются общей равномерной коррозии.
- коррозия в растворах электролитов – жидкостях, проводящих электрический ток;
- почвенная или подземная коррозия металлических сооружений, находящихся под землей;
- биологическая коррозия – это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов.
По видам дополнительных воздействий различают следующие случаи коррозии:
- электрокоррозия под действием внешнего источника тока, т.е. коррозия изделий, находящихся под землей, вызванная блуждающими токами;
- контактная коррозия металлов – разрушение металла в растворе электролита вследствие контакта с другим металлом, имеющим более положительный электродный потенциал, чем потенциал основного металла.
- радиационная коррозия – это процессы коррозии в условиях радиоактивного облучения;
- коррозия в условиях механического воздействия .
Наиболее типичными видами подобного разрушения являются коррозионные растрескивание, усталость, кавитация, эрозия и фреттинг-коррозия
Бетон и железобетон находят широкое применение в качестве конструкционного материала при строительстве зданий и сооружений химических производств. Но они не обладают достаточной химической стойкостью против действия кислых сред. Свойства бетона и его стойкость в первую очередь зависит от химического состава цемента из которого он изготовлен.
Наибольшее применение в конструкциях и оборудовании находят бетоны на портландцементе. Причиной пониженной химической стойкости бетона к действию минеральных и органических кислот является наличие свободной гидроокиси кальция (до 20%), трехкальциевого алюмината (3CaO×Al2O3) и других гидратированных соединений кальция.
Коррозия бетона происходит тем интенсивнее, чем выше концентрация водных растворов кислот. При повышенных температурах агрессивной среды коррозия бетонов ускоряется. Несколько более высокой кислотостойкостью обладает бетон, изготовленный на глиноземистом цементе, из-за пониженного содержания оксида кальция.
Кислотостойкость бетонов на цементах с повышенным содержанием оксида кальция в некоторой степени зависит от плотности бетона. При большей плотности бетона кислоты оказывают на него несколько меньшее воздействие из-за трудности проникновения агрессивной среды внутрь материала.
Щелочестойкость бетонов определяется главным образом химическим составом вяжущих, на которых они изготовлены, а также щелочестойкостью мелких и крупных заполнителей.
Увеличение срока службы строительных конструкций и оборудования достигается путем правильного выбора материала с учетом его стойкости к агрессивным средам, действующим в производственных условиях. Кроме того, необходимо принимать меры профилактического характера.
К таким мерам относятся:
- герметизация производственной аппаратуры и трубопроводов, хорошая вентиляция помещения, улавливание газообразных и пылевидных продуктов, выделяющихся в процессе производства;
- правильная эксплуатация различных сливных устройств, исключающая возможность проникновения в почву агрессивных веществ;
- применение гидроизолирующих устройств и др.
Непосредственная защита металлов от коррозии осуществляется нанесением на их поверхность неметаллических и металлических покрытий либо изменением химического состава металлов в поверхностных слоях:
- оксидированием,
- азотированием,
- фосфатированием.
Для защиты поверхностей от коррозии существуют разнообразные покрытия:
- лакокрасочные (антистатичные и армированные, полиуретановые, акриловые, порошковые эпоксидно – полиэфирные, органосиликатные и кремнийорганические),
- металлизационные с цинком, алюминием, медью и комбинациями этих металлов.
Это краски, лаки, эмали, тонкодисперсные порошки, пленки.
Лакокрасочные покрытия вследствие экономичности, удобства и простоты нанесения, хорошей стойкости к действию промышленных агрессивных газов нашли широкое применение для защиты металлических и железобетонных конструкций от коррозии.
Защитные свойства лакокрасочного покрытия в значительной степени обуславливаются механическими и химическими свойствами, сцеплением пленки с защищаемой поверхностью.
Лакокрасочные материалы в зависимости от назначения и условий эксплуатации делятся на десять групп:
- А – покрытия стойкие на открытом воздухе;
- АН – то же, под навесом;
- П – то же, в помещении;
- Х – химически стойкие;
- Т – термостойкие;
- М – маслостойкие;
- В – водостойкие;
- ХК – кислотостойкие;
- ХЩ – щелочестойкие;
- Б – бензостойкие.
Наиболее распространены в промышленности покрытия металлические, неметаллические (органического и неорганического происхождения), а также покрытия, образованные в результате химической и электрохимической обработки металла.
Выбор вида покрытия зависит от условий, в которых используется защищаемое изделие (перепад температур, повышенная влажность, морская или пресная вода, щелочь, кислота, соли металлов, радиация, электроток и огонь), и технологичность возможностей формирования покрытия.
Наиболее часто применяемые способы защиты металлов:
- легирование;
- электрохимическая защита;
- покрытие металлами;
- защитные пленки.
Легирование – это введение в металл на стадии его производства определенного количества специальных добавок, например – хрома или марганца. Это придает сталям особые свойства, необходимые для использования в сложных условиях. Для возведения современных зданий, особенно повышенной этажности, необходима высококачественная атмосферостойкая легированная сталь, например, погодоустойчивая марка COR-TEN. Такой материал позволяет решить проблемы эксплуатации сооружений даже в экстремальных климатических условиях.
Одними из самых популярных и относительно недорогих мер защиты от коррозии сегодня являются методы, изменяющие химический состав металла в поверхностных слоях. Как правило, это электрохимические способы нанесения покрытий на металл. Наиболее известный процесс называется оцинковкой, которая в зависимости от способа обработки металла делится на горячую и холодную.
В первом случае обрабатываемый материал погружается в специальную ванну. Затем под воздействием переменного тока осуществляется его обработка в растворе фосфата цинка при плотности тока 4 А/дм², напряжении 20 В и температуре 600-700ºС. В результате электрохимической реакции образуется ферроцинковый сплав. При применении второго способа на подготовленную поверхность стального листа наносится защитный слой из цинка. Оцинковка толщиной 0,3 мм позволяет обеспечить защиту обработанной поверхности металла более чем на 30 лет.
Итальянская фирма «Metalnastri» разработала метод, сочетающий в себе качество горячего и технологичность холодного цинкования. Это простая идея наклейки цинковой фольги на стальную поверхность. Высокую антикоррозийность создает сплошной цинковый слой, а токопроводящие клеевые композиции обеспечивают и электрохимическую защиту поверхности.
ЦНИИПСК им. А.П. Мельникова предложил метод термодиффузионного цинкования (ТДЦ) метизных и малогабаритных изделий из стали и чугуна. Метод заключается в нагреве металлоизделий в среде, содержащей порошок цинка. В результате на поверхности изделия образуется цинковое покрытие с хорошими защитными и декоративными свойствами.
Технологический процесс такого цинкования экологически чист и практически безотходен. В качестве сырья используются отечественные материалы, не требующие специальной обработки. ТДЦпокрытие обладает высокой адгезией и износостойкостью, обеспечиваемой в результате взаимной диффузии железа и цинка. Срок службы покрытия в 1,5-4 раза больше по сравнению с традиционными цинковыми покрытия.
Широкое распространение цинковых покрытий обусловлено их хорошими химическими свойствами. Для стали (катод) цинк является анодом, за счет этого образуется гальваническая пара, имеющая высокие защитные свойства, хорошо сохраняемые даже при малой толщине слоя. Скорость разрушения цинкового покрытия составляет примерно 1-10 мкм в год в зависимости от различных факторов. Оцинковка может осуществляться совместно с другими металлами – с добавлением алюминия (Al) или железа (Fe). В настоящее время в России широко используется сталь Galfan c цинкоалюминиевым покрытием и сталь Galvannealed с цинкожелезным покрытием.
При покрытии другими металлами в зависимости от вида коррозии покрывающий слой наносят различными способами. В качестве покрывающего материала часто используется хром или никель. Хромирование – электролитическое нанесение покрытия из хрома на поверхность металлического изделия. Никелирование, также нанесение на поверхность изделий никеля толщиной от 2 до 50 мкм.
На практике обычно применяются следующие методы:
- Погружение изделий в расплавленный металл (горячий способ). Заключается в том, что изделия погружают в ванну с расплавленным металлом или же нагретую поверхность деталей обволакивают расплавленным металлом.
- Метод термической диффузии. Основан на диффузии (проникновении) в поверхностные слои деталей присадок при высокой температуре. Диффузионные покрытия наносятся при нагреве деталей в твердой (порошкообразной), жидкой или газообразной фазе металла.
- Металлизация. Заключается в нанесении (распылении) на поверхность деталей слоя присадок расплавленного металла с помощью пульверизаторов.
- Контактный метод осаждения металла. Осуществляется без применения внешнего источника тока за счет вытеснения менее благородными металлами более благородных из растворов их солей. Толщина таких покрытий невелика и защитные свойства их невысоки.
Следует отметить, что металлические покрытия достаточно хорошо защищают металл от коррозии. Однако при нарушении защитного слоя она может протекать даже более интенсивно, чем без покрытия. Поэтому в промышленности для улучшения свойств металлических поверхностей, обработанных электротехническим методом, используется способ нанесения защитных покрытий из полимерных материалов. Такие продукты получили широкое распространение в строительной индустрии.
Использование полимерных материалов для антикоррозионной защиты обусловлено их уникальными физико-химическими показателями. Полимеры имеют небольшой удельный вес, высокую стойкость к не механическим воздействиям (соприкосновение с водой, солями, щелочами или кислотами). Обладают пластичностью и светостойкостью. В настоящее время наибольшее распространение получили « трехслойные» продукты с двойным уровнем защиты.
Первый уровень – непосредственно оцинковка, второй – полимер. Благодаря такой структуре сталь становится стойкой к воздействию агрессивных сред, механическим повреждениям и ультрафиолетовому изучению. Срок их службы составляет порядка 50 лет, в зависимости от качества и толщины покрытия. Необходимо также учесть, что высокие эксплуатационные характеристики таких материалов напрямую зависят от качества оцинковки исходного металла, а потребительские качества – от применяемого в составе полимера.
Альтернативой полимерным материалам являются конструкционные пластмассы и стеклопластики, получаемые на основе различных синтетических смол и стекловолокнистых наполнителей. В настоящее время выпускается значительный ассортимент материалов, особое место среди них занимает полиэтилен. Он инертен во многих кислотах, щелочах и растворителях, а также имеет высокую теплостойкость.
Другим направлением использования полиэтилена в качестве химически стойкого материала является порошковое напыление. Применение полиэтиленовых покрытий объясняется их дешевизной и хорошими защитными свойствами. Покрытия легко наносятся на поверхность различными способами, в том числе пневматическим и электростатическим распылением.
Защитные пленки. Способ заключается в нанесении на металл защитной оболочки из различных компонентов в следующей последовательности: шпатлевка, грунтовка, краска, лак или эмаль.
Для противокоррозионной защиты конструкций зданий и сооружений (ферм, ригелей, балок, колонн, стеновых панелей), а также наружных и внутренних поверхностей емкостного технологического оборудования, трубопроводов, газоводов, воздуховодов вентиляционных систем, которые в процессе эксплуатации не подвергаются механическим воздействиям абразивных частиц, применяют лакокрасочные покрытия. Такие покрытия наиболее эффективны для защиты от атмосферной коррозии. Однако срок службы лакокрасочных покрытий невелик и составляет 4-5 лет. Для повышения коррозионной стойкости лакокрасочных покрытий используют различные противокоррозионные пигменты.
Следует назвать антикоррозионные пигменты фирмы SNCZ (Франция): фосфаты цинка; модифицированные фосфаты цинка; фосфаты, не содержащие цинк; полифосфаты; феррит кальция, а также тетраоксихромат цинка; хроматы стронция, цинка, бария.
Наиболее часто используются фосфаты цинка PZ 20 и PZ W2 в большинстве лакокрасочных систем: органоразбавляемых, водоразбавляемых, воздушной и горячей сушки.
Там, где нельзя использовать противокоррозионные пигменты, содержащие цинк (контакт с пищевыми продуктами), используются пигменты на основе щелочеземельных фосфатов Новинокс РАТ 30, Новинокс РАТ 15 и Новинокс РС01.
Металлоконструкции, подвергающиеся воздействию соляного тумана, могут быть защищены лакокрасочными материалами, содержащими фосфат щелочеземельных металлов. Фосфат щелочеземельных металлов – нетоксичный пигмент, что повышает экологичность лакокрасочного покрытия и увеличивает сферу его применения.
Тетраоксихромат цинка ТС 20, хромат стронция L203E и хромат цинка CZ20 – применяются в лакокрасочных материалах, использующихся в авиационных, судовых покрытиях, а также в составе адгезивов для легких сплавов.
Для защитных покрытий, эксплуатирующихся в условиях высоких температур (до 600ºС), используются хромат бария М 20 и феррит кальция FC 71. Применение феррита кальция для защитных покрытий – новое направление в лакокрасочных материалах. В табл. 1 представлена стойкость различных лакокрасочных материалов (ЛКМ) к агрессивным средам.
Таблица 1. Стойкость лакокрасочных материалов
Примечания: ++ отлично, + хорошо, ± удовлетворитльно
Наиболее распространенным способом защиты от коррозии строительных конструкций, сооружений и оборудования является использование неметаллических химически стойких материалов: кислотоупорной керамики, жидких резиновых смесей, листовых и пленочных полимерных материалов (винипласта, поливинилхлорида, полиэтилена, резины), лакокрасочных материалов, синтетических смол и др.
Для правильного использования неметаллических химически стойких материалов необходимо знать не только их химическую стойкость, но и физико-химические свойства, обеспечивающие условия совместной работы покрытия и защищаемой поверхности. При использовании комбинированных защитных покрытий, состоящих из органического подслоя и футеровочного покрытия, важным является обеспечение на подслое температуры, не превышающей максимальной для данного вида подслоя.
Для листовых и пленочных полимерных материалов необходимо знать величину их адгезии с защищаемой поверхностью. Ряд неметаллических химически стойких материалов, широко используемых в противокоррозионной технике, содержит в своем составе агрессивные соединения, которые при непосредственном контакте с поверхностью металла или бетона могут вызвать образование побочных продуктов коррозии, что, в свою очередь, снизит величину их адгезии с защищаемой поверхностью. Эти особенности необходимо учитывать при использовании того или иного материала для создания надежного противокоррозионного покрытия.
Защита металлов от коррозии

Железо и сплавы на его основе подвержены коррозии – разрушению, которое происходит вследствие химического или электрохимического взаимодействия компонентов металлов и сплавов с различными веществами окружающей среды. В результате этих окислительно-восстановительных реакций металлы связываются в оксиды, что приводит к потере их эксплуатационных свойств. Первые проявления разрушительного процесса – образование на поверхности пятен рыжего цвета. Своевременные меры по предотвращению коррозии обеспечивают значительное продление срока службы металлических изделий и конструкций.
Виды коррозии металлов
Коррозионные процессы различаются по характеру разрушения, механизму протекания процесса, типу агрессивной среды, вызывающей коррозию.
Характер разрушения
По этому признаку выделяют следующие типы коррозии:
- Сплошная – равномерная или неравномерная. Затрагивает равномерно всю поверхность металлоизделия или конструкции.
- Местная. Поражаются отельные участки поверхности.
- Питтинг-коррозия (точечная). Поражения – отдельные, глубокие или сквозные.
- Межкристаллитная. Разрушающиеся области располагаются вдоль границ зерен.
Механизм протекания коррозии
Основные типы коррозии – химическая и электрохимическая. Химические коррозионные процессы протекают в результате химреакций, при которых разрушаются металлические связи, а образуются новые – между атомами металла и окислителя. Химическая коррозия возникает при контакте металлов и сплавов со средами, не проводящими электрический ток. Она может быть жидкостной и газовой.
- Газовая коррозия протекает в агрессивных газовых и паровых средах при отсутствии сконденсированной влаги на поверхности металлоизделия или металлоконструкции. Она может стать причиной полного разрушения железа и сплавов на его основе. На поверхности алюминия и алюминиевых сплавов в газовых средах образуется защитная пленка, защищающая их от коррозии. Примеры газов, которые становятся причиной возникновения химических коррозионных процессов: кислород, диоксид серы, сероводород.
- Жидкостная коррозия протекает при контакте металлической поверхности с жидкими неэлектролитами – нефтью и нефтепродуктами. При наличии даже небольшого количества воды этот химический процесс легко превращается в электрохимический.
Электрохимическая коррозия возникает при контакте металлов и сплавов с жидкостями-электролитами вследствие протекания двух взаимосвязанных процессов:
- анодный – ионы металла переходят в раствор электролита;
- катодный – электроны, которые образовались на стадии анодного этапа, связываются частицами окислителя.
В зависимости от среды, в которой протекают электрохимические коррозионные процессы, различают следующие типы коррозии:
- Атмосферная. Самая распространенная. Протекает в условиях атмосферы или другого влажного газа.
- В растворах электролитов – кислотах, щелочах, солях, обычной воде.
- Почвенная. Скорость процесса зависит от состава грунта. Наименее агрессивны песчаные почвы, наиболее – кислые почвы.
- Аэрационная. Ее вызывает неравномерный доступ воздушной среды к разным частям изделий и конструкций.
- Биологическая. Ее провоцируют микроорганизмы, которые в результате жизнедеятельности вырабатывают углекислый газ, сероводород и другие газы, вызывающие коррозионные процессы.
- Электрическая. Возникает из-за блуждающих токов, которые появляются при эксплуатации электротранспорта.
Общий вывод! Коррозионные процессы активнее всего развиваются на поверхностях, удобных для отложения пыли, осадков, плохо обдуваемых воздушными струями. Поэтому они подвержены застою воздуха, накоплению и длительному сохранению на поверхности влаги.
Способы защиты металла от коррозии
На стадии производства стали в ее состав могут вводиться легирующие добавки, которые предотвращают появление очагов всех (или некоторых) видов коррозии. Таким элементом является, хром, которого должно быть не менее 13 % от общего количества всех компонентов. Для предотвращения возникновения и развития коррозии в сталях без легирующих добавок используют следующие методы антикоррозионной защиты – конструктивные, пассивные, активные.
Конструктивные
Заключаются в защите поверхности металла с помощью нетонкослойных покрытий – панелей, резиновых прокладок, заслонов. Эти способы имеют мало преимуществ: их сложно, а иногда невозможно реализовать, материалы для конструктивной защиты стоят дорого и после монтажа занимают много места. Их применяют нечасто и только в местах, где они скрыты от глаз.
Пассивные
На металлическое изделие наносится тонкослойное покрытие, которое выполняет чисто барьерные характеристики, то есть процесс защиты заключается в предотвращении контакта металла с наружной средой. Для пассивного способа защиты используют неметаллические покрытия – грунтовки, лаки, краски, эмали. После высыхания они образуют прочную и твердую пленку, имеющую хорошее сцепление с основанием.
Преимущества пассивного способа: невысокая цена и удобное нанесение покрытий, большой ассортимент составов разных цветов и характеристик, создание надежного барьера между металлом и окружающей средой. Недостатки: невысокая устойчивость к механическим повреждениям, необходимость периодически обновлять барьерный слой.
Активные (электрохимические)
Самый распространенный способ создания активной защиты для стальной поверхности – цинкование (горячее, термодиффузионное, гальваническое, холодное). Первые три технологии осуществимы только в производственных условиях. Чаще всего используется горячее цинкование. Стальной листовой прокат цинкуют на непрерывных линиях. Преимущества такого процесса: возможность получать цинковый слой достаточной толщины, высокие автоматизация и производительность процесса. В бытовых условиях применяют только холодное цинкование – нанесение на стальную поверхность цинкнаполненного материала. Обычно холодное цинкование применяют для локального восстановления цинкового покрытия.
Принцип активного защитного действия цинка заключается в том, что он обладает меньшей скоростью коррозии в данной среде, что позволяет ему обеспечить электрохимическую катодную защиту стальной основы. При нанесении на сталь цинкового покрытия цинк с железом образуют гальваническую пару, в которой цинк является более активным металлом. При контакте с влагой и другими коррозионноопасными средами цинк-анод отдает электроны, которые принимает железо-катод, что позволяет ему сохранять свои технические характеристики. Защитный процесс длится до полного исчезновения цинкового слоя.
Плюсы цинкования – долговечность и возможность добавлять цинковый слой в процессе эксплуатации изделий и конструкций. Минусы – необходимость в тщательной подготовке поверхности, обязательное соблюдении технологических правил, сложность утилизации токсичных отходов.
Читайте также:
