Сравнить металлические свойства натрия и магния
Обновлено: 28.09.2024
Сравните металлические свойства : – натрия и калия ; – натрия и магния.

У калия более выражены металлические свойства чем у натрия.
У натрия более выражены металлические свойства чем у магния.

Ряд элементов расположенных в порядке увеличения их металлических свойств : 1)кальций, алюминий вор 2?
Ряд элементов расположенных в порядке увеличения их металлических свойств : 1)кальций, алюминий вор 2.
Магний, натрий, калий 3.
Калий, натрий, литий 4.
Барий, кальций, стронций.

Сравнить металлические свойства натрия и магния, неметаллические - фтора и хлора?
Сравнить металлические свойства натрия и магния, неметаллические - фтора и хлора.

Расположитесь значение химических элементов литий калий натрий магний порядке увеличения металлических свойств ответ поясните?
Расположитесь значение химических элементов литий калий натрий магний порядке увеличения металлических свойств ответ поясните.

Элемент с наиболее ярко выраженными металлическими свойствами :А?
Элемент с наиболее ярко выраженными металлическими свойствами :
А) Калий обладает более выраженными металлическими свойствами чем магний?
А) Калий обладает более выраженными металлическими свойствами чем магний.
Б) Оксид натрия проявляет более выраженные основные свойства, чем оксид аллюминия что верно?
Больше металлических свойств проявляет : 1) литий, 2) рубидий, 3) калий, 4) натрий?
Больше металлических свойств проявляет : 1) литий, 2) рубидий, 3) калий, 4) натрий.

Металлические свойства у магния выражены сильнее, чем у 1) бериллия 2) калия 3) кальция 4) натрия?
Металлические свойства у магния выражены сильнее, чем у 1) бериллия 2) калия 3) кальция 4) натрия.
У какого элемента больше выражены металлические свойства : у натрия или магния?
У какого элемента больше выражены металлические свойства : у натрия или магния?

Расположите в порядке увеличения металических свойств : лития, калия, натрия, магния?
Расположите в порядке увеличения металических свойств : лития, калия, натрия, магния.
Распределить элементы в порядке усиления Металлических свойств : калий, магний, алюминий, натрий Распределите элементы в порядке уменьшения неМеталлических свойств : азот, бор, кислород, фтор?
Распределить элементы в порядке усиления Металлических свойств : калий, магний, алюминий, натрий Распределите элементы в порядке уменьшения неМеталлических свойств : азот, бор, кислород, фтор.
На этой странице находится вопрос Сравните металлические свойства : – натрия и калия ; – натрия и магния?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 5 - 9 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..

Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.

В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Бериллия, ответ 1) надеюсь помог.
Металлические свойства наиболее сильно выражены у бария кальция стронция магния?
Металлические свойства наиболее сильно выражены у бария кальция стронция магния?
У какого элемента сильнее выражены металлические свойтва : а)у бериллия или стронция ; б)у натрия или аллюминия?
У какого элемента сильнее выражены металлические свойтва : а)у бериллия или стронция ; б)у натрия или аллюминия?
У какого из щелочноземельных металлов, магния или бериллия, ярче выражены металлические свойства?
У какого из щелочноземельных металлов, магния или бериллия, ярче выражены металлические свойства?
Оснόвные свойства оксида магния выражены сильнее, чем оснόвные свойства 1) оксида бериллия 2) оксида натрия 3) оксида кальция 4) оксида калия?
Оснόвные свойства оксида магния выражены сильнее, чем оснόвные свойства 1) оксида бериллия 2) оксида натрия 3) оксида кальция 4) оксида калия.
Обьясните у какого элемента сильнее выражены металлические свойства калий или кальций?
Обьясните у какого элемента сильнее выражены металлические свойства калий или кальций.
У чего металлические свойства ярче выражены у Калия или кальция?
У чего металлические свойства ярче выражены у Калия или кальция?
Наиболее выражены основные свойства у оксида 1) натрия 2) калия 3) магния 4) бериллия?
Наиболее выражены основные свойства у оксида 1) натрия 2) калия 3) магния 4) бериллия.
У кого сильнее выражены восстановительные свойства у калия или магния?
У кого сильнее выражены восстановительные свойства у калия или магния?
Сравните металлические свойства : – натрия и калия ; – натрия и магния?
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева

Видеоурок начинается воспоминанием ученика Васи, который должен сделать домашнее задание по химии, а для этого ему нужно охарактеризовать два химических элемента: натрий и фосфор по плану, который они изучали в 8 классе. В видеофрагменте подробно расписан план характеристики химического элемента на основании положения его в Периодической системе, приведены конкретные примеры и подробное описание элементов натрия и фосфора.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева"
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
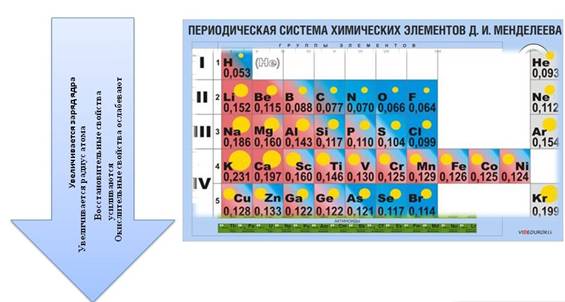
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
· окислительные – ослабевают.
· высшая степень окисления остается неизменной и равна номеру группы
· низшая степень окисления тоже не изменяется и равна № группы – 8.
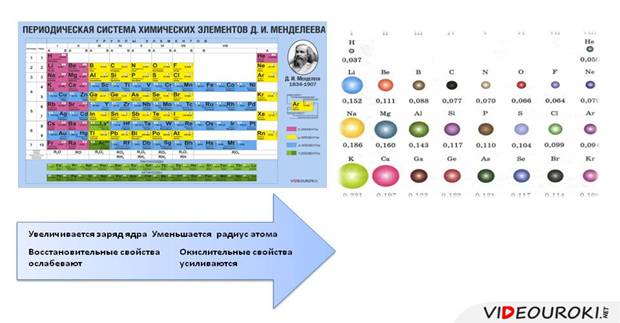
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
· низшая степень окисления изменяется от -4 до -1: в четвертой группе она равна -4, в пятой -3, в шестой -2, а в седьмой -1.

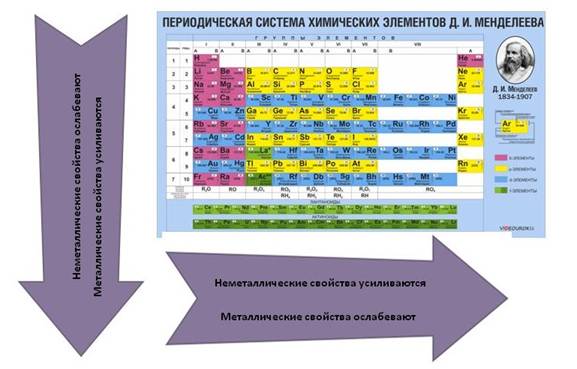
Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах слева направо усиливаются.
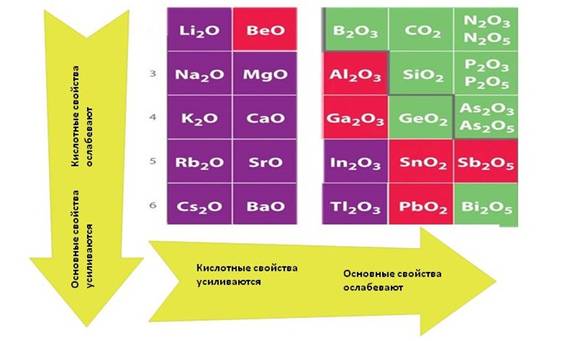
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у оксида алюминия (Al2O3), у оксида углерода (IV) (CO2) – кислотные свойства выражены сильнее, чем у оксида бора (B2O3).
Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
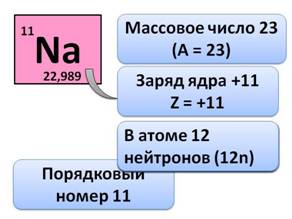
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23

· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
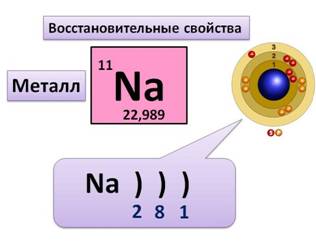
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.

Сравним свойства натрия со свойствами его соседей по группе: металлические свойства натрия выражены сильнее, чем у лития, но слабее, чем у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у магния, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.

Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.

Натрий – металл, но он не образует летучих водородных соединений.
Охарактеризуем фосфор.
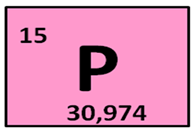
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).

Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
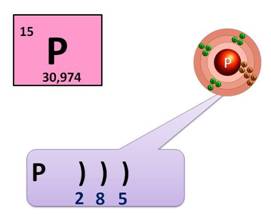
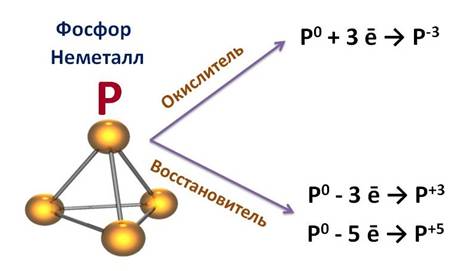
Фосфор – это неметалл, он может быть как окислителем, так и восстановителем. Как окислитель, он может присоединить 3 электрона до завершения внешнего уровня, получая при этом степень окисления -3 (Р 0 + 3 ē → Р -3 ), а как восстановитель, он может отдать 3 или 5 электронов и получить степень окисления +3 или +5 (Р 0 - 3 ē → Р +3 , Р 0 - 5 ē → Р +5 ).
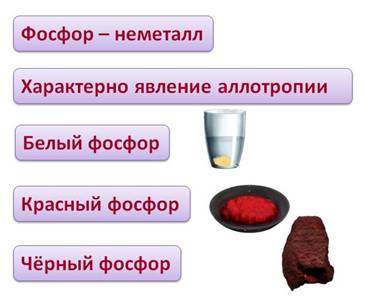
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.

Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.

Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
1)металлический свойства натрия выражены сильнее, так как в периодах металлические свойства уменьшаются слева направо
2) неметалл свойства фтора сильнее так как неметалл свойства уменьшаются в группе сверху вниз.
Металлические свойства у натрия выражены сильнее, чем у магния.
Неметаллические свойства фтора сильнее вырожены.

У каких из приведенных элементов наиболее ярко выражены неметаллические свойства : фосфор, алюминий, кремний, сера, фтор, хлор ?
У каких из приведенных элементов наиболее ярко выражены неметаллические свойства : фосфор, алюминий, кремний, сера, фтор, хлор ?
Расположите в ряд по возрастанию неметаллических свойств элемент хлор магний сера фтор углерод йод натрий?
Расположите в ряд по возрастанию неметаллических свойств элемент хлор магний сера фтор углерод йод натрий.
Расположите элементы в порядке возрастания а) металлических свойств : ванадий, германий, селен, калий, мышьяк, железо, бром ; б) неметаллических свойств : йод, фтор, астат, хлор ; в) радиуса атома : к?
Расположите элементы в порядке возрастания а) металлических свойств : ванадий, германий, селен, калий, мышьяк, железо, бром ; б) неметаллических свойств : йод, фтор, астат, хлор ; в) радиуса атома : кремний, хлор, магний, сера, натрий, фосфор, алюминий.
Объясните причину изменения свойств элементов.
Как изменяются неметаллические свойства простых веществ в ряду натрий магний и алюминий?
Как изменяются неметаллические свойства простых веществ в ряду натрий магний и алюминий.
Сравните строение и свойства атомов натрия, хлора, аргона?
Сравните строение и свойства атомов натрия, хлора, аргона.
1) Даны элементы : Кремний, Натрий, Алюминий, Магний?
1) Даны элементы : Кремний, Натрий, Алюминий, Магний.
Расположить элементы в порядке возрастания металлических свойств.
2) Даны элементы : Хлор, Йод, Бром, Фтор.
Расположить элементы в порядке возрастания неметаллических свойств.
1)наиболее ярко выражены неметаллические свойства у элемента : а) фосфора б) хлора в) углерода г) натрия 2) Сходные химические свойства имеют вещества : а) кальций и барий б) фосфор и сера в) натрий и?
1)наиболее ярко выражены неметаллические свойства у элемента : а) фосфора б) хлора в) углерода г) натрия 2) Сходные химические свойства имеют вещества : а) кальций и барий б) фосфор и сера в) натрий и кальций г) азот и фтор.
Вы находитесь на странице вопроса Сравнить металлические свойства натрия и магния, неметаллические - фтора и хлора? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 - 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Читайте также:
