Сродство к кислороду металлов
Обновлено: 04.10.2024
Реакции восстановления и окисления металлов являются составной частью металлургических процессов. Поэтому для изучения таких реакций нужно знать характеристики, оценивающие прочность связи металла с кислородом.
Оценка степени сродства элементов к кислороду по изменению изобарно-изотермного потенциала образования оксидов.
Изобарно-изотермный потенциал является функцией состояния.
Н - энтальпия; Т - термодинамическая температура; S - энтропия тела (системы);
и отражает общую движущую силу процесса, которая складывается из стремления системы к уменьшению энтальпии и возрастанию энтропии. Изменение энергии Гиббса (∆G) - мера химического сродства веществ, взятых в данных соотношениях, при данных условиях.
Рассчитав ∆G процесса, можно сделать вывод о возможности протекания процесса в прямом направлении. Самопроизвольное течение процессов возможно при условии убыли в нихизобарно-изотермного потенциала (энергии Гиббса), то есть∆G
При наличии в системе газовой фазы кислорода направление протекания процессов определяется изменением изобарно-изотермного потенциала G. На рис. 91 приведены кривые, построенные по результатам определения изобарно-изотермного потенциала образования некоторых оксидов в зависимости от температуры:
если в данной реакции изобарный потенциал уменьшается, процесс самопроизвольно развивается в направлении окисления;
если этот потенциал растет,— самопроизвольное окисление невозможно;
наконец, значение изобарного потенциала, равное нулю, отвечает равновесному состоянию реакции.
Нетрудно видеть, что чем больше по своему значению убыль G при образовании данного оксида, тем выше сродство элемента к кислороду в этом оксиде.

Из графиков вытекает следующее:
1. В интервале 1000—3500 °К изобарно-изотермный потенциал образования оксидов с повышением температуры увеличивается, что говорит об уменьшении степени сродства элементов к кислороду с ростом температуры (окисление затормаживается).Исключение составляет реакция образования окиси углерода.
2. По убывающей силе сродства к кислороду при температуре 3500 °Крассмотренные элементы можно расположить в такой ряд:С; Ti; Al; Mn; Si; Fe; Ni.
Интересна зависимость от температуры сродства углерода к кислороду: при относительно низких температурах (1000 ºС), близких к началу затвердевания сталей, углерод как раскислитель смещается с первого на пятое место в указанном ряду, уступая в сродстве к кислороду алюминию, титану, кремнию и марганцу.
Оценка степени сродства элементов к кислороду по упругости диссоциации оксидов.
Реакции окисления металлов обратимы и поэтому оксиды способны диссоциировать.
Напишем в общем виде такую реакцию:
Если МеО и Me — чистые конденсированные вещества, то единственным газообразным продуктом является кислород. В таких гетерогенных системах константа равновесия определяется одним парциальным давлением кислорода:
Величину ро2 — давление свободного кислорода, отвечающее состоянию равновесия реакции,— называют упругостью диссоциации данного оксида МеО. Иначе говоря, упругость диссоциации химического соединения есть концентрация единственного газообразного компонента в равновесной системе, выраженная в атмосферах.
Упругость диссоциации данного оксида МеО определяет соотношение между неокисленным Ме и МеО, и таким образом, может служить показателем сродства к кислороду элемента М.
"Чем меньше значение упругости диссоциации химического соединения (оксида), тем прочнее этот оксид.»(парциальное давление кислорода нижезначит его меньшереакция диссоциации смещена влевоокисел проченон активен по отношению к кислороду)
В самом деле, чем меньше, при прочих равных условиях,давление(или концентрация)свободного кислорода, отвечающее состоянию равновесия реакции,тем большее его количество связано в оксид и тем легче образуется последний.Наоборот, чем большее давление (или концентрация) свободного кислорода отвечает состоянию равновесия реакции, тем меньшее его количество связано в оксид, т. е. тем меньше сродство элемента к кислороду.
Так как упругость диссоциации совпадает с константой равновесия, то для ее определения могут быть использованы термодинамические методы, применяемые для вычисления констант.
Все реакции протекают в направлении достижения состояния равновесия.Поэтомув зависимости от соотношения между упругостью диссоциации оксида ро2 и действительным парциальным давлением кислорода в газовой фазе ро2 факт оксид или диссоциирует, или образуется.
Возможны три соотношения этих величин:
1) ро2 = ро2 факт — реакция находится в состоянии равновесия;
2) ро2 > ро2 факт — имеет место восстановление данного элемента из оксида, которое протекает тем энергичнее и полнее, чем больше разность ро2 - ро2 факт.
3) ро2 < ро2 факт — наблюдается окисление элемента кислородом, протекающее тем энергичнее и полнее, чем больше разность ро2 - ро2 факт.
Парциальное давление кислорода воздуха в обычных условиях равно 0,21 am. Упругость диссоциации большинства оксидов очень мала - значительно меньше парциального давления кислорода воздуха. Поэтому естественное состояние подавляющего большинства металлов — окисленное.
Исключение составляет лишь группа благородных металлов, которые отличаются высокой упругостью диссоциации оксидов. Поэтому они трудно окисляются на воздухе (золото, платина, серебро).

На рис. 92 показаны кривые зависимости логарифмов упругости диссоциации для различных оксидов от температуры. Пунктирная прямая отвечает парциальному давлению кислорода воздуха, что позволяет сопоставить сродство рассматриваемых элементов к кислороду.
Анализ приведенных на рис. 92 данных дает возможность сделать следующие основные выводы:
1. С увеличением температуры значение упругости диссоциации для всех оксидов увеличивается, что говорит об уменьшении стойкости оксидов.
2. Все кривые упругости диссоциации оксидов лежат выше прямой, отвечающей парциальному давлению кислорода воздуха. Это означает, что в рассматриваемом интервале температур будут существовать оксиды. Исключение составляет закись никеля NiO, у которой при температуре выше 2400 °К значение упругости диссоциации становится выше парциального давления кислорода воздуха. Таким образом, никель будет самопроизвольно восстанавливаться из оксида.
3. Чем выше расположена соответствующая кривая упругости диссоциации оксида, тем прочнее он и тем более сильным раскислителем будет элемент, образовавший с кислородом данный оксид.
4. По убывающей силе сродства рассмотренных элементов к кислороду их можно расположить в следующих два ряда:
- при температуре 3500 °К: С; Ti; Al; Мп; Si; Fe; Ni;
- при температуре 1700 °К: AI; Ti; Si; С; Мп; Fe; Ni.
Сопоставление этих рядов показывает, что с понижением температуры раскисляющая способность углерода падает, а при температуре, отвечающей затвердеванию стали или близкой к ней, более энергичными раскислишлями становятся алюминий, титан и кремний.
Приведенные данные позволяют оценить сродство к кислороду различных элементов и дать сравнение прочности их оксидов.
В действительности на порядок и скорость окисления (раскисления) элементов влияет не только температура, но и их концентрация,
причем совместное наличие нескольких элементов в растворе лишает их возможности свободно и независимо друг oт друга реагировать с кислородом.
Поэтому, вводя в жидкий металл большее количество раскислителя, мы способствуем более полному связыванию кислорода в оксиды. Вследствие малого удельного веса и нерастворимости оксидов в жидком металле они всплывают на его поверхность, образуя шлаки.
Метод оценки сродства элементов к кислороду по упругости диссоциации оксидов не лишен недостатков,главный из которых -низкие значения получаемых величин, в связи с чем в ряде случаев понятие упругости диссоциации как давления теряет физический смысл.
Более широко применяется оценка сродства к кислороду по изменению изобарно-изотермного потенциала образования оксидов.Однакоизобарный потенциал характеризует это сродство при концентрации элементов, равной единице, в то время какупругость диссоциации оксидов рассчитывается при любых концентрациях элементов.
С кислородом
Одним из характерных процессов, протекающих при сварке плавлением, является окисление металла.
Под термином «окисление» в узком смысле понимают химическое взаимодействие того или иного элемента с кислородом.
Окисление металла в сварочной ванне происходит различными способами, если имеется одно или несколько из нижеперечисленных условий:
а) наличие в газовой фазе свободного кислорода (при сварке открытой дугой) или сложных газовых молекул (СО2 и Н2О), способных при диссоциации выделять кислород;
б) присутствие на свариваемых кромках металла и присадочном металле окислов, способных при взаимодействии с жидким металлом окислять последний;
в) растворение в металле находящиеся в шлаке окислов;
г) использование для сварки химически активных шлаков, отдающих кислород металлу в результате обменных окислительно-восстановительных реакций с металлом сварочной ванны.
Характер окисления различных металлов при сварке может быть различным [4].
Некоторые металлы в жидком и твёрдом состоянии практически не растворяют кислород (Al, Mg, Zn и др.). Окисление этих металлов при сварке (в сварочной ванне) приводит к образованию обособлённой фазы – окислов, которые могут находиться либо в виде плёнки (поверхностной), либо в виде отдельных частиц во взвешенном состоянии.
Другие металлы (Fe, Cu, Ni, Ti) обладают способностью растворять кислород. При этом растворимость кислорода в жидкой фазе значительно больше, чем в твёрдой и увеличивается с повышением температуры. Окисление этих металлов сопровождается растворением в ванне жидкого металла образующихся окислов, если концентрация О2 в ванне не достигает предела насыщения.
На практике приходится сваривать не чистые металлы, а сплавы, поэтому при наличии окислительных условий происходит окисление не только металлической основы, но и примесей.
Возможность окисления элемента определяется его сродством к кислороду при данной температуре, которое зависит от концентрации элемента и упругости диссоциации окислов в свободном состоянии.
Окисление металла может происходить следующими способами:
1. Окисление металла в сварочной ванне свободным кислородом газовой фазы.Если в газовой фазе имеется свободный (молекулярный) кислород, то последний может реагировать с металлом по реакции
Константа равновесия этой реакции выражается парциальным давлением кислорода, называемым упругостью диссоциации окисла:
Значение упругости диссоциации окисла (т.е. равновесное парциальное давление кислорода для образования окисла), когда окисел и металл является конденсированными фазами и не находятся в растворе, позволяет определять действие газовой среды [6].
Упругость диссоциации окислов, находящихся в растворе , отличается от упругости диссоциации свободных окислов Po2:
где – упругость диссоциации окисла, растворенного в металле;
Po2 – упругость диссоциации свободного окисла;
– степень насыщения металлического раствора окислом.
| – концентрация окисла в металле; |
| – концентрация насыщения. |
Так, для закиси железа, растворённой в жидком железе:
Для закиси железа концентрация насыщения определяется по уравнению
Упругость диссоциации закиси железа FeO в виде конденсированной фазы описывается уравнением
Можно рассчитать равновесное парциальное давление кислорода в газовой фазе при различных содержаниях закиси железа в жидком металле, например для электродов ЦМ-7.
Парциальное давление кислорода Ро2 в металле, наплавленном электродами ЦМ-7, определяется как:
Т=2073 °К (1800 °С); .
[FeO] = 0,0271 %; [FeO]max = 2,86 %; ат; Po2 = 3,44×10 -7 ат. ат.
Если какой либо элемент растворён в металле, а его окисел нерастворим ни в металле, ни в шлаке (например, Mn и Si растворяются в металле, а окислы SiO2, MnO нет), то константа равновесия реакции
m[Me] + 2[O] = (MemO2)
, а через парциальное давление Kc = Po2.
Поскольку окисел MemO2 нерастворим в металле и шлаке, то его концентрацию, как величину постоянную, вводим в константу равновесия. Концентрацию кислорода Co2 заменяем парциальным давлением кислорода , необходимым для образования окисла, т.е. искомой упругостью диссоциации окисла.
Таким образом, упругость диссоциации окислов растворённого элемента будет тем меньше, чем больше концентрация элемента в растворе, т.е. элемент будет окисляться тем легче, чем больше его концентрация.
Если окислы растворимого в металле элемента растворимы в металле или шлаке, то и являются переменными и вводить их в константу нельзя:
Отсюда следует, что упругость диссоциации окисла будет тем меньше, а окисление тем интенсивнее, чем больше концентрация элемента и чем меньше концентрация окислов этого элемента.
Обычно окислы раскислителей практически нерастворимы в металле (Fe), и переходят в шлак. Следовательно, употребляя какой либо раскислитель, необходимо, чтобы концентрация его окислов в шлаке была по возможности меньше и даже при возможности удалять окислы раскислителя из шпака.
В приложении к сварочной металлургии изложенное позволяет прийти к выводу о несовместимости раскислителя и его окисла в покрытиях электродов.
Если в состав покрытия или флюса введен какой-либо элемент в качестве раскислителя, то в качестве шлакообразующей фазы не следует использовать окисел того же элемента, так как это уменьшает силу действия раскислителя.
Если в состав покрытия введен элемент как легирующий, то одновременно следует ввести в покрытие и окисел этого элемента, чтобы предохранить от выгорания легирующий элемент.
2. Окисление сварочной ванны сложными газами.При наличии в газовой фазе сложных молекул, способных при диссоциации выделять кислород, также возможно окисление жидкого металла при сварке. Так, при высокой концентрации в газовой фазе CO2 и H2O имеем
Образующаяся закись железа (FeO) растворяется частично в расплавленном металле, а частично в шлаке по константе распределения
3. Окисление зоны плавления поверхностными окислами.Окисление сварочной ванны (зоны плавления) может происходить за счет окислов, находящихся на поверхности свариваемых кромок. К таким окислам относится окалина (Fe3O4) и ржавчина (Fe2O3).
4. Окисление сварочной ванны шлаками, содержащими закись железа.Окисление металла окислами, находящимися в шлаке и растворяющимися в металле, происходит в связи с распределением таких окислов между шлаками и металлом по константе распределения (табл. 2)
Содержание FeO в шлаке в зависимости от содержания кислорода
| Содержание FeO в шлаке, % | 14,2 | 15,0 | 22,7 | 26,8 | 56,0 | 61,0 |
| Содержание кислорода в металле шва, % | 0,036 | 0,039 | 0,062 | 0,118 | 0,187 | 0,211 |
5. Окисление сварочной ванны химически активными шлаками. При электродуговой сварке сталей наличие в зоне сварки шлаков, содержащих окислы (например, SiO и MnO) в высокотемпературной части зоны плавления, делает возможным интенсивное окисление железа.
SiO2 + 2Fe = 2FeO + Si; MnO + Fe = FeO + Mn.
В высокотемпературной части сварочной ванны эти реакции идут предпочтительно слева направо, так как:
а) при высоких температурах сродство к кислороду у всех элементов уменьшается и выравнивается;
б) высокая концентрация железа уменьшает упругость диссоциации, т.е. повышает сродство (силу) к кислороду железа.
6.Окисление сварочной ванны при наличии в ней элементов-раскислителей. При наличии окислительных условий концентрация кислорода в сварочной ванне может быть значительно ограничена, если жидкий металл содержит элементы-раскислители, обладающие сродством к кислороду больше, чем металл-растворитель [2].
На рис. 5 представлены упругости диссоциаций окислов некоторых элементов в зависимости от их концентраций в сварочной ванне. Упругость диссоциации FeO приведены для сталей, когда концентрация FeO равна концентрации насыщения.
Анализ кривых показывает:
– раскислительное действие Al, Ti, Si, Mn наиболее эффективно в низкотемпературной части сварочной ванны;
– увеличение концентрации элемента-раскислителя в сварочной ванне уменьшает упругость диссоциации (увеличивает сродство к кислороду), что обеспечивает достаточно полное раскисление.
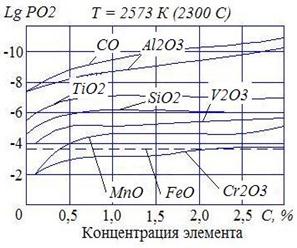 | 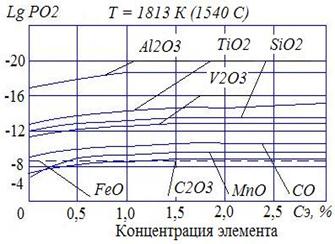 |
| Рис. 5. Упругость диссоциации окислов в зависимости от концентрации в сварочной ванне |
Однако введение элементов-раскислителей в сварочную ванну более 1,5. 2,0 % не увеличивает эффективность раскисления, поэтому в состав покрытий электродов вводят не один раскислитель в большом количестве, а несколько в пределах 1,5. 3,0 %.
При некоторых процессах сварки в результате взаимодействия жидкого металла с газовой фазой и шлаками наблюдается значительное увеличение содержания кислорода в металле шва по сравнению с его содержанием в основном металле и сварочной проволоке (табл. 3).
Химическое сродство элементов к кислороду
Химическое сродство – способность реагирующих веществ образовывать новые соединения. Причинами, вызывающими химическое сродство, являются межатомные взаимодействия.
Значение химического сродства одних элементов по отношению к другим позволяет оценить характер взаимодействия различных веществ при сварке. Особенно значимы данные о сродстве элементов к кислороду. Существуют три основных способа оценки сродства элементов к кислороду:
– по тепловому эффекту реакции окисления;
– изменению изобарно-изотермического потенциала образованию окислов;
– упругости диссоциации окислов.
Оценка степени сродства элементов к кислороду по тепловому эффекту реакции.Степень сродства различных элементов к кислороду по тепловому эффекту реакции окисления оценивается при взаимодействии газообразного кислорода и вещества с образованием продуктов реакции в конденсированном виде, т.е. в жидком или твёрдом состоянии.
В этом случае тепловой эффект относится к одной граммолекуле кислорода, принимавшего участие в реакции. Такие реакции и их тепловые эффекты можно сравнивать между собой, и при этом чем больше значение теплового эффекта реакции, тем больше сродство реагирующих веществ к кислороду. Так, реакции:
Ti + O2 = TiO2 + 219 ккал/(г×моль); Si + O2 = SiO2 + 206 ккал/(г×моль);
=MnO+186,2 ккал/(г×моль);
=FeO+129,0 ккал/(г×моль).
определяют следующий ряд элементов по увеличивающемуся сродству к кислороду: Fe, Mn, Si, Ti.
Оценка степени сродства к кислороду по изменению изобарно-изотермического потенциала. При наличии в системе газовой фазы кислорода направление протекания процессов определяется изменением изобарно-изотермического потенциала.
Если в реакции изобарно-изотермический потенциал уменьшается, процесс самопроизвольно развивается в направлении окисления; если этот потенциал увеличивается, значит самопроизвольное окисление невозможно, значение потенциала равно нулю, что отвечает состоянию равновесия. Чем меньше по своему значению изобарно-изотермический потенциал, тем больше сродство элемента к кислороду в этом окисле.
Оценка степени сродства элементов к кислороду по упругости диссоциации окислов. В сварочной металлургии наиболее распространена оценка степени сродства элементов к кислороду по упругости диссоциации окислов. В общем виде реакция окисления элемента с образованием конденсированного окисла определяется как:
2MeO = 2Me + O2.
Константа равновесия этой реакции
Так как значение парциального давления (упругость паров) не зависит от концентрации вещества, находящегося в конденсированном виде, и является величиной постоянной:
PMe = const; PMeO = const, то имеем KP = Pо2.
Величина Ро2 – давление свободного кислорода, необходимое для образования окисла данного элемента и отвечающее состоянию равновесия данной реакции называют упругостью диссоциации данного окисла MeO. Таким образом, упругость диссоциации химического соединения есть концентрация (давление) газообразного компонента (кислорода) в равновесной системе, выраженная в атмосферах.
Чем меньше значение упругости диссоциации химического соединения – окисла, тем прочнее этот окисел.
Поскольку давление свободного кислорода для образования окисла очень мало, то пользуются значением логарифма давления, т.е. lg Po2, который определяется как:
Чтобы определить, в каком направлении может протекать реакция образования окисла, следует сопоставить расчётное значение lg Po с логарифмом действительного парциального значения давления кислорода при протекании реакции (в нашем случае – атмосферное, т.е. Po2).
а) lg Po2 = lg [Po2] – реакция находится в состоянии равновесия;
б) lg Po2 > lg [Po2] – наблюдается восстановление элемента из окисла;
в) lg Po2 < lg [Po2] – наблюдается окисление элемента кислородом и тем энергичнее, чем больше разность lg Po2– lg[Po2].
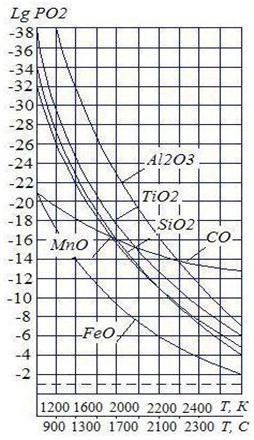 Рис. 5. Изменение упругости диссоциации окисла от температуры | На рис. 5 показано изменение упругости диссоциации различных окислов в зависимости от температуры. Из графика видно: 1. Все кривые, выражающие зависимость упругости диссоциации окислов и температуры, расположены выше прямой, отвечающей парциальному давлению воздуха. Это означает, что в рассматриваемом интервале температур металлы существуют устойчиво в виде окислов. 2. Чем выше расположена кривая упругости диссоциации окисла, тем прочнее окисел и тем более сильным раскислителем будет элемент, образовавший с кислородом окисел. |
3. С увеличением температуры значения упругости диссоциации окислов увеличиваются, следовательно стойкость существования окислов уменьшается (т.е. сродство к кислороду уменьшается); окислы становятся менее прочными.
При больших температурах значения упругости диссоциации окислов элементов выравниваются между собой по сравнению со значениями при низких температурах. Так, при Т = 2400 °С разница между значениями упругости диссоциации железа Si и Mn соответственно 3,62 и 3,82, а при Т = 1500 °С соответственно 7,18 и 5,98. Таким образом, наибольший эффект раскисления Si и Mn проявляется в низкотемпературной части сварочной ванны.
4. В отличие от Si, Mn и других раскислителей углерод с уменьшением температуры теряет раскисляющую способность, а при высоких температурах углерод является самым сильным раскислителем.
Расчет химического сродства элементов к кислороду
Реакции восстановления и окисления металлов являются составной частью металлургических процессов. Поэтому для их изучения нужно знать характеристики, оценивающие химическое сродство - прочность связи металла с кислородом. Применяют два метода оценки химического сродства элементов к кислороду.
Оценка химического сродства к кислороду элементов по изменению энергии Гиббса при образовании оксидов. При наличии в системе газовой фазы - кислорода - направление протекания процессов определяется изменением энергии Гиббса AG. Если для данной реакции AG < 0, процесс самопроизвольно развивается в направлении окисления; если AG >0, самопроизвольное окисление невозможно и происходит диссоциация оксида; если AG = О, то имеет место равновесное состояние реакции. Чем больше убыль энергии Гиббса AG при образовании данного оксида, тем выше химическое сродство элемента к кислороду в этом оксиде.
Изменение энергии Гиббса в процессе образования различных оксидов рассчитывают по константе равновесия реакции, используя уравнение (8.42). На рис. 8.12 приведены графики AG (7), построенные по результатам определения изменения энергии Г иббса при образовании некоторых оксидов для разных температур. В результате анализа кривых можно сделать следующие выводы.
1. При нормальной температуре для всех элементов, представленных на рис. 8.12, изменение энергии Гиббса меньше нуля - это означает, что они должны находиться в виде оксидов.
2. В интервале температур 1000. 2500 К изменение энергии Гиббса при образовании оксидов с повышением температуры увеличивается, что свидетельствует об уменьшении химического сродства элементов к кислороду. Исключение составляет реакция образования окиси углерода.
Рис. 8.12. Влияние температуры на изменение энергии Гиббса AG0, приходящегося на 1 моль 02, для реакций диссоциации различных оксидов:
1 - Си20; 2 - Ni20; 3 - FeO; 4 - СО; 5 - Сг203; 6 - МпО; 7 - Si02; 8 - V203; 9 - Ті02; 10 - А1203; 11 - MgO; 12 - CaO
3. По убыванию химического сродства к кислороду при температуре 2500 К рассмотренные элементы можно расположить в такой ряд: С, Ті, А1, Мп, Si, Fe, Ni. Интерес представляет зависимость от температуры химического сродства углерода к кислороду - при относительно низких температурах, близких к началу затвердевания сталей, углерод как раскислитель переходит с первого на пятое место в указанном ряду, уступая алюминию, титану, кремнию и марганцу в химическом сродстве к кислороду.
4. При высоких температурах кремний и марганец в ряду сродства к кислороду меняются местами.
Однако изменение энергии Гиббса AG° рассчитывают на 1 моль вещества (или для химической реакции), что не позволяет применить его для расчетов окисления компонентов в расплаве, где их молярная концентрация всегда меньше единицы.
Оценка химического сродства элементов к кислороду по упругости диссоциации оксидов. Этот метод оценки применяют для элементов в системах с участием газовой фазы. Реакции окисления металлов обратимы, и поэтому оксиды обладают способностью к диссоциации с выделением кислорода. Напишем в общем виде такую реакцию:
Если МеО и Me - чистые конденсированные вещества, то единственным газообразным продуктом в реакции (8.67а) является кислород. В таких гетерогенных системах константа равновесия определяется только парциальным давлением кислорода, т. е.
Величину pq2 - давление чистого кислорода, соответствующее состоянию равновесия реакции, - называют упругостью диссоциации данного оксида МеО. Иначе говоря, упругость диссоциации химического соединения есть концентрация единственного газообразного компонента в равновесной системе, выраженная в единицах давления (паскалях). Чем меньше значение упругости диссоциации при одних и тех же температуре и внешнем давлении, например оксида, тем прочнее этот оксид. В самом деле, чем меньше при прочих равных условиях давление (или концентрация) чистого кислорода, соответствующее состоянию равновесия реакции, тем большее его количество связано в оксиде и тем легче образуется последний. И наоборот, чем большее давление (или концентрация) чистого кислорода соответствует состоянию равновесия реакции, тем меньшее его количество связано в оксиде, т. е. тем меньше химическое сродство элемента к кислороду. Так как упругость диссоциации совпадает согласно (8.676) с константой равновесия, то для определения упругости диссоциации могут быть использованы термодинамические методы, применяемые для вычисления константы равновесия. Используя формулу (8.42) и
учитывая, что для реакции (8.67а) Кр = р02, получаем
Все реакции протекают в направлении достижения состояния равновесия. Поэтому в зависимости от соотношения между упругостью диссоциации оксида Pq2 и возникшим парциальным давлением кислорода в газовой фазе plQ происходит диссоциация
оксида или его образование. Возможны три варианта соотношения этих величин:
1) lgPo2 = lgPq2 - реакция находится в состоянии равновесия;
2) lgPo2 > lg - имеет место восстановление данного элемента из оксида, которое протекает тем энергичнее и полнее, чем больше разность lg/?о2 - lgPq2 ;
Парциальное давление кислорода р0г в воздушной среде при
стандартных условиях равно 0,21 • 105 Па. Упругость диссоциации большинства оксидов, участвующих в сварочных процессах при
Рис. 8.13. Сравнение химического сродства элементов к кислороду по упругости диссоциации их оксидов при повышении температуры (штриховой линией показано парциальное давление кислорода воздуха)
различных Т приведена на рис. 8.13. Ее значения очень малы - существенно меньше парциального давления кислорода воздуха (lgp02 =-0,68).
Поэтому естественное состояние подавляющего большинства металлов - окисленное. Исключение составляет лишь группа благородных металлов (золото, платина, серебро), которые отличаются высокой упругостью диссоциации оксидов. Поэтому они трудно окисляются на воздухе.
Кривые зависимости логарифмов упругости диссоциации для различных оксидов от температуры (см. рис. 8.13) и штриховая прямая, соответствующая парциальному давлению кислорода воздуха, поз
воляют сопоставить химическое сродство рассматриваемых элементов к кислороду и сделать следующие основные выводы:
1. С увеличением температуры упругость диссоциации для всех оксидов увеличивается, что говорит об уменьшении стойкости оксидов.
2. Все кривые упругости диссоциации оксидов лежат ниже прямой, показывающей парциальное давление кислорода воздуха. Это означает, что в рассматриваемом интервале температур в контакте с воздухом будут существовать оксиды. Исключение составляет закись никеля NiO, у которой при температуре выше 2400 К упругость диссоциации становится выше парциального давления кислорода воздуха. Таким образом, никель будет самопроизвольно восстанавливаться из оксида.
3. Чем ниже расположена соответствующая кривая упругости диссоциации оксида, тем он прочнее и тем более сильным раскис - лителем будет элемент, образовавший с кислородом данный оксид.
4. По убывающей степени химического сродства рассмотренных элементов к кислороду их можно расположить в следующих два ряда:
при температуре 3000 К (стадия капли) - С, Ті, Al, Мп, Si, Fe,
при температуре 1700 К (стадия кристаллизации сварочной ванны) - Al, Ті, Si, С, Мп, Fe, Ni.
Сравнение расположения одного и того же элемента в этих двух рядах показывает, что с понижением температуры раскисляющая способность углерода падает, а при температуре, отвечающей затвердеванию стали (Т ~ 1700 К) или близкой к ней, более энергичными раскислителями становятся алюминий, титан и кремний.
Определение химического сродства элементов к кислороду в составе сплавов. Приведенные данные позволяют оценить химическое сродство к кислороду различных элементов в чистом виде и дать сравнение прочности их оксидов. В действительности на порядок и скорость окисления элементов или диссоциации их оксидов влияет не только температура, но и их концентрация в сплаве, причем если одновременно в растворе находятся нескольких элементов, то это лишает их возможности свободно и независимо друг от друга реагировать с кислородом.
При сварке необходимо создать условия для диссоциации оксидов других элементов в сплаве, являющихся неметаллическими включениями, либо условия для окисления вредных примесей (серы S и фосфора Р), обеспечивающие их удаление из сплавов в виде газовых продуктов реакции окисления.
3. Сварка трением. Ширина зоны нагрева от «внутреннего» источника энергии при сварке трением значительно ниже, чем при контактной сварке оплавлением. Кроме того, процесс формирования шва обычно протекает при температурах, близких к температуре плавления сплава, но не превышающих ее, т. е. без затрат на скрытую теплоту плавления. При общей ширине пластической зоны формирования соединения около 5 мм минимальная удельная энергия составит
еСт = 2,7 ■ 660 • 0,5 = 891 Дж/см2 ~ 9 Дж/мм2.
4. Холодная сварка. Имеем «внутренний» источник энергии. Преобразование энергии сжатия деталей происходит в некотором активном объеме с одинаковой глубиной по обеим сторонам от шва. Энергия, требуемая для сварки, в данном случае также определяется как произведение среднего теплосодержания при температуре стыка около 600 °С (для алюминия) и глубины активной зоны, равной ~ 1 мм:
ест = 2,7 • 600 ■ 0,1 • 2 = 324 Дж/см2 = 3,24 Дж/мм2.
5. Сварка взрывом. Экспериментально установлено, что для сварки алюминиевых пластин толщиной 1 мм требуется около 1 г взрывчатого вещества на 1 см2 площади соединяемых деталей. Учитывая, что удельная энергия для взрывчатого вещества составляет ~ 6000 Дж/г, получаем ориентировочную оценку:
єст = 1 ■ 6000 Дж/см2 = 60 Дж/мм2.
Сопоставление энергозатрат при рассмотренных способах сварки показывает, что способы сварки давлением менее энергоемки по сравнению со сваркой плавлением. Немаловажно и то, что при сварке в твердой фазе не требуется расходовать энергию на расплавление металла, что экономит около 15. 30 % энергии.
основы меаллургических процессов
в результате растворения его в другом сульфиде или ошлакования; 3) плавлением сульфида Me'S и особенно его возгонкой.
Обычно в результате взаимодействия металлической и штейновой фаз друг с другом металлы с малым химическим сродством к сере переходят в металлический расплав. А металлы с высоким химическим сродством к сере – в штейн. Так, например, благородные металлы всегда концентрируются в свинце или меди, а не в сульфидном расплаве. Различие в концентрациях металлов в этих фазах составляет несколько десятков раз.
12.5. Взаимодействие в системе Me–S–O при высоких температурах
При высоких температурах в присутствии газовой фазы возможно взаимодействие между жидкими сульфидами и оксидами одного и того же металла. Из реакций, которые рассматривались ранее, особое значение имеет реакция взаимодействия сульфидов и оксидов с получением металла:
MeS 2MeO 3Me SO 2 .
Эта реакция является одной из важнейших при конвертировании медных и полиметаллических свинцовых штейнов. Закономерности ее протекания имеют большое значение для установления возможностей получения различных металлов из сульфидных концентратов.
Реакция (12.58) может быть представлена в виде алгебраической суммы трех реакций:
MeS 2MeO 3Me SO
Реакция пойдет в прямом направлении тогда, когда G 4 0 , т.е.G 1 G 2 G 3 , т.е. суммарное химическое сродство металла к сере и
кислороду должно быть меньше химического сродства серы к кислороду. При взаимодействии чистых фаз или при образовании
насыщенных растворов ( a MeO a MeS a Me 1)
суммарной реакции определяется по формуле:
Таким образом, направление реакции определяется соотношением
равновесного p SO 2 (равн)
и внешнего p SO 2 (г.ф) давлений сернистого газа.
p SO 2 (г.ф) , причем, если
сернистый газ отводить
реакции, реакция идет до исчезновения исходных веществ, если они взяты в стехиометрическом соотношении. Приближенный расчет возможности протекания различных реакций при взаимодействии оксидов и сульфидов одного и того же металла при условии, что активности конденсированных фаз равны единице, показывает, что наиболее успешно протекают реакции:
Cu 2 S 2Cu 2 O 6Cu SO 2 ;
PbS 2PbO 3Pb SO 2 .
В реакции (12.59) нормальное давление p SO
уже при 730 °C, в реакции (12.60) – при 900 °C. Менее успешно
Ni 3 S 2 4NiO 7Ni 2SO 2 .
Реакцию (12.61) можно осуществить при температурах порядка
1600 °C; затруднено протекание реакции:
FeS 2FeO 3Fe SO 2 .
Даже при 1500 °C давление сернистого газа не превышает 10 3 Па. Более сложен расчет равновесия реакции (12.58) при условии
образования ненасыщенных жидких растворов. В этом случае константа равновесия определяется по формуле:
При равновесии должны соблюдаться соотношения:
Сохраняется условие протекания реакции в прямом направлении с получением металла: p SO 2 (равн) p SO 2 (г.ф) . Осложнения в расчетах связаны
с необходимостью определения активностей компонентов в жидких фазах (металлической, оксидной и сульфидной). При этом следует учитывать, что по мере протекания реакции в металлической фазе будут растворяться кислород (т.е. MeO) и сера (т.е. MeS), что отразится на значениях активностей компонентов. Для их определения необходимо знать коэффициенты активности и значения параметров взаимодействия кислорода и серы в металлической фазе.
В качестве примера на рис. 12.12 и 12.13 приведена диаграмма парциальных давлений системы Cu–S–O при 1473 K и системы Pb–S–O при 1173 и 1373 K. На рис. 12.12 линии фазового равновесия между расплавом меди, Cu 2 O и Cu 2 S и газовой фазой определены на основе данных об активностях компонентов. На диаграмме представлены области существования отдельных фаз, т.е. Cu 2 O, Cu 2 S и расплава меди, в котором растворены кислород и сера. Эта диаграмма позволяет установить состав черновой меди при конвертировании так называемого белого матта (т.е. Cu 2 S). При продувке воздухом жидкой Cu 2 S протекают реакции:
Cu 2 S 2Cu 2 O 6Cu SO 2 .
Давление SO 2 составляет 11,3 кПа. На диаграмме этот состав изображен изобарой ABC. По мере протекания реакции (12.64) сульфид меди исчезает и образуется кислородсодержащий расплав меди. При дальнейшей продувке и том же парциальном давлении сернистого ангидрида состав черновой меди соответствует точке C. По мере уменьшения в расплаве меди содержания серы (т.е. Cu 2 S) уменьшается
активность Cu 2 S и соответственно снижается парциальное давление SO 2 в газовой фазе. При этом равновесный состав черновой меди переместится в точку D и понизится содержание растворенной серы до 0,01 и кислорода до 0,1 %.
Из аналогичного вида диаграммы системы Pb–S–O (рис. 12.13) следует, что при температуре 1173 K, кроме областей устойчивости Pb, PbO и PbS существуют области устойчивости оксисульфатов свинца
PbSO 4 ·PbO, PbSO 4 ·2PbO и PbSO 4 ·4PbO. Их следует учитывать при рассмотрении реакции (12.60) взаимодействия сульфида и оксида свинца. Точка B на диаграмме соответствует равновесному давлению
для этой реакции.
Рис. 12.12. Диаграмма парциальных давлений системы Cu–S–O при 1473 K
Рис. 12.13. Диаграмма парциальных давлений системы Pb–S–O
при 1173 K (а) и 1373 K (б)
Как видно, она находится в стороне от граничных линий жидких
фаз Pb, PbO и PbS ТВ . На диаграмму нанесены изобары lg p SO
также значения растворимости серы (PbS) в расплавленном свинце и активности свинца и сульфида свинца. Диаграмма позволяет установить связь между содержанием серы в жидком свинце и равновесными давлениями O 2 , S 2 , SO 2 и SO 3 .
При 1373 K (рис. 12.13, б ) все конденсированные фазы, за исключением PbSO 4 , будут жидкими.
12.6. Взаимодействие в системе Me–Me'–S–O
Как уже указывалось, одной из важнейших реакций в системе Me– Me'–S–O является взаимодействие между сульфидами и оксидами различных металлов:
MeO Me S Me O MeS.
Подобные реакции имеют место при конвертировании медных штейнов в первый период продувки и при плавке сульфидных концентратов на штейн. Условия протекания реакции в прямом направлении ( a MeO a MeS 1) в случае взаимодействия
чистых фаз можно установить из рассмотрения частных реакций:
1) 2MeO 2Me O 2 ; G 1
2) 2Me S 2Me S 2 ; G 2
2MeO 2Me S 2Me O 2MeS;
Реакция пойдет в прямом направлении при условии, если
G 3 1 2 ( G 1 G 2 ) 0 ,
т.е. в том случае, если химическое сродство Me к сере выше, чем Me', а к кислороду Me меньше, чем Me', т.е. если сульфид MeS менее прочен, чем сульфид Me'S, а оксид MeO более прочен, чем оксид Me'O. Таким образом, исходя из сравнения химического сродства металлов к кислороду (рис. 4.1) и сере (рис. 4.2) по стремлению переходить в сульфидную фазу при обмене кислорода на серу металлы можно расположить в таком (по убыванию) порядке: Cu, Pb, Ni, Zn, Fe. Следовательно, FeS переводит оксиды Cu, Pb, Ni и Zn в сульфидную фазу.
Более распространенным является взаимодействие с образованием жидких растворов – оксидного (шлакового) и сульфидного (штейн), как видим ниже:
Константа равновесия в общем виде выражается соотношением активностей реагирующих фаз и имеет вид:
По ходу реакции в прямом направлении активности, а следовательно, концентрации и (MeO) уменьшаются, а активности и (Me'O) увеличиваются. Это приведет к возрастанию концентрации Me в штейновой фазе, а Me' – в шлаковой. Полнота взаимодействия тем больше, чем больше различие химического сродства Me и Me' к сере и соответственно к кислороду.
Успешному протеканию реакции (12.67) также способствуют высокие первоначальные концентрации Me'S в штейне ( a 1) и
ошлакование Me'O ( a (Me O) 1) путем, например, добавки флюса,
образующего с Me'O прочные соединения.
Наиболее отчетливо проявляются эти закономерности при конвертировании медных штейнов. Медные штейны содержат в основном сульфиды Cu 2 S и FeS, поэтому при продувке их воздухом вначале будет происходить преимущественно окисление Cu 2 S с переводом Cu 2 O в шлаковую фазу.
Рис. 12.14. Диаграмма парциальных давлений системы
Cu–Fe–S–O–Si при 1473 K (a) и при 1573 K (б)
Затем произойдет обменная реакция между шлаком, содержащим Cu 2 O и штейном, содержащим FeS. Она имеет вид:
Вследствие того, что у железа химическое сродство к кислороду значительно выше, чем у меди, равновесие этой реакции сдвинуто вправо, что обеспечит переход меди в штейновую фазу, а железа – в шлаковую фазу. Добавки флюса SiO 2 дополнительно способствуют этому процессу, так как FeO образует с SiO 2 прочное соединение 2FeO·SiO 2 . В этом случае в системе Cu–Fe–S–O присутствует также SiO 2 , что усложнит характер взаимодействия между сульфидами и оксидами. Причем, кроме конденсированных фаз, при рассмотрении равновесий в этой системе необходимо учитывать и влияние газовой фазы.
Обобщенные данные о превращениях в системе Cu–Fe–S–O–Si с учетом a Fe ,a FeO ,a Cu 2 O , содержаний меди в белом матте (штейне,
обогащенном Cu 2 S), а также содержаний кислорода и серы в металлической меди приведены на рис. 12.14. Представленные диаграммы не учитывают соотношения количеств меди, железа и кремнезема, поэтому они позволяют лишь провести качественную оценку фазовых равновесий системы при изменении ее состава в процессе окислительной продувки кислородсодержащим газом.
Область pqrstp представляет собой область сосуществования жидкого штейна и шлака с газовой фазой. Линия tp соответствует равновесию твердого магнитного оксида железа (Fe 3 O 4 ) со штейно-
шлаковым расплавом при давлении p SO
10 5 Па; линия st
соответствует равновесию железо-силикатного шлака, насыщенного кремнеземом с твердыми SiO 2 и Fe 3 O 4 . Линии rq и rs соответствуют равновесию твердого металлического железа (γ-Fe) и жидкой меди со штейно-шлаковым расплавом, линия pq – равновесию реакции окисления сульфида железа, как видно из выражения:
Влияние температуры на превращения в системе Cu–Fe–S–O–Si выявляется из сравнения диаграмм для 1473 и 1573 K. Если, например, процесс плавки медных сульфидных концентратов протекает при парциальном давлении сернистого газа Па, то происходят следующие
превращения, которые можно установить, перемещаясь по изобаре p SO 2 10 4 Па от области существования сульфидов в направлении образования жидкой меди. При этом, чем выше p O 2 в системе, тем
богаче по меди и беднее по железу получается штейн. В точке B в равновесии находится белый матт, состоящий практически из чистого Cu 2 S, и железосиликатный шлак.
При температуре 1573 K в точке C находится в равновесии черновая медь (содержащая ~0,2 % растворенного кислорода и 1,0 % S), Cu 2 S, шлак, насыщенный кремнеземом и шпинельная фаза, представляющая собой почти чистый магнитный оксид железа.
12.7. Механизм и кинетика взаимодействия в системе Me–S–О при наличии твердых фаз
Взаимодействие твердых сульфидов с кислородом (рис. 12.15) или кислородсодержащими газами (в частности, с воздухом) является типичным гетерогенным процессом и описывается схемой:
Tв I Г I Tв II Г II .
В начальной стадии, когда отсутствует твердый продукт реакции (рис. 12.15, а ), процесс складывается из следующих последовательных стадий:
1) массопереноса кислорода из ядра газового потока к внешней поверхности сульфида (внешняя диффузия);
2) адсорбции кислорода на поверхности сульфида;
3) химическое взаимодействие адсорбированного кислорода с сульфидом ( хемосорбция ), сопровождающееся образованием продукта реакции (оксида или промежуточного соединения типа сульфата) и сернистого ангидрида;
4) десорбция газообразного продукта реакции, т.е. SO 2 с реакционной поверхности и переход его в газовую фазу.
Эта схема справедлива только в первый момент взаимодействия. Общим является случай, когда в результате взаимодействия образуется твердый продукт реакции – оксид (рис. 12.15, б ).
Рис. 12.15. Схема взаимодействия частицы твердого сульфида с кислородсодержащей газовой фазой: а – начальный момент; б – через некоторый промежуток времени
При наличии слоя оксида взаимодействие осложняется, и одной из определяющих стадий будет диффузия анионов и катионов через слой оксида к реакционной поверхности сульфида.
Таким образом, в общем случае процесс взаимодействия твердых сульфидов с кислородсодержащей газовой фазой включает диффузионные явления, хемосорбцию и кристаллохимические превращения.
Стадии переноса газообразных веществ к реакционной зоне в металлургических процессах (в частности, при горении твердого углерода и в восстановительных процессах) достаточно подробно рассмотрены в соответствующих разделах (гл. 2). Эти закономерности, связанные с молекулярной диффузией и конвективным массопереносом,
в основном справедливы и для случая взаимодействия твердых сульфидов с газовой фазой, содержащей кислород.
В значительной мере остаются справедливыми и общие закономерности адсорбционно-десорбционных явлений. Относительно механизма кристаллохимических превращений имеются различные точки зрения.
Согласно оксидной теории первичными продуктами взаимодействия при окислительном обжиге сульфидов являются оксиды, которые затем, при соответствующих условиях, превращаются
в сульфаты в результате их взаимодействия с газовой фазой,
содержащей SO 3 , SO 2 , O 2 .
По адсорбционно-диссоциационной теории в результате хемосорбции кислорода образуется пероксидный комплекс, который затем разлагается с выделением атомарного кислорода. Последний вступает во взаимодействие с соседними молекулами сульфида, образуя метастабильные сорбционные комплексы сульфатного типа с
нарастающей насыщенностью кислородом (MeSO → MeSO 2 → MeSO 3 → MeSO 4 ). Прочность комплексов зависит от температуры и катионного окружения, что характеризуется поляризующей способностью катиона, т.е. отношением заряда катиона к его радиусу
(так называемый ионный потенциал ).
Наиболее существенное влияние оказывает температура, поэтому при сравнительно низких температурах в качестве первичного продукта образуются сульфаты, а при высоких – оксиды. Если у металла небольшое химическое сродство к кислороду, возможно образование металла.
В соответствии с теорией В.А. Пазухина, принявшего во внимание полупроводниковую природу сульфидов и оксидов, процесс взаимодействия сульфида с кислородом начинается с образования
аниона SO 2 4 в результате связывания аниона S 2 решетки сульфида с адсорбированной частицей кислорода и имеет вид:
Устойчивость комплексного аниона SO 2 4 в дальнейшем будет зависеть от температуры и катионного окружения. Под воздействием силового поля катионов анионы SO 2 4 будут подвергаться сильной
поляризации, степень которой зависит от природы катиона. Повышение температуры также будет способствовать разрушению комплексного аниона, что видно из выражения:
т.е. произойдет замещение аниона S 2
в решетке сульфида на анион O 2
и перестройка в решетку оксида.
По-видимому, механизм взаимодействия твердых сульфидов с газообразным кислородом более сложен и неодинаков при различных режимах обжига. Необходимо учитывать полупроводниковую природу сульфидов в первой стадии, когда еще не образовалась пленка оксида, а затем, при ее образовании, и полупроводниковую природу оксидов.
Как уже указывалось, одну из начальных стадий составляет хемосорбция кислорода на поверхности сульфида. Молекулы кислорода, имея высокое химическое сродство к электрону, ионизируются и отнимают электроны из решетки сульфида.
В частности, сульфид олова SnS имеет избыток серы против стехиометрического, т.е. он относится к p -полупроводникам с катионными вакансиями, поэтому хемосорбция кислорода сопровождается заимствованием электронов из поверхностного слоя сульфида, что повышает концентрацию вакансий, как видно из выражения:
Читайте также:
