Стандартные электродные потенциалы металлов
Обновлено: 04.10.2024
В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым переодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые же металлы, такие, как Cu, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот — водород сам способен вытеснять металлы из солей ртути и серебра.
Итогом трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда — «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала.
Что же такое электродный потенциал? Как он возникает?
Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (и тогда потенциал положителен) или которую можно получить (и тогда потенциал отрицателен) при переносе единицы электричества из бесконечности в данную точку.
Согласно современным представлениям, в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением.
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость Me z + + mH2O ? [Me(H2O)m] z+ , а электроны останутся на пластинке металла, в результате чего металл зарядиться отрицательно.
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так (рис.1):
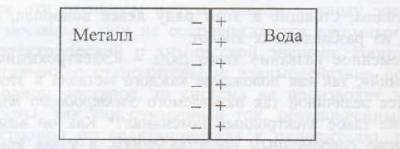
Рис.1. двойной электрический слой на границе металл–вода
Таким образом, на границе соприкосновения жидкости с металлом электрический потенциал? резко изменяется и наблюдается скачок (или разность) потенциала ??, который принято называть электродным потенциалом.
. В большинстве современной химической литературы скачки потенциалов обозначаются просто ?.
Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, следовательно, б?льшим будет отрицательный заряд металла, что, в свою очередь, обусловит б?льшую разность потенциалов на границе металл—жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
На рис. 2. представлена схема возникновения двойного электрического слоя в случае цинковой и медной пластинок, погруженных в растворы их солей.
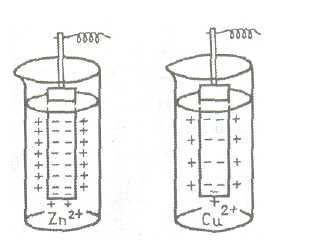
Рис.2. Схема возникновения электродного потенциала
Видно, что величина электродного потенциала определяется прежде всего природойметалла. Кроме того она зависит от температуры, концентрации раствора и других факторов. Поэтому для сравнения электродных потенциалов необходимо выбрать некоторые стандартные условия. Обычно сравнение производят при 25°С, давлении 101,3 кПа и в растворе с концентрацией одноименного иона, равной единице (1 моль/л).
Таким образом, стандартным электродным потенциалом называется электродный потенциал при концентрации иона металла 1 моль/л.
Абсолютное значение электродного потенциала измерить невозможно (поскольку введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов). Вместе с тем не представляет труда измерение величины относительного электродного потенциала.
Относительные электродные потенциалы металлов измеряют относительно стандартного водородного электрода, потенциал которого произвольно принят за нуль.
Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в стандартном водородном электроде используют инертный металл (например, Pt).
Конструктивно водородный электрод (рис.3) состоит из платиновой пластинки, покрытой слоем мелкозернистой платины — платиновой чернью, частично погруженной в раствор кислоты с концентрацией ионов водорода, равной 1 моль/л. Обычно берут раствор нелетучей кислоты — серной H2SO4 или хлорной HClO4. К пластинке подают чистый газообразный водород под постоянным давлением 101,3 кПа.
Возникновение потенциала на стандартном водородном электроде можно представить следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние, поэтому в поверхностном слое платины устанавливается равновесие Н2 ? 2Н, а на границе платины и раствора серной кислоты — равновесие Н ? Н + + е.
Суммарный процесс выражается уравнением:
Таким образом, водородный электрод можно обозначить как Н2/Н + , Pt, где вертикальная черта означает поверхность раздела фаз.
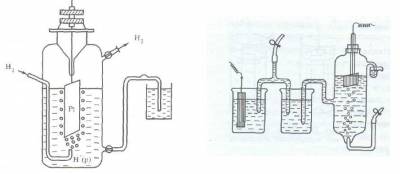
Рис. 3. Схема водородного электрода или так
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом (рис.3), то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродныхпотенциаловводородногоэлектродаи изучаемогометалла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента:
ЭДС= ??1 –??2 или ЭДС = ??к –??А
В замкнутом гальваническом элементе, т.е. при измеряемом значении силы тока в элементе (т.е. при соединении платины с некоторым металлом металлическим проводником) разность потенциалов катода и анода называют напряжением:
Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U,которое не равноЭДСэлемента, т.е. U < ЭДС.
Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока (в физике ЭДС = I·R + I·rвнутр.., где rвнутр– внутреннее сопротивление электродов. При I ~ 0 произведение I·rвнутр.. = 0, но выражение I·R хоть и очень мало, но все-таки оно есть и равно ЭДС). Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю. Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое сопротивление (высокоомным вольтметром). Вследствие высокого сопротивления вольтметра мал ток, протекающий через элемент, поэтому не велика разница между ЭДС и напряжением элемента.
Измеренная ЭДС цепи, составленной из стандартного водородного электрода и стандартного металлического электрода является электродным потенциалом последнего.
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, то получим ряд напряжений металлов:
?? 0 , ВK, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
(или просто ? 0 ) –2,92 –2,38 0,0 0,8 1,2
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньшей алгебраической величиной ? 0 обладает металл, тем он химически активнее, т.е. тем больше его восстановительная способность.
2. Чем дальше расположены друг от друга в ряду напряжений два металла, тем б?льшую электродвижущую силу будет иметь построенный из них гальванический элемент, причем катодом всегда будет являться тот электрод, потенциал которого больше.
Ряд стандартных электродных потенциалов
Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Металлы в виде простых веществ – восстановители, ионы металлов – окислители.
Чем наиболее отрицателен электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель (например, Li, Na, K). И наоборот, чем наиболее положителен потенциал металлического электрода, тем большей окислительной способностью обладают его ионы.
Активные металлы начала ряда, а также щелочные и щелочноземельные вытесняют водород из воды, Например,
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием.
Все металлы, стоящие в ряду стандартных электродных потенциалов до водорода, вытесняют его из растворов кислот с концентрацией (активностью) ионов водорода 1 моль/л. Например,
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов кислот с концентрацией ионов водорода 1 моль/л.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Например,
Чем дальше расположены друг от друга в ряду напряжений два данных металла, тем наибольшую ЭДС будет иметь составленный из них гальванический элемент.
Уравнение Нернста
Потенциал металлического электрода зависит от природы металла, концентрации (активности) ионов металла в растворе, температуры.
Если условия отличаются от стандартных, например, если концентрация ионов металла в растворе не равна 1 моль/л, то электродный потенциал металла не является стандартным и его либо определяют экспериментально, либо вычисляют.
При экспериментальном определении составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод (рис 8.2):
(катод) Pt, H2/2H + || Me n+ /Me (анод),
и определяется его электродвижущая сила как разность равновесных потенциалов катода и анода (ЭДС=│Ек−Еа│). Так как потенциал стандартного водородного электрода равен нулю (Е o =0,00 В), то ЭДС элемента будет равна потенциалу измеряемого электрода.
Для вычисления электродного потенциала в нестандартных условиях применяют уравнение Нернста:
Так как металл – твердое вещество и вступает в реакцию только с поверхности, его концентрация постоянна и не должна входит в уравнение. Поэтому для вычисления электродных потенциалов металла уравнение Нернста приобретает более простой вид:
где Е о – стандартный электродный потенциал, В; R – газовая постоянная, равная 8,314 Вт-с/моль∙К; Т − температура, К; n − число электронов, участвующих в окислительно-восстановительном процессе; F –число Фарадея, равное 96500 Кл/моль; – активность ионов металла,моль/л.
При подстановке числовых значений R, F и стандартной температуры Т = 298 К и при переходе к десятичным логарифмам, уравнение Нернста принимает еще более простой вид:
Уравнение Нернста для разбавленных растворов, в которых активности мало отличаются от концентраций ( [Me n + ]), имеет вид:
Стандартные электродные потенциалы металлов
Понятие об электродном потенциале
Электроды– электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита. Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода). Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков.
Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом:
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом. В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал.
В результате перераспределения зарядов на границе «металл – раствор» возникает двойной электрический слой (рис. 9.1) и возникает скачок потенциала между металлом и раствором.
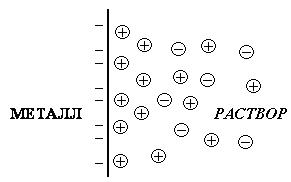 |
| Рис. 9.1. Двойной электрический слой на границе раздела «металл – раствор» |
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д. Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю. В качестве электрода сравнения обычно принимают стандартный водородный электрод.
Стандартным электродным потенциалом (j 0 )называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙10 5 Па.
По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов. Чем меньше значение φ 0 , тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется. Чем больше значение φ 0 , тем сильнее окислительные свойства катиона металла, находящегося в растворе.
Стандартные электродные потенциалы φ 0 некоторых металлов
| Электрод | Электродный потенциал, В | Электрод | Электродный потенциал, В |
| Li + /Li | –3,05 | Cd 2+ /Cd | –0,40 |
| Rb + /Rb | –2,93 | Co 2+ /Co | –0,28 |
| K + /K | –2,92 | Ni 2+ /Ni | –0,25 |
| Ba 2+ /Ba | –2.90 | Sn 2+ /Sn | –0,136 |
| Ca 2+ /Ca | –2,87 | Pb 2+ /Pb | –0,127 |
| Na + /Na | –2,71 | 2H + /H | 0,00 |
| Mg 2+ /Mg | –2,37 | Sb 3+ /Sb | +0,20 |
| Al 3+ /Al | –1,70 | Bi 3+ /Bi | +0,22 |
| Ti 2+ /Ti | –1,60 | Cu 2+ /Cu | +0,34 |
| V 2+ /V | –1,18 | Ag + /Ag | +0,85 |
| Mn 2+ /Mn | –1,18 | Hg 2+ /Hg | +0,85 |
| Zn 2+ /Zn | –0,76 | Pt 2+ /Pt | +1,19 |
| Cr 3+ /Cr | –0,74 | Au 3+ /Au | +1,5 |
| Fe 2+ /Fe | –0,44 |
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
где T – температура, К;
F – число Фарадея, равное 96 500 Кл/моль;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К);
n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
Читайте также:
