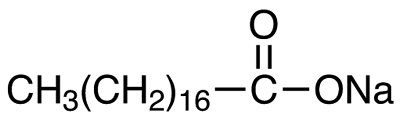Стеариновая кислота и металл
Обновлено: 05.10.2024
Впитал с молоком матери. Поэтическое выражение может касаться стеариновой кислоты .
Содержась в грудном молоке, она входит и в состав смесей для искусственного вскармливания.
Вещество помогает развиваться мозгу и нервной системе младенца. Нужно соединение и взрослым.
В их организмах стеариновая кислота становится энергетическим депо. Главное, не переборщить.
В продуктах для взрослых становится все больше пальмового масла – основного источника соединения.
Немало его и в сое, примешиваемой ко многим блюдам. В детских смесях кислоты ровно столько, сколько нужно.
А не вредим ли себе мы, потребляя ее бесконтрольно? Узнаем ответ на вопрос, изучив полный спектр свойств кислоты .
Свойства стеариновой кислоты
Свойства соединения могут «выйти боком» при чрезмерном потреблении. Стеариновая кислота относится к жирным, органическим веществам.
Маслянист реагент даже на вид. Это, в отличие от большинства кислот , твердая масса, белый , или желтоватый порошок. Он рыхлый и мягкий.
Плотность вещества не превышает 1-го грамма на кубический сантиметр. Избыток жирного соединения в организме способствует образованию холестериновых бляшек.
Они, в свою очередь, провоцируют формирование тромбов – смертельно опасных сгустков крови в сосудах.
Третья стадия – изменение артериального давления, головные боли. Может развиться диабет, а у мужчин нарушиться половая функция.
К тому же, избыток стеариновой, и других жирных кислот , ведет к сбоям в работе желудочно-кишечного тракта.
Так, стеариновая жирная кислота может стать причиной чрезмерно мягкого стула. Если он постоянен и в рационе много жиров, стоит задуматься.
Итогом бесконтрольного потребления реагента становятся даже инфаркты и инсульты.
Вред стеариновой кислоты связан именно с ее переизбытком. Как известно, любое вещество может быть, как ядом, так и лекарством.
Вопрос лишь в дозировке. Дозировку же высчитывают, исходя из концентрации.
Кристаллы соединения не растворяются в воде, зато, разбавляются деэтиловым эфиром. На его основе и делают растворы.
Обычно, они 90-95-процентные, но есть и более слабые. Концентрация зависит от сферы применения. Где пригождается реагент – тема отдельной главы.
Предварительно скажем, что растительная стеариновая кислота делает смеси более нежными, равномерными, то есть, улучшает их консистенцию.
На коже соединение образует тонкую пленку. Прежде, чем рассказать, при каких обстоятельствах это может пригодиться, ознакомимся с обстоятельствами, меняющими состояние кислоты .
Плавится вещество при 70-ти градусах Цельсия, закипает на отметке в 376. Кислота легко воспламеняется и столь же легко портится, особенно, на солнце .
Соединение впервые выделено из свиного сала. Помните, что становится с животным жиром, полежавшим на жаре?
Тоже происходит и со стеариновой кислотой. Состав хранится долго лишь в сухих, прохладных и темных местах.
Здесь вещество остается первозданным, пригодным для применения. Пищевая промышленность – не единственная отрасль, нуждающаяся в стеарине. Огласим весь список.
Применение стеариновой кислоты
Применение реагента тесно связано с косметической промышленностью. Помните разговор о влиянии вещества на консистенцию смесей?
Так вот, крема с помощью стеариновой кислоты теряют прозрачность, становятся более густыми и плотными.
Этот эффект не помешает и пене для бритья. Так что, в нее героиню статьи тоже добавляют.
Стеариновая кислота в косметике – это 2-5% от ее общей массы. Если в креме, лосьоне, пене, реагента больше, его стоит забраковать.
Учесть нужно и то, что человек тоже частично состоит из жиров, выделяет их в качестве смазки покровов.
Получается, кроме поставляемой извне, есть еще стеариновая кислота кожи. В теплое время года ее вполне достаточно.
Кремами с героиней статьи лучше запасаться зимой. Пленка, которой соединение покрывает кожу, защищает от обветривания, мороза.
Добавляется стеариновая кислота и в мыло. Для него приемлемо содержание реагента в районе 7-10%.
Именно поэтому, мыло твердое . От консистенции зависит, вязким будет брикет, или же, распадающимся на кусочки.
Не секрет, что мыло – щелочь. Кислота в нем, как говориться, омыливается, преобразуясь в стеарат натрия .
У некоторых производителей его содержание доходит до 25%, что не есть хорошо.
Пленка на коже получается столь плотной, что закупоривает поры, мешает покровам дышать.
Жир стеариновой кислоты используют, так же, медики, фармацевты. Те, кто хоть однажды пользовался ректальными, или вагинальными свечами, знают, как важно, чтобы они просто вводились.
Восковой, скользкой поверхностью пилюли обязаны именно стеариновой кислоте. Формула соединения пригождается и в медицинских мазях.
Их, как и косметические крема, нужно сгущать. К тому же, маслянистые составы проще распределяются по коже.
Будучи не самой долговечной, героиня статьи способна увеличить срок годности лекарств.
Стеариновая кислота в таблетках, мазях, свечах, помогает равномерному распределению, «переплетению» компонентов.
Говоря научным языком, реагент стабилизирует эмульсионное сырье. В итоге, препараты дольше не расслаиваются на фракции, а значит, и не теряют своих свойств.
Стеариновая кислота входит в состав пластичных смазок. В отличие от большинства «сородичей», соединение химически малоактивно, металлы, к примеру, не разъедает.
Наносить пластичные смазки со стеарином можно и на другие поверхности. Обычно, обрабатывают трущиеся детали, как говориться, для лучшего хода.
Как видно, промышленниками эксплуатируются физические свойства стеариновой кислоты. Витамином, то есть, веществом, важным с химической точки зрения, героиня статьи является лишь в продуктах питания.
Хотя, и там стеарин эксплуатируют ради нужной консистенции пюре, маргаринов, кремов для пирожных.
Встретить стеариновую кислоту можно в самых неожиданных места. Лоснящаяся бумага , к примеру, обработана именно ей.
В резине реагент тоже содержится, а еще, используется в нефтяной и химической промышленностях.
Рынок сбыта, как видно, обширен. Остается выяснить, где и как получают нужные объемы вещества.
Добыча стеариновой кислоты
Дабы понять, как добыть стеариновую кислоту, нужно изучить ее формулу: — CH3(CH2)16COOH.
Глядя на запись, понимаешь, почему химики именуют соединение цитилуксусным, или н-октадекановым.
Понимаешь и оправданность основного способа промышленного получения стеариновой кислоты. Ее формируют путем гидрирования олеиновой кислоты с формулой C17H33COOH.
Гидрированием в химии именуется не прибавление, как может показаться из названия метода, воды, а присоединение лишь водорода .
В итоге, получается нужная формула стеариновой кислоты. Приходят к ней и синтетическим способом, окисляя насыщенные углеводороды. Для этого используют соединения марганца .
Если говорить о средних, и небольших объемах добычи, можно использовать тоже сало, или отходы рафинации растительных масел.
Их кипятят и обрабатывают раствором едкого натра. Получается соапсточное, то есть, сформированное из осадка, мыло.
На него воздействуют серной кислотой, выделяя несколько других кислот. Их дистиллируют при температуре около 200-от градусов и отбирают в вакууме.
Остается гидрогенизировать кислоты на медноникелевом катализаторе. В общем, процесс кропотливый и объясняет популярность первых двух методов получения стеариновой кислоты.
Соль вопроса в ее получении заключается не только в действиях, но и приобретении. Узнаем почем нынче реагент, и кто им торгует.
Цена стеариновой кислоты
Купить стеариновую кислоту оптом на 30-50% дешевле, чем в розницу. В первом случае за кило порошка просят порядка 50-60-ти рублей, а во втором – все 100-200.
Основной поставщик на российский рынок – Китай . Немало и отечественных предложений.
Предприятия по производству соединения есть, к примеру, в Перми, Волгограде, Дзержинске, Краснодаре, Самаре.
За желтый порошок, как правило, просят меньше, поскольку цвет говорит о наличии примесей. Белые кристаллы чище, а поэтому, и стоят дороже.
Отгружают сыпучее вещество в мешках. Они могут быть из простой бумаги. Стандартные фасовки: 15, 25, 35 килограммов.
Из зарубежных производителей активными игроками на рынке становятся предприятия Индонезии. У них качественный продукт и конкурентноспособный ценник.
Стеариновая кислота и металл
Стеариновая кислота, известная в химическом мире как цетилуксусная или октодекановая кислота, относится к одноосновным насыщенным карбоновым кислотам алифатического ряда.

В виде глицеридов является важнейшей составляющей твердых жиров, преимущественно триглицеридов животного происхождения, которые выполняют функцию энергетического накопителя в организме животного. Стеариновая кислота синтезируется в животном организме из пальмитиновой кислоты под воздействием элонгаз – ферментов, ответственных за длину алифатической цепи. Она также находится в полужидких жирах, в частности в пальмовом масле, однако в значительно меньшем количестве, чем в жирах животного происхождения. В малых количествах эту кислоту можно встретить в некоторых видах нефти. Широкому кругу потребителей техническая стеариновая кислота известна также как стеарин, который представляет собой смесь стеариновой и пальмитиновой кислот.
Свойства продукта и технические характеристики
Стеариновая кислота CH3(CH2)16COOH, одноосновная карбоновая кислота алифатического ряда. Белые кристаллы, нерастворимые в воде, растворима в диэтиловом эфире. Стеариновая кислота была открыта в свином сале в 1816 году французским химиком Шеврелем.
Молекулярная масса 248,48 г/моль, плотность 0,94 г/мл, Температура плавления стеариновой кислоты составляет 69,6 0С, а температура кипения – 376,1 0С.
В нижеследующих таблицах кратко представлены требования к основным маркам стеариновой кислоты Т-18 и Т-32 (ГОСТ 6484-96). Приняв тот факт, что на всех производствах указанные технические требования соблюдаются, можно считать приведенные данные основными свойствами этого вещества.
РОССИЯ
Марка Т-32 ГОСТ 6484-96
Показатель
Марка Т-18 ГОСТ 6484-96
Помимо стеариновой кислоты отечественного производства на рынке также присутствует кислота импортного производства. В нижеследующих таблицах укажем основные требования и технические характеристики стеариновой кислоты из Китая и Малайзии.
МАЛАЙЗИЯ
Стеариновая кислота STEARIC ACID Palmera B1810
КИТАЙ
Стеариновая кислота SA 1801
Области применения стеариновой кислоты
В настоящее время стеариновая кислота используется в различных областях промышленности. Полифункциональный характер стеариновой кислоты позволяет использовать ее в качестве активатора ускорителей вулканизации, диспергатора наполнителей резиновых смесей, мягчителя (пластификатора). При непосредственном введении в каучук она улучшает распределение ингредиентов и обрабатываемость резиновых смесей. Склонность стеарина к миграции способствует снижению клейкости резиновых смесей.
Фармакопейная стеариновая кислота широко применяется в фармацевтической промышленности. В косметической промышленности стеариновая кислота используется в качестве структурообразующего и эмульгирующего компонента в кремах.
Стеариновую кислоту используют в аналитической химии при нефелометрическом определении кальция, магния и лития, а также качестве жидкой фазы в распределительной газо-жидкостной хроматографии для разделения смеси жирных кислот. При полировании металлов стеариновая кислота является компонентом полировальных паст.
Это соединение применяется не только в качестве функционального химиката, но и как химическое сырье. Например, для получения октадецилового (стеарилового) спирта, который употребляется как структурообразователь и эмолент в кремах и пеногаситель в моющих средствах. В промышленности стеариновая кислота используется также для синтеза октадециламина.
Производные и соли октадециламина применяются в качестве эмульгаторов и добавок к битумам в дорожном строительстве; флотоагентов прямой и обратной флотации при обогащении калийных и фосфоритных руд, полевого шпата, слюды; антислеживателей неорганических солей и удобрений; ингибиторов коррозии в кислых средах; деэмульгаторов необработанной нефти в нефтяной промышленности; компонентов антистатиков; отвердителей эпоксидных смол.
Из солей стеариновой кислоты применяют стеарат натрия как анионное ПАВ, в качестве моющего средства и компонента косметических изделий, загустителя смазок, стабилизатора при формовании полиамидов и антивспенивающей добавки в пищевой промышленности, а также стеарат кальция – в качестве загустителя смазок, стабилизатора поливинилхлорида и наружной смазки при формовании изделий из него, вспомогательного сиккатива и матирующего вещества в лакокрасочных материалах, гидрофобизатора для цемента и тканей, добавки, препятствующей слеживанию муки, эмульгатора для косметических препаратов. Кроме того, в производстве масляных лаков используется стеарат магния. Стеарат цинка применяют в медицине, производстве каучука, пластмасс и клеенки. Стеарат меди используется для бронзирования гипса и в качестве агента, препятствующего обрастанию. Стеарат свинца применяют в качестве сиккатива. Водорастворимые соли стеариновой кислоты, в частности стеараты натрия, калия и аммиака, являются мылами. Эфиры стеариновой кислоты применяют в качестве компонентов клеящих паст, антиоксидантов, эмульсий для обработки текстиля и кожи, стабилизаторов пищевых продуктов. Сложные эфиры стеариновой кислоты представлены этил- и бутилстеаратами, применяемыми в качестве пластификаторов, и гликольстеаратом, который используется как заменитель натурального воска.
Далее рассмотрим технология производства стеариновой кислоты.
Технология производства стеариновой кислоты
В настоящее время основным способом производства стеариновой кислоты в мире и в России остается гидролиз животных и растительных жиров, а также растительных масел. Основным сырьем при этом является пальмовое масло, кокосовое масло, рапсовое масло, стеариновую кислоту также можно выделять из соевого и подсолнечного масла.
Также перспективным возобновляемым источником сырья для получения стеариновой кислоты считается талловое масло – побочный продукт переработки крафт-целлюлозы. Сырое талловое масло в равных пропорциях содержит жирные и смоляные кислоты и в
меньших количествах, неомыляемые вещества. Очищенное талловое масло имеет повышенное содержание жирных кислот, в том числе ненасыщенных – линолевой (45–50%), олеиновой (30–35%) и насыщенных – стеариновой (10%) и пальмитиновой (5%).
Остановимся на основных методах получения стеариновой кислоты: гидролиз жиров и гидрирование непредельных кислот. Животные жиры – непревзойденные помощники в деле извлечения стеариновой кислоты. Для получения конечного продукта жир должен пройти обработку щелочными растворами, кислотой или просто водой при высокой температуре для расщепления глицеридов на глицерин и свободные кислоты, включая стеариновую.
Наиболее распространенный метод получения чистой стеариновой кислоты предполагает использование раствора щелочи. В результате образуется мыло, расщепляющееся под воздействием соляной или серной кислоты, затем смесь кипятится, пока выделившаяся смесь жирных кислот не сделается совершенно прозрачной. После охлаждения застывшую твердую массу промывают водой.
Технология производства стеариновой кислоты из растительных и животных жиров
В настоящее время производство стеариновой кислоты происходит на гидролизном цех, или так называемомй гидрозаводе. В качестве сырьевой базы используется подсолнечное или растительное неочищенное масло (или другие растительные или животные жиры). При использовании рапсового масла качество стеарина хуже – выше йодное число. На первой стадии производства сырье разделяют на фракции – жиры и воду. На второй стадии идет процесс образования соапстока, который затем насыщают водородом, в результате чего образуется саломас. При температуре 200°С и с помощью катализатора саломас расщепляют до воды и масла. Заключительная стадия предполагает извлечение стеарина из полученной жирной кислоты.
Технология производства стеариновой кислоты из нефтехимического сырья
В условиях роста спроса на стеариновую кислоту возникает проблема нехватки природного сырья, в связи с чем, растет популярность синтетических жирных кислот (СЖК), получаемых из нефтехимического сырья. Стеариновая кислота, полученная методом синтеза, является химически чистым продуктом и применяется в тех же областях, что и кислота полученная гидролизом растительных и животных жиров.
Одним из способов получения жирных кислот является синтез из олефинов в присутствии карбонила кобальта:
- гидрокарбоксилирование при 145–165°С и 5–30 МПа:
R-CH=CH2 + CO + H2O → RCH2CH2COOH;
- гидрокарбоалкоксилирование при 165–175°С и 5–15 Мпа с последующим гидролизом образующегося эфира:
R-CH=CH2 + СО + R’OH → RCH2CH2COOR’ → RCH2CH2COOH + R’OH.
Преимуществами этой технологии являются малостадийность и высокий выход кислот. Однако довольно жесткие условия и образование большого количества кислот изо-строения осложняют процесс. СЖК можно синтезировать также гидрокарбоксилированием олефинов в присутствии кислот, например, H2SO4, HF, ВF3, при 50–100°С, давлении 5–15 МПа. При использовании сокатализаторов (карбонилов Сu и Ag) реакцию можно вести при 0–30°С и 0,1 МПа. Получают в основном смеси кислот изостроения. Они отличаются низкими температурами плавления и кипения, высокой вязкостью, хорошей растворимостью. Недостаток метода – высокоагрессивная среда. СЖК фракции С12–С15, C16–С18 также получают методом оксосинтеза. На первой стадии с помощью гидроформилирования получают альдегиды, которые впоследствии могут быть превращены в спирты и/или окислены до жирных кислот. Получаемые кислоты содержат меньше побочных продуктов, чем кислоты, синтезируемые из парафинов. Однако данный способ в СНГ утратил свою актуальность в связи с отсутствием сырья и закрытием всех производств жирных спиртов.
В 1959 году в СССР было принято решение о внедрении в производство мыла на основе СЖК в качестве альтернативы природным жирным кислотам. В 1966 году мировой объем выпуска СЖК фракций С5–С30 составил 204,5 тыс. тонн, в том числе фракций С10 – С20 – 107,5 тыс. тонн. 14,9 тыс. тонн СЖК перерабатывалось в жирные спирты, которые впоследствии использовались при изготовлении синтетических моющих средств. Согласно некоторым данным, в СССР было запланировано в течение одной пятилетки произвести порядка 373 тыс. тонн СЖК. На то время основным способом получения СЖК в СССР было низкотемтературное жидкофазное окисление парафинов. Недостатки приведенного выше процесса: невысокий выход целевой фракции С10 – С20 (около 50% на сырье), низкое качество кислот, обусловленное присутствием до 3% побочных продуктов (дикарбоновых, кето- и гидроксикарбоновых кислот и др.).
А также большой объем сточных вод (до 8 м3 на 1 т кислот), загрязненных Na2SO4 и низкомолекулярными кислотами. В советские времена в России и Украине объемы выпуска синтетических жирных кислот исчислялись сотнями тысяч тонн. Однако в начале 90-х гг. волна повсеместного закрытия цехов по выпуску этой продукции охватила такие крупные промышленные предприятия, как Шебекинский химический завод (Белгородская область, Россия), Волгоградский НПЗ (Россия), Волгодонский НПЗ (Россия), «Омскнефтеоргсинтез» (Омская область, Россия), Надворненский НПЗ (Ивано-Франковская область, Украина) и Бердянский опытный нефтемаслозавод (Запорожская область, Украина). Последним, в 2001 году, было закрыто производство СЖК на предприятии ОАО «Уфанефтехим» (Республика Башкортостан, Россия). Ликвидация данных производств была обусловлена, прежде всего, нерентабельностью существующих технологий: низкое качество кислот, с присутствием до 3% побочных продуктов (дикарбоновых, кето- и гидроксикарбоновых кислот и др.), большой объем сточных вод (до 8 м3 на 1 т кислот), загрязненных Na2SO4 и низкомолекулярными кислотами. Кроме того, дефицитной является сырьевая база узких фракций С16 – С18. Сейчас уже можно сказать, что промышленное производство СЖК как в мире в целом, так и в странах Содружества в частности, кануло в Лету.
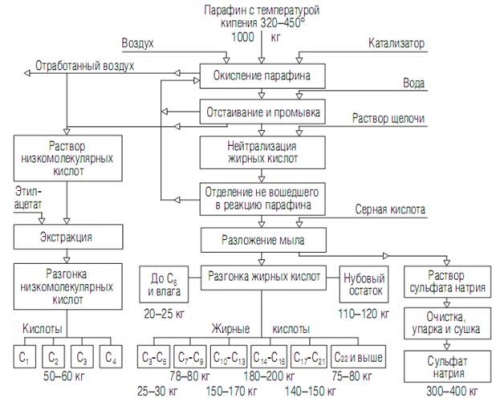
Ниже представлена принципиальная схема получения СЖК.
Принципиальная схема получения синтетических жирных кислот
Подробнее с текущей ситуацией и прогнозом развития российского рынка стеариновой кислоты можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков: «Рынок стеариновой кислоты в России».
Об авторе :
Академия Конъюнктуры Промышленных Рынков оказывает три вида услуг, связанных с анализом рынков, технологий и проектов в промышленных отраслях - проведение маркетинговых исследований, разработка ТЭО и бизнес-планов инвестиционных проектов.
• Маркетинговые исследования
• Технико-экономическое обоснование
• Бизнес-планирование
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Стеарат натрия: свойства, формула, реакции, применениеСтеарат натрия — это сложное вещество, соединение натрия и стеариновой кислоты. Стеарат обладает хорошими пенящими свойствами, проявляет себя как ПАВ, создавая густую и устойчивую пену. Его применяют в промышленной химии для создания моющих средств, шампуней, зубных паст. Натриевый стеарат – эмульгатор, стабилизатор и загуститель. Его вносят в пищевые продукты, чтобы добиться постоянства структуры и смешивания несмешиваемых ингредиентов. Вещество нашло применение в фармацевтической промышленности, где повышает растворимость действующего вещества, улучшая всасывание.
Что такое стеарат натрияСтеарат натрия – это органическое соединение, натриевая соль стеариновой кислоты. Другие названия стеарат натрия:
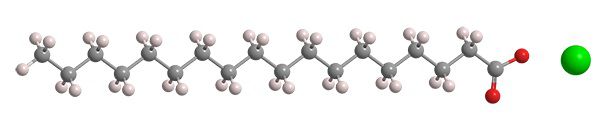
Химические и физические свойства обусловлены специфическим строение стеарата. Он состоит из двух структурных частей: отрицательно заряженной полярной карбоксильной группировки (карбоксилат), которая обуславливает гидрофильную активность – способность хорошо впитывать воду; а также положительно заряженной неполярной углеводной цепи, проявляющей гидрофобность, т.е. способность отталкивать воду. За счёт наличия компонентов, противоположных по свойствам, происходит образование мицелл. Мицеллами называют мельчайшие частички, плавающие в коллоидном растворе. По сути, они являются агрегатами поверхностно-активных веществ, они не растворяются и не оседают на дно. Это связано с амфифильностью, положительно заряженные структуры молекулы при этом находятся в центре, стремясь не соприкасаться с водой, а отрицательно заряженные выворачиваются наружу. Взвесь мицелл в воде образует мицеллярный раствор, мыльный раствор. Частички абсорбируют жиры и загрязнения, поэтому эффективно используются при производстве шампуней, гелей для душа, моющих средств. Физические свойства, внешний видОктадеканоат натрия – это синтетическое соединение, при нормальных условиях имеет вид бесцветных или беловатых мелких ромбических кристаллов с высокой гигроскопичностью. Насыпная плотность низкая. Склонен к образованию кристаллогидратов – молекулярных соединений, в которых катионы металла образуют прочную связь с водой. Стеарат не имеет вкуса и запаха, плохо растворим в воде комнатной температуры, но растворимость растёт с нагреванием. Наилучшая растворимость – в горячей воде. Растворим в неполярных растворителях, прежде всего, спиртах (этанол, метанол), а также в различных эфирах. Растворимость снижается в кислой среде, а также в присутствии металлов щелочноземельного ряда (Ca 2+ , Mg 2+ ): в так называемой «жесткой» воде. Минимальная температура для образования в мыльном растворе мицелл составляет 50-67 °С. В этом диапазоне наиболее ярко проявляются его очищающие свойства. Гидрофильно-липофильный баланс натриевого стеарата составляет 17,6 из 20. Этот показатель характеризует равновесие между гидрофобной и гидрофильной частями молекул, непосредственно влияющее на растворение в жидкости. Чем больше значение, тем лучше растворимость в воде. Температура плавления октадеканоата соды лежит в диапазоне от 278 °С до 290 °С, при этом точка возгорания вещества составляет 176 °С. Разлагается при температурном режиме, достигающем 300 °С. Формула, производство и получениеХимическая формула стеарата натрия: Рациональная формула соединения (формула, показывающая функциональные, химически активные группировки молекулы): В пространственном отношении стеарат представляет собой углеродную цепочку, состоящую из 16 атомов, с метальным радикалом (-CH3) и -COONa-группой, это карбоксильная группа (-COOH) с атомом натрия, который заместил водород.
Структурная формула стеарата натрия Стеарат натрия получают из раствора стеариновой кислоты. Она представляет собой органическую карбоновую кислоту, хорошо растворимую в эфирах и спиртах. Для синтеза октадеканоата натрия стеариновую кислоту растворяют в спирте. Спиртовой раствор имеет кислую реакцию за счёт карбоксильной группы, с ним проводят реакцию нейтрализации – реакция, в ходе которой кислота нейтрализуется (т.е. преобразуется в воду) за счёт взаимодействия с гидроксидом. Стеариновую кислоту нейтрализуют сильные щёлочи, например, едкий натр. В результате реакции образуется вода и стеарат натрия: Нейтрализация широко используется как в лабораторном, так и в промышленном синтезе. Она проста, характеризуется дешевизной реактивов и безотходностью, т.к. в качестве побочного продукта выделяется вода.
Молекула стеарата натрия Реакции со стеаратом натрия и химические свойстваСтеарат натрия относится к классу солей карбоновых кислот. Он вступает во взаимодействие с веществами, которые проявляют более сильные кислотные свойства, уступая им в ходе реакции: При реакции образуются другая кислота – стеариновая кислота, а также другая соль – сульфат натрия. Кроме того, стеарат натрия подвергается гидролизу, т.е. разложению водой с образованием новых соединений. В данном случае реакция идёт в обе стороны, т.е. она обратима: Натриевый стеарат подвержен реакции декарбоксилирования, т.е. сплавления со щелочами с отщеплением углекислого газа (CO2) из COOH-группы. Взаимодействие идёт при интенсивном нагреве, его также называют реакцией Дюма, в честь учёного, впервые открывшего этот процесс. Важной особенностью взаимодействия является наличие атома натрия, который заместил водород в функциональной группировке. Поэтому в качестве побочного продукта реакции не улетучивается углекислый газ, а образуется карбонат натрия: Из стеарата натрия получают углеводороды за счёт пропускания электрического тока. Происходит электролиз, приводящий к формированию высшего алкана – тетратриаконтана , а также углекислого газа, водорода и едкого натра. Реакция носит имя немецкого органического химика Германа Кольбе: Воздействие на организмСтеарат натрия является нетоксичным веществом и не оказывает негативного влияния на здоровье человека, его кожу, волосы, пищеварительную систему. В продуктах питания и лекарственных препаратах он находится в ничтожно малом количестве, которого достаточно для стабилизации среды. Натриевая соль стеариновой кислоты в моющих средствах и товарах личной гигиены не вызывает аллергии, чувство стянутости кожи, раздражения и зуда. Октадеканоат натрия абсолютно безопасен для людей и окружающей среды. ПрименениеОсновная сфера использования стеарата натрия – химическая промышленность. Он наряду с другими солями натрия является важным компонентом шампуней, мыла, жидкостей для посуды, гелей для душа и другого. Соединение обуславливает пенящие свойства этих товаров, высокую очищающую способность. Менее активно стеарата натрия применяется в пищевой отрасли, т.к. в продукты питания чаще добавляют стеарат магния. В небольших дозах октадеканоат натрия проявляет свойства стабилизатора и антивспенивающего агента. В фармацевтике актуально его внесения для смешивания несмешиваемых сред. Применение стеарата натрия в качестве моющего средства, моющие свойстваСтеарат натрия относится к поверхностно-активным веществам (ПАВ). Он способен снижать поверхностное натяжение воды, образуя адсорбционный слой, в котором концентрация молекул соединения крайне высока. Гидрофобная часть взаимодействует с источником загрязнения, который часто имеет липидную природу, присоединяясь к нему. При этом гидрофильная часть остаётся связанной с водой за счёт влаголюбивости. Таким образом вещество захватывает и утягивает с собой грязь и жир, работая как моющее средство. Другая сторона функций стеарата натрия заключается в разрывании связей между частицами загрязнений, образующих сплошную корку на поверхности. Это происходит за счёт ухудшения поверхностного натяжения этих фаз. Поэтому внесение октадеканоата натрия в состав жидкости для посуды позволяет отчищать стойкий налёт. Моющее действие стеарата натрия реализуется в несколько стадий:
Все три стадии работы стеарата натрия характеризуют его химические и физические особенности и нашли применение не только при производстве моющих средств и товаров для личной гигиены, но и в фармацевтической промышленности, где также необходимо повышать растворимость некоторых веществ в растворе и стабилизировать их. Применение стеарата натрия в пищевой промышленности, фармацевтике и других отраслях.В пищевой промышленности стеарату натрия присвоен код пищевой добавки Е470а. Применение стеарата натрия стабилизатором и эмульгатором, помогает при различных фазах смешивания, сохраняет нужную структуру и привлекательный товарный вид. Применение стеарата натрия осуществляется по множестве продуктов питания. Его можно найти в составе таких продуктов, как:
Пищевая добавка Е470а предотвращает слёживание и образование комочков в сыпучей продукции, делает её более устойчивой к поглощению влаги из воздуха. В то же время при растворении сухого порошка стеарат натрия выполняет роль стабилизатора, не позволяя ему оседать на дно. Для производства продуктов питания используется антивспенивающее действие натриевой соли стеариновой кислоты. Пеногаситель образует плёнку на поверхности вещества, тем самым не давая жидкости вспениваться. Пена может мешать при разливе готового изделия в тару, а также в процессе производства. Ухудшаются вкусовые качества и вид товара. Стеарат натрия не позволяет формироваться пенному слою. Применение стеарата натрия осущетвляется и в фармацевтической промышленности. В фармацевтике стеарат соды вводят в состав растворов, чтобы усилить растворимость веществ, изначально склонных к образованию осадков или дисперсий. Он выполняет здесь функции поверхностно-активного вещества. В косметологии применение стеарата натрия обусловлено тем, что октадеканоат соды является ключевой стабилизирующей добавкой дезодорантов, мицеллярной воды для снятия макияжа. Он входит в состав зубной пасты как эмульгатор и загуститель, способствуя поддержанию упругой структуры. Загущающие свойства обусловили применение стеарата натрия в производстве смазочных материалов. В пластмассовой промышленности он применяется как стабилизатор и смазывающее вещество при выпуске полиамидов. Где купить и сколько стоитСтеарат натрия продаётся заводами-производителями в оптовых количествах. Стоимость вещества от 160 рублей за килограмм, при этом минимальных заказ должен составлять не менее 25 кг. Натриевая соль стеариновой кислоты производится в России и странах СНГ, но большую часть рынка занимает китайский производитель. ЗаключениеСтеарат натрия – это поверхностно-активное вещество, соединение стеариновой кислоты с натрием, проявляет хорошие очищающие свойства. Оно используется для производства моющих средств, шампуней, мыла, зубных паст. Применяется также в пищевой промышленности как пищевая добавка Е407а, где играет роль эмульгатора, стабилизатора, антивспенивателя. Октадеканоат натрия – безопасное соединение, которое не вызывает аллергии и раздражения и не наносит вреда организму. С этим связано его повсеместное применение. Стабилизирующее действие важно для фармацевтики и производства пластмасс. Читайте также:
|