Степень переохлаждения металла зависит от
Обновлено: 28.09.2024
При значении температуры, равной ТS, жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная, или теоретическая, температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже значения температуры ТS. Температура, при значении которой практически начинается кристаллизация, называется фактической температурой кристаллизации (Τкр).
Охлаждение жидкости ниже значения равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения ΔΤ:
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждения).
Рассмотрим переход металла из жидкого состояния в твердое. При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Кристаллизация протекает в условиях, когда система переходит термодинамически к более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно описать с помощью кривых охлаждения в координатах время τ– температура Т (рис. 3.2).
Процесс кристаллизации чистого металла:
| Рис. 3.2. Кривая охлаждения чистого металла: Τтеор – теоретическая температура кристаллизации; Τкр.– фактическая температура кристаллизации |
Кристаллизация складывается из элементарных процессов – зарождения центров кристаллизации и роста кристаллов из этих центров. Скорость каждого из процессов зависит от степени переохлаждения (n = ΔΤ) жидкости относительно равновесной температуры т.е. температуры, при которой энергии Гиббса (свободная энергия) жидкого и кристаллического состояний равны. При n = 0 образование зародышей кристаллов (центров кристаллизации) невозможно, поскольку равен нулю движущий фактор процесса (разность энергий Гиббса жидкого и твердого состояний). С увеличением переохлаждения эта разность растет. При этом происходит увеличение скорости возникновения цен 
тров (числа центров – ЧЦ, имеет размерность 1/мм³·с) и скорости роста кристаллов (СК, есть скорость увеличения линейных размеров кристалла, размерность этой величины мм/с). Отметим, с увеличением n снижается диффузионная подвижность атомов, это вызывает
| Рис. 3.3. Зависимость числа центров кристаллизации (ЧЦ) и скорости роста кристаллов (СК) от степени переохлаждения |
Число центров кристаллизации ЧЦ и скорость роста кристаллов СК влияют на размер зерна, а следовательно, и на свойства металлов. При небольших значениях n (при малом ЧЦ и большой СК) образуются крупнозернистые структуры. С увеличением переохлаждения структуры измельчаются (ЧЦ возрастает быстрее, чем СК). Как правило, чем мельче зерно, тем выше механические свойства металлов и сплавов (особенно характеристики прочности и пластичности).
От степени переохлаждения зависит критический размер зародыша, т.е. такой минимальный размер, при котором рост зародыша сопровождается снижением энергии Гиббса системы. Зародыши мельче критического неспособны к росту и растворяются в жидкости. Чем больше степень переохлаждения жидкости, тем меньше критический размер зародыша.
Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела (рис. 3.4).
Зародыши с размерами, равными и большими критического rk, растут с уменьшением энергии и поэтому способны к существованию.
| Рис.3.4. Зависимость энергии системы от размера зародыша твердой фазы |

Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.

Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.3.5).
| Рис. 3.5. Кинетическая кривая процесса кристаллизации |
При кристаллизации кристаллы, окруженные со всех сторон жидкостью, имеют более или менее правильную геометрическую форму. При столкновении растущих кристаллов форма нарушается, становится неправильной, так как рост граней на участках соприкосновения прекращается. Такие искаженные кристаллы называют кристаллитами, или зернами. Таким образом, форма и размер образовавшихся в результате кристаллизации зерен определяются условиями столкновения растущих кристаллов.
Условиями для получения мелкозернистой структуры являются: максимальное число центров кристаллизации и малая скорость роста кристаллов. Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды. Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации. Искусственное введение в жидкий металл тугоплавких мелких частичек, служащих дополнительными центрами кристаллизации или влияющих на их образование, является наиболее прогрессивным методом регулирования размеров зерен, их формы, а следовательно, и, свойств металлов и сплавов и называется модифицированием.
По механизму воздействия различают:
1. Вещества, не растворяющиеся в жидком металле, выступают в качестве дополнительных центров кристаллизации.
2. Поверхностно-активные вещества, которые растворяются в металле и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
При какой (каких) температуре (температурах) возможен процесс кристаллизации?
В жидком металле(МL) при высоких t0 атомы находиться в беспорядочном движении. Правильное кристаллическое строение МL приобретают в процессе затвердения, т.е. при переходе из жидкого состояния в твердое.
Процесс образования кристаллов при переходе вещества из жидкого состояния в твердое называется ПЕРВИЧНОЙ КРИСТАЛЛИЗАЦИЕЙ.
Процесс изменения кристаллического строения вещества в твердом состоянии называется ВТОРИЧНОЙ КРИСТАЛЛИЗАЦИЕЙ.
Как всякий спонтанный процесс, кристаллизация протекает при термодинамических условиях, обеспечивающих снижение свободной энергии Гиббса системы F:
где U – внутренняя энергия, T – температура, S – энтропия.
Температура
Температура, при которой свободная энергия в твердом и жидком состояниях равна, называется равновеснойили теоретической температурой кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс сопровождался уменьшением свободной энергии. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения (DТ):
Степень переохлаждения зависит от природы металла, от степени его загрязнения (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждения).
Для изучения кристаллизации строят кривые охлаждения, которые показывают изменения t 0 c течением времени по мере охлаждения расплавленного ML.
| ТКР |
| ТКР |
| ТКР |
| V3 |
| V2 |
| Т, °С |
| t, время |
| Тs равновесная тем-ра кристаллизации |
| V1 |
До точки ТКР охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На горизонтальном участке идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсируется рассеиванием теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Кристаллизация складывается из двух процессов – зарождения центров кристаллизации и роста кристаллов из этих центров. Скорость каждого из процессов зависит от степени переохлаждения. При DТ = 0 образование зародышей кристаллов невозможно, т.к. равна нулю разность энергий Гиббса жидкого и твердого состояний. С увеличением переохлаждения эта разность растет, вызывая увеличение скорости возникновения центров (числа центров – ч.ц.) и скорости роста кристаллов (с.к.).
При небольших значениях DТ (при малых величинах ч.ц. и больших с.к.) образуются крупнозернистые структуры. С увеличением переохлаждения структуры измельчаются (ч.ц. возрастает быстрее, чем с.к.)
От степени переохлаждения зависит критический размер зародыша, т.е. такой минимальный размер, при котором рост зародыша сопровождается снижением энергии Гиббса. Зародыши мельче критического к росту не способны и растворяются в жидкости.
При охлаждении жидкого металла атомы его в отдельных местах начинают группироваться образуя отдельные центры кристаллизации.
Вокруг отдельных центров кристаллизации начинают расти кристаллы.
В начале кристаллы растут свободно, т.к. со всех сторон их окружает жидкий металл. Затем они присоединяются друг к другу и начинают расти там, где еще есть жидкий металл.
Кристаллы присоединяются друг к другу и несмотря на их правильное строение получают неправильную внешнюю форму. Кристаллы неправильной формы называются зернами или кристаллитами.
От величины образования зерен, их формы и расположения зависят свойства металла.
Металлы и сплавы с мелкозернистым строением имеют более высокую прочность и лучшую сопротивляемость ударным нагрузкам.
Схема процесса кристаллизации
В реальных условиях форма и размер образующихся кристаллов, помимо условий столкновения, зависят от направления и скорости отвода теплоты, температуры жидкого металла, вида и количества примесей. Нередко при кристаллизации возникают разветвленные древовидные кристаллы, называемые дендритами.
Вопросы теста:
С.к.
Ч.к. с.к.
Ч.к.
a) Любую. Характер структуры мало зависит от степени переохлаждения
Виды сплавов
Сплав – это вещество, полученное сплавлением двух и более компонентов, и состоящее из одной или нескольких фаз, образующих различные структуры.
Компонент – химически индивидуальное вещество, т.е. вещество которое может быть выделено из системы и существовать вне ее. Компонентами могут быть чистые металлы или неметаллы, а также химические соединения.
Фаза – совокупность гомогенных частей системы, одинаковых по составу, химическим и физическим свойствам, и отделенных от других частей системы поверхностью раздела, при переходе через которую структура и свойства изменяются скачкообразно.
Структура – строение сплава, видимое в микроскоп, т.е. взаимное расположение фаз, их форма и размер (зерна).
В сплаве могут образовываться следующие фазы: расплав (жидкий раствор), твердые растворы, механические смеси, химические соединения.
В твердых растворах компоненты растворяются друг в друге не только в жидком, но и в твердом состоянии. Микроструктура таких сплавов состоит из однородных зерен, имеющих кристаллическую решетку элемента растворителя. Обозначают твердые растворы греческими буквами α, b, g.Аббревиатура вида А(В) означает твердый раствор, состоящий из компонентов А и В, причем компонент В растворен в кристаллической решетке компонента А.
Механические свойства твердых растворов нелинейно зависят от соотношения компонентов. Они могут быть существенно выше (ниже) свойств любого из образующих сплав компонентов.
Твердые растворы могут быть растворами замещения и растворами внедрения. В растворах замещения атомы растворенного элемента замещают атомы элемента-растворителя в узлах его кристаллической решетки, в растворах внедрения – внедрены в межузельное пространство. Растворы замещения могут быть ограниченными и неограниченными (непрерывными).

а) твердый раствор замещения; б) твердый раствор внедрения
В кристаллической решетке неограниченных твердых растворов А(В) атомы растворенного элемента В могут полностью заменить атомы растворителя А. В данном случае невозможно установить какой из элементов является растворителем, а какой растворенным веществом. Поэтому аббревиатура неограниченных растворов А(В) и В(А) идентичны.
При образовании механических смесей компоненты химически не взаимодействуют и не растворяются друг в друге. Металлографический анализ структуры обнаружит зерна каждого из входящих в состав сплава компонентов. Механические свойства смесей линейно зависят от соотношения компонентов и являются промежуточными между свойствами чистых компонентов.
Сплав – химическое соединение образуется при определенном соотношении компонентов. Ему может быть приписана химическая формула АmВn , где m и n – количество атомов компонентов А и В, образующих соединение. Химические соединения имеют следующие характерные особенности:
Ø Кристаллическая решетка, отличная от решеток элементов, образующих соединение;
Ø Атомы в решетке химического соединения расположены упорядоченно;
Ø Кратное весовое соотношение компонентов (АmВn);
Ø Резкое отличие механических свойств соединения от свойств элементов, образующих соединение;
Ø Имеют постоянную температуру плавления;
Ø Образование химического соединения сопровождается значительным тепловым эффектом.
Вопросы теста:
Теория сплавов
Кристаллизация металлов
При какой (каких) температуре (температурах) возможен процесс кристаллизации?
Теоретические основы процесса кристаллизации металлов
Процесс образования кристаллов называется кристаллизацией. Визуальное изучение кристаллизации металлов сопряжено с техническими трудностями. Поскольку законы кристаллизации растворов солей и расплавленных металлов сходны, изучение процесса кристаллизации можно проводить на растворах солей.
Согласно законам термодинамики, устойчивым состоянием при определённых внешних условиях будет то состояние, которое обладает меньшим уровнем свободной энергии. Под свободной энергией понимают часть внутренней энергии, которая может быть превращена в работу. При изменении внешних условий (например, при понижении температуры) любая система самопроизвольно стремится к состоянию с наименьшим уровнем свободной энергии.

Рис. 2.1. Изменение свободной энергии жидкого Gж и твёрдого Gт состояния в зависимости
от температуры: Ткр − фактическая температура кристаллизации, То − теоретическая
(равновесная) температура кристаллизации и плавления, ΔТ − степень переохлаждения,
Тпл − фактическая температура плавления, ΔТ ' − степень перегрева
С изменением температуры свободная энергия жидкого Gж и твёрдого Gт состояния изменяется по разным законам (рис. 2.1). При высоких температурах жидкое состояние обладает меньшей свободной энергией, поэтому металл при этих температурах находится в жидком состоянии (области III, IV). При охлаждении металл достигнет температуры Т0, при которой свободные энергии жидкого и твёрдого состояния равны. Эта температура Т0 носит название теоретической (равновесной) температуры кристаллизации при охлаждении и температуры плавления при нагреве.
При Т0 процесс кристаллизации протекать не может. Для развития процесса кристаллизации надо создать условия, при которых свободная энергия твёрдого состояния будет меньше, чем свободная энергия жидкого состояния. Это возможно лишь при охлаждении ниже Ткр, т. е. ниже теоретической температуры кристаллизации на некоторую величину ΔТ. В области II металл при охлаждении продолжает оставаться в жидком состоянии, поскольку разность (Gж – Gт) невелика и температура не достигла критического значения Ткр при котором твёрдое состояние обладает меньшей свободной энергией. При достижении Ткр разность (Gж – Gт) увеличивается, поэтому оставаться дальше в жидком состоянии металл не может, и при этой температуре в металле самопроизвольно начинается процесс кристаллизации.
В области I (рис. 2.1) металл будет находиться в твердом состоянии. Температура Ткр носит название фактической температуры кристаллизации, а разность между теоретической и фактической температурами степенью переохлаждения. Таким образом, кристаллизация может протекать лишь в условиях переохлаждения ниже теоретической температуры кристаллизации.
Для развития процесса плавления необходима некоторая степень перегрева:
где Тпл – фактическая температура плавления.
Д. К. Чернов ещё в 1878 году показал, что кристаллизация складывается из двух элементарных процессов (рис. 2.2). Первый процесс заключается в образовании из жидкого раствора мельчайших кристаллических частиц-зародышей или центров кристаллизации. Интенсивность этого процесса определяется числом зародышей ЧЗ, возникающих в единице объёма (1 мм 3 ) за единицу времени (1 с). Второй процесс состоит в росте кристаллов из зародышей. Интенсивность этого процесса определяется скоростью кристаллизации (СК) – линейным перемещением грани кристалла (в миллиметрах) в единицу времени (1 с).

Рис. 2.2. Последовательные этапы процесса кристаллизации
Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов. В месте соприкосновения кристаллов рост отдельных их граней прекращается и развиваются не все, а только некоторые грани кристаллов. В результате кристаллы не имеют правильной геометрической формы и называются кристаллитами или зернами.
Процессы образования зародышей и роста кристаллов протекают одновременно, причём интенсивность их зависит от степени переохлаждения. При данной степени переохлаждения величины ЧЗ и СК – постоянные в течение всего времени процесса кристаллизации.
Размер полученных кристаллов N зависит от соотношения ЧЗ и СК при данной степени переохлаждения и выражается формулой
где α − коэффициент пропорциональности.
При малой степени переохлаждения ΔТ1 (рис. 2.3) кристаллы после затвердевания будут крупными, так как ЧЗ мало, а СК велика. При большой степени переохлаждения ΔТ2 кристаллы будут мелкими, так как кристаллизация в этом случае идёт при почти той же СК, что и в первом случае, но при значительно большем ЧЗ.
Таким образом, изменяя степень переохлаждения, можно получить кристаллы разной величины.

Рис. 2.3. Зависимость ЧЗ и СК от степени переохлаждения при кристаллизации металлов
Степень переохлаждения зависит от скорости охлаждения. Чем больше скорость охлаждения, тем больше степень переохлаждения и мельче кристаллы. В реальных условиях затвердевания больших масс металла на процесс кристаллизации, размер и форму кристаллов оказывают влияние и другие факторы: твёрдые взвешенные тугоплавкие частицы примесей, инородные тела, газовые включения, теплоёмкость самого металла, направление отвода тепла, конвекционные потоки в жидком металле, температура заливаемого металла и формы, способы заливки, состояние поверхности изложницы (формы) и другие.
Форма растущих кристаллов определяется не только условиями их столкновений между собой, но и составом сплава, наличием примесей и условиями охлаждения. В большинстве случаев при кристаллизации металлов механизм образования кристаллов носит так называемый дендритный характер.
Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях решетки, которые имеют наибольшую плотность упаковки атомов (минимальное межатомное расстояние). В этих направлениях образуются длинные ветви будущего кристалла − так называемые оси первого порядка (I на рис. 2.4).

Рис. 2.4. Схема дендритного роста кристалла
В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называют осями второго порядка (II), от осей второго порядка растут оси третьего порядка (III) и т. д.
По мере кристаллизации образуются оси более высокого порядка (четвертого, пятого, шестого и т. д.), которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
Если жидкого металла не хватает для заполнения межосных пустот, то древовидная форма кристаллов сохраняется. Такие дендриты можно обнаружить в усадочных раковинах и на свободной поверхности слитков. Если жидкого металла достаточно для заполнения межосного пространства, то образуются крупные кристаллы, вытянутые в направлении главного теплоотвода. Такие кристаллы называются столбчатыми.
При равномерном теплоотводе, а также при большом числе зародышей, кристаллы растут с одинаковой скоростью по всем направлениям и вырастают равнооcными.
Процесс кристаллизации слитка спокойной стали (рис. 2.5а) начинается у стенок изложницы и последовательно продвигается к центру слитка.


Рис. 2.5. Строение стального слитка: а – реальный слиток стали;
б – схема строения слитка: 1 – мелкие равноосные кристаллы; 2 – столбчатые кристаллы;
3 – крупные равноосные кристаллы
У стенок изложницы (рис. 2.5б) образуется зона 1 − зона мелких равноосных, беспорядочно направленных кристаллов. Мелкие кристаллы получаются благодаря быстрому охлаждению ещё холодной стенкой прилегающих слоев жидкой стали.
Поэтому кристаллизация здесь идёт при большой степени переохлаждения, при большом числе зародышей. Кристаллы получаются равноосными, беспорядочно направленными, потому что оси первого порядка растут перпендикулярно неровностям внутренней поверхности изложницы. Растущие кристаллы сталкиваются между собой и образуют зону мелких дезориентированных кристаллов.
Следующая зона 2 − зона столбчатых крупных кристаллов, главная ось которых перпендикулярна стенке изложницы. Кристаллы получаются крупными, так как в этой зоне скорость охлаждения меньше, чем в зоне 1, потому что тепло отводится не холодной стенкой, а через зону 1 и уже нагревшуюся стенку изложницы. Кристаллизация идёт с меньшей степенью переохлаждения и с меньшим числом зародышей.
Кристаллы вытянуты главной осью перпендикулярно стенке изложницы, так как в этом направлении идет главный теплоотвод. В центре слитка образуется зона 3 − зона крупных равноосных кристаллов. В этой части слитка скорость охлаждения меньше, чем в зонах 1 и 2, поэтому кристаллизация идет при малой степени переохлаждения, при малом числе зародышей. Кристаллы этой зоны получаются равноосными, произвольно ориентированными, так как отвод тепла идет во всех направлениях с одинаковой скоростью. Скелетом этих крупных кристаллов являются дендриты (рис. 2.5а).
Кристаллизация солей
В данной работе студенты изучают процесс кристаллизации четырёх солей: нитрата свинца Рb(NO3)2, хлорида аммония NH4Cl, дихромата калия К2Сr2O7 (хромпик), хлорида натрия NaCl (поваренная соль), вызванный испарением растворителя.
Водные растворы этих солей приготавливаются почти насыщенными с тем, чтобы незначительное испарение воды привело их к состоянию перенасыщения и выделению кристаллов.
Наблюдение за процессом кристаллизации солей производится с помощью биологического микроскопа, работающего по принципу проходящего света (рис. 2.6). Лучи от естественного источника света, отразившись от зеркала микроскопа, проходят через отверстие предметного столика, предметное стекло, каплю соли и попадают в объектив. Полученное в объективе изображение капли увеличивается им и окуляром. Пройдя через окуляр, лучи попадают в глаз наблюдателя. Наблюдение за кристаллизацией капель в этой работе проводится при увеличении, но более чем
в 100 раз.
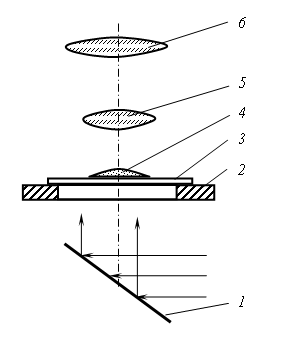
Рис. 2.6. Схема хода лучей в биологическом микроскопе:
1 – зеркало; 2 – предметный столик; 3 – предметное стекло; 4 – капля соли; 5 – объектив; 6 – окуляр
Порядок выполнения работы
1. Глядя в окуляр, вращать зеркало микроскопа, добиваясь яркого освещения (получить светлое поле).
2. Предметное стекло с нанесенной на него каплей соли установить на предметный столик так, чтобы капля была в центре отверстия предметного столика.
3. Произвести грубую настройку на фокус, для чего смотреть одним глазом в окуляр и, держа второй глаз открытым, вращать винт грубой подачи, поднимая тубус до тех пор, пока не появится изображение капли.
4. Вращением микрометрического винта произвести тонкую настройку на фокус.
5. Перемещать предметное стекло по предметному столику, наблюдая за кристаллизацией сначала у краёв капли, а затем в центре капли.
6. По мере появления кристаллов производить зарисовку в журнал, передавая при этом особенности их строения.
7. Исследование начинать с капли нитрата свинца, так как его кристаллизация идёт аналогично кристаллизации слитка спокойной стали.
Наибольшее испарение возникает у краёв капли, так как тут уровень жидкости наименьший, а концентрация соли раньше, чем в других местах, достигает предела насыщения. Здесь образуются мелкие равноосные кристаллы. Они настолько мелкие, что при используемом в данной работе увеличении каждый кристалл невиден, и эта зона чаще всего просматривается в виде тонкой тёмной линии (рис. 2.7).
Затем начинают образовываться крупные, вытянутые нормально к краям капли столбчатые кристаллы. Здесь кристаллизация идёт при большой скорости и ограниченном числе зародышей.
В последнюю очередь кристаллизация идёт в центре капли, где образуются крупные кристаллы, имеющие форму дендритов.
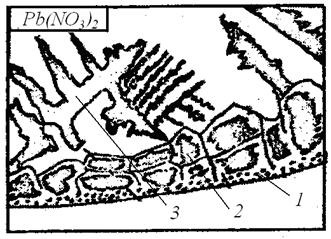
Рис. 2.7. Строение затвердевшей капли раствора нитрата свинца:
1 – мелкие равноосные кристаллы, 2 – крупные вытянутые кристаллы, 3 – дендриты
3. Контрольные вопросы
1. На рис. 2.1 укажите:
· теоретическую температуру кристаллизации (плавления) металла;
· фактическую температуру кристаллизации (плавления) металла;
· необходимое условие, при котором начнётся процесс кристаллизации (процесс плавления) металла;
·а) жидком при охлаждении;
б) твёрдом при охлаждении;
в) твёрдом при нагреве;
г) жидком при нагреве.
2. На рис. 2.3 укажите, при какой величине переохлаждения металл закристаллизуется наиболее крупнозернистым (наиболее мелкозернистым).
3. Укажите среду закристаллизовавшегося раствора соли: а) Рb(NO3)2,
б) NH4Cl; в) К2Сr2O7; г) NaCl. Объясните особенности её строения.
4. Укажите форму и схему строения закристаллизовавшейся капли водного раствора соли, схожую со структурой слитка спокойной стали. Объясните особенности ее строения.
Кристаллизация металлов
Схема роста кристаллов показана на рис. 2. Кристалл растет в направлении, противоположном отводу тепла. Сначала образуется главная ось кристалла 1, затем на главной оси образуются оси первого порядка 2, на них – оси второго порядка 3, на них – оси следующего порядка и т. д., пока в этом объеме есть жидкий металл.
Атомы жидкости пристраиваются к атомам кристаллов, создавая их форму и обеспечивая их рост. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму до момента их соприкосновения. В месте соприкосновения кристаллов рост их отдельных осей и граней прекращается. В результате к окончанию процесса кристаллизации кристаллы не имеют правильной геометрической формы, но сохраняют свое древовидное строение. Кристаллы древовидной формы называются дендритами (см. рис. 2).
Дендритное строение – признак литого состояния металла (слиток, отливка). При значительной пластической деформации литого металла форма и размеры кристаллов изменяются – дендриты дробятся, из них образуются новые кристаллы неопределенной формы, называемые зернами (рис. 3). Зернистое строение – признак деформированного металла (прокат, поковки, штампованные полуфабрикаты).
Рис. 2. Дендритная кристаллизация: а – схема дендритного строения
по Чернову; б – схема кристаллизации слитка; дендриты: Чернова (в),
на поверхности сурьмы (г) и алюминия (д)
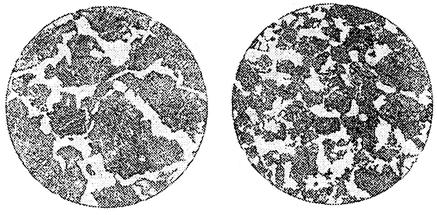
Рис. 3. Микроструктура доэвтектоидной стали:
а – крупнозернистая; б – мелкозернистая
Размер кристаллов металла во многом определяет его прочностные свойства: чем мельче кристаллы, тем выше сопротивление металла ударным и циклическим нагрузкам. Итак, в процессе кристаллизации два фактора определяют строение металла: число центров кристаллизации и скорость роста кристаллов из этих центров.
Проследим за изменением температуры металла при охлаждении жидкости через равные промежутки времени (рис. 4). Сначала температура жидкого металла понижается равномерно в зависимости от скорости охлаждения V1, V2, V3. Затем понижение температуры прекращается и на кривой охлаждения появляется горизонтальный участок (площадка). В это время отвод тепла компенсируется выделением скрытой теплоты кристаллизации и металл переходит в твердое состояние (образуются и растут кристаллы). После окончания кристаллизации температура вновь равномерно понижается, металл охлаждается в твердом состоянии.
При теоретической температуре кристаллизации (температуре плавления) жидкий металл и твердые кристаллы могут существовать одновременно и бесконечно долго. Следовательно, кристаллизация может происходить только при определенном переохлаждении металла ниже теоретической (равновесной) температуры. Разность между теоретическим и фактическим значениями температуры кристаллизации металла называется степенью переохлаждения:
где Тпл – теоретическая (равновесная) температура кристаллизации (плавления) металла;
Тк – фактическая температура кристаллизации данного металла.
Степень переохлаждения металла зависит от скорости охлаждения V1, V2, V3 (см. рис. 4).
Скорости охлаждения V1 соответствует малая степень переохлаждения DТ1. Охлаждение расплава со скоростью V2 вызывает увеличение степени переохлаждения DТ2, а большая скорость охлаждения V3 приведет к увеличению степени переохлаждения DТ3, и кристаллизация будет происходить при более низкой температуре. В итоге это скажется на факторах процесса кристаллизации:
Vохл ®DТ®ЧЦК – СРК, (2)
где ЧЦК – число центров кристаллизации;
СРК – скорость роста кристаллов из этих центров.
Однако не всегда имеется возможность регулировать скорость охлаждения жидкого металла. Методом получения мелких кристаллов при затвердевании металла является создание искусственных центров кристаллизации. Для этого в расплавленный металл вводят специальные вещества, называемые модификаторами. Процесс искусственного регулирования количества и размеров кристаллов называется модифицированием.
Читайте также:
