Степени окисления амфотерных металлов
Обновлено: 04.05.2024
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
Элементы с постоянными степенями окисления в сложных соединениях:
| Степень окисления | Элементы | Примеры соединений | Названия соединений |
|---|---|---|---|
| -1 | F | NaF OF2 | Фторид натрия Фторид кислорода |
| +1 | Все металлы 1-ой группы главной подгруппы (Li-Fr) | Na2O KH | Оксид натрия Гирид калия |
| +2 | Все металлы 2-ой группы главной подгруппы (Be-Ra), а также Zn и Cd | BeO CaH2 | Оксид бериллия Гидрид кальция |
| +3 | Al | Al2O3 Al(OH)3 Al2(SO4)3 | Оксид алюминия Гидроксид алюминия Сульфат алюминия |
Элементы с переменными степенями окисления:
1. Водород
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | H2 | Водород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| +1 | H2O H2O2 H2SO4 KOH NaHSO3 | Вода Пероксид водорода Серная кислота Гидроксид калия Гидросульфит натрия | В таких соединениях, как вода, пероксид водорода, все кислоты, основания, кислые соли, все органические соединения |
| -1 | NaH CaH2 | Гидрид натрия Гидрид кальция | Только с металлами водород может проявлять степень окисления -1 |
2. Кислород
Положительные степени окисления кислород проявляет только в соединениях с фтором
3. Сера
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | S8 | Сера | Светло-желтый порошок; нерастворим в воде, тяжелее её, но в воде не тонет, плавает на её поверхности, так как ею не смачивается. Молекулы S8 образуют молекулярную кристаллическую решетку. Сера существует в виде нескольких аллотропных модификаций: ромбическая, моноклинная, пластическая. |
| -2 | H2S CaS | Сероводородная кислота Сульфид кальция | Все сульфиды |
| -1 | FeS2 | Персульфид железа (II) (пирит, серный колчедан, железный колчедан) | Единственное соединение со ст. ок. -1 |
| +4 | SO2 H2SO3 CaSO3 | Оксид серы (IV) Сернистая кислота Сульфит кальция | В таких соединениях как оксид серы (IV), сернистой кислоте и всех её солях |
| +6 | SO3 H2SO4 CaSO4 | Оксид серы (VI) Серная кислота Сульфат кальция | В таких соединениях как оксид серы (VI), серной кислоте и всех её солях |
4. Азот
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | N2 | Азот (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -3 | NH3 Na3N Ca3N2 | Аммиак Нитрид натрия Нитрид кальция | В таких соединениях, как аммиак и все нитриды |
| -2 | N2H4 | Гидразин | Степени окисления -2 и -1 встречаются только в органических соединениях |
| -1 | NH2OH | Гидроксиламин | |
| +1 | N2O | Оксид азота (I) | Азот проявляет положительные степени окисления только в соединениях с кислородом и фтором |
| +2 | NO | Оксид азота (II) | |
| +3 | N2O3 HNO2 NF3 | Оксид азота (III) Азотистая кислота Фторид азота (III) | В таких соединениях, как оксид азота (III), азотистой кислоте и всех её солях, фториде азота (III) |
| +4 | NO2 | Оксид азота (IV) | Смешанный оксид азота (IV) |
| +5 | N2O5 HNO3 | Оксид азота (V) Азотная кислота | В таких соединениях, как оксид азота (V), азотной кислоте и всех её солях |
5. Галогены*
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
6. Углерод**
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | C | Углерод | Аллотропные модификации: алмаз, графит, карбин (черный порошок, полимерные цепи -CC-, =С=С=), фуллерены (темные, похожие на сажу, C60-C200) |
| +2 | CO | Оксид углерода (II) (угарный газ) | В таких соединениях как CO, а также в некоторых органических соединениях |
| +4 | CO2 |
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных солей
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Какие оксиды называют амфотерными?
К амфотерным относят в основном оксиды металлов +3 и +4 степени окисления, но также можно встретить амфотерные оксиды и в степени окисления «+2».
Таблица 1. – Примеры амфотерных оксидов в различных степенях окисления
В таблице представлены лишь самые популярные примеры оксидов, встречающихся на ЕГЭ, многие другие оксиды при различных условиях реагируют как со щелочами, так и с кислотами.
Подробнее о классификации оксидов можно узнать в статье Классификация оксидов
Химические свойства амфотерных оксидов
- Амфотерные оксиды проявляют свойств основных оксидов в реакции с кислотами:
- Амфотерные оксиды проявляют основность при реакции с кислотными оксидами:
- Амфотерные оксиды проявляют свойства кислотных оксидов при взаимодействии со щелочами (растворимыми основаниями). При этом реакция осуществима как в растворах с концентрированными щелочами, так и при сплавлении.
В растворах:
Полученную соль называют тетрагидроксоцинкат натрия
Полученную соль называют тетрагидроксоалюминат натрия.
Формула полученной соли зависит от количества воды и щелочи, вступивших в реакцию, так в избытке щелочи образуется гексагидроксоалюминат, а не тетрагидроксоалюминат:
При сплавлении:
Полученная соль называется цинкат натрия.
Полученная соль называется алюминатом калия (метаалюминат)
В следующих таблицах приведены некоторые средние и комплексные анионы, в состав которых входят амфотерные металлы.
Таблица 2. – Анионы, содержащие амфотерные металлы в валентности II.
Таблица 3. – Анионы, содержащие амфотерные металлы в валентности III.
Соли с координационным числом «6» образуются в сильном избытке щелочи.
Таблица 4. – Наиболее распространенные ионы, содержащие амфотерные металлы в валентности IV.
Пользуясь данными таблицами, можно назвать многие соли, например, средние соли:
KAlO2 – алюминат калия
NaAlO2 – алюминат натрия
BaZnO2 – цинкат бария
CaBeO2 – бериллат кальция
K2PbO2 – плюмбит калия, содержит свинец (II)
BaPbO2 – плюмбит бария
K4PbO4 – плюмбат (ортоплюмбат) калия, содержит свинец (IV)
KCrO2 – хромит калия
NaFeO2 – феррит натрия
И комплексные соли:
K[Al(OH)4] – тетрагидроксоалюминат калия
K3[Al(OH)6] – гексагидроксоалюминат калия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Ca[Zn(OH)4] – тетрагидроксоцинкат кальция
K2[Be(OH)4] – тетрагидроксобериллат калия
Ba[Be(OH)4] – тетрагидроксобериллат бария
Na2[Pb(OH)4] – тетрагидроксоплюмбит натрия
Na2[Pb(OH)6] – гексагидроксоплюмбат натрия
Ca[Sn(OH)6] – гексагидроксостаннат кальция
Na[Cr(OH)4] – тетрагидроксохромит натрия
K3[Cr(OH)6] – гексагидроксохромит калия
Ca3[Cr(OH)6] – гексагидроксохромит кальция
Na3[Fe(OH)6] – гексагидроксоферрит натрия
Как составлять формулы безводных солей?
Например, в реакции участвовал оксид свинца IV и оксид кальция:
В первую очередь необходимо знать остатки соответствующих кислот, следовательно и формулы кислот, содержащих амфотерный металл. И хоть многие из них не выделены, теоретически мы можем установить их формулы. Для амфотерных металлов в III и IV валентности можно установить орто- и мета-формулы кислот. Для металлов в II валентности выделяют только одну форму кислоты, поэтому для них не указывают уточняющую приставку «орто-» или «мета-», а вывод формулы соответствует выводу как орто- так и мета-формул кислот и их остатков у металлов в III и IV валентности.
Орто-формула соответствует гидроксиду амфотерного металла с учетом того, что в кислоте порядок элементов меняется (водород должен стоять на первом месте).
Таблица 5. – Амфотерные оксиды и кислотные остатки, соответствующие им
Для амфотерных металлов в III валентности можно выделить общую формулу орто-кислоты и орто-аниона: H3MeO3 и MeO3 3- .
Для амфотерных металлов в IV валентности можно выделить общую формулу орто-кислоты и орто-аниона: H4MeO4 и MeO4 4- .
Таким образом, в реакции оксида свинца IV и оксида кальция можно получить ортоплюмбат кальция:
PbO2 + 2CaO = Ca2PbO4 (ортоплюмбат кальция)
Для этих же металлов можно вывести мета-формулы кислот и их остатков, для этого при образовании формулы используются наименьшие значения индексов. Так, формула орто-хромистой кислоты, как и любого другого гидроксида в кислотной форме, начинается с водорода, а заканчивается кислородом, степень окисления хрома «+3» учитывается при установке индексов:
Подробнее о таком способе можно прочитать в статье Свойства кислотных оксидов
Таким образом, оксиду алюминия и оксиду свинца IV соответствуют следующие мета-формулы:
Таблица 6. – Амфотерные оксиды и кислотные остатки, соответствующие им
Поэтому в реакции между оксидом кальция и диоксидом свинца может образоваться и метаплюмбат кальция.
- Амфотерные оксиды проявляют свойства кислотных в реакциях с основными оксидами. Реакция происходит при сплавлении:
ZnO + CaO = CaZnO2 – цинкат кальция
Al2O3 + SrO = Sr(AlO2)2 – алюминат (метаалюминат) стронция
- Амфотерные оксиды способны вытеснять летучие оксиды из солей:
- Как и многие другие нерастворимые оксиды, амфотерные оксиды реагируют с восстановителями (C, CO, H2, NH3, CH4, более активные металлы). Реакции идут только при нагревании.
Получение амфотерных оксидов
- Термическое разложение амфотерных гидроксидов:
Данная реакция не подходит для получения оксида железа III, так как при окислении железа образуется двойной оксид Fe3O4.
- Термическим разложением нитратов. Причем, если в состав катиона входит металл с переменной степенью окисления, в продукте его степень окисления может измениться:
Оксиды хрома и железа в III валентности разлагаются без изменения степени окисления металла:
Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей
Амфотерные гидроксиды проявляют свойства как основных, так и кислотных гидроксидов в зависимости от среды.
Большинство металлов периодической системы могут образовывать амфотерные гидроксиды, чаще всего это гидроксиды металлов в степени окисления «+2» и «+3», а также, теоретически, гидроксиды металлов в степени окисления «+4», хотя большинство из них не выделены (для них существуют только соответствующие соли). Подробнее о классификации гидроксидов можно прочитать в статье «Классификация гидроксидов и оснований»
Химические свойства амфотерных гидроксидов
- Как уже было сказано выше, амфотерные гидроксиды ведут себя как типичные основания при реакции с кислотами:
- Амфотерные гидроксиды реагируют с твёрдыми щелочами при сплавлении и с растворами концентрированных щелочей:
В растворах щелочей:
О том, какие анионы характерны для амфотерных оксидов и гидроксидов, Вы можете прочитать в статье «Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных»
- Амфотерные гидроксиды взаимодействуют с солями, образованными щелочным металлом и анионом, с которым «амфотерный металл» не может образовать существующую или устойчивую соль (для алюминия это сульфиты, сульфиды, карбонаты, нитриты, ацетаты и силикаты). Информация о том, существует ли соль или мгновенно разлагается в водных растворах, можно получить из таблицы растворимости:
- Амфотерные гидроксиды разлагаются при нагревании на воду и соответствующих оксид (степень окисления металла в исходном гидроксиде и в полученном оксиде одинаковая):
Получение амфотерных гидроксидов
Напрямую, растворением соответствующего оксида в воде, амфотерный гидроксид получить нельзя из-за низкой растворимости в воде амфотерных оксидов. Поэтому амфотерные гидроксиды получают в основном из солей.
- Действием раствора щелочи на растворимую соль, содержащую металл, соединения котного могут проявлять амфотерность:
В этих реакциях не используют концентрированный раствор щелочи и большие избытки растворов щелочи, иначе образуются не амфотерные гидроксиды, а комплексные соединения:
Зависимость продукта от количества взятой щелочи можно выразить следующей схемой:
- Амфотерные гидроксиды получают действием на растворы солей, содержащих «амфотерный» металл аммиака:
- Амфотерные гидроксиды получают действием на раствор соли, содержащей «амфотерный» металл растворов солей, содержащих анион, с которым амфотерный металл не образует существующих солей или соли гидролизуются в водной среде:
- Амфотерные гидроксиды можно получить действием разбавленных кислот на гидроксокомплексы:
Если использовать избыток кислоты, то образуется не амфотерный гидроксид, а соль, так как избыток кислоты растворяет гидроксид:
Классификация оксидов
Все сложные неорганические вещества можно разделить на следующие группы:
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»
* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K + и O2 -1 .
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
* Гидроксид – соединение элемента с гидроксо-группой (OH ‒ ).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
Классификация оксидов неметаллов.
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
Классификация оксидов металлов.
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Амфотерные металлы: цинк и алюминий
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металлов
Под амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
Характеристики элементов-металлов
Алюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s 2 3p 1 .
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d 10 4s 2 . В соединениях цинк проявляет постоянную степень окисления +2.
Физические свойства
Алюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).
Способы получения
Химические свойства
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинка
Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинка
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей
- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
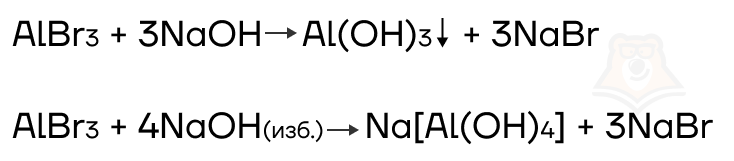
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Проверь себя
Задание 1.
Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.
Задание 2.
Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.
Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.
Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.
Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
Читайте также:
