Степени окисления переходных металлов
Обновлено: 05.10.2024
Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. [1] В общем виде электронное строение переходных элементов можно представить следующим образом: " />
. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на металлами.
Содержание
Общая характеристика переходных элементов
Все переходные элементы имеют следующие общие свойства: [2]
- Небольшие значения электроотрицательности.
- Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
- Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
- Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди [3]
| Атомный номер | Название, символ | Электронная конфигурация | Степени окисления | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|
| 29 | Медь Cu | [Ar] 3d 10 4s 1 | 0, +1, +2 | 8,96 [4] [5] | 1083 [4] [5] | 2543 [4] [5] |
| 47 | Серебро Ag | [Kr] 4d 10 5s 1 | 0, +1, +3 | 10,5 [6] | 960,8 [6] | 2167 [6] |
| 79 | Золото Au | [Xe] 4f 14 5d 10 6s 1 | 0, +1, +3 | 19,3 [7] | 1063,4 [7] | 2880 [7] |


В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди(II).
Для меди наиболее характерна степень окисления +2 [11] , однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Оксид меди(II)

Оксид меди(II) CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
Растворы всех солей двухвалентной меди окрашены в голубой цвет, который им придают гидратированные ионы .
Гидроксид меди(II)
Это малорастворимое в воде вещество голубого цвета. Гидроксид меди(II) — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
При добавлении аммиака Cu(OH)2 растворяется с образованием ярко-синего комплекса:
Соединения одновалентной меди
Соединения одновалентной меди крайне неустойчивы, поскольку медь стремится перейти либо в Cu 2+ , либо в Cu 0 . Стабильными являются нерастворимые соединения CuCl, CuCN, Cu2S и комплексы типаСеребро

Серебро более инертно, чем медь [14] , но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl − , Br − , I − :
\longrightarrow \ AgCl \downarrow>" />
При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
Золото

Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений. [15] В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот ("царской водке"):
Платиновые металлы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Примечания
Литература
См. также
Ссылки
- Переходные металлы
- Группы химических элементов
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Переходные металлы" в других словарях:
ПЕРЕХОДНЫЕ МЕТАЛЛЫ — химич. элементы I6 и VIIIб подгрупп периодич. системы элементов. В П. м. внутр. оболочки атомов заполнены только частично. Различают d металлы, у к рых происходит постепенное заполнение З d (от Sc до Ni), 4 d (от Y до Pd) и 5 d (от Hf до Pt)… … Физическая энциклопедия
переходные металлы — Элементы 16 и VIII6 подгруппы Периодич. системы. У атомов п. м. внутр. оболочки заполнены только частично. Различают rf ме таллы, у к рых происходит постепенное заполнение 3
переходные металлы — [transition metals] элементы Iб и VIIIб подгруппы Периодической системы. У атомов переходных металлов внутренние оболочки заполнены только частично. Различают d металлы, у которых происходит постепенное заполнение 3d (от Se до Ni), 4d (от Y до… … Энциклопедический словарь по металлургии
Металлы платиновой группы — H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y … Википедия
Переходные элементы — Переходные металлы (переходные элементы) химические элементы побочных подгрупп I VIII групп Периодической системы элементов Д.И. Менделеева (3 12 групп в длиннопериодном варианте таблицы). Переходные металлы выделяют на основании незавершённости… … Википедия
металлы — Простые вещ ва, обладающие в обычных условиях хар рными св вами: высокой электро и теплопроводностью, отрицат. темп рным коэфф. электропроводности, способностью хорошо отражать электромагн. волны, пластичностью. М. В. Ломоносов определял м. как… … Справочник технического переводчика
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d и f элементами. Назв. переходные связано с тем, что в периодах П. э. вклиниваются между s и р элементами. Всего известно 65 … Химическая энциклопедия
МЕТАЛЛЫ — (от греч. metallon, первоначально шахта, руда, копи), простые в ва, обладающие в обычных условиях характерными св вами: высокими электропроводностью и теплопроводностью, отрицательным температурным коэфф. электропроводности, способностью хорошо… … Физическая энциклопедия
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы) химические элементы подгрупп б периодической системы Менделеева. Атомы переходных элементов имеют незавершенные внутренние электронные оболочки. Различают d элементы, у которых происходит заполнение внутренних 3d , 4d , 5d и… … Большой Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — переходные металлы, d и f элементы, хим. элементы, у к рых d и f оболочки частично заполнены электронами. К d элементам относятся металлы подгрупп меди Си, цинка Zn, скандия Sc, титана Ti, ванадия V, хрома Сr, марганца Мп, а также VIII гр.… … Большой энциклопедический политехнический словарь
Степени окисления переходных металлов
Периодическая система всегда под руками
В органической химии элементов немного, и можно не сомневаться, что любой человек, осмелившийся назвать себя химиком, помнит, где находится углерод, кислород, азот и галогены, и уж тем более водород. В химии переходных металлов элементов намного больше, и упомнить их все не всем по силам, и человек, даже отдавший химии всю жизнь, имеет полное право замешкаться, вспоминая, где, например, находится какой-нибудь иридий, и элемент ли это вообще, а может быть цветок какой аленький или синенький.
Но здесь это совершенно необходимо – мы все время будем считать электроны, оценивать положение элементов в группах и рядах, и не попадаться на глупые вопросы, например, про катализ кросс-сочетания фосфиновыми комплексами свинца. Фосфиновые комплексы у свинца вполне могут быть, но металл это непереходный, а следовательно нам в этом курсе малоинтересный. Вторая буква в символе просто предательская – перевернем ее и все встанет на свои места.
Поэтому сразу обзаведемся Периодической таблицей элементов. Для наших целей больше подходит не привычная с детства (раннего или позднего, кому как повезло) уютная и компактная короткопериодная таблица, восходящая еще к Д.И.Менделееву, а так называемая длиннопериодная. Историческая короткопериодная таблица была основана на ранжировании элементов по единственно доступному в глубокой древности параметру, атомным весам. Ни о каких электронах, а тем более атомных орбиталях, валентных оболочках и пр. тогда не было известно совершенно ничего. Короткопериодная форма поэтому мешает в группах элементы различных типов, разделяя их только по неочевидным на близорукий взгляд главным и побочным подгруппам. Но самая неудачная особенность исторической формы – запихивание 15 элементов в одну восьмую группу, что делает непростым понимание того, чем все эти восхитительные элементы различаются, и почему только им, благородным газам и металлам, и тройке более банальных металлов досталась такая свалка. Воздадим поэтому должное восхищение величию исторической Таблицы, и перейдем к более современной форме, которая построена по заполнению валентных уровней электронами, и четко разделяет разные блоки элементов.
Маленькое отступление, навеянное посещением Северной Химической Аудитории. Пожалуйста, никогда не называйте Периодическую таблицу Таблицей имени Д.И. Менделеева. Это какое-то филологическое недоразумение, крайне оскорбительное для памяти действительно великого ученого. Можно сколько угодно спорить о том, называть ли таблицу таблицей Менделеева, и какую конкретно таблицу так называть, и можно ли так называть длиннопериодную форму (на мой взгляд, можно, но это неважно), и не нужно ли тогда же поминать Лотара Мейера – все это суета, которую стоит оставить бессмысленным чиновникам от науки и ошивающимся вокруг них проходимцам. Все вменяемые люди знают и помнят, кому история химии обязана этим выдающимся инструментом, и пошло мельтешить вокруг этого не стоит. Ничто никуда не денется и не забудется.
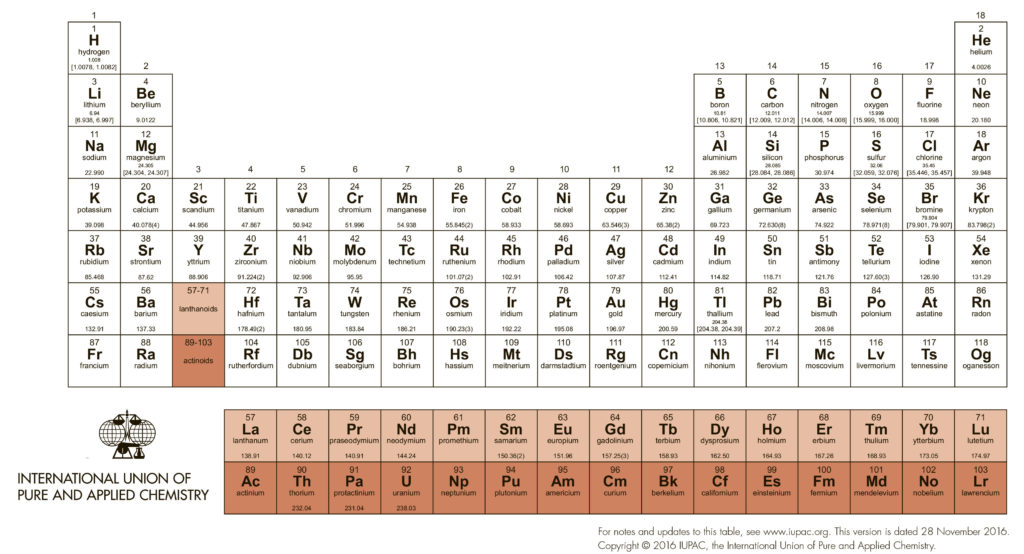
D-Элементы
В длиннопериодной Таблице элементы расположены строго по мере заполнения валентных уровней, участвующих в образовании химических связей и вообще в любой химической деятельности. Напомню, что заполнение уровней атомов элементов происходит в соответствии с их относительной энергией снизу вверх (это называется принципом Aufbau, в разных формулировках также называется принципом Маделунга-Клечковского), причем эмпирически (спектроскопически) установлен порядок заполнения, удобно представляемый простой диаграммой: выписываем все уровни в порядке появления, и дальше снимаем слоями по диагонали. Получаем сразу и принцип заполнения оболочек, и то, как происходит комплектование периодов в Таблице. Только в первых трех периодах уровни заполняются просто и скучно – по номеру оболочки (точнее, значению главного квантового числа n). В четвертом и пятом d-уровни из предыдущей оболочки выплывают и встают между очередными s и p-уровнями. Это очень важно, так как в значительной степени определяет место интересующих нас элементов, переходных металлов, в Таблице – они нагло влезают между s- и р-элементами, то есть между самыми металлическими металлами (щелочными и щелочноземельными) и неметаллами вместе с примкнувшими к ним металлоидами и горсткой непереходных металлов. Валентные оболочки в этих двух периодах содержат s, p, d уровни, то есть в сумме могут принять 18 электронов. Как увидим скоро, это священное число химии переходных металлов. В шестом периоде происходит следующий сюрприз – влезает “забытый” f-уровень с на две единицы меньшим номером, причем до d-уровня, и его неспешное заполнение дает семейство f-элементов, лантанидов. А уж дальше идут нормальные d-элементы, но сильно отличающиеся от родственников с верхних этажей как раз наличием этого уже заполненного f-уровня. Можно было бы ожидать, что в этом ряду произойдет и расширение числа электронов на валентной оболочке на 14 f-электронов, но это не так – заполненный f-уровень становится внутренним, и напрямую в образовании связей не участвует, валентная оболочка по-прежнему остается sdp-типа и вмещает 18 электронов, а на особые свойства этих элементов довесок в виде полного f-уровня влияет косвенно, в основном через эффект сильно потяжелевшего и несущего очень большой дополнительный положительный заряд ядра. Про следующий период говорить ничего не будем, там все радиоактивное и малостабильное, кроме самого начала очередной порции f-элементов, но мы договорились, что f-элементами заниматься не будем вообще. Пока не сбылось древнее пророчество о наличии “островка стабильности” среди трансурановых элементов, пополнения семейства переходных металлов чем-то осязаемым ждать не приходится. В 7 периоде ничего не появилось, хотя он полностью заполнен и даже названия все даны. Подождем восьмого.
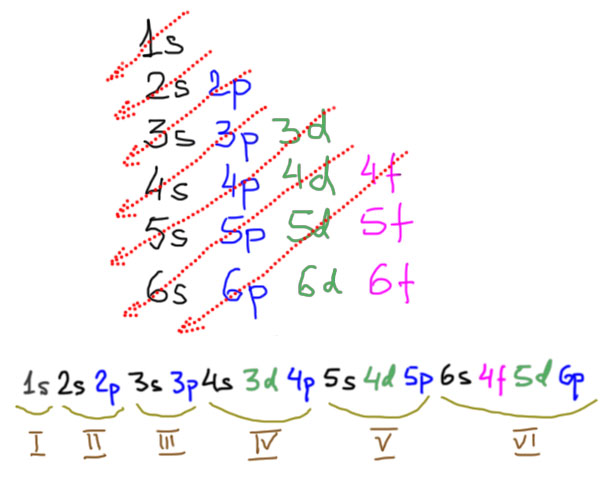
Электроны на d-уровне
Посмотрим теперь на d-элементы повнимательнее. Есть три полных ряда таких элементов. В каждом последовательно заполняется соответствующий d-уровень. Всего d-орбиталей пять, а d-электронов, соответственно, десять. Поэтому и в каждом ряду есть десять элементов, располагающихся в группах от 3 до 12. Номера групп с 3 по 7 соответствуют исторической Таблице Менделеева, только там используется понятие “побочная подгруппа”, а в длиннопериодной Таблице все группы равноправны (хотя термин main group elements, элементы главных (под)групп, очень широко распространен для обозначения s- и p-элементов и не собирается сдавать позиции). При заполнении оболочек у атома каждого элемента, к сожалению, наблюдаются достаточно серьезные отклонения от простого порядка, когда каждый следующий электрон просто занимал бы следующее свободное место. Электроны вообще очень капризные ребята, их квантовые привычки непросто понять и запомнить. В первом ряду все еще достаточно просто, достаточно усвоить, что при возможности полностью заполнить (в каждой ячейке по два спаренных) или полузаполнить (в каждой ячейке по одному неспаренному) d-уровень, все остальное уходит на второй план, и выбивающуюся из ряда конфигурацию атомов хрома или меди, заимствующих электрон с уже заполненного s-уровня, запомнить несложно. Но во втором или третьем ряду даже эти простые идеи как-то перестают работать однозначно.
К счастью, в реальной химии редко имеют дело с одиночными атомами, а когда образуется коодинационное соединение, комплекс, картина просто радикально упрощается. Считается, что так как в образовании связей с лигандами в первую очередь участвуют именно d-орбитали, то в комплексах они стабилизируются и опускаются ниже s-орбиталей.
А если это объяснение кажется несколько натянутым и неубедительным, то можно просто подумать о том, что в комплексах металлов все равно из валентных орбиталей металла и орбиталей лигандов образуются новые орбитали комплекса, металл все равно отдает на это все, что у него есть, и электроны придется переразмещать заново, снизу вверх, уже на орбиталях комплекса, далеко не все из которых сохранят чистый d-характер как в исходном атоме металла. Поэтому то, что называется d-электронной конфигурацией атома металла в комплексе, на самом деле совершенная формальность, а раз так, то нет смысла это усложнять и лучше воспользоваться самым простым вариантом из возможных – берем все, что есть, и для удобства считаем размещенным на d-орбиталях металла.
Иными словами, для целей координационной химии электроны на атомах металлов в степени окисления 0 (что это означает, скоро обсудим, а пока примем просто за точку отсчета) размещаются на d-орбиталях, пока уровень не будет заполнен полностью. Это невероятно удобно, потому что число d-электронов становится равным номеру группы в длиннопериодной Таблице. Сколько валентных электронов, скажем, у ниобия? – ниобий в 5 группе, значит пять. А у иридия? – в 9-й группе, значит девять.
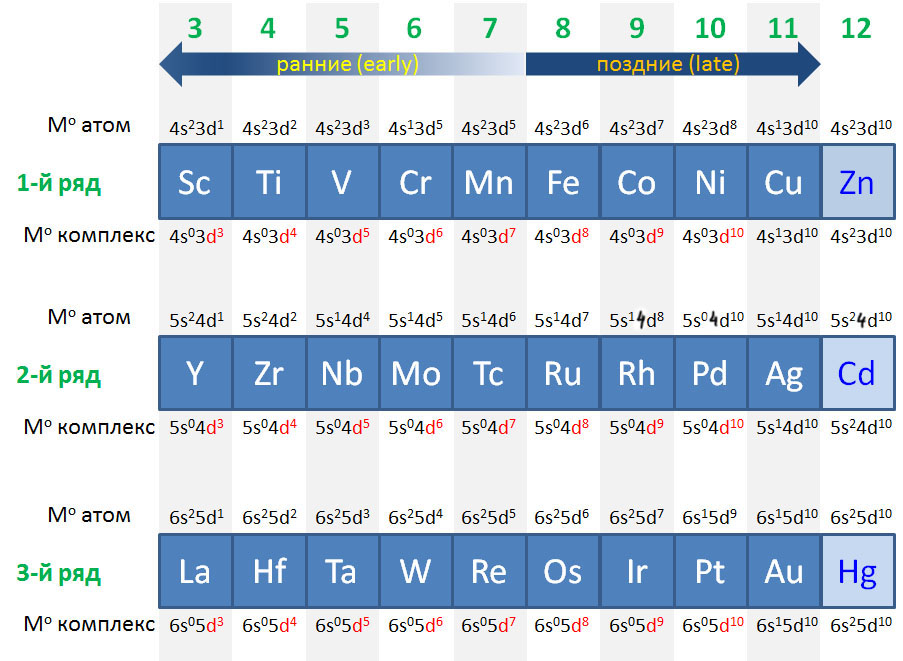
Так и будет до 10 группы (никель-палладий-платина), когда d-уровень полностью заполнится, и настанет черед s-уровня, того самого, который в изолированном атоме был ниже d-уровня. Теперь он выше и берет первый следующий электрон в 11 группе (медь-серебро-золото), образуя конфигурацию с полностью заполненным d-уровнем, который поэтому сразу становится внутренним, и полузаполненным s-уровнем. О, так значит металлы этой группы не переходные металлы, а s-элементы, и права была историческая таблица Менделеева, когда помещала их в одну группу с щелочными металлами? Права, но не совсем, и в следующем слайде мы увидим, что претензии металлов группы меди на то, чтобы на полных основаниях примыкать к семье переходных металлов, очень основательны. А вот в 12 группе положение, на первый взгляд, похожее, но на самом деле радикально другое – там второй электрон попадает на s-уровень, а d-уровень окончательно становится внутренним.
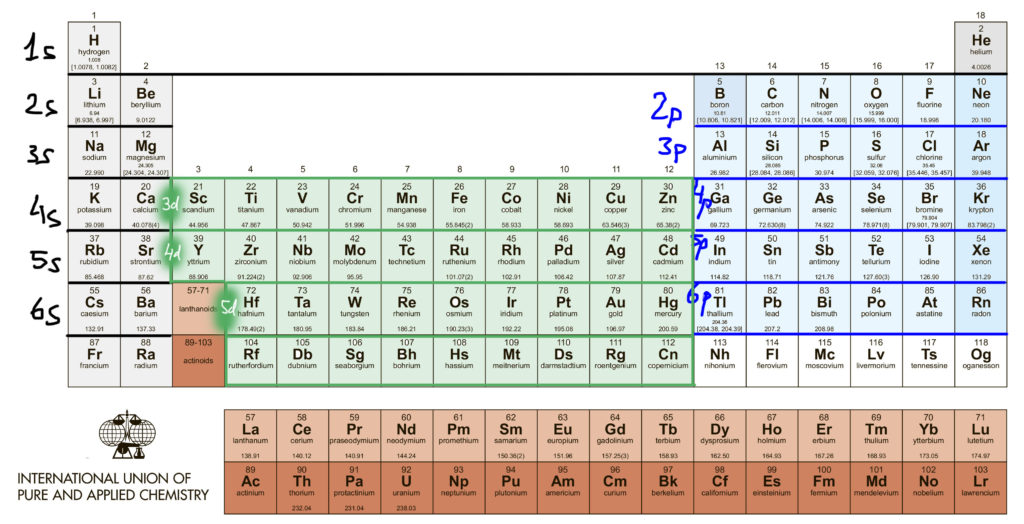
Валентные состояния d-элементов. Переходные металлы.
Легко определить и число электронов на атомах металлов в разных степенях окисления. Для металлов характерны положительные степени окисления (есть и отрицательные, но об этом после). Так как положительная степень окисления – это просто недостаток электронов до числа, положенного каждому элементу, берем нульвалентный элемент и вычитаем. Вот что получается для первого ряда (для остальных будет то же самое). Очевидно, что отнять у атома больше, чем у него есть, невозможно. Поэтому максимальная положительная степень окисления не может быть больше номера группы, но не больше восьми. В этом одна из причин деления переходных металлов на ранние и поздние. Ранние – это те, которых можно достаточно легко ободрать до нитки (до d 0 ), а поздние – те, которые этому успешно сопротивляются. Железо – поздний переходный металл, хотя у него есть степень окисления +8, но достичь ее очень трудно и она очень неустойчива. Во втором и третьем ряду металлы легче расстаются с электронами, и степени окисления +8 для рутения и особенно осмия намного проще достигаются (недавняя история с радиоактивным загрязнением изотопом рутения этим и объясняется), но все равно эти элементы классифицируются как поздние переходные металлы. Вообще, группы 7 и 8 иногда обзывают как ни то, ни се (middle transition metals), но это скверная привычка. Чуть позже уточним эту странную классификацию (ранние-поздние), так как она играет значительную роль в химии переходных металлов.
Так что же такое “переходный металл” и одно ли это и то же, что d-элемент. Не совсем. D-элементы – это более формальное понятие, так как число каждого из типов элементов в периоде соответствует предельной емкости оболочки: s-элеметов два, p-элементов шесть, d-элементов десять, ну и все – отсчитываем от скандия десять, приезжаем в цинк, вопрос закрыт. А вот термин “ переходный металл ” имеет более существенное наполнение, хотя оно и менялось с течением времени. Более-менее устоявшийся подход состоит в том, что элемент имеет право так называться, если у него есть валентные состояния, в которых d-оболочка неполна (имеет меньше 10 электронов), в этом случае d-электроны точно участвуют в образовании связей . Если d-оболочка либо всегда пустая, либо всегда полная, участие d-электронов в образовании связей не очевидно и долго являлось предметом споров. Это старая проблема, связанная с так называемыми гипервалентными состояниями p-элементов, которым прописан валентный октет, но которые, начиная с 3 периода, как это следует из общепринятых структурных формул, умеют образовывать больше ковалентных связей, чем этот октет позволяет. Когда структурная химия была еще очень молода, и еще не совсем освоила электронную теорию химической связи, такие состояния (например, сера и другие халькогены в шестивалентном состоянии, или фосфор и его аналоги в пятивалентном состоянии) часто приписывались участию вакантных d-орбиталей, которые таким образом неявно становились валентными. В современной химии так делать не принято, считается анахронизмом, признаком приверженности преданиям далекой старины, а правило октета Льюиса считается в химии непереходных элементов незыблемым, а поэтому такие элементы не имеют право называться d-элементами.
Следовательно, элементы 12 группы (цинк-кадмий-ртуть) не являются переходными металлами, d-оболочка у них всегда заполнена и спрятана очень глубоко – в комплексах этих металлов граничные орбитали всегда сидят только на лигандах, почти никогда не бывает смещения электронной плотности металл-лиганд и других атрибутов электронной структуры комплексов настоящих переходных металлов. Эти металлы очень похожи на обычные непереходные p-элементы, следующие прямо за ними: цинк-галлий, кадмий-индий и особенно ртуть-таллий-свинец.
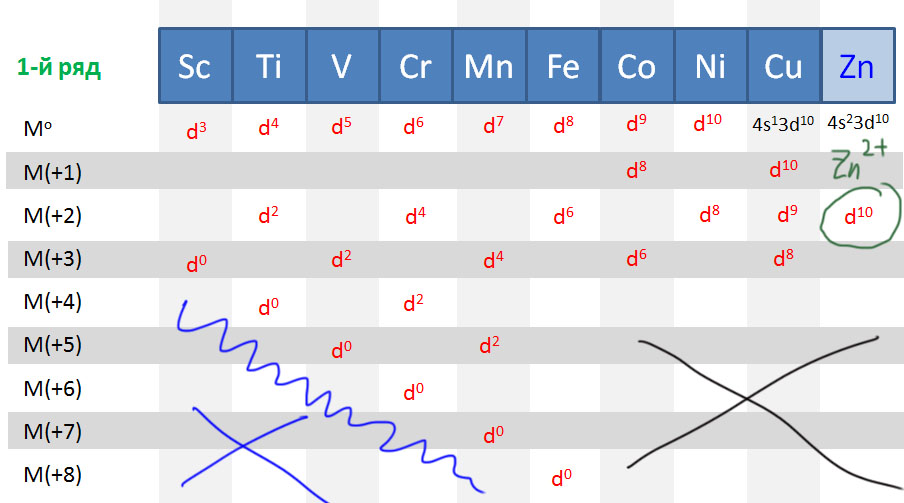
Или ничего, или всё: ранние и поздние переходные металлы
Деление переходных металлов на ранние и поздние очень популярно и часто используется, но точного определения не имеет. Это деление связано с одной очень понятной тенденцией в заполнении валентных оболочек и устойчивости валентных состояний разных элементов. Аналогия довольно прозрачная: где в таблице находятся самые металлические (наиболее электроположительные или наименее электроотрицательные) металлы (щелочные и щелочноземельные)? Слева, в начале периодов. А где находятся самые неметаллические (самые электроотрицательные) неметаллы (галогены и кислород)? Справа, в конце периодов. У первых очень мало электронов, проще их отдать, образуя катионы с зарядом, соответствующим номеру группы. У вторых, наоборот, почти полный комплект, и хочется получить недостающее.
Очень похожая картина наблюдается и в рядах переходных металлов. Те, что ближе к началу, предпочитают отдавать электроны. Их любимые степени окисления соответствуют конфигурациям d 0 и d 2 , то есть высокие степени окисления от +3 и выше, соответствующие номеру группы, что роднит их с непереходными металлами. В реакциях они часто проявляют льюисову кислотность и электрофильность, в состоянии d 0 имеют много общего с непереходными металлами, в частности высокую степень ионности связей с лигандами. Что все это значит, мы подробно разберем дальше, пока просто отметим эти особенности. К ранним переходным металлам почти всегда относят группы с 3-ей по 6-ю, и довольно часто присоединяют и седьмую.
С другой стороны, металлы в конце уже имеют много d-электронов, настолько много, что отдать их все всё равно невозможно. Тогда проще или сохранить имеющееся, или даже приобрести недостающие до полного комплекта. Эти металлы не любят высокие степени окисления, которые редко превышают +4, а наиболее распространенными являются +1 и +2. Самые популярные конфигурации d 8 и d 10 . Им свойственны так называемые низковалентные состояния (степени окисления 0 и +1), и даже небольшие отрицательные степени окисления -1 и -2, а в реакциях они часто проявляют нуклеофильность.
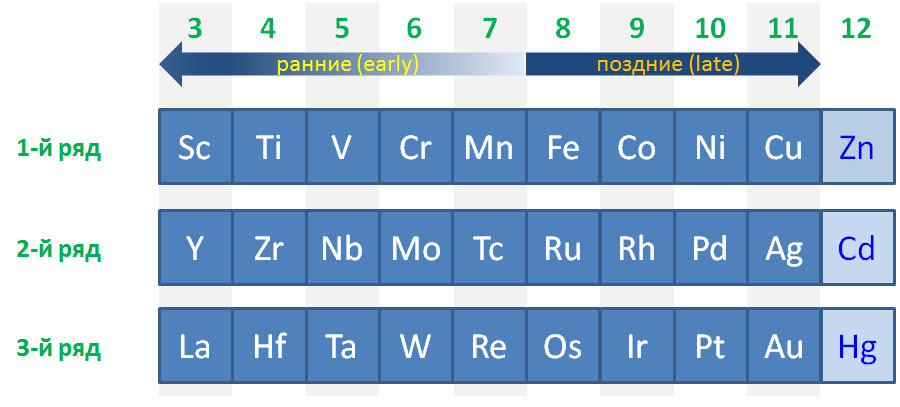
В заключение подчеркнем, что деление переходных металлов на ранние и поздние – просто удобное упрощение, позволяющее грубо классифицировать элементы и в самых общих чертах понимать, какой химии мы ожидаем от представителей групп. Сказать точно, где кончаются первые и начинаются вторые, и наоборот, точно невозможно и не имеет никакого смысла. Собственно как и в химии непереходных элементов, где совершенно нет четкого представления о том, где кончаются неметаллы и начинаются металлы, из-за чего в той химии даже появляется пограничная группа металлоидов, столь же нечеткая. Тем более не имеет смысла выделение в особую группу каких-то средних переходных металлов, хотя этот термин встретить можно, но крайне трудно понять, что же он может означать, и зачем его вводить. Один средневековый христианский мыслитель, брат Вильям Оккамский, советовал в любой мыслительной деятельности не умножать сущностей сверх необходимого, то есть не вводить избыточных и нечетких понятий там, где уже существуют более осмысленные и определенные понятия. Вот и мы не будем, и обойдемся ранними и поздними переходными металлами. К тому же не стоит забывать, что в действительности каждый – каждый! – металл уникален, ни один не повторяет свойства другого хотя бы на 10%, и каждый имеет свою уникальную роль, свои реакции, свое применение, ни один нельзя заменить на другой, а все вместе они создают фантастическое разнообразие молекул и взаимодействий.
Переходные элементы
Переходные металлы (переходные элементы) — химические элементы побочных подгрупп I — VIII групп Периодической системы элементов Д.И. Менделеева (3 — 12 групп в длиннопериодном варианте таблицы).
Переходные металлы выделяют на основании незавершённости внутренних электронных оболочек их атомов или ионов. Термин «переходные» связан с тем, что в периодах эти элементы располагаются между s- и р-элементами. Переходные металлы, в свою очередь, подразделяют на d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f- (лантаноиды) либо 5f-подоболочка (актиноиды). Цинк, кадмий и ртуть, обычно причисляемые к переходным металлам, строго говоря, таковыми не являются, поскольку их катионы имеют завершённый d-подуровень.
Незавершённость внутренних электронных оболочек предопределяет наличие у переходных металлов ряда специфических свойств: способность к образованию координационных (комплексных) соединений, ферромагнетизм некоторых металлов, парамагнетизм многих соединений и т.д.
Смотреть что такое "Переходные элементы" в других словарях:
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе … Современная энциклопедия
Переходные элементы — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе. … Иллюстрированный энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, металлические элементы, имеющие незаполненные внутренние электронные оболочки. Переходные элементы характеризуются переменной ВАЛЕНТНОСТЬЮ и образованием окрашенных ионов. Сюда входят элементы с атомным номером от 21 до 112.… … Научно-технический энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — хим. элементыпобочных подгрупп (b подгрупп) периодической системы элементов. К ним относятся d и f элементы, т. е. элементы, у к рыхпроисходит заполнение 3d ,4d , 5d оболочки (переходныеметаллы) или 4f и 5f оболочки (лантаноиды и актиноиды… … Физическая энциклопедия
переходные элементы — (переходные металлы), химические элементы подгрупп «б» периодической системы. Атомы переходных элементов имеют незавершённые внутренние электронные оболочки. Различают d элементы, у которых происходит заполнение внутренних 3d , 4d , 5d и 6d… … Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — В соответствии с периодической классификацией элементов существует 44 элемента, образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней (валентной) электронной оболочке число электронов равно номеру группы. При переходе от… … Энциклопедия Кольера
переходные элементы — pereinamieji elementai statusas T sritis chemija apibrėžtis d ir f elementai. atitikmenys: angl. transition elements rus. переходные элементы … Chemijos terminų aiškinamasis žodynas
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы), хим. элементы подгрупп б периодич. системы. Атомы П. э. имеют незавершённые внутр. электронные оболочки. Различают rf элементы, у к рых происходит заполнение внутр. 3d , 4d , 5d и 6d подоболочек, и f элементы, у к рых… … Естествознание. Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
В соответствии с периодической классификацией элементов существует 44 элемента, образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней (валентной) электронной оболочке число электронов равно номеру группы. При переходе от элемента одной подгруппы к элементу соседней подгруппы вдоль периода слева направо число валентных электронов возрастает на 1. Поэтому происходит регулярное изменение свойств от металлических в семействах с низкими номерами до неметаллических в семействах с большими номерами. В то же время имеется более 60 элементов, которые не подчиняются вышеописанным принципам застройки электронной структуры. Все эти элементы являются металлами по своим химическим свойствам (некоторые очень активными), сходными с металлами подгруппы IIA. В этом классе находятся металлы, образующие сплавы (Fe, Mn, Mo, Cu, Zn, Pt, Au и др.) либо являющиеся драгоценными металлами, обладающие важными структурными свойствами. У этих элементов в отличие от элементов подгрупп А, у которых заполняется электронами внешний слой, электроны поступают на внутренние слои, а элементы называются "переходными".
За некоторыми исключениями, в целом для электронного строения переходных элементов характерно наличие двух электронов на внешней электронной оболочке, т.е. на ns-уровне, и размещение следующих электронов на внутреннюю оболочку, т.е. на уровень (n 1) или (n 2). Так как химические и многие физические свойства определяются типом и энергией внешних электронов по отношению к ядру, а структуры внешних электронных оболочек идентичны для всех переходных элементов, то и наблюдается много сходства в их химических и физических свойствах. Добавление к каждому последующему (в ряду периодической таблицы) металлу одного протона к ядру и одного электрона на внутреннюю оболочку не увеличивает радиуса, а скорее несколько уменьшает его. Это уменьшение, или сжатие, несопоставимо по величине с сжатием в горизонтальном ряду непереходных элементов периодической таблицы (например, от Li до F), но имеет ту же природу.
Переходные элементы можно разделить на две отдельные группы серий в зависимости от того, расположены последующие электроны на первом (n 1) или втором (n 2) уровне от внешнего слоя. Соответственно элементы относятся в первом случае к коротким (1-му и 2-му) переходным рядам и нормальным сериям (d-сериям) длинных (3-го и 4-го) переходных рядов, а во втором случае к внутренним сериям (f-сериям) длинных переходных рядов (см. табл. 9).
Не всегда можно точно предсказать или рассчитать электронную конфигурацию элементов с большими атомными номерами, поэтому некоторые обозначения нельзя считать окончательными. Среди химиков нет полного согласия об обозначении элементов подгрупп IB и IIB как подгрупп переходных элементов. В частности это относится к металлам Cu, Ag, Au (IB) и Zn, Cd, Hg (IIB). В каждой из этих подгрупп элементы содержат внутреннюю завершенную оболочку из 18 электронов. Поэтому если определение переходного элемента предусматривает расположение очередного электрона во внутренней оболочке, то металлы подгрупп IB и IIB не являются ни переходными, ни непереходными элементами. Но поскольку они обладают многими свойствами, общими со свойствами переходных элементов, то их в этом разделе относят к переходным элементам.
Общие свойства. Сначала рассматриваются некоторые общие свойства, затем свойства по подгруппам и отдельные элементы более детально. Общие и физические свойства сведены в таблицы.
Электронная конфигурация. За некоторым исключением все переходные элементы имеют 2 электрона на внешнем или высшем энергетическом уровне и один или более электронов на низшем (n 1) или (n 2). При переходе от элемента к элементу в пределах одного ряда элементов ядро увеличивается на 1 протон, увеличивая заряд, и соответственно число электронов также увеличивается на 1. Этот дополнительный электрон располагается на (n 1) или (n 2) уровне, т.е. на внутренней оболочке, что приводит к некоторому уменьшению радиуса атома, или сжатию с увеличением атомного номера. На основании этого эффекта можно объяснить многие периодические изменения свойств.
Образование связи. Описанное электронное строение позволяет всем этим элементам образовывать химическую связь в соединениях с участием 3 электронов; многие переходные элементы образуют связь с помощью 2 внешних электронов, и все эти элементы могут (хотя и не всегда) предоставлять количество электронов, равное номеру группы, в которой находится данный элемент. Возможность участия в связеобразовании различного числа электронов называется поливалентностью. Например, у марганца, элемента подгруппы VIIВ, степень окисления изменяется от II (MnCl2) до VII (KMnO4). Чем больше электронов участвует в образовании химической связи, тем более ковалентной становится связь.
Окраска ионов. Так как при переходе от одного элемента к другому вдоль ряда переходных элементов в периодической таблице последующие электроны поступают на внутреннюю оболочку и поэтому мало энергетически отличаются друг от друга, то достаточно небольших затрат энергии для перескока электрона в более высокое энергетическое состояние. Атомы и ионы, которые имеют такие подвижные электроны, обычно хорошо окрашены, так как энергии света достаточно для перескока электронов. Поэтому многие ионы переходных элементов окрашены и образуют окрашенные соединения.
Физические свойства. Малое количество электронов на внешнем уровне объясняет высокую электро- и теплопроводность переходных металлов. Те же электроны могут участвовать и в образовании связей между атомами одного элемента. Природа такого связеобразовании не всегда понятна, но коррелирует с высокими величинами температур плавления и кипения. Строгой тенденции внутри семейства переходных металлов не существует, но атом третьего члена подгруппы В не должен быть больше атома стоящего над ним металла. Например, атомный радиус Zr равен 1,57 , а третий член подгруппы IVB Hf, стоящий под Zr, также имеет r = 1,57 .
Магнитные свойства. Общее правило застройки электронных оболочек атомов состоит в том, что электроны заполняют незанятые орбитали неспаренными электронами, прежде чем начнется заселение орбиталей вторым электроном с образованием пары электронов с одинаковой энергией. Для всех переходных элементов (кроме свободных металлов подгрупп IB и IIB) внутренний уровень (n 1 или n 2) будет иметь такие неспаренные электроны. Благодаря этим электронам атом или ион "втягивается" электромагнитным полем, т.е. обладает парамагнетизмом. Атом или ион, имеющий спаренные электроны, "выталкивается" электромагнитным полем, и такое свойство называется диамагнетизмом. У некоторых переходных металлов, например у Fe из подгруппы VIIIВ, парамагнетизм выражен очень сильно и его принято называть ферромагнетизмом.
Образование комплексных ионов. Малый радиус переходного элемента и наличие вакантных орбиталей для размещения электронов являются благоприятными условиями для взаимодействия этих элементов с большим количеством молекул и ионов, способных быть донорами электронов. Образующиеся по такому механизму соединения или ионы называются координационными или комплексными. Более детальное обсуждение переходных элементов приведено при рассмотрении каждой подгруппы. Порядок их рассмотрения основан на общем правиле классификации элементов, начиная с подгруппы IIIB, а подгруппы IB и IIB рассматриваются в конце как последние члены 1-го, 2-го и 3-го рядов переходных металлов. Последняя, внутренняя серия 4-го ряда переходных металлов актиноиды или трансурановые элементы рассматривается отдельно.
Энциклопедия Кольера. — Открытое общество . 2000 .
Переходные металлы
Переходные металлы — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Переходные металлы - общая характеристика
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются переходными.
Находясь только в больших периодах (IV, V, VI), d-элементы образуют "вставные декады" (по 10 элементов) между s- и d-элементами, поэтому имеют общее название — переходные металлы.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока) на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах n— номер периода.
В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементов являются не только s-электроны внешнего слоя, но и все или некоторые d-электроны предвнешнего слоя, d-элементы образуют три переходных ряда — в IV, V и VI периодах соответственно. Первый ряд включает 10 элементов: от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей (табл. 29).
| Элемент | Символ | Атомный номер | Электронная конфигурация |
| Скандий | Sc | 21 |  |
| Титан | Ti | 22 |  |
| Ванадий | V | 23 |  |
| Хром | Cr | 24 | |
| Марганец | Mn | 25 | |
| Железо | Fe | 26 | |
| Кобальт | Co | 27 | |
| Никель | Ni | 28 | |
| Медь | Cu | 29 | |
| Цинк | Zn | 30 |
Как следует из таблицы, хром и медь имеют всего по одному электрону. Согласно закономерностям заполнения энергетических уровней и подуровней у атомов хрома и меди на четвертом энергетическом уровне должно быть два электрона. Однако один из двух электронов переходит на третий энергетический уровень, на незаполненную d-орбиталь ("провал электрона"). Медь в соединениях проявляет степени окисления + 1, +2, хром проявляет степени окисления +2, +3, +6. Для d-металлов III—VII групп высшая валентность и высшая степень окисления равны номеру группы, т. е. суммарному числу (n — 1)d- и ns-подуровнях, например у d-элементов четвертого периода (табл. 30).
d-металлы II группы, атомы которых имеют завершенную структуру d-подуровня d-подуровень полностью завершен, поэтому цинк в соединениях проявляет только степень окисления +2.
В периодах с увеличением заряда ядра металлические свойства изменяются более медленно по сравнению со свойствами s- и p-элементов. В побочных подгруппах сверху вниз восстановительные свойства d-элементов уменьшаются. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d-металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода: (Fe, Cr, Zn, Mil и др.); малоактивные металлы (Сu, Hg и др.) и благородные металлы (Аu, Pt), располагающиеся в ряду напряжений после водорода.
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями, например:
— восстановители.
Кислотно-основные свойства оксидов и гидроксидов d-элементов, а также окислительно-восстановительные свойства их соединений зависят от степени окисления металла. Как следует из таблицы при увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается (табл. 31).

Например, СrО и Сг(ОН)2 — это основные оксиды и гидроксиды. Сг2O3 и Сг(ОН)3 — амфотерные, СrO3 и Н2СrО4, Н2Сг2О2 — кислотные.
d-металлы по сравнению с другими металлами характеризуются более большей твердостью, плотностью, высокой температурами плавления и кипения, d-металлы хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон. Так, медь, серебро и золото, обладающие конфигурацией d 10 s 1
Большинство соединений переходных металлов окрашены. Для d-элементов характерно образование комплексных соединений.
Все d-элементы расположены в побочных подгруппах периодической системы элементов и являются металлами. В каждом большом периоде d-элементы располагаются между s- и p-элементами. В отличие от щелочных и щелочноземельных металлов, большинство d-металлов имеют переменную валентность и переменную степень окисления. В свободном состоянии d-металлы (как и вообще все металлы) являются восстановителями. Соединения d-элементов могут проявлять как восстановительные, так и окислительные функции. Соединения с высокими степенями окисления являются окислителями, а соединения с невысокими степенями окисления — восстановителями. При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается.
Комплексные соединения
Мир веществ многообразен, и мы встречались с группой веществ, которые принадлежат к комплексным соединениям. Данными веществами стали заниматься с XIX века, но понять их строение с позиций существовавших представлений о валентности было трудно. В 1893 году швейцарским химиком-неоргаником Альфредом Вернером была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений, которую назвали координационной теорией, поэтому комплексные соединения часто называют координационными соединениями. Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Комплексные соединения образуются в результате взаимодействия между собой солей, кислот и оснований, например:

Строение комплексных соединений. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой.
Во внутреннюю сферу, которую обозначают квадратными скобками, входит центральный атом, или комплексообразователь, и окружающие его ионы, атомы или молекулы, называемые лигандами. Наиболее часто комплексообразователями служат атомы металлов. В качестве лигандов выступают ионы Cl, Br, I , CN, NO2, ОН или нейтральные молекулы NH3, Н2O, СО.

В состав внутренней сферы одного соединения могут входить различные лиганды, например, в и Cl2, являются лигандами. Число лигандов, располагающихся вокруг комплексообразователя, определяет координационное число центрального атома. Так, в соединении — шести. Координационное число принимает значения от 2 до 12, но чаще всего оно равно 2, 4 или 6. Внешняя сфера может быть образована как катионами, так и анионами. Заряды внешней и внутренней сфер противоположны. Рассмотрим несколько примеров: 1. Структура комплекса
Железо (+2) является центральным ионом. Ионы CN выполняют роль лигандов. Железо в комплексе с цианогруппами образует внутреннюю координационную сферу. Ионы калия образуют внешнюю координационную сферу. Положительный заряд внешней сферы компенсирует отрицательный заряд внутренней сферы. Координационное число комплексообразователя (Fe), определяемое числом координационных связей, равно 6.
2. Структура комплекса 3 выполняют роль лигандов. Кобальт в комплексе с NH3 образует внутреннюю сферу. Ионы хлора образуют внешнюю координационную сферу. Координационное число комплексообразователя (Со) равно 6.
3. Структура комплекса 3 и ионы Сl выполняют роль лигандов- Платина в комплексе с NH3 иСl образует внутреннюю координационную сферу. Заряд внутренней сферы равен 0. Внешняя координационная сфера отсутствует. Координационное число комплексообразователя Pt равно 4. Как видим, комплексные соединения чрезвычайно разнообразны по составу и строению.
Классификация комплексных соединений Большое многообразие комплексных соединений и их свойств не позволяет создать единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
1. По составу: например, соли кислоты
2. По типу координируемых лигандов: а) аквакомплексы — это комплексные катионы, в которых лигандами являются молекулы Н2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз. Например: б) гидроксокомплексы — это комплексные анионы, в которых лигандами являются гидроксид-ионы ОН - . Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств — Be, Zn, Al, Сг. Например:

в) аммиакаты — это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы. Например:

г) ацидокомплексы — это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например:

3. По заряду внутренней сферы а) комплексный катион, например,

б) комплексный анион, например,
Химические свойства
1. В растворе комплексные соединения ведут себя как сильные электролиты, т. е. полностью диссоциируют на катионы и анионы:

а)

б)
2. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
а) при недостатке кислоты:


б) при избытке кислоты:

3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
Значение и применение комплексных соединений
Комплексные соединения имеют большое значение в природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения. Например, гемоглобин крови является комплексным соединением железа, а хлорофилл — комплексным соединением магния, витамин В12 — комплексным соединением кобальта. Образование комплексных соединений используют в химической технологии для извлечения золота, металлов платиновой группы и др. Эти соединения широко применяют в аналитической химии в качестве индикаторов.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными. Комплексные соединения образованы двумя составляющими: внутренней координационной сферой и внешней координационной сферой. Комплексообразователями являются металлы. Окружающие комплексообразователя ионы, атомы или молекулы, называются лигандами. Число лигандов, располагающихся вокруг комплексообразователя, определяет координационное число центрального атома. Координационное число принимает значения от 2 до 12, но чаще всего оно равно 2, 4 и 6.
Биологическая роль переходных металлов
Хром — постоянная составная часть растительных и животных организмов. Биологическая активность хрома объясняется главным образом способностью ионов Сr 3- образовывать комплексные соединения. Например, ионы Сr 3- участвуют в стабилизации структуры нуклеиновых кислот. Недостаток хрома замедляет рост живых организмов, нарушает углеводный обмен вызывает болезнь глаз, симптомы диабета. Соединения хрома ядовиты и в медицине не применяются.
Марганец. Марганец — микроэлемент. Биогенная функция ионов Мn 2+ состоит в регуляции активности ферментов. Поэтому ионы Мn 2+ обладают широким спектром биологических эффектов: оказывают влияние на кроветворение, минеральный обмен, рост, размножение и т. д. Кроме того, ионы Мn 2+ стабилизируют структуру нуклеиновых кислот. В медицине используется перманганат калия КМnO4. Этот антисептик применяется в водных растворах для промывания ран, полоскания горла и т. д.
Железо. Железо входит в состав ферментов, которые катализируют окислительно-восстановительные процессы в организме человека. Играет важную роль в синтезе белков, процессах фотосинтеза и дыхания растений. Недостаток железа в организме человека приводит к болезни крови (анемии) и нарушению иммунной системы. В организме взрослого человека содержится около 3,5 г железа. Основная его масса сконцентрирована в гемоглобине. По форме гемоглобин похож на шарик диаметром около 5,5 нм. Гемоглобин — сложный белок,который переносит кислород по всем тканям и органам. В нашей жизни становится все больше продуктов, которые могут вызвать недомогание у любого человека. Одним из таких продуктов является оксид углерода (II) — угарный газ. Оксид углерода (II) образуется при неполном сгорании любого топлива (газ, уголь, дрова, бензин и др.) Кроме того увеличивается количество транспорта, а с ним и угарного газа в атмосфере. При этом распространяется газ быстро, смешиваясь с воздухом без потери своих отравляющих свойств. Для человека угарный газ — сильнейший яд. Поступая в организм при дыхании, он проникает из легких в кровеносную систему, где и вступает в обратимое химическое взаимодействие как с окси-, так и с дезоксигемоглобином:

где Нb — гемоглобин. Образующийся комплекс карбоксигемоглобин (НbСО) не способен присоединять к себе кислород. Таким образом,связываясь с гемоглобином угарный газ препятствует снабжению организма кислородом. В результате кровь утрачивает способность переносить и доставлять тканям кислород и развивается кислородное голодание или гипоксия. В первую очередь страдает головной мозг, но возможно поражение и других органов — в зависимости от общего состояния здоровья.
Такое состояние опасно для жизни и при тяжелом отравлении может быть смертельным. Основная проблема состоит в том, что угарный газ не имеет ни цвета, ни вкуса, ни запаха, не вызывает вообще никаких ощущений.
К первым симптомам отравления угарным газом относятся: тошнота, рвота, головокружение, частый пульс, дезориентация. Возможно развитие обморока, эйфории, спутанности сознания.
• Если начинается озноб, падает температура — укутайте потеплее, напоите сладким чаем (если человек в сознании, разумеется).
• Устройте поудобнее (и желательно — на свежем воздухе или, хотя бы, у открытого окна), чтобы облегчить дыхание.
• Потерявшего сознание уложите на бок и следите, чтобы его голова не запрокидывалась, особенно если вдруг возникнет рвота, дайте понюхать ватку, смоченную нашатырным спиртом, для того, чтобы привести человека в сознание; При необходимости сделать пострадавшему непрямой массаж сердца и провести искусственное дыхание.
• Чем раньше пострадавшему будет оказана медицинская помощь, тем больше шансов на его выздоровление.
Учтите: от отравления угарным газом существует противоядие. Этот препарат называется ацизол, выпускается в виде капсул и в виде раствора в ампулах (для внутримышечных инъекций).
Для того, чтобы предотвратить отравление угарным газом нужно соблюдать несложные правила:
• не ночевать в гараже;
• не использовать газовую горелку или керосиновую лампу для отопления закрытого помещения;
• не оставлять в гараже машину с включенным двигателем;
• не спать в машине с включенным двигателем.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Читайте также:

