Свойства кремния полупроводниковые взаимодействие с кислородом металлами щелочами
Обновлено: 27.09.2024
Исследование и анализ природных соединений кремния (силиция). Рассмотрение его аллотропных модификаций: аморфной и кристаллической. Характеристика химических свойств кремния: взаимодействия с галогенами, кислородом, металлами, кислотами и щелочами.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 22.01.2016 |
| Размер файла | 22,8 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Государственное автономное профессиональное общеобразовательное
Учреждение РБ «Уфимский медицинский колледж»
На тему: «Свойства кремния»
Выполнила: Факкарова И.Ш.
Студентка 1-го курса
1. Происхождение кремния
Природные соединения кремния или силиция (англ. Silicon, франц. и нем. Silicium) - двуокись кремния (кремнезема) - известны очень давно. Древние хорошо знали горный хрусталь, или кварц, а также драгоценные камни, представляющие собой окрашенный в разные цвета кварц (аметист, дымчатый кварц, хальцедон, хризопраз, топаз, оникс и др.) Элементарный кремний был получен лишь в XIX в., хотя попытки разложить кремнезем предпринимались еще Шееле и Лавуазье, Дзви (с помощью Вольтова столба), Гей-Люссаком и Тенаром (химическим путем). Верцелиус, стремясь разложить кремнезем, нагревал его в смеси с железным порошком и углем до 1500° С и получил при этом ферросилиций. Лишь в 1823 r. при исследованиях соединений плавиковой кислоты, в том числе SiF4, он получил свободный аморфный кремний ("радикал кремнезема") взаимодействием паров фтористого кремния и калия. Сент Клер-Девилль в 1855 г. получил кристаллический кремний.
Название силиций или кизель (Kiesel, кремень) было предложено Берцелиусом. Еще ранее Томсон предложил название силикон (Silicon), принятое в Англии и США, по аналогии с борон (Boron) и карбон (Carbon). Слово силиций (Silicium) происходит от силика (кремнезем); окончание "а" было принято в XVIII и XIX вв. для обозначения земель (Silica, Aluminia, Thoria, Terbia, Glucina, Cadmia и др.). В свою очередь слово силика связано с лат. Silex (крепкий, кремень).
2. Нахождение в природе
Содержание кремния в земной коре составляет по разным данным 27,6--29,5 % по массе. Таким образом, по распространённости в земной коре кремний занимает второе место после кислорода.
Встречается только в виде соединений. Оксид кремния образует большое количество природных веществ - горный хрусталь, кварц, кремнезем. Составляет основу многих полудрагоценных камней - агат, аметист, яшма и др. Также кремний входит в состав породообразующих минералов - силикатов и алюмосиликатов - полевых шпатов, глин, слюд и др.
Получение
В лаборатории
Восстановлением из оксида магнием или алюминием:
SiO2 + 2Mg = Si + 2MgO;
В промышленности
Восстановлением из оксида коксом в электрических печах:
SiO2 + 2C = Si + 2CO.
При таком процессе кремний довольно сильно загрязнен карбидами кремния.
Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
Также чистый кремний получается при термическом разложении силана:
3. Физические свойства кремния
Физические свойства: кристаллический кремний обладает металлическим блеском, тугоплавкий, очень твердый, полупроводник.
Кремний образует две аллотропные модификации - аморфный и кристаллический кремний.
Кристаллический кремний - вещество темно-серого цвета с металлическим блеском, имеет кубическую структуру алмаза, но значительно уступает ему по твердости, довольно хрупок. Температура плавления 1415 °C, температура кипения 2680 °C, плотность 2,33 г/см 3 . Обладает полупроводниковыми свойствами, его сопротивление понижается при повышении температуры.
Аморфный кремний - порошок бурого цвета на основе сильно разупорядоченной алмазоподобной структуры. Обладает большей реакционной способностью, чем кристаллический кремний.
4. Химические свойства
Взаимодействие с галогенами
При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно взаимодействует только с фтором, при этом проявляет восстановительные свойства:
С хлором реагирует при нагревании до 400-600 °С:
Взаимодействие с кислородом
Измельченный кремний при нагревании до 400-600 °С реагирует с кислородом:
Взаимодействие с другими неметаллами
При очень высокой температуре около 2000 °С реагирует с углеродом:
При 1000 °С реагирует с азотом:
С водородом не взаимодействует.
Взаимодействие с галогеноводородами
С фтороводородом реагирует при обычных условиях:
с хлороводородом - при 300 °С, с бромоводородом - при 500 °С.
Взаимодействие с металлами
Окислительные свойства для кремния менее характерны, но они проявляются в реакциях с металлами, при этом образует силициды:
Взаимодействие с кислотами
Кремний устойчив к действию кислот, в кислой среде он покрывается нерастворимой пленкой оксида и пассивируется. Кремний взаимодействует только со смесью плавиковой и азотной кислот:
Взаимодействие со щелочами
Растворяется в щелочах, образуя силикат и водород:
5. Биологическое значение
Еще великий В.И. Вернадский писал: "Никакой организм не может существовать без кремния". Кремний играет важную роль в процессе усвоения других элементов: кальция, фосфора, магния, серы, калия, алюминия, натрия и др. Поэтому употреблять большое количество биологически активных добавок не имеет смысла, если в организме не хватает соединений кремния. В дополнение ко всему, необходимо отметить, что из-за недостатка кремния развиваются различные заболевания.
Считается, что кальций основной участник формирования твердости тканей, а кремний ответственен за их гибкость. К примеру, без соединений кремния потеряют эластичность:
- соединительная ткань сухожилий;
- стенки сосудов и желудочно-кишечного тракта;
- железы внутренней секреции;
- клапаны сердечно-сосудистой системы (сердца и вен).
При травмах и переломах костей в организме человека уровень кремния в костях повышается в 50 и более раз по сравнению с нормальным, здоровым состоянием. Как только происходит срастание тканей кости, содержание кремния становится прежним.
Кремний оказывает структурирующее действие на молекулы воды, что способствует удалению токсинов, грибков, вредных бактерий из организма.
В случае нехватки кремния в составе стенок сосудов, их эластичность падает. Вместе с этим уменьшается способность сосудов мозга сужаться и расширяться. Кроме того, в стенке начинают откладываться соли кальция, что еще больше снижает эластичность сосудов.
С нарушением обмена кремния связывают развитие следующих заболеваний:
Еще в 60-е годы XX века французскими учеными М. Лепгер и Ж. Лепгер были описаны факты, которые подтверждали, что у людей, страдающих атеросклерозом, зачастую очень низкий уровень кремния в тканях, составляющих основу стенки сосудов. Ученые также экспериментально доказали, что при дополнительном введении в организм соединений кремния приостанавливает формирование атеросклеротических бляшек, что позволяет длительно сохранять нормальную функцию сосудов.
Другие эффекты кремния в организме:
· стимулирующее воздействие на иммунную систему;
· улучшение роста волос и ногтей;
· уменьшение вероятности развития инфаркта и инсульта.
· алопеция (облысение) развивается в связи с гибелью волосяных фолликулов при нарушении обмена кремния.
В наибольших количествах Кремний обнаружен в плотной соединительной ткани, почках, поджелудочной железе. В суточном рационе человека содержится до 1 г Кремния. При высоком содержании в воздухе пыли оксида кремния (IV) она попадает в легкие человека и вызывает заболевание - силикоз. кремний химический аморфный
6. Пищевые источники кремния
Максимальное количество кремния содержится в нешлифованном рисе, овсяной крупе и просе. Пшеничные отруби и хлеб, сделанный из муки грубого помола, также являются доступным источником достаточного количества кремния. Включая в свой рацион шпинат, лук, сельдерей, морковь, огурцы, белокочанную капусту, человек получает данный микроэлемент. Молоко, мясо, яйца и другие продукты животного происхождения служат полноценными донорами кремния. Кроме вышеперечисленных источников, кремний содержится в следующих продуктах:
Важная особенность, которую необходимо отметить: мясная пища препятствует поступлению кремния в организм, несмотря на то, что сама является хорошим источником данного микроэлемента. Овощи и фрукты, содержащие в своем составе растительную клетчатку, улучшают всасывание кремния. Углеводная и рафинированная пища не способствует повышению содержания кремния в сыворотке крови.
Большое количество кремния содержат следующие лекарственные растения:
Дефицит кремния
Недостаток содержания кремния в организме может приводить к развитию сахарного диабета, заболеваний сердечно-сосудистой системы и злокачественных новообразований, кандидоза. Нарушения деятельности нервной системы проявляются в виде расстройства координации движений, пошатывания при ходьбе; возникают общая слабость и раздражительность, чувство страха. Со стороны желудочно-кишечного тракта наблюдается возрастание частоты возникновения воспалительных заболеваний (гастрит, энтерит).
Дефицит кремния развивается не только в случае его недостаточного поступления, но и при ряде паразитарных заболеваний. Потребность в данном микроэлементе повышается в период активного роста у детей, физических перегрузках. Снижение кислотности желудочного сока приводит к нарушению всасывания кремния в желудке и тонком кишечнике.
Избыток кремния
Избыток кремния в организме развивается у людей, которые проживают в местности с высоким содержанием соединений кремния в воде и продуктах питания, что приводит к образованию камней в почках, развитию фиброза легких и опухолей плевры, органов брюшной полости. Мочекаменная болезнь в данном случае развивается в результате повышения активности процессов, заключающихся в кристаллизации солей в моче. При вдыхании кремния он в избыточном количестве накапливается в ткани легких, что служит причиной развития силикоза (затрудняется дыхание).
Значительно реже при избытке кремния наблюдаются:
· нарушение терморегуляции (снижение температуры тела ниже 36,4 °С либо повышение выше 38°С);
· снижение проницаемости сосудов;
Кремний используется в металлургии в качестве добавки к стали, в производстве сплавов. Их него изготавливают фотоэлементы, полупроводниковые приборы для производства радиоприёмников, телевизоров, компьютеров.
Силициды используются для получения жаропрочных и кислотоупорных сплавов и высокотемпературных полупроводниковых материалов.
Монооксид кремния применяется для создания изолирующих и защитных слоев в полупроводниковых устройствах.
Диоксид кремния применяется для производства стекла, керамики, бетонных изделий и кирпича. Чистый кварц используется в приборостроении.
Уравнения реакций:
Кремний горит в кислороде, образуя диоксид кремния, или оксид кремния:
Будучи неметаллом, при нагревании он соединяется с металлами с образованием силицидов, например:
Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния -- силан:
В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды:
Повышенная реакционная способность силана по сравнению с метаном СН4 объясняется тем, что у кремния больше размер атома, чем у углерода, поэтому химические связи --Н слабее связей С--Н.
Кремний взаимодействует с концентрированными водными растворами щелочей, образуя силикаты и водород:
Кремний получают, восстанавливая его из диоксида магнием или углеродом. Оксид кремния(IV), или диоксид кремния, или кремнезем, как и С02, является кислотным оксидом. Однако в отличие от С02 имеет не молекулярную, а атомную кристаллическую решетку. Поэтому SiO2 твердое и тугоплавкое вещество. Он не растворяется в воде и кислотах, кроме, как вы знаете, плавиковой, но взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты -- силикатов.
Силикаты можно получить также сплавлением диоксида кремния с оксидами металлов или с карбонатами:
Силикаты натрия и калия называют растворимым стеклом. Их водные растворы -- это хорошо известный силикатный клей. Из растворов силикатов действием на них более сильных кислот -- соляной, серной, уксусной и даже угольной получается кремниевая кислота Н2SiO3:
Следовательно, Н2SiO3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объем раствора, превращая его в полутвердую массу, похожую на студень, желе.
Подобные документы
Строение атома кремния, его основные химические и физические свойства. Распространение силикатов и кремнезема в природе, использование кристаллов кварца в промышленности. Методы получения чистого и особо чистого кремния для полупроводниковой техники.
реферат [243,5 K], добавлен 25.12.2014
Обзор руднотермических печей, применяемых при производстве кремния. Пересчет химического состава сырья и углеродистых восстановителей, применяемых при производстве кремния в мольные количества химических элементов с учетом загрузочных коэффициентов.
курсовая работа [516,0 K], добавлен 12.04.2015
Прямое азотирование кремния. Процессы осаждения из газовой фазы. Плазмохимическое осаждение и реактивное распыление. Структура тонких пленок нитрида кремния. Влияние поверхности подложки на состав, структуру и морфологию осаждаемых слоев нитрида кремния.
курсовая работа [985,1 K], добавлен 03.12.2014
Кремний — элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д.И. Менделеева; распространение в природе. Разновидности минералов на основе оксида кремния. Области применения соединений кремния; стекло.
презентация [7,3 M], добавлен 16.05.2011
Строение электронных оболочек атомов d-элементов, их компоненты. Принципы их взаимодействия с простыми веществами (кислородом, галогенами, серой, углеродом), а также с водой, кислотами, щелочами и растворами солей. Кислотно-основные свойства гидроксидов.
контрольная работа [55,6 K], добавлен 02.04.2016
Второй по распространенности (после кислорода) элемент земной коры. Простое вещество и элемент кремний. Соединения кремния. Области применения соединений кремния. Кремнийорганические соединения. Кремниевая жизнь.
реферат [186,0 K], добавлен 14.08.2007
Химические свойства простых веществ. Общие сведения об углероде и кремнии. Химические соединения углерода, его кислородные и азотсодержащие производные. Карбиды, растворимые и нерастворимые в воде и разбавленных кислотах. Кислородные соединения кремния.
Кремний. Химия кремния и его соединений

Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :

+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :

+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl

Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:

Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:

Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Na 2 SiO 3 + 2 HCl → H 2 SiO 3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
§ 35. Кремний и его соединения
Второй представитель элементов главной подгруппы IV группы (IVА группы) Периодической системы Д. И. Менделеева — кремний Si.
В природе кремний — второй по распространённости после кислорода химический элемент. Земная кора более чем на четверть состоит из его соединений. Наиболее распространённым соединением кремния является оксид кремния (IV) SiO2, другое его название — кремнезём.
В природе он образует минерал кварц (рис. 158), многие разновидности которого — горный хрусталь и его знаменитая лиловая форма — аметист, а также агат, опал, яшма, халцедон, сердолик, известны как поделочные и полудрагоценные камни. Из оксида кремния (IV) состоят также обычный и кварцевый песок.

Рис. 158.
Кристаллы кварца, вкраплённые в доломит
Из разновидностей минералов на основе оксида кремния (IV) (кремня, халцедона и др.) первобытные люди изготовляли орудия труда. Именно кремень, этот невзрачный и не очень прочный камень, положил начало каменному веку — веку кремнёвых орудий труда (рис. 159). Причин этому две: распространённость и доступность кремня, а также его способность образовывать при сколе острые режущие края.

Рис. 159.
Орудия каменного века
Второй тип природных соединений кремния — это силикаты. Среди них наиболее распространены алюмосиликаты (понятно, что эти силикаты содержат химический элемент алюминий). К алюмосиликатам относят гранит, различные виды глин, слюды. Силикатом, не содержащим алюминия, является, например, асбест, из которого изготавливают огнеупорные ткани.
Оксид кремния (IV) SiO2 необходим для жизни растений и животных. Он придаёт прочность стеблям растений и защитным покровам животных (рис. 160). Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезём.

Рис. 160.
Оксид кремния (IV) придаёт прочность стеблям растений и защитным покровам животных
Соединения кремния придают гладкость и прочность волосам и ногтям человека.
Кремний входит и в состав низших живых организмов — диатомовых водорослей и радиолярий, нежнейших комочков живой материи, которые создают свои непревзойдённые по красоте скелеты из кремнезёма (рис. 161).

Рис. 161.
Скелеты диатомовых водорослей (а) и радиолярий (б) состоят из кремнезёма
Свойства кремния. Вы пользуетесь микрокалькулятором с солнечной батарейкой и поэтому имеете представление о кристаллическом кремнии. Это полупроводник. В отличие от металлов, с повышением температуры его электропроводность увеличивается. На спутниках, космических кораблях, станциях и крышах домов (рис. 162) устанавливают солнечные батареи, преобразующие солнечную энергию в электрическую. В них работают кристаллы полупроводников, и в первую очередь кремния. Кремниевые фотоэлементы могут превратить в электрическую до 10% поглощённой солнечной энергии.

Рис. 162.
Солнечная батарея на крыше дома
Кремний горит в кислороде, образуя уже известный вам оксид кремния (IV):
Будучи неметаллом, при нагревании кремний соединяется с металлами с образованием силицидов, например:
Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния — силан:

В отличие от углеводородов, силан на воздухе самовоспламеняется и сгорает с образованием оксида кремния (IV) и воды:
Повышенная реакционная способность силана по сравнению с метаном СН4 объясняется тем, что размер атома у кремния больше, чем у углерода, поэтому химические связи Si—Н менее прочные, чем связи С—Н.

Кремний получают, восстанавливая его из оксида кремния (IV) магнием или углеродом:

Оксид кремния (IV), или диоксид кремния, или кремнезём SiO2, как и СO2, является кислотным оксидом. Однако в отличие от С02 имеет не молекулярную, а атомную кристаллическую решётку. Поэтому SiO2 твёрдое и тугоплавкое вещество. Он не растворяется в воде и кислотах, кроме, как вы знаете, плавиковой, но взаимодействует при высоких температурах с щелочами с образованием солей кремниевой кислоты — силикатов:
Силикаты можно получить также сплавлением оксида кремния (IV) с оксидами металлов или с карбонатами:

Силикаты натрия и калия называют растворимым стеклом. Их водные растворы — это хорошо известный силикатный клей.
Из растворов силикатов действием на них более сильных кислот — соляной, серной, уксусной и даже угольной получается кремниевая кислота H2SiO3 (рис. 163):

Рис. 163. Качественная реакция на силикат-ион
Следовательно, H2SiO3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объём раствора, превращая его в полутвёрдую массу, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество — силикагель, широко применяемый в качестве адсорбента — поглотителя других веществ.
Лабораторный опыт № 40
Получение кремниевой кислоты и изучение её свойств
Применение кремния. Вы уже знаете, что кремний применяют для получения полупроводниковых материалов, а также кислотоупорных сплавов. При сплавлении кварцевого песка с углём при высоких температурах образуется карбид кремния SiC, который по твёрдости уступает только алмазу. Поэтому его используют для затачивания резцов металлорежущих станков и шлифовки драгоценных камней.
Из расплавленного кварца изготавливают различную кварцевую химическую посуду, которая может выдерживать высокую температуру и не трескается при резком охлаждении.
Соединения кремния служат основой для производства стекла и цемента.
Обычное оконное стекло имеет состав, который можно выразить формулой Na2O • СаО • 6SiO2. Его получают в специальных стекловаренных печах сплавлением смеси соды, известняка и песка.
Отличительная особенность стекла — способность размягчаться и в расплавленном состоянии принимать любую форму, которая сохраняется при застывании стекла. На этом основано производство посуды и других изделий из стекла.
Дополнительные качества стеклу придают различные добавки. Так, введением оксида свинца получают хрустальное стекло, оксид хрома окрашивает стекло в зелёный цвет, оксид кобальта — в синий и т. д. (рис. 164).

Рис. 164.
Изделия из цветного стекла
Стекло — одно из древнейших изобретений человечества. Уже 3—4 тыс. лет назад производство стекла было развито в Египте, Сирии, Финикии и Причерноморье.
Стекло — это материал не только ремесленников, но и художников. Высокого совершенства достигли мастера Древнего Рима, которые умели получать цветные стёкла и делать из их кусочков мозаики.

Рис. 165.
Цветное стекло в витражах собора Нотр-Дам, Шартр
Произведения искусства из стекла являются обязательными атрибутами любого крупного музея, и цветные витражи церквей, мозаичные панно — яркие тому примеры (рис. 165). В одном из помещений Санкт-Петербургского отделения Российской академии наук находится мозаичный портрет Петра I, выполненный М. В. Ломоносовым (рис. 166).

Рис. 166.
Мозаичный портрет Петра I
Области применения стекла очень обширны. Это оконное, бутылочное, ламповое, зеркальное стекло; стекло оптическое — от стёкол очков до стёкол фотокамер; линзы бесчисленных оптических приборов — от микроскопов до телескопов.
Другой важный материал, получаемый на основе соединения кремния, — цемент. Его получают спеканием глины и известняка в специальных вращающихся печах.
Если порошок цемента смешать с водой, то образуется цементное тесто, или, как его называют строители, «цементный раствор», который постепенно затвердевает. При добавлении к цементу песка или щебня в качестве наполнителя получают бетон. Прочность бетона возрастает, если в него вводится железный каркас, — получается железобетон, из которого изготавливают стеновые панели, блоки перекрытий, фермы мостов и т. д.
Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор (рис. 167), фаянс и изделия из них.

Рис. 167.
Фарфоровые изделия
Открытие кремния. Хотя уже в глубокой древности люди широко использовали в быту соединения кремния, сам кремний был впервые получен в 1824 г. шведским химиком Й. Я. Берцелиусом. Однако за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями.
Латинское название силициум берёт своё начало от латинского слова силекс— «кремень». Русское название «кремний» происходит от греческого кремнос — «утёс, скала».
Химические свойства кремния

Кремний – твёрдый неметалл, входящий в состав горных пород. При обычных условиях инертен, но при нагревании проявляет окислительные и восстановительные свойства. Химические свойства кремния использует силикатная промышленность для изготовления стекла, зеркал, электроники, строительного материала.
Общее описание элемента
Кремний расположен в четвёртой группе и третьем периоде таблицы Менделеева. Ядро атома кремния имеет положительный заряд +14. Вокруг ядра движется 14 отрицательно заряженных электронов.
Атом может переходить в возбуждённое состояние за счёт свободного d-подуровня. Поэтому элемент проявляет две положительные степени окисления (+2 и +4) и одну отрицательную (-4). Электронная конфигурация – 1s 2 2s 2 2p 6 3s 2 3p 2 .
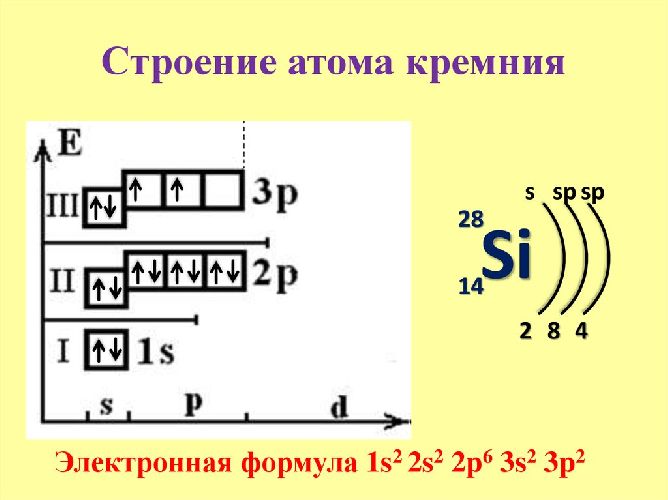
Рис. 1. Строение атома кремния.
Кремний – хрупкий полупроводник с высокими температурами правления и кипения. Относительно лёгкий неметалл: плотность составляет 2,33 г/см 3 .

Рис. 2. Агат.
Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдаёт электроны. Реакции возможны только при сильном нагревании. При нормальных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
Элемент
Описание
Реакция
При обычных условиях
Взаимодействует при 600°C с образованием диоксида (песка)
Реагирует при 400°C
Реагирует при 2000°C с образованием карборунда
Протекает при 1000°C
Реагирует при 1000°C
Взаимодействует при 2000°C
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Окислительные свойства кремний проявляет только в реакциях с металлами. При сплавлении образуются соли – силициды:
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
Уравнение
Реагирует с плавиковой кислотой при обычных условиях, с соляной кислотой – при 300°С, с бромоводородом – при 500°С
Является устойчивым по отношению к кислотам, покрываясь оксидной плёнкой. Реакция идёт только со смесью азотной и плавиковой кислот
В водных растворах растворяется, образуя силикаты и водород
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.
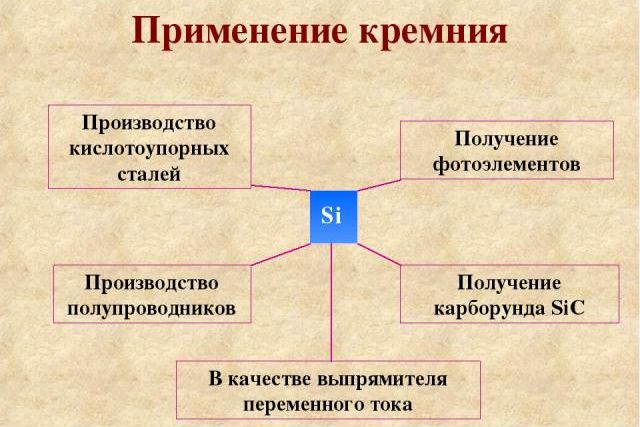
Рис. 3. Применение кремния.
Что мы узнали?
Кремний – хрупкий неметалл, взаимодействующий с металлами, неметаллами и сложными веществами. В реакциях с металлами проявляет свойства окислителя, с неметаллами – восстановителя. Реагирует при нормальных условиях только с фтором, плавиковой кислотой (в том числе вместе с азотной кислотой), со щелочами. Остальные реакции протекают при повышенных температурах.
Читайте также:
