Связь между ионами металла и блуждающими электронами называется
Обновлено: 19.09.2024
Ионы -это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь характерна между атомами металлов и неметаллов, при этом электроны перемещаются из внешнего слоя металлов во внешний слой неметаллов.
Те атомы, которые легко теряют электроны и становятся положительными ионами, условно называют электроположительными, тогда как атомы, принимающие электроны, условно называют электроотрицательными. Например:
Электроположительность Мg равна +2; электроотрицательность О равна – 2.
Ионных соединений сравнительно немного. Ионная связь в молекулах солей, щелочей, основных оксидов: NaF, NaCl, Na2O, MgO, Ca(OH)2 и др.
Классификация ионов:
1. Простые (Cl - , K + )
3. Гидратированные (в растворах и кристаллогидратах – CuSO4·5H2O)
4. Негидратированные (безводные соли – CuSO4)
5. Катионы – положительно заряженные частицы (H + , Na + , K + , Cu 2+ )
6. Анионы – отрицательно заряженные частицы (Cl - ,SO4 2- , PO4 3- , OH - )
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис , где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl - , NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.

Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь. Физические свойства металлов. Водородная связь. Водородная связь, ее роль в формировании структур биополимеров.
Если ионная, ковалентная, металлическая химические связи являются внутримолекулярными, то особый вид межмолекулярного взаимодействия представляет водородная связь.
Название этого типа связи показывает, что в ее образовании принимает участие атом водорода. Водородная связь может рассматриваться как некоторая дополнительная связь, которую проявляет атом водорода, уже связанный в молекуле ковалентной связью с другим атомом.
Атом водорода образует водородную связь лишь с атомами определенных элементов, к которым относятся атомы Р, С1, О, S, N. Эти атомы сильно стягивают на себя общую электронную пару, что вызывает появление у них эффективного отрицательного заряда и приводит к превращению атома водорода в протон, почти лишенный электрона.
В отличие от других положительных ионов положительный ион водорода не имеет электронов, поэтому не отталкивается электронными облаками названных выше отрицательно заряженных атомов, а только притягивается. Так как размеры протона во много раз меньше размеров других ионов, то это позволяет ему ближе подходить к другим частицам. Водородная связь и является причиной ассоциации молекул некоторых водородных соединений. Так, например, во фтороводороде существуют не только молекулы НF, но и ассоциированные агрегаты (НF)2 и (НF)3:
В обычной воде за счет водородной связи существуют ассоциированные молекулы состава (Н2О)n, где: n — 2, 3, 4, 5…
Простые молекулы H2O существуют в парообразном состоянии.
Существование ассоциатов у воды и является причиной различных аномалий воды.
Водородной связью называется химическая связь, образованная атомом водорода, связанного с атомом другого элемента, который обладает большим значением электроотрицательности.
· Водородная связь обозначается пунктирной линией.
· Водородную связь могут иметь разнородные молекулы.
· Например: воды и спирта:
· Водородная связь менее прочная, чем ковалентная связь.
Металлическая связь.
Элементы, атомы которых легко теряют электроны, образуют металлическую связь. Таким свойством обладают металлы.Однако и у неметаллов при известных условиях, например у фосфора при сверхвысоком давлении, атомная связь переходит в металлическую связь. У металла висмута в твердом состоянии наряду с металлической связью имеется атомная связь.
При достаточном сближении атомов металла происходит их взаимодействие, при этом электроны утрачивают связи со своими атомами и становятся общими для всего комплекса. Следовательно, металлическая связь проявляется в твердом и жидком состоянии металла, тогда как в газообразном состоянии молекулы металла представляют собой отдельные атомы, почти не действующие друг на друга.
В металлах имеются положительно заряженные ионы, атомы и перемещающиеся между ними общие «полусвободные» электроны. Эти«полусвободные» электроны легко подвижны, непрочно связаны с томом и становятся одновременно общими для всех атомов. Поэтому металлы характеризуются высокой электрической проводимостью и теплопроводностью, сравнительно легко излучают электроны при нагревании и облучении их светом.
Химическая связь, основанная на обобществлении валентных электронов, принадлежащих всем атомам в кристалле, получила название металлической связи.
Металлической связью называют связь в металлах и сплавах между атом-ионами металлов, осуществляемую относительно свободными общими валентными электронами
Металлическая связь довольно прочная, особенно в тяжелых металлах, чем объясняются их высокие температуры плавления и кипения.
Агрегатные состояния веществ и. Твердое, жидкое и газообразное состояния веществ. Переход вещества из одного агрегатного состояния в другое. Чистые вещества и смеси. Понятие о смеси веществ. Гомогенные и гетерогенные смеси. Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидкоми газообразном.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решетки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях.
В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью.
По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические.
Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
Теоретический материал по теме "Типы химической связи"
Химическая связь – это взаимодействие, связывающее отдельные атомы в более сложные системы.
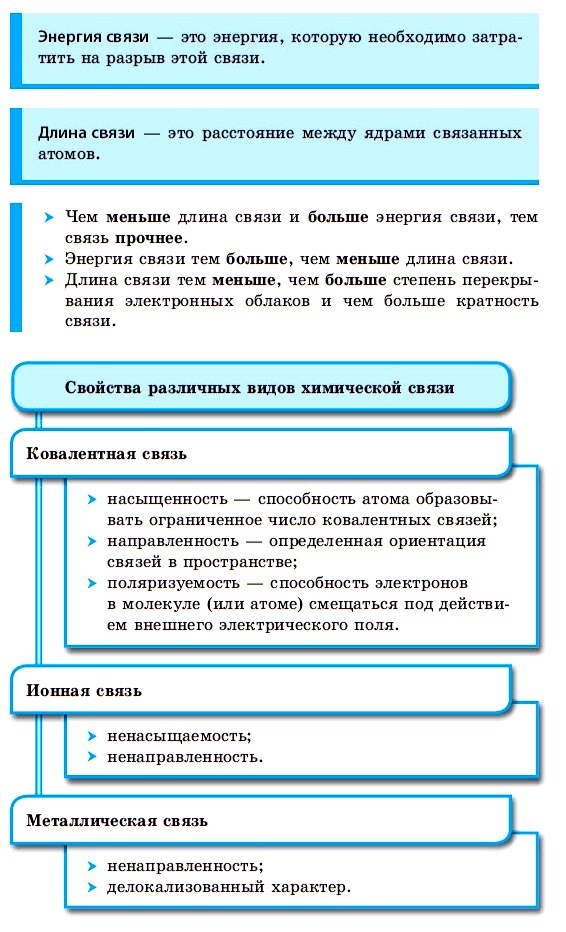
• ковалентная (полярная и не полярная)
1. Ковалентная – возникает в результате образования общих электронных пар между двумя атомами = обобществления электронов
Возникает между атомами неметаллов
1.а) Между атомами одинаковых неметаллов – ковалентная неполярная
Общая электронная пара принадлежит обоим атомам одинаково. Отсутствует смещение электронной плотности* к одному из атомов.
*Электронная плотность — плотность вероятности обнаружения электрона в данной точке конфигурационного пространства.

Важно! Благородные газы НЕ образуют ковалентных связей, так как обладают устойчивым числом электронов на внешнем уровне. Газы существуют в форме свободных атомов.
1.б) Между атомами неметаллов, незначительно отличающимися по электроотрицательности – ковалентная полярная
В данной связи электронная пара смещается к более электроотрицательному атому.
Электроотрицательность можно определить по таблице – чем ближе к F, тем выше электроотрицательность (способность притягивать к себе электроны).
При этом на атоме, от которого смещается электронная пара возникает частичный положительный заряд. На атоме, к которому смещается электрон - частично отрицательный. Заряд – «дельта»
Важно понимать, что ни один из атомов полностью не отдаёт и не принимает электрон, они только смещаются.
Основные характеристики ковалентной связи:
- Энергия связи – это энергия, которую необходимо затратить на разрыв связи
- Длина связи – это расстояние между ядрами связанных атомов
- Полярность связи – неравномерное распределение между атомами электронной плотности. Чем выше разность электроотрицательности – тем выше полярность
Два механизма образования ковалентной связи:
• обменный (HCl, H2S, NH3) – каждый атом предоставляет для
образования связи свои неспаренные электроны
• донорно-акцепторный – связь образуется за счет не поделённой электронной пары одного атома и свободной орбитали другого атома
Пример – образование катиона аммония

2. Ионная связь – осуществляется за счет электростатического притяжения противоположно заряженных ионов.
Возникает из-за перехода электронов от атома металла к атому неметалла.

Примеры веществ: оксиды и галогениды металлов (BaO, NaCl), щелочи, соли кислородосодержащих кислот
3. Металлическая связь – связь между положительными ионами в кристалле металла, которую осуществляют обобществленные валентные электроны («электронный газ»)
Атомы металлов легко превращаются в положительно заряженные электроны. Освободившиеся электроны свободно перемещаются по всему кристаллу и осуществляют связь между ионами.

4. Водородная связь – это связь между положительно поляризованным атомом водорода и другим отрицательно поляризованным атомом
Может возникать между двумя молекулами – например молекулами воды или аммиака
Или между отдельными частями внутри одной молекулы (например салициловой кислоты или белка)
Водородная связь возникает между водородом и сильно
электроотрицательным элементом – N, O и F
Образование химических связей обусловлено перераспределением электронов между атомами: иногда атомы полностью отдают/принимают электроны, превращаясь в ионы (как в ионной связи), а иногда электрон только частично переход к другому атому (ковалентная связь).
Частичный «условный заряд», который принимает атом при данном перераспределении электронов – называется степенью окисления атома.
Степень окисления – это условный заряд атомов в химическом соединении, который определяется из предположения, что все связи ионные.
Электроны «отдаются» - положительная степень окисления атома
Электроны «принимаются» - отрицательная степень окисления атома
Сумма всех степеней окисления в соединении = 0
Степень окисления атомов в простом веществе = 0
Чтобы рассчитывать степень окисления, нужно знать постоянные степени окисления:
Связь между ионами металла и блуждающими электронами называется
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.

Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.

При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:

В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.

В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.

Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов: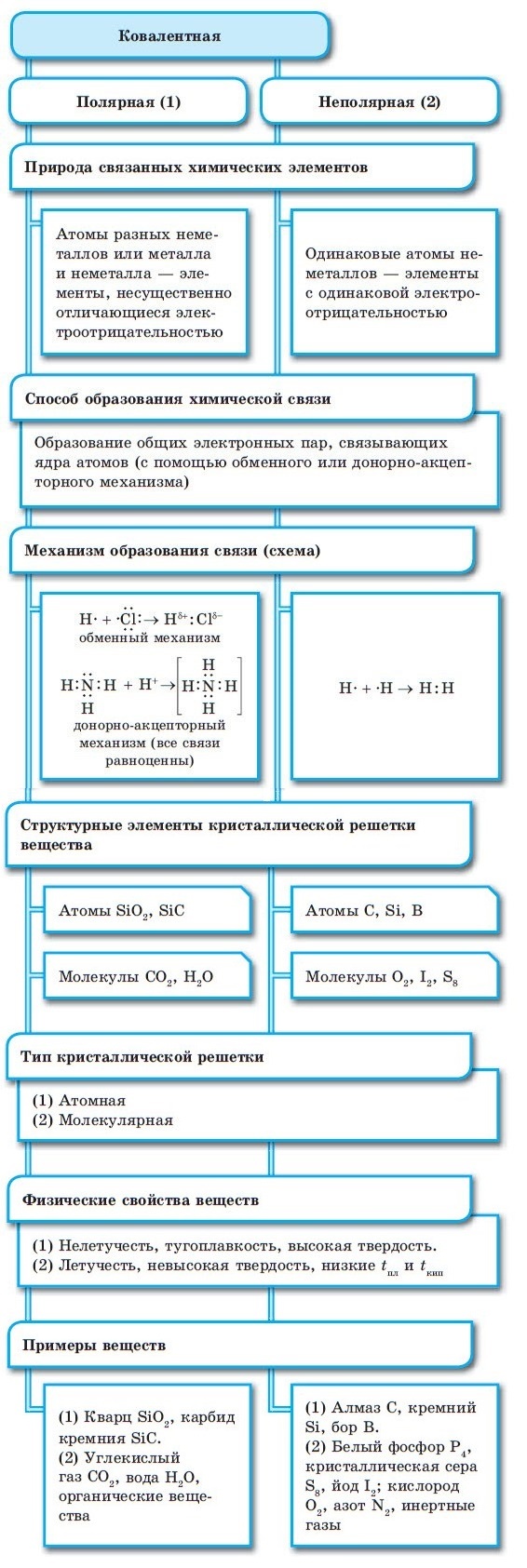

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Связь между всеми положительно заряженными ионами и свободно перемещающимися в междоузлиях кристаллической решетки электронами называется металлической
Она возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
5.3 История развития представлений об образовании химической связи
Э. Франкленд в 1852 предложил концепцию, согласно которой каждый элемент образует соединения, связываясь с определённым числом эквивалентов др. элементов, при этом один эквивалент соответствует количеству, требуемому одной валентностью. Ф. А. Кекуле и А. В. Г. Кольбе в 1857 в соответствии с представлениями валентности выдвинули положение, что углерод обычно имеет валентность 4, образует 4 связи с др. атомами. А. С. Купер в 1858 указал, что атомы углерода, связываясь между собой, могут образовывать цепочки. В его записи химические формулы имели очень большое сходство с современными, связи изображались чёрточками, соответствующими валентным связям между атомами. Термин «химическое строение» впервые ввёл А. М. Бутлеров в 1861. Он подчёркивал, сколь существенно выражать строение единой формулой, показывающей, как в молекуле соединения каждый атом связан с др. атомами. Согласно Бутлерову, все свойства соединения предопределяются его молекулярным строением; он высказал уверенность, что точную структурную формулу можно установить по результатам изучения путей синтеза данного соединения. Следующий шаг, заключавшийся в приписывании молекулам пространственной трёхмерной структуры, был сделан в 1874 Я. Х. Вант-Гоффом и Ж. А. Ле Белем.
В 19 в. валентная связь изображалась чёрточкой между символами двух химических элементов. Природа этой связи была совершенно неизвестна. После открытия электрона делались многочисленные попытки развить электронную теорию химической связи. Наиболее успешными были работы американского ученого Г. Н. Льюиса, который в 1916 предложил рассматривать образование химической связи, называемой теперь ковалентной связью, как результат того, что пара электронов становится общей для двух атомов.
Согласно теории химической связи, наибольшей устойчивостью обладают внешние оболочки из двух или восьми электронов (электронные группировки благородных газов). Атомы, имеющие на внешней оболочке менее восьми (или иногда двух) электронов, стремятся приобрести структуру благородных газов. Такая закономерность позволила В. Косселю и Г. Льюису сформулировать положение, которое является основным при рассмотрении условий образования молекулы: «При образовании молекулы в ходе химической реакции атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки».
Разработка квантовой механики (1925) и использование многих экспериментальных методов (молекулярной спектроскопии, рентгенографии кристаллов, газовой электронографии, методов изучения магнитных свойств) для определения длин связей (межатомных расстояний), углов между связями, числа неспаренных электронов и других структурных параметров молекул и кристаллов привели к более глубокому пониманию природы химической связи.
Образование ковалентной связи можно рассматривать в рамках двух методов квантовой химии: методавалентных связейи метода молекулярных орбиталей.
Метод валентных связей
Предположения Льюиса о том, что химическая связь образуется за счет обобществления двух электронов послужили основой для развития метода валентных связей.
Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. Такая химическая связь называется ковалентной.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам и находится на орбитали, образовавшейся за счет перекрывания двух атомных орбиталей.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные
облака. Связь образуется в том случае, когда в атомные волновые функции образующие связь будут иметь одинаковые знаки в области перекрывания.
3) Химическая связь в методе ВС является двухцентровой и локализована в области между ядрами двух атомов ее образующих.
Метод валентных связей (ВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. B образовании химической связи принимают участие валентные электроны.
Валентностьатома в данном соединении – это количество общих электронных пар, которые данный атом образует по обменному и донорно-акцепторному механизму с другими атомами. Например, валентность азота в аммиаке (NH3) равна трем, а в ионе аммония (NH4 + ) – четырем.
Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Гибридизация орбиталей
Для объяснения фактов, когда атом образует большее число связей, чем число неспаренных электронов в его основном состоянии (например, атом углерода), в методе валентных связей (ВС) используется постулат о гибpидизации близких по энергии атомных орбиталей.
Читайте также:
