Связь между структурой и свойствами металлов и сплавов
Обновлено: 17.05.2024
Рассмотрим ряд основополагающих определений и понятий.
Сплав – вещество, полученное сплавлением двух и более элементов (компонентов). Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называются металлическим сплавом.
По количеству компонентов сплавы соответственно называются двойными, тройными и многокомпонентными.
Структурные составляющие – обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями.
Система – совокупность тел (твердых, жидких) в определенном объеме при определенных внешних условиях, взятых для исследования.
Компонент – простейшая часть (вещество) из образующих систему. В металлических сплавах компонентами являются элементы (металлы и неметаллы) и химические соединения (не диссоциирующие при нагревании)
Фаза – однородная часть системы, имеющая физическую границу раздела (поверхность), при переходе через которую химические состав или структура изменяются скачком.
2.1. Строение сплавов
Чистые металлы находят довольно ограниченное применение. Основными конструкционными материалами являются металлические сплавы. В основном сплавы получают путём кристаллизации жидкого расплава нескольких металлов, но могут быть и другие пути – спеканием, диффузией, осаждением и другие.
Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях и образуют однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла.
При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. По характеру взаимодействия компонентов все сплавы подразделяются на три основных типа: механические смеси, твердые растворы и химические соединения.
Механическая смесь двух компонентов образуется, если они не способны к взаимодействию или взаимному растворению.
Каждый компонент при этом кристаллизуется в свою кристаллическую решетку. Структура механических смесей неоднородная, состоящая из отдельных зерен компонента А и компонента В. Свойства механических смесей зависят от количественного соотношения компонентов.
Если механическая смесь образуется при первичной кристаллизации, она называется эвтектической, если в результате вторичной – эвтектоидной.
Твердые растворы образуются, когда один компонент растворяется в другом. Тогда в твердом состоянии атомы одного компонента входят в кристаллическую решетку другого. Если атомы кристаллической решетки одного компонента А частичного замещаются атомами другого В, образуются твердые растворы замещения, рис. 2.1а. Твердые растворы замещения образуются элементами, атомные радиусы которых отличаются не более чем на 8 – 15%, но и в этом случае кристаллическая решетка растворителя искажается, не утрачивая своего строения.
Если атомы растворимого компонента В внедряются в пустоты решетки растворителя А, то образуются твердые растворы внедрения (рис. 2.1б). Следовательно, атомы растворимого элемента должны быть соизмеримы с пустотами кристаллической решетки растворителя. Концентрация твердых растворов внедрения не может быть высокой – не более 1…2%.

Рис. 2.1. Схемы твердых растворов замещения (а) внедрения (б)
Твердый раствор имеет однородную структуру и одну кристаллическую решетку. Обозначают твердые растворы буквами греческого алфавита α, β, γ, δ и т.д.
Химическое соединение образуется, если компоненты сплава А и В вступают в химическое взаимодействие. Химическое соединение имеет свою кристаллическую решетку, которая отличается от кристаллических решеток компонентов. При этом сохраняется кратное соотношение компонентов, что позволяет выразить состав химического соединения формулой А n В m .
Свойства химического соединения резко отличаются от свойств образующих его компонентов при этом они, как правило, обладают большой твердостью и хрупкостью (карбиды, нитриды и др.). Химическое соединение имеет однородную структуру, состоящую из одинаковых по составу и свойствам зерен, и может играть роль компонента в сплавах.
2.2. Диаграммы состояния двойных сплавов
Диаграмма состояния – графическое изображение состояния сплава изучаемой системы в зависимости от концентрации в нем компонентов и температуры. Диаграмма состояния показывает равновесные, устойчивые состояния сплава, т.е. такие, которые при данных условиях обладают минимальной свободной энергией.
Построение диаграмм состояния осуществляют различными экспериментальными методами. Наиболее часто используется метод термического анализа. Он заключается в том, что составляют несколько сплавов с различной концентрацией компонентов, расплавляют их и медленно охлаждают, фиксируя время охлаждения и температуру.
По полученным данным строят серию кривых охлаждения в координатах: время (τ, сек) – температура (t,°С), на которых наблюдают точки перегибов и температурные остановки – критические точки фазовых переходов (рис. 2.2).
Рис. 2.2. Кривая охлаждения сплава
В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур, поэтому на кривых охлаждения сплавов есть две критические точки. В верхней критической точке, называемой точкой ликвидус (tл), начинается кристаллизация. В нижней критической точке - солидус (tс) кристаллизация завершается.
Диаграмму строят в координатах температура – концентрация. Линии диаграммы разграничивают области одинаковых фазовых состояний. Для построения диаграммы состояния используют большое количество кривых охлаждения для сплавов различных концентраций. При построении диаграммы критические точки переносятся с кривых охлаждения на диаграмму (оси температура – концентрация) и соединяются линией. В получившихся на диаграмме областях записывают фазы или структурные составляющие. Линия начала кристаллизации сплавов на диаграмме называется линией ликвидус, а линия окончания кристаллизации – солидус.
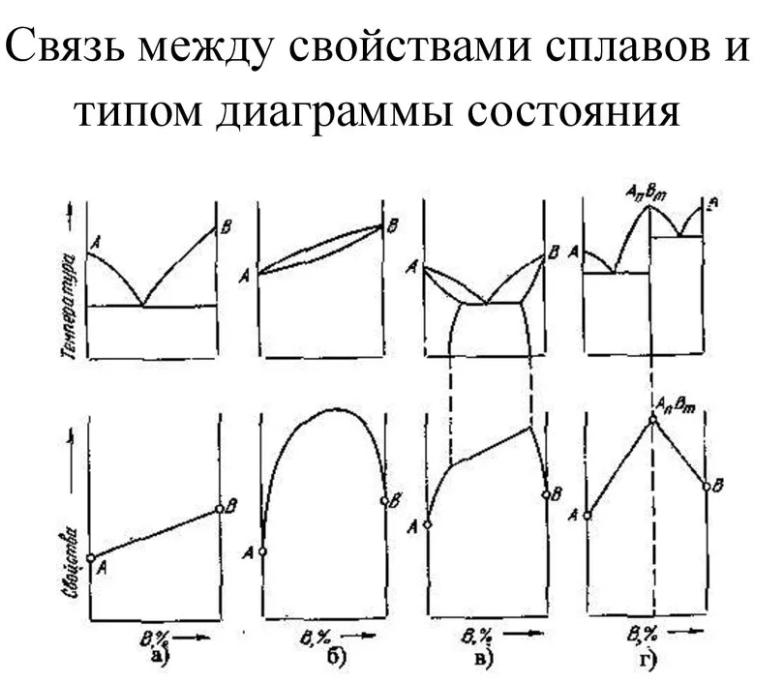
Вид диаграммы зависит от того, как взаимодействуют между собой компоненты.
Диаграмма состояния сплавов,
образующих механические смеси чистых компонентов (1 тип)
Рассмотрим кривые охлаждения нескольких сплавов системы А – В, имеющих различный состав (рис. 2.3). Кристаллизация чистого компонента А (100%) начинается в т.1 и заканчивается в т.1*, протекая при постоянной температуре. Выше этой температуры компонент А находится в жидком состоянии, ниже – в твердом. Аналогично происходит кристаллизация чистого компонента В.
Кривая охлаждения сплава (60% А + 40%В) аналогична кривым охлаждения чистых компонентов. На ней имеется также только одна температурная остановка 2-2*, т.е. кристаллизация происходит при постоянной температуре. Особенность кристаллизации этого сплава заключается в том, что происходит одновременная кристаллизация обоих компонентов – появляются и растут кристаллы, образуя мелкокристаллическую механическую смесь обоих компонентов (А+В).
Механическая смесь двух или более разнородных кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой (от эвтэо (греч.) – легкоплавкий). Сплав, отвечающий составу эвтектики, называют эвтектическим сплавом. Он имеет постоянную и минимальную температуру плавления (кристаллизации) для сплавов данной системы и постоянный химический состав.

Рис. 2.3. Диаграмма состояния сплавов, образующих механические смеси
чистых компонентов, состав сплавов: 1 – 100%А, 2 – 80%А+20%В,
3 – 60%А+40%В, 4 – 20%А+80%В, 5 – 100%В
Кристаллизация сплава (80%А + 20%В) происходит иначе. На кривой имеются две кристаллические точки: точка перегиба 1 и температурная остановка 2-2*. Выше т.1 сплав находится в жидком состоянии, в т.1 появляются первые зародыши кристаллов компонента А – начало кристаллизации. Выделение и рост зерен А продолжается до т.2. При этой температуре жидкий сплав, вследствие удаления из расплава компонента А в виде твердых кристаллов, приобретет эвтектический состав (60%А + 40%В) и при постоянной температуре, равной эвтектической, произойдет одновременная кристаллизация обоих компонентов (А+В), т.е. произойдет эвтектическое превращение.
Сказанное в равной степени относится и к сплаву (20%А + 80%В), отличие состоит лишь в том, что на участке 1–2 происходит образование и рост зерен компонента В. Для этих сплавов характерной особенностью является то, что кристаллизация на участке 1–2 происходит в интервале температур.
Полученные критические точки перенесем на диаграмму, где координатами будут концентрация и температура. Если затем соединить линией все точки начала кристаллизации (линия АСВ) и точки окончания кристаллизации линия (ДСF), то получим диаграмму состояния системы А – В. Линия АСВ – геометрическое место точек ликвидус, называется линией ликвидус. Линия ДСF – линией солидус. Выше линии ликвидус находится жидкость (расплав), ниже линии солидус – сплавы находятся в твердом состоянии. Сплав, отвечающий составу эвтектики (точка С), как уже указывалось, называется эвтектическим. Сплавы, находящиеся левее точки С, называют доэвтектическими. Их структура – избыточные кристаллы А и эвтектика (А+В). Сплавы, расположенные правее точки С, – заэвтектические, их структура кристаллы – В и эвтектика (А+В). Из этого следует что А, В и эвтектика (А+В) являются структурными составляющими сплавов.
Диаграмма состояния сплавов с неограниченной растворимостью
компонентов в твердом состоянии (2 тип)
Для таких сплавов возможно образование двух фаз: жидкого сплава Ж и твердого раствора α. На диаграмме две линии, верхняя – ликвидус и нижняя – солидус (рис. 2.4).

Рис. 2.4. Диаграмма состояния сплавов с неограниченной растворимостью
Диаграмма состояния сплавов с ограниченной растворимостью
в твердом состоянии (3 тип)
В таких сплавах могут существовать три фазы: жидкий раствор (Ж), твердый раствор компонента В в компоненте А – (α) и твердый раствор компонента А в компоненте В – (β). Эта диаграмма содержит в себе элементы двух предыдущих (рис. 2.5).

Рис. 2.5. Диаграмма состояния сплавов с ограниченной растворимостью
компонентов в твердом состоянии
Линия АСВ – линия ликвидус, линия АЕСFВ – линия солидус. Линия ЕСF – линия эвтектики. Таким образом, здесь также образуется эвтектика, доэвтектические и заэвтектические сплавы. Линия РЕ – линия ограниченной растворимости компонента В в компоненте А, по этой линии происходит выделение вторичных кристаллов β II (вследствие уменьшения растворимости компонента В в компоненте А с понижением температуры). Процесс выделения вторичных кристаллов называется вторичной кристаллизацией.
Диаграмма состояния сплавов, образующих устойчивые химические соединения (4 тип)

Рис. 2.6. Диаграмма 4 типа
Такая диаграмма характеризуется наличием вертикальной линии, соответствующей соотношению компонентов в химическом соединении АnВ m (рис. 2.6). Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых устойчивым химическим соединением и одним из компонентов. На рисунке представлена диаграмма для случая, когда каждый из компонентов образует с химическим соединением механическую смесь.
2.3. Пластическая деформация, наклеп и рекристаллизация
Пластическая деформация – это необратимая деформация, т.е. ее влияние на форму, структуру и свойства тела сохраняются после снятия нагрузки. При пластической деформации зерна деформируются, вытягиваются в направлении деформации, образуется волокнистая структура, увеличивается число дислокаций. При этом прочность и твердость металла повышается, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом, или нагартовкой.
Волокнистое строение и наклеп можно устранить при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве. Снимается искажение кристаллической решетки. Этот процесс называется возвратом (рис. 2.7). Но волокнистая структура при этом сохраняется.
При нагреве до более высоких температур в металле происходит образование новых равноосных зерен. Такой процесс называют рекристаллизацией. Наклеп при этом снимается полностью. Различают рекристаллизацию первичную и собирательную.
Рекристаллизация первичная (участок 1–2 на рис. 2.7) заключается в образовании зародышей и росте новых равновесных зерен с неискаженной кристаллической решеткой.
Собирательная рекристаллизация – вторая стадия процесса, заключающаяся в росте образовавшихся новых зерен. Рост зерен обусловлен стремлением системы к более равновесному состоянию за счет уменьшения внутренней поверхности зерен. Особенность собирательной рекристаллизации – вторичная рекристаллизация – рост отдельных зерен за счет других. Основными факторами, определяющими величину зерен, являются температура, продолжительность выдержки при нагреве и степень деформации.

Рис. 2.7. Схема изменения структуры и свойств наклепанного металла
при возврате (отдыхе) и рекристаллизации
Температура, при которой идет процесс рекристаллизации, называется температурой рекристаллизации. Абсолютная температура рекристаллизации
где а – коэффициент, зависящий от структуры и состава металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3 – 0,4, для сплавов а = 0,5 – 0,6.
На практике наклеп устраняют рекристаллизационным отжигом.
Если деформирование происходит при температуре выше температуры рекристаллизации, то наклепа не происходит. Такая деформация называется горячей. Деформация, которая происходит при температуре ниже температуры рекристаллизации, называется холодной.
Связь между структурой и свойствами сплавов
При образовании твердого раствора предел прочности, текучести и твердость повышаются при сохранении достаточно высокой пластичности. При образовании твердого раствора внедрения прочность во много раз больше, чем при образовании твердого раствора замещения той же концентрации.
Сочетание повышенной прочности и хорошей пластичности позволяет использовать твердые растворы как основу конструкционных сплавов.
Благодаря высокой пластичности сплавы — твердые растворы легко деформируются, но плохо обрабатываются резанием. Такие сплавы имеют низкие литейные свойства.
При образовании твердых растворов значительно увеличивается электросопротивление. Поэтому сплавы — твердые растворы широко применяют для изготовления проволоки электронагревательных элементов и реостатов.
Для получения высоких литейных свойств концентрация компонентов в сплавах должна превышать их предельную растворимость в твердом состоянии и приближаться к эвтектическому составу. Эвтектические сплавы обладают хорошей жидкотекучестью. Но при появлении в структуре сплава эвтектики сильно снижается его пластичность. Поэтому в деформируемых сплавах содержание компонентов не превышает величины предельной растворимости при эвтектической температуре.
Химические соединения, образующиеся в сплавах, обладают свойствами, резко отличающимися от свойств исходных компонентов. Они имеют очень высокую твердость, но хрупки. Химические соединения имеют большое значение в качестве твердых структурных составляющих в сплавах.
Диаграммы состояния сплавов
Для определения количества фаз в сплаве, их состава пользуются диаграммами фазового равновесия — диаграммами состояния. Диаграмма состояния — графическое изображение фазового состава сплава в состоянии равновесия или близком к нему в зависимости от содержания компонентов в сплаве и от температуры.
Температуры, при которых изменяются строение и свойства (происходят фазовые превращения) металлов и сплавов, называют критическими точками. Чистые металлы имеют одну критическую точку, которой является температура плавления (кристаллизации). Они плавятся и затвердевают при одной и той же постоянной температуре. В отличие от чистых металлов сплавы плавятся и кристаллизуются в интервале температур, т. е. они имеют две критические точки — температуру начала кристаллизации (полного расплавления) и температуру полного затвердевания (начала плавления) при охлаждении расплава (при нагревании сплава).
В расплавленном состоянии металлы обычно неограниченно растворимы друг в друге. В твердом состоянии их взаимная растворимость может изменяться.
Рассмотрим диаграмму состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (рис. 6).
Система состоит из двух компонентов А и В, полностью растворимых друг в друге в твердом состоянии. Ось абсцисс показывает изменение концентрации растворенного компонента В от 0 до 100 %, ось ординат — температуру, при которой рассматривается состояние системы.
Вертикальная линия, соответствующая чистому компоненту А (0 % В), является диаграммой состояния компонента А. При нагревании чистого компонента А он находится в твердом состоянии до температуры ТА, которая является температурой плавления (соответственно и температурой кристаллизации). При этой температуре компонент А плавится и выше этой критической точки находится в жидком состоянии.
Вертикальная линия, соответствующая чистому компоненту В (100 % В), является диаграммой состояния компонента В. Критическая точка — температура плавления Тв.
Сплав с содержанием 50 % В (вертикальная линия I), так же как и другие сплавы системы, имеет две критические точки Ts — температура начала плавления (конца кристаллизации) и TL — температура конца плавления (начала кристаллизации). Интервал температур от Ts до TL — это интервал плавления (кристаллизации) сплава.
Выше температуры TL сплав находится в расплавленном состоянии, представляет собой однофазную систему. Линия, соответствующая температурам, выше которых сплав полностью расплавлен, называется линией ликвидус (линия TATLTB на рис. 6).
Ниже температуры Ts сплав представляет собой твердый раствор L, система однофазна. Линия, соответствующая температурам, ниже которых сплав находится полностью в твердом состоянии, называется линией солидус (линия TATSTB на рис. 6).
В интервале кристаллизации TL — Ts сплав представляет собой двухфазную систему: часть сплава находится в жидком состоянии (расплав), остальной сплав в твердом состоянии (кристаллы L — твердого раствора).
Рассмотрим диаграмму состояния компонентов с ограниченной растворимостью друг в друге в твердом состоянии (рис. 7).
ТА И ТВ — температуры плавления компонентов А и В соответственно. Линия ТАСТВ — линия ликвидус. Линия TAECDTB — линия солидус.
Предельная растворимость компонента В в компоненте А соответствует точке F, компонента А в компоненте В — точке G. В интервале концентраций, соответствующих точкам Fn G, компоненты А и В друг в друге нерастворимы. После кристаллизации сплавы таких концентраций представляют собой двухфазную систему, состоящую из α и β — твердых растворов.
Сплав, соответствующий проекции точки С, является самым легкоплавким и называется эвтектическим. Этот сплав кристаллизуется (плавится) при постоянной температуре, при этом из расплава кристаллизуются одновременно две твердые фазы (α и β-растворы). Такой процесс называется эвтектическим превращением.
Эвтектика — это механическая смесь нескольких твердых фаз, одновременно кристаллизующихся при постоянной температуре из расплава.
Сплавы, относящиеся к области левее точки С до точки Е, называются доэвтектическими, правее точки С до точки D — заэвтектическими.
Связь между структурой и свойствами сплавов
Между составом и структурой сплава, определяемой типом диаграммы состояния, и свойствами сплава существует определенная зависимость.
Для получения высоких литейных свойств концентрация компонентов в сплавах должна превышать их предельную растворимость в твердом состоянии и приближаться к эвтектическому составу. Эвтектические сплавы обладают хорошей жидкотекучестью. Но при появлении в структуре сплава эвтектики сильно снижается его пластичность. Поэтому в деформируемых сплавах содержание компонентов не превышает величины предельной растворимости при эвтектической температуре.
Структурные составляющие железоуглеродистых сплавов
Железоуглеродистые сплавы могут иметь следующие структурные составляющие.
Феррит (Ф) — твердый раствор внедрения углерода и других элементов в α-железе. Имеет объемно-центрированную кубическую решетку. Растворимость углерода в феррите очень мала: при комнатной температуре до 0,005 %; наибольшая растворимость 0,02 % при 727°С. Феррит высокопластичен и мягок, хорошо обрабатывается давлением в холодном состоянии.
Аустенит (А) — твердый раствор углерода и других элементов в у-железе. Существует только при высоких температурах. Предельная растворимость углерода в γ-железе 2,14 % при температуре 1147°С и 0,8 % при 727°С. Эта температура является нижней границей существования аустенита в железоуглеродистых сплавах. Аустенит высокопластичен, но более тверд, чем феррит.
Цементит (Ц) — химическое соединение железа с углеродом (карбид железа Fe3C). В цементите содержится 6,67 % углерода. Температура плавления цементита около 1600°С. Имеет сложную кристаллическую решетку. Самая твердая и хрупкая составляющая железоуглеродистых сплавов. Цементит неустойчив и в определенных условиях распадается с образованием свободного углерода в виде графита по реакции:
Fe3C → 3Fe + С.
Чем больше цементита в железоуглеродистом сплаве, тем выше его твердость.
Графит — аллотропическая модификация углерода. Графит мягок, прочность его очень низкая. В чугунах и графитизированной стали содержится в виде включений различных форм. Форма графитовых включений влияет на механические и технологические свойства сплава.
Перлит (П) — механическая смесь феррита и цементита, содержащая 0,8 % углерода. Образуется при перекристаллизации (распаде) аустенита при температуре 727°С. Этот распад называется эвтектоидным, а перлит — эвтектоидом. Перлит обладает высокими прочностью, твердостью и повышает механические свойства сплава.
Ледебурит — механическая смесь аустенита и цементита, содержащая 4,3 % углерода. Образуется в результате эвтектического превращения при температуре 1147°С. При температуре 727°С аустенит превращается в перлит, и после охлаждения ледебурит представляет собой смесь перлита с цементитом. Ледебурит имеет высокую твердость и большую хрупкость. Содержится во всех белых чугунах
Введение
Метериаловедение - это прикладная наука, изучающая связи между строением (или структурой), составом и свойствами материалов. Кратко в математической форме это можно выразить следующим образом:
Свойства = f (химический состав, структура)
Структура материала весьма чутко реагирует на внешние механические, термические и физические воздействия. Поэтому закономерности влияния этих факторов на структуру и, в конечном счете, свойства материалов также является предметом изучения материаловедения.
Курс «Материаловедение» состоит из двух разделов: первый- теоретические основы материаловедения. В этом разделе изучаются свойства материалов, а также влияние на эти свойства эксплуатационных факторов; атомно-кристаллическое строение металлов и сплавов; диаграммы состояния; формирование структуры и свойств при кристаллизации и пластической деформации; диаграмма железоуглеродистых сплавов; теория термической обработки.
Во втором разделе изучаются структура и свойства конкретных классов материалов (практическое материаловедение).
Все материалы, применяемые в машиностроении, исходя из их природы, можно разделить на следующие основные группы:
1. Металлические материалы, к которым относятся:
сплавы на основе железа – чистое железо, стали, чугуны;
стали и сплавы с особыми физическими свойствами (магнитные и немагнитные стали и сплавы, аморфные сплавы, сплавы с высоким электрическим сопротивлением, сплавы с эффектом памяти формы и т.д.);
цветные металлы и сплавы – алюминий и сплавы на его основе (деформирующиеся и литейные; упрочняемые и не упрочняемые термической обработкой), медь и сплавы на ее основе (латуни, бронзы), титан и сплавы на его основе, подшипниковые сплавы и др.
композиционные материалы с металлической матрицей;
2. Неметаллические материалы:
полимерные органические материалы – пластмассы (термореактивные и термопластичные), резины;
композиционные материалы с неметаллической матрицей (стекло-пластики, углепластики, оргпластики и др.);
неорганические материалы (стекло, ситаллы, керамика);
Кроме того, возможна классификация конструкционных материалов по свойствам, определяющим выбор материала для конкретных деталей конструкций. Каждая группа материалов оценивается соответствующими критериями, обеспечивающими работоспособность в эксплуатации.
В соответствии с выбранным принципом классификации все конструкционные материалы подразделяют на следующие группы:
материалы, обеспечивающие жесткость, статическую и циклическую прочность (стали);
материалы с особыми технологическими свойствами;
материалы с высокими упругими свойствами;
материалы с малой плотностью;
материалы с высокой удельной прочностью;
материалы, устойчивые к воздействию температуры и рабочей среды.
Свойства металлов и сплавов
При выборе материала исходят из комплекса свойств, которые подразделяют на механические, физические, химические и технологические.
Физические свойства определяют поведение материалов в тепловых, гравитационных, электромагнитных и радиационных полях. К физическим относятся такие свойства материалов как плотность, теплоемкость, температура плавления, термическое расширение, магнитные характеристики, теплопроводность, электропроводность.
Под химическими свойствами понимают способность материалов вступать в химическое взаимодействие с другими веществами, сопротивляемость окислению, проникновению газов и химически активных веществ. Характерным примером химического взаимодействия среды и металла является коррозия.
Технологические свойства металлов и сплавов характеризуют их способность подвергаться горячей и холодной обработке. Комплекс этих свойств включает в себя технологичность при выплавке, горячем и холодном деформировании, обработке резанием, термической обработке и, особенно, сварке.
При конструировании изделий в первую очередь руководствуются механическими свойствами материалов.
Механические свойства материалов характеризуют их способность сопротивляться деформированию и разрушению под действием различного рода нагрузок. Механические нагрузки могут быть статическими, динамическими и циклическими. Кроме того, материалы могут подвергаться деформации и разрушению как при разных температурных условиях, так и в различных, в том числе агрессивных средах. Для того, чтобы обеспечить надежную работу конкретных машин и приборов, необходимо учитывать условия эксплуатации, т.е. к материалу предъявляют эксплуатационные требования.
К основным механическим свойствам относят прочность, упругость, ударную вязкость, пластичность, твердость.
Для определения механических свойств материалов разработаны различные методы испытаний. При статических методах материал подвергают воздействию постоянной силы, возрастающей весьма медленно. При динамических испытаниях материал подвергают воздействию удара или силы быстро возрастающей.
Определение прочности, пластичности, упругости
Прочность – способность материала сопротивляться разрушению под действием внешних сил.
Пластичность – способность материала к пластической деформации, т.е. к получению остаточного изменения формы и размеров без разрушения.
Упругость – свойство материала восстанавливать свои размеры и форму после прекращения действия нагрузки.
Прочность, пластичность и упругость материала определяют при статических испытаниях на растяжение.
Рис. 3.1. Статические испытания на растяжение:
а – схема испытания; б – диаграмма растяжения
Испытания производятся на цилиндрических (или плоских) образцах с определенным соотношением между длиной l0 и диаметром d0. Образец растягивается под действием приложенной силы P (рис. 1.1.) до разрушения. Внешняя нагрузка вызывает в образце напряжение и деформацию. Напряжение σ – это отношение силы P к площади поперечного сечения F, МПа:
,
Деформация характеризует изменение размеров образца под действием нагрузки, %
100,где l – длина растянутого образца. Деформация может быть упругой (исчезающей после снятия нагрузки) и пластической (остающейся после снятия нагрузки).
При испытаниях строится диаграмма растяжения, представляющая собой зависимость напряжения от деформации (рис.3.1.).
После проведения испытаний определяются следующие характеристики механических свойств:
Предел упругости σу – это максимальное напряжение, при котором в образце не возникают пластические деформации.
Предел текучести – напряжение, вызывающее пластическую деформацию, равную 0,2%.
Предел прочности (или временное сопротивление)Относительное удлинение после разрыва l0, %:
· 100,
где lk – длина образца после разрыва.
Относительным сужением после разрыва· 100,
где Fk – площадь поперечного сечения образца в месте разрыва. Относительное удлинение и относительное сужение являются характеристиками пластичности.
Твердость – способность материала сопротивляться проникновению в него другого тела.
Твердость материала испытывается при статическом характере вдавливания в него шарика, конуса или пирамиды.
Наиболее широкое применение нашли методы определения твердости по Бринеллю, Роквеллу и Виккерсу (рис. 3.2.).
Твердость по Бринеллю (НВ) определяется вдавливанием в испытываемую поверхность под нагрузкой Р стального шарика диаметром Д (рис.3.2, а).
После снятия нагрузки на поверхности образца остается отпечаток (лунка).
Твердость определяется по формуле
НВ =где F – площадь поверхности отпечатка.
Рис. 3.2. Схемы определения твердости:
а – по Бринеллю; б – по Роквеллу; в – по Виккерсу
Практически величину твердости определяют не по формуле, а по прилагаемой к прибору таблице в зависимости от диаметра отпечатка.
Между твердостью по Бринеллю и пределом прочности металла существует приближенная зависимость
Для сталиТвердость по Роквеллу определяют по глубине отпечатка. Метод основан по вдавливании в испытуемый образец закаленного стального шарика диаметром 1,588 мм (шкала В) или алмазного конуса с углом при вершине 120 0 (шкалы А и С). Вдавливание производится под действием двух нагрузок – предварительной Р0, равной 100 Н и окончательной Р, равной 600, 1000, 1500 Н для шкал А, В и С соответственно. Число твердости по Роквеллу HRA, HRB и HRC определяется по разности глубин вдавливания в условных единицах.
Твердость по Виккерсу определяют вдавливанием в испытываемую поверхность (шлифованную или даже полированную) четырехгранной алмазной пирамиды с углом при вершине 136 0 . Метод используют для определения твердости деталей малой толщины и тонких поверхностных слоев, имеющих высокую твердость. Число твердости по Виккерсу HV определяется отношением приложенной нагрузки к площади поверхности отпечатка.
Практически величину твердости определяют не по формуле, а по прилагаемым к прибору таблицам по измеренной величине d (диагональность отпечатка) рис. 3.2, в.
Определение ударной вязкости
Для оценки вязкости материалов и установления их склонности к переходу из вязкого в хрупкое состояние проводят испытания при динамических нагрузках.
Метод основан на разрушении образца с надрезом (рис. 3.3., а) посередине одним ударом маятникового копра (рис. 3.3, б).
Рис. 3.3. Схема испытания образца на маятниковом копре
КС = А/F, Дж/м 2 , где А работа, затраченная на разрушение образца; F площадь поперечного сечения образца в месте надреза, м; КС ударная вязкость, индексы V,U (KC V, КС U) характеризуют форму надреза.
Лекция 1
Часть 1. Металловедение и термическая обработка металлов.
Введение. Строение и свойства чистых металлов.
1. Предмет и содержание науки «Материаловедение».
2. Классификация материалов и требования к ним.
3. Металлы и их свойства. Металлическая связь.
4. Кристаллическое строение металлов. Типы кристаллических решеток.
5. Анизотропия свойств металлов.
Материаловедение – это наука, изучающая взаимосвязь между составом, строением и свойствами материалов. С развитием техники расширяется ассортимент используемых материалов. Наряду с традиционными, появляются новые материалы, требующиеся в различных областях народного хозяйства и обладающие особыми свойствами. Подобно тому, как 32 буквы алфавита или 7 нотных знаков создают все многообразие языка и музыки, так и элементы таблицы Менделеева позволяют получить неисчислимое множество материалов с разнообразными свойствами. В их числе магнитные, теплопрочные и тугоплавкие, спеченные порошковые материалы, композиционные материалы, ситаллы (стекло – кристаллы или стекло и керамика) и др.
Во все времена технический прогресс всегда был и будет связан с материалами.
Именно с новыми материалами связывают ученые и инженеры решение задач, стоящих перед обществом. Взять, к примеру, управляемую термоядерную реакцию, которая обеспечит человечество энергией на миллионы лет. Сейчас практическая реализация научных идей сдерживается из-за отсутствия мощных сверхпроводящих магнитов. Удастся создать подобные соленоиды, значит осуществится управляемая термоядерная реакция. Нет – решение проблемы века отложится на 10-ти летия. В формуле «технология – материал – технология» заключается одна из важнейших функций материала и его влияние на научно-технический прогресс. Например, титан.
Курс «Материаловедение» включает 2 части. 1 – Материаловедение и термическая обработка металлов; 2 – неметаллические материалы (полимеры, керамика, стекло, резина и т.д.).
Очевидные успехи в создании современных неметаллических материалов должны бы несколько снизить темпы развития некоторых металлургических процессов, но металлы в целом сохранят свое значение как основной материал в машиностроении и в большинстве других отраслей народного хозяйства еще несколько десятилетий. По самым смелым прогнозам, полимеры и композиты уже должны были к 1990 году вытеснить не более 10-ти % черных и около 30% цветных металлов. Для нашей цивилизации металлы останутся незаменивыми, потребность в них будет расти и впредь.
Чтобы изучать материаловедение, необходимо выяснить общее для всех материалов. Для большинства технических материалов характерно кристаллическое строение. Это позволяет с единых позиций рассмотреть закономерности формирования кристаллической структуры и свойств, определяемых природой связи между атомами. Улучшение характеристик уже имеющихся материалов достигается корректировкой химического состава и внешними воздействиями (тепловым, пластическим деформированием). Создаются и принципиально новые материалы.
Металловедение изучает зависимость между составом, строением и свойствами металлов и сплавов и закономерности их изменения под воздействием внешних факторов (тепловых, химических, механических, электромагнитных и радиоактивных).
Впервые осуществление связи между строением стали и ее свойствами было установлено Павлом Петровичем Аносовым (1799-1851г.г.). [Ю. Г. Гуревич «Загадка булатного узора». Знание, 1985, 190 с.]. Имеется в виду секрет булата, основанный на термической обработке.
Основоположником металловедения как науки является Дмитрий Константинович Чернов – русский металлург (1839-1921 гг.). Он показал, что сталь в твердом состоянии при нагреве или охлаждении подвергается фазовым превращениям, вызывающим значительные изменения ее свойств. Д. К. Чернов – основатель современной теории кристаллизации металлов.
Большая роль в развитии металловедения принадлежит н. С. Курнакову (нач. ХХ в.), применившему физико-химические методы анализа для исследования металлов. Им было изучено большое количество систем, построены диаграммы состояния и установлены зависимости между составом, структурой и свойствами различных сплавов.
Кристаллическое строение металлических сплавов и фаз было установлено в начале 20-х годов благодаря широкому использованию рентгеновского анализа, позволившему изучить изменения строения в зависимости от обработки сплава.
Важнейшие исследования в этой области были проведены советскими учеными Г. В. Вульфом, С. С. Штейнбергом, Г. В. Курдюмовым и др. Выполняли их и зарубежные ученые: М. Лауэ и П. Дебай (Германия). У. Г. Брэгг (Англия и др.
В развитие термической обработки большой вклад внесли современные исследователи н. А. Минкевич, Н. Г. Гудцов, А. А. Бочвар.
Металловедение не может не развиваться и в настоящее время. За последние годы созданы новые виды термической и химико-термической обработки стали, разработаны основы легирования стали, созданы коррозионно-стойкие, высокопрочные стали и сплавы, а также стали и сплавы на основе Al, Ti и других металлов. Все более широко применяются редкие металлыи их сплавы.
Металловедение тесно свяхано с другими науками – общетехническими (физхимия, химсопромат) и технологическими (технология конструкционных материалов), специальными.
Все материалы, применяемые в машиностроении, целесообразно разделить на 2 основные группы: металлические и неметаллические.
К металлическим относятся металлы и их сплавы. В природе приблизительно 4/5 всех элементов приходится на долю черных и цветных металлов.
Железо и сплавы на его основе (сталь, чугун) принято называть черными металлами. Сюда же можно отнести тугоплавкие металлы (W, V, Mo).
К цветным металлам относятся:
б) тяжелые (γ > 5 г/см 3 ) – Cu, Ni, Pb (8,9; 8,9; 11,34).
в) легкоплавкие – Zn, Cd, Hg, Bi, Sn (419,5; 321; -38,9 °С тпл/кр; 271; 232 °С).
г) благородные металлы – Ag, Au, Pt, Pd, Os.
Неметаллические материалы могут быть органического и неорганического происхождения. К органическим относятся полимерные материалы (пластмассы, каучуки, резина), углеграфитные материалы, дерево.
Неорганические материалы подразделяются на:
а) горные породы; б) керамические материалы; в) искусственные плавленые силикатные материалы (стекло, эмали).
Материалы должны обладать необходимой механической прочностью и достаточным запасом пластичности.
Ежегодно 1/3 металлических материалов выходит из строя в результате коррозии, поэтому важным требованием является высокая коррозионная стойкость.
В ряде отраслей техники необходима высокая жаропрочность, т.е. способность материалов сохранять необходимую прочность при работе в области высоких температур.
При низких температурах металлы могут переходить в хрупкое состояние. Для предотвращения этого металл должен обладать стойкостью к хладноломкости.
Во всех случаях учитывается экономическая целесообразность использования того или иного материала. Иногда предъявляются специфические требования, например, определенная степень чистоты.
Известно в настоящее время 80 металлов. Они занимают 4/5 всех клеточек таблицы Менделеева. Металлам характерны следующие свойства:
Высокая тепло - и электропроводимость.
Положительный коэффициент электрического сопротивления. С повышением температуры электрическое сопротивление возрастает. Большое число металлов (примерно 30) обладают сверхпроводимостью. При температуре, близкой к абсолютному 0 электрическое сопротивление этих металлов скачкообразно падает до 0.
Способность испускать электроны при нагреве (термоэлектронная эмиссия).
Отражательная способность, непрозрачность и металлический блеск.
Повышенная способность к пластической деформации. При наличии этих свойств достигается так называемое металлическое состояние вещества.
Металлоиды, в отличие от металлов, как правило, хрупки, не обладают металлическим блеском, характеризуются низкой тепло- и электропроводимостью и отрицательным коэффициентом электрического сопротивления.
Все наиболее характерные свойства металлов объясняются наличием в них легкоподвижных электронов проводимости.
Как известно, атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Различают внешние (валентные) электроны, связь которых с ядром незначительна и внутренние – более прочно связанные с ядром.
Внешние электроны способны отщепляться от атомов и находится в относительно свободном состоянии, образуя электронный газ. Положительно заряженные ионы стягиваются отрицательно заряженным электронным газом в кристалл.
Атомы в металлах располагаются близко один к другому. Это означает, что наблюдается значительное перекрывание орбиталей внешних электронов и что валентные электроны фактически связаны не с отдельным ядром, а делокализованы по всем атомам металла. Таким образом, металл представляет собой ионно-электронную систему, устойчивость которой определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами. Такое взаимодействие между ионами и электронным облаком называется металлической связью.
Сила связи в металле определяется силами отталкивания и силами притяжения между ионами и электронами, не имеющими резко выраженного направленного характера.
Атомы или ионы располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной.
Различают 4 типа металлической атомной связи – ионную, ковалентную, полярную и металлическую.
Ионная связь возникает у разнородных атомов, когда какой-либо из них отдает с внешней оболочки, а другой принимает 1 или несколько электронов. Образующиеся при этом положительные и отрицательные ионы с завершенными внешними оболочками благодаря электрическим силам взаимно притягиваются.
Ковалентная связь возникает обычно у одинаковых атомов и осуществляется парами валентных электронов, которые одновременно принадлежат 2-м соседним ионам, находящимся в узлах решетки. Связь имеет резкую направленность и высокую прочность. Этот тип связи характерен для соединений углерода.
Полярная связь возникает вследствие смещения электронной плотности в молекулах к более электроотрицательному атому и появления слабого электрического притяжения.
Приведенные положения позволяют объяснить характерные свойства металла.
Электрическая проводимость – наличием в металле свободных электронов, которые под влиянием разности потенциалов перемещаются от отрицательного полюса к положительному. С повышением температуры усиливаются колебательные движения ионов, что затрудняет прямолинейное движение электронов, в результате чего возрастает электрическое сопротивление.
При низких температурах колебательное движение ионов сильно уменьшается и электропроводимость возрастает. У некоторых металлов в результате упорядоченного движения пар электронов при очень низких температурах (< 20 0 К) электрическая проводимость обращается в ∞ (сверхпроводимость).
Высокая теплопроводимость металлов обусловливается как большой подвижностью свободных электронов, так и колебательными движениями ионов, вследствие чего происходит быстрое выравнивание температуры в массе металла.
Высокая пластичность металла объясняется периодичностью их атомной структуры и ненаправленностью металлической связи. В процессе пластической деформации (ковка, прокатка), т.е. при смещении объемов металла, связь между ионами не нарушается.
Направленность – важнейшее свойство ковалентной связи, определяющее геометрию молекулы. Причина направленности заключается в том, что перекрывание облаков, образующих химическую связь, происходит в направлении набольшей плотности их (наибольшей вытянутости), например, Cl2 ∞∞.
Кристаллы с ковалентной связью хрупки, т.к. при деформации связь нарушается.
Все металлы и их сплавы – тела кристаллические и, в отличие от аморфных тел с хаотичным расположением атомов, в металлах они расположены закономерно.
Металлы, полученные обычным способом, поликристалличны и состоят из большого числа мелких (10 -1 ÷ 10 -5 см) различно ориентированных по отношению другш к другу кристаллов, имеющих неправильную форму (вследствие условий кристаллизации) и называемых кристаллитами или зернами.
Гипотеза о закономерности расположения частиц в кристаллах была выдвинута в 1860 году Е. С. Федоровым и доказана в 1912 году м. Лауэ с помощью рентгеноструктурного анализа.
Косвенным доказательством кристалличности строения металлов может служить термический анализ. Если tзатв=f(τ) и для чистых металлов строго постоянна, то график охлаждения вещества будет иметь следующий вид:

Т.е. закономерности неодинаковы для кристаллических и аморфных веществ.
Переход кристаллического вещества из жидкого состояния в твердое происходит при температуре кристаллизации (Ткр.). Процесс перехода протекает в определенный промежуток времени и сопровождается выделением скрытой теплоты кристаллизации. Поэтому, несмотря на охлаждение металлов, температура в течение данного времени остается неизменной (горизонтальный участок). Скрытая теплота затвердевания компенсирует потерю тепла в пространстве.
Затвердевание аморфного вещества происходит постепенно без резко выраженной границы между жидким и твердым состоянием.
Структура (строение) аморфного вещества характеризуется беспорядочной пространственной сеткой, в узлах которой расположены ионы, атомы или гр. атомов.
Для описания кристаллической структуры веществ пользуются понятием кристаллической решетки.
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл.
Для металлов характерны сравнительно простые типы кристаллических решеток с высокой плотностью упаковки атомов. Расположение атомов в кристалле удобно изображить в виде так называемых элементарных кристаллических ячеек. Это наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме.
Простая кубическая (на долю одной элементарной ячейки – 1 атом)
Объемноцентрированная (ОЦК) кубическая.
Кубическую решетку определяет длина ребра куба [а] = ангстрем, А
А о =10 -10 м=10 -8 см α-Fe, W, V, Mo
4.Гексагональная плотноупакованная (ГПУ)
Размеры характеризуются const значением c/d=1,633. При иных соотношениех c/d получается неплотноупакованная решетка. Mg, Zn, Re, Os.
Геометрию и плотность упаковки элементарных частиц в кристалле отражают такие понятия, как координационое число (КЧ) и коэффициент компактности (КК). Координационное число определяет число ближайших равноудаленных элементарных частиц.
Коэффициент компактности определяет отношение объема всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки.

При образовании твердого раствора важен предел прочности
Существует четкая взаимосвязь между составом и структурой сплава, которая определяется типом диаграммы состояния и характеристиками сплава.
При образовании твердого раствора прочность на растяжение, предел текучести и твердость увеличиваются, сохраняя при этом достаточно высокую ductility. In при образовании твердого раствора входного типа прочность во много раз больше, чем при образовании замещенного твердого раствора той же концентрации.
Сочетание повышенной прочности и отличной пластичности позволяет использовать твердые растворы в качестве основы для конструкционных сплавов.
Благодаря своей высокой пластичности сплав-твердый раствор легко деформируется, но обработка резанием оказывается недостаточной. Такие сплавы обладают низкой Литейной способностью.
- За счет образования твердого раствора электрическое сопротивление значительно возрастает. Поэтому сплав-твердый раствор широко используется в производстве проволочных нагревательных элементов и реостатов.
Получения высоких литейных свойств
Для получения высоких литейных свойств концентрация компонентов в сплаве превышает конечную растворимость в твердом состоянии и должна приближаться к эвтектическому составу. Эвтектический сплав обладает хорошей текучестью.
Однако, когда эвтектика появляется в структуре сплава, его пластичность значительно снижается. Поэтому в кованых сплавах содержание компонентов не превышает значения предельной растворимости при эвтектической температуре.
- Соединения, образующиеся в сплаве, имеют значительно отличающиеся свойства от свойств исходного компонента. У них очень высокая твердость, но они рассыпчатые. Соединение очень важно как твердый структурный компонент сплава.
В состав сплава входят металлы (железо, медь, алюминий, никель и др.) и неметаллические элементы (углерод).Соединения, находящиеся в рассматриваемом интервале температур, если они не диссоциируют на составные части, могут быть компонентом. Количество компонентов, составляющих систему (сплав), может быть различным.
Чистые металлы-это однокомпонентные системы.
Техническая ценность материала зависит от структуры и выражается в его свойствах, например, сплав 2 металлов-2 компонента.
Структура материала характеризуется его структурой. Структура-это набор стабильных связующих элементов materials. It обеспечивает его целостность и сохранение основных характеристик, наряду с внешними и внутренними модификациями. Структура материала определяется многими факторами: строением атомов, ионов, молекул, распределением электронов в нем, типами связей между частицами. В зависимости от назначения изделия, металлы и сплавы нуждаются в определенных свойствах.
Сплавы, допускающие горячую и холодную обработку
Эти свойства подразделяются на 4 группы: физические, химические, механические и технические. Чистый металл после кристаллизации всегда состоит из одного и того же типа мелких кристаллов. Из злаков того же химического состава. Ряд частиц (кристаллитов) одного и того же химического состава называется фазой. Все чистые металлы однофазны. В отличие от чистых металлов, процесс формирования сплава значительно сложнее. Результаты кристаллизации редко становятся ясными.
Это обусловлено взаимной растворимостью компонентов, условиями охлаждения и последующей термообработкой. Если сплав состоит из частиц одинакового химического состава, то он однофазный (однородный).
Если образуются кристаллы различного химического состава, то сплав считается многофазным(гетерогенным) и его фазовый состав определяется типом образующихся кристаллов.
Зерно в разных фазах может сосуществовать по-разному. Структура частиц невидима невооруженным глазом, но она доступна только для микроскопического исследования тонких, полированных и вытравленных деталей.
Схема микроструктур сплавов
Механические, технологические и другие свойства в конечном счете определяются фазовым составом и структурными компонентами. Этим объясняется целесообразность наличия большого количества сплавов, химический состав которых часто»незначительно» отличается.
Существует четкая взаимосвязь между фазовым составом и свойствами сплава. Однофазные сплавы на основе ненасыщенных α-растворов пригодны для холодной и горячей деформации, так как обладают высокой пластичностью при низких и высоких температурах.
- Поскольку при изменении температуры не происходит фазового превращения, исключается возможность термического упрочнения, и поэтому отверждается только холодная деформация. 。Многофазные сплавы с низкой пластичностью или хрупкими фазами имеют пониженную пластичность.
Фазовый состав и свойства сплавов
Обычно они ограничиваются обработкой давлением (например, только в «горячем»или» холодном » состоянии) или вообще не деформируются.
| Реферат на тему | На заказ | Образец и пример |
| Связь между структурой и свойствами сплавов | Большинство различных металлических материалов, используемых в технологии, являются сплавами. | Чистые металлы не используются в технологии, поскольку они характеризуются низкой прочностью на растяжение. |
Сплавы, содержащие компоненты, растворимость которых изменяется, допускают термическое упрочнение (за счет закалки и последующего старения).
Сплавы с составом, близким к эвтектическому, обладают повышенными литейными свойствами (из-за отсутствия крупных первичных кристаллов используются бывшие эвтектические сплавы).
Образовательный сайт для студентов и школьников
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Читайте также:
