Таблица менделеева цветные металлы
Обновлено: 16.05.2024
Периодическая система элементов Д. И. Менделеева
Таблица Менделеева - это, вероятно, одна из наиболее часто используемых таблиц. Вряд ли найдется хотя бы один человек старше 14 лет, который ни разу не слышал о ней. Это неудивительно, ибо эта таблица - кладезь полезной информации для любого химика. Напомню основное.
- В каждой ячейке данной таблицы указаны название химического элемента, его символ, порядковый номер и приближенное значение атомной массы.
- Порядковый номер элемента совпадает с количеством протонов в ядре атома данного элемента и с количеством электронов в атоме.
- Элементы, расположенные в таблице Менделеева в одной группе (в одном вертикальном ряду) и в одной подгруппе, имеют похожие свойства.
- Свойства элементов в периодах (горизонтальных рядах) изменяются похожим образом. Например, 2-й и 3-й периоды включают 8 элементов, начинаются со щелочного металла, заканчиваются благородным газом.
Последние два пункта - следствия периодического закона , который в современной формулировке звучит так:
Свойства элементов и образуемых ими соединений находятся в периодической зависимости от заряда ядра атома.
Периодический закон Менделеева - один из основных законов химии, а таблица, которую мы обсуждаем, является лишь средством, позволяющим наглядно выразить этот закон.
Я предлагаю вам несколько вариантов таблицы Менделеева:
Классический вариант таблицы Менделеева
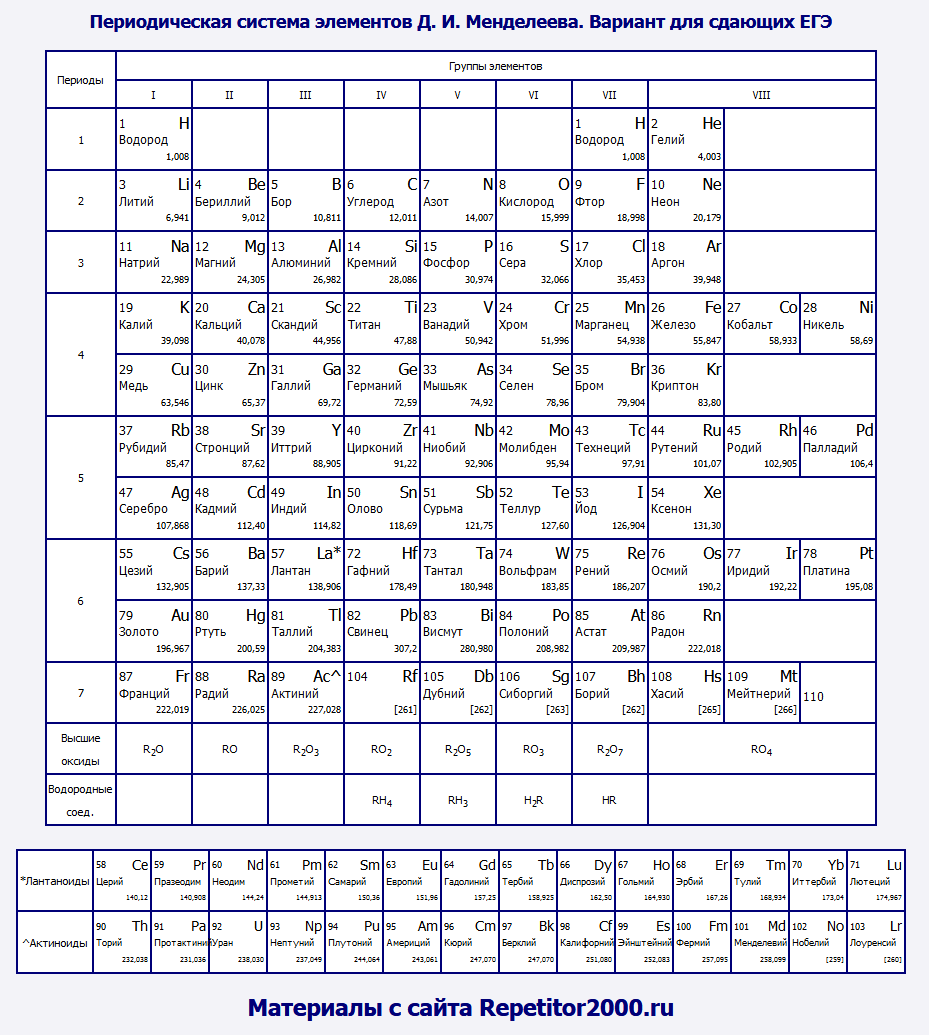
Вероятно, именно такой вариант периодической таблицы является для вас наиболее привычным. Нечто подобное мы видим в любом школьном учебнике химии. К сожалению, данный вариант (т. н. короткопериодный) не очень наглядно отражает периодический закон. Возьмите, например, элементы седьмой группы: ярко выраженные неметаллы (F, Cl, Br, I) соседствуют здесь с типичными металлами (Mn, Tc, Re). А ведь мы ожидаем видеть в одной группе элементы с похожими свойствами.
Приходится выделять т. н. главные и побочные подгруппы, прибегать к другим ухищрениям (например, "вырезать" из таблицы лантаноиды и актиноиды). В действительности, правильный вариант таблицы Менделеева выглядит так, а короткопериодная форма - это некоторый компромиссный вариант, который используется в целях экономии места.
| *Лантаноиды |
Длиннопериодная форма таблицы МенделееваИменно нечто подобное и было создано Дмитрием Ивановичем Менделеевым. Именно такой вариант таблицы наиболее наглядно иллюстрирует периодический закон. К сожалению, у длиннопериодной формы есть один недостаток: таблица занимает слишком много места. Именно поэтому многие отдают предпочтение короткопериодной форме.
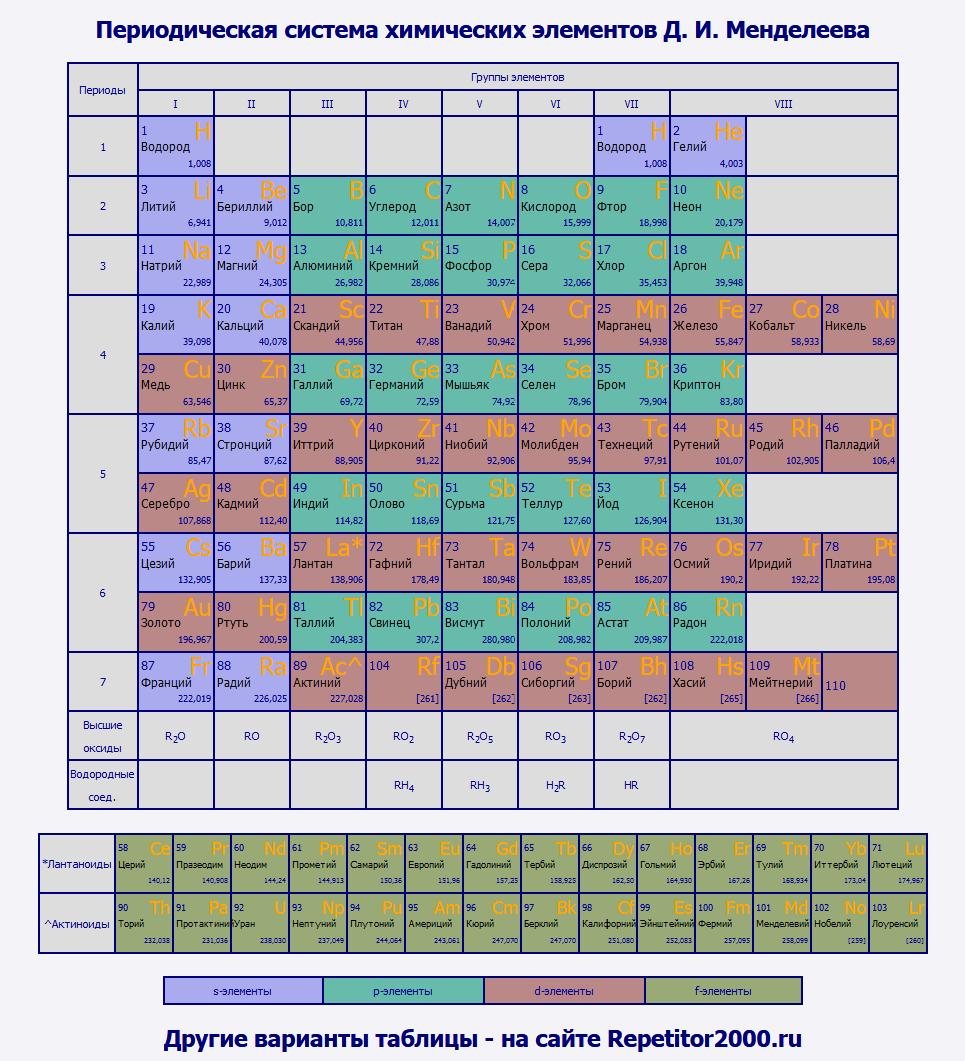
Таблица Менделеева с выделением s-, p-, d-, f- элементовРазными цветами в данном варианте таблицы Менделеева отмечены s-, p-, d- и f- элементы. Напоминаю, что элемент относится к одному из этих типов, если внешние электроны в атоме данного элемента находятся соответственно на s-, p-, d- или f- подуровне. Например, электронная формула натрия имеет вид: 1s 2 s2s 2 2p 6 3s 1 . Внешний электронный уровень - 3s, следовательно, натрий относится к s-элементам. Электронная формула кислорода: 1s 2 s2s 2 2p 4 . Внешний электронный подуровень - 2p, значит кислород - это р-элемент. Свойства элементов из этих 4 групп отличаются достаточно сильно. Например, среди d-элементов присутствуют только металлы, а большинство неметаллов относятся к p-элементам. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Высшие оксиды | R 2 O | RO | R 2 O 3 | RO 2 | R 2 O 5 | RO 3 | R 2 O 7 | RO 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Водородные соед. | RH 4 | RH 3 | H 2 R | HR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| *Лантаноиды |
Таблица Менделеева, в которой отмечены металлы и неметаллыНеметаллы отмечены в этой таблице красным цветом. Обратите внимание: неметаллы сосредоточены в правой верхней части таблицы Менделеева. Все они, кроме водорода и гелия, относятся к p-элементам. Вы не найдете ни одного неметалла среди d-элементов и f-элементов. Именно по этой причине я счел возможным не приводить в данном варианте список лантаноидов и актиноидов - все они относятся к металлам. Иногда особым образом выделяют группу элементов, сочетающих в себе свойства металлов и неметаллов (например, к ним можно отнести германий). Данные элементы называют полуметаллами или металлоидами. | |||||||||
| Высшие оксиды | R 2 O | RO | R 2 O 3 | RO 2 | R 2 O 5 | RO 3 | R 2 O 7 | RO 4 | ||
| Водородные соед. | RH 4 | RH 3 | H 2 R | HR | ||||||
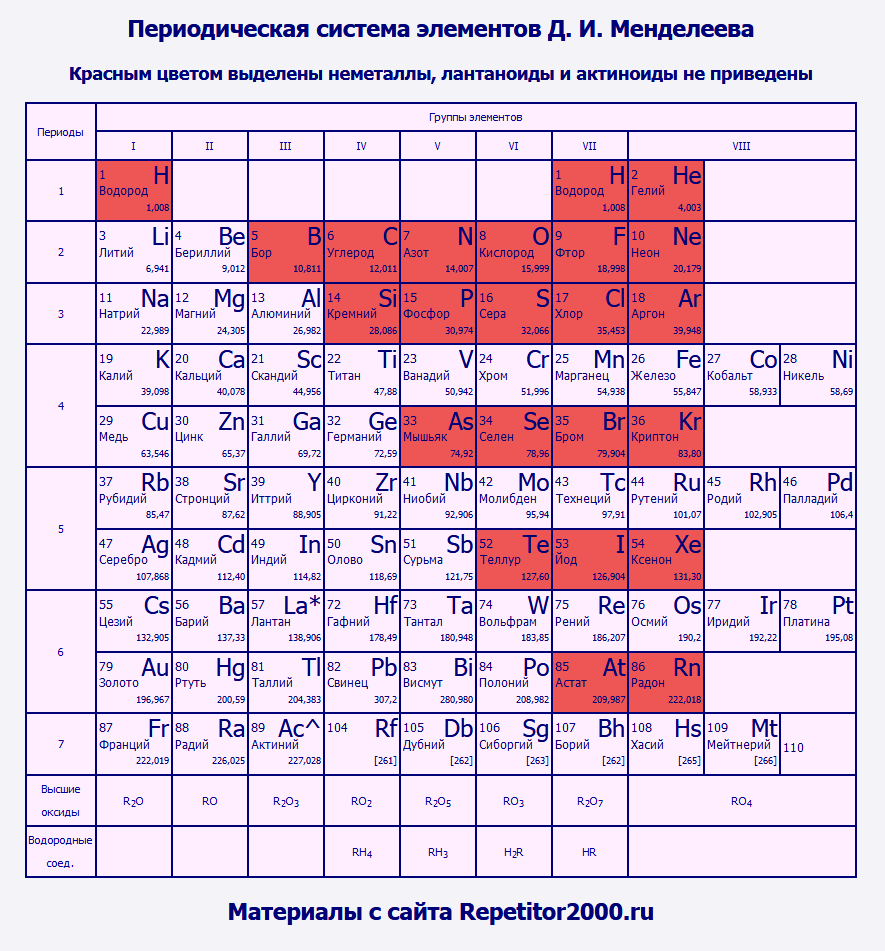
Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных - серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K - в главной подгруппе, Cu и Ag - в побочной. Свойства натрия и калия весьма похожи - активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) - типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете длиннопериодную форму таблицы Менделеева: "мешанина" из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.
ТАБЛИЦА МЕНДЕЛЕЕВА - периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) - это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 - 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец - это группа, определяющая основные физико-химические свойства, а строки - это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента - это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
2 элемента (1s 2 )
18 элементов (5s 2 4d 10 5p 6 )
8 элементов (2s 2 2p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
8 элементов (3s 2 3p 6 )
18 элементов (4s 2 3d 10 4p 6 )
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
внешний (n) s-подуровень
внешний (n) р-подуровень
предвнешний (n–1 ) d-подуровень
(n-2)f 1–14 (n-1)d 1–10 ns 1–2
третий снаружи (n–2) f-подуровень
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s 2 p 6 , для гелия s 2 .
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R - обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда "Основы химии", который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса". Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: "Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)."
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
Цветные металлы их применение и добыча (Таблица)
70—80 % добываемого молибдена идёт на производство легированных сталей, а также для получения жаропрочных и коррозийных сплавов.
Молибденовая проволока используется для высокотемпературных индукционных печей.
Из молибдена изготовляют аноды, сетки, катоды, держатели нити накала в электролампах Соединения молибдена необходимы как катализатор химических реакций, является пигментом красителей, компонентом глазури.
MoS 2 используется как твердая высокотемпературная смазка.
Молибден входит в состав удобрений.
В авиации применяются хромомолибденовые трубы.
Ювелиры иногда заменяют платину молибденом.
Для противостояния огненому смерчу нос корабля покрывают молибденом.
США (Колорадо (рудник Henderson ), Нью-Мексико (месторождение Questa ), Айдахо (месторождение Thompson Creek )). Компании: "Freeport McMoRan Copper and Gold Inc.", "Phelps Dodge Mining Corp.", "Kennecott Utah Copper Corp.", "Thompson Creek Metals Co Inc."
Китай (в 7 провинциях). Компании Китайское государственное предприятие, «Wanbao Zhenxing», Jinduicheng Molybdenum Group", "China Molybdenum Co", "Luoyang Luanchuan Molybdenum Group Co", "Huludao Lianshan Molybdenum Co".
Канада (Британская Колумбия). Компании: "Thompson Creek Metals Co Inc.", Falconbridge Ltd., Teck Cominco Ltd., "Adanac Molybdenium Corp.".
Чили (Chuquicamata, El Teniente, Los-Pelambres, Andina). Этими месторождениями владеет чилийская государственная корпорация Codelco ( Corp . Nacional del Cobre de Chile).
Мексика (месторождение La Caridad). Компания Grupo Mexico SA de CV.
Перу (рудник Tokepala ).
Россия. В Сибири - Сорское месторождение (Хакассия), Жирекенское и Бугдаинское (Восточное Забайкалье), Орекитканское (Бурятия). Сорское и Жирекенское месторождение разрабатываются ОАО «Группа Сибирский алюминий». Производство осуществляет компания "Союзметаллресурс".
Япония. Компании: Mitsui &Co Ltd., Sojitz Corp., Marubeni Corp., Nippon Mining Holdings Inc.
Австралия. Компания BHP Billiton Group, "Moly Mines Ltd.".
На суммарное производство в Сев. и Юж. Америке и КНР приходится около 90% всей добычи молибдена в мире.
Кобальт
Кобальт применяют для легировании стали. Из кобальтовых сплавов изготовляют сверла, резцы, обрабатывающий инструмент, а также промышленные и авиационные газотурбинные двигатели. Используется в космической промышленности.
Магнитные свойства применяются в аппаратуре магнитной записи, сердечниках электромоторов и трансформаторов.
Из кобальта, ванадия и хрома изготовляют постоянные ма- гниты.
Кобальт – катализатор химических реакций.
В производстве литиевых аккумуляторов используют кобальтат лития.
Силицид кобальта - термоэлектрический материал и позволяет производить термоэлектрогенераторы с высоким КПД.
Радиоактивный кобальт-60 используется в медицине и в гамма-дефектоскопии. Он же применяется в качестве топлива в радиоизотопных источниках энергии.
Кобальт используется для производства лаков и красок, керамики и эмали.
Конго (ДРК). Месторождение - Tenke Fungurume . Компании: конголезская государственная La Generale des Carrieres et des Mines, Lundin Mining, Freeport-McMoRan Copper and Gold.
Замбия. Шахта Nkana, рудник Mufulira. Компании: Chambishi Metals plc, ZCCM Investment Holdings Ltd., Luanshya Copper Mines, Glencore (Швейцария), First Quantum (лидер производства).
Австралия. Рудный район Марлборо в провинции Квинсленд, месторождение Маунт-Терсти. Компания Gladstone Pacific Nickel Ltd , Fox Resources .
Россия (Урал, Алтай). ЗАО "Русская медная компания", «Норильский никель», «Уфалейникель» «Союзнихром», "Южуралникель".
Свинец
Нитрат свинца применяется для изготовления смесей взрывчатых веществ. Используется свинец для изготовления ядовитого антидетонатора – тетраэтилсвинца.
Еще сохраняется в некоторых странах использование этилированого бензина (в состав его входит тетраэтилсвинец).
Соединения свинца используются в химии и физике (как катодный материал.
Из него изготовляют аккумуляторные пластины.
Свинец входит в состав оболочки электрических кабелей.
Малоактивный свинец используют для изготовления кислотоупорной аппаратуры для химической промышленности.
Свинцовые экраны делают защищают работников рентгеновских кабинетов от излучения.
Свинец содержат также подшипниковые сплавы баббиты, «мягкие» припои.
В строительстве свинец используют для уплотнения швов и создания сейсмостойких фундаментов. В военной технике – для изготовления шрапнели, оболочки пуль.
Сульфид свинца в виде порошка используют для обжига глиняной посуды и для обнаружения ионов свинца.
Сплавы свинца с сурьмой используют в производстве типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников.
Самые большие запасы находятся в Австралии (15,6 млн. тонн), Казахстане (14,8 млн. тонн), США (12,2 млн. тонн), Канаде (9,6 млн. тонн), Китае (7,6 млн. тонн). Доля России в мировых запасах свинца оценивается в 10-12%. Основными производителями свинцового сырья в мире остаются Австралия (685 тысяч тонн свинца в концентрате), Китай (580), США (460), Перу (270), Мексика (175). В значительных объемах добыча ведется в Казахстане, России, Ирландии, Швеции, ЮАР. Соответственно основными производителями свинца в мире являются Австралия, Китай и США (более 70% мирового выпуска). Австралия по производству свинца в концентратах занимает первое место в мире - 25% мирового производства.
Крупнейшими в мире компаниями по производству свинца являются Doe Ran (США), BHP Billiton (Австралия), MIM (Австралия), Cominco (Канада).
Россия. Николаевский рудник, Месторождение Озерное (Бурятия). Компании: ГМК Дальполиметалл, ООО "Корпорация "Металлы Восточной Сибири"
Китай. Компании "Чуаньвэй", Yubei Metal, Shenzhen Zhongjin Lingnan Nonfemet Co. Ltd., Henan Lingbao Xinling Lead Refining Co. Ltd., Western Mining.
Казахстан. Компании: « ShalkiyaZin », «Южполиметалл», «Казцинк»
Мексика. Месторождения - шахта Naica в штате Chihuahua . Компания - Industrias Penoles .
США. Месторождения - штаты Миссури (8 рудников), Колорадо, Айдахо и Монтана.
Медь
В электротехнике из меди изготовляют силовые кабели, провода и др. проводники. Медные провода используют в обмотке электродвигателей и силовых трансформаторов.
Используют медь в теплоотводных устройствах.
Из меди изготовляют трубы.
Медь – основа для получения сплавов латуни и бронзы, а также медноникелевых. Ювелиры делают сплавы из меди с золотом для создания боле прочных изделий.
Медь – катализатор в реакции полимеризации ацетилена.
Медные листы используются в архитектуре.
В будущем медь найдет применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса всех поверхностей, к которым прикасается человек.
Основные страны с богатыми месторождениями меди это: Чили-22%, США-12%, Китай -6%, Казахстан-5%, Польша-5%, Индонезия-4%, Россия-3%, Замбия-3%.
Лидируют по производству меди Чили (22%), США (20%), СНГ (9%). А также Канада (7,5%), Китай (7,5%), Замбия (5%).
Крупнейшие компании по добыче медной руды: Codelco -11%, Phelps Dodge -8%, Rio Tinto -7%, BHP Billiton -7%, Grupo Mexico -5%, PT Pakuafu Indah -5%, Angio American -4%, Норильский никель-3%, KGHM Polska Miedz 3%.
К крупнейшим месторождениям относятся: Чукикамата, которое уже отрабатывается более 100 лет (26 млн. т) в Чили, и Эскондида (23,6 млн. т), которое начали отрабатывать с 1990 года в Чили, Грасберг (27,1млн. т) в Индонезии, Кольяуаси (17 млн т) Чили, Октябрьское (16 млн. т) Россия и Удокан (14 млн. т) Россия. В числе недавно освоенных крупных месторождений относятся: Антамина в Перу, Эль-Тесоро в Чили, Салобу и Соссегу в Бразилии, Нурказган в Казахстане. Активно разведываются Ую-Толгой в Монголии, Пэббл на Аляске, Эль-Пачон в Аргентине.
Олово
Олово используется как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах.
Из олова делают белую жесть для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.
Из олова и меди делают важнейший сплав – бронзу.
Олово - легирующий компонент при получении сплавов титана.
Двуокись олова используется в процессе «доводки» поверхности стекла.
Олово применяется в химических источниках тока.
Перспективно использование олова в свинцово-оловянном аккумуляторе.
Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Китае, Индонезии, Малайзии и Тайланде. Другие важные месторождения касситерита находятся в Южной Америке (Боливии, Перу, Бразилии) и Австралии В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90-х годов), в Приморском крае (Кавалеровский р-н), в Хабаровском крае (Солнечный р-н, Верхнебуреинский р-н (Правоурмийское), в Якутии (Депутатское) и других районах.
Крупнейшие компании: Bangka Belitung Timah Sejahtera (Индонезия), Thaisarco , Yunnan Tin , Singapore Tin Industries , Western Mining Co (Китай), PT Timah и PT Koba (Индонезия), Glencore , Bluestone Tin (Австралия).
Цинк
2. В медицине (оксид цинка как антисептик) — 10%
3. Производство сплавов — 10%
4. Производство резиновых шин — 10%
5. Масляные краски — 10%
Цинк используется для восстановления благородных металлов, для защиты стали от коррозии.
Также используется в качестве материала для отрицательного электрода в химических источниках тока.
Цинк применяется для изготовления цинк-воздушных аккумуляторов.
Цинк – компонент латуни.
Соединения цинка - полупроводники.
Страны, производящие цинк, - Китай, Австралия, Перу, Канада, США, Мексика, Ирландия.
Месторождения - Ред-Дог (США), Сенчури (Австралия), Брансуик (Канада), Серро-де-Паско (Перу), Брокен-Хилл и Макартур-Риверз (Австралия), Лишин и Тара (Ирландия).
Крупнейший производитель цветного металла в России - ОАО «Челябинский цинковый завод».
Компании - «Корея Цинк» (Юж. Корея), австралийская «Пасминко», бельгийская «Умикор», финская «Оутокумпу» и казахстанская «Казцинк», финская Boliden Kokkola O , немецкая Sudamin Investment . Китайские: Zhuye Torch Metals, Huludao Zinc Industry, Shenzhen Zhongjin Lingnan, Baiyin Non!Ferrous Metals. А также – Falconbride, Zinifex, Glencore International, Met-Mex Penoles.
Вольфрам
Из вольфрама делают нити накаливания для осветительных приборов, кинескопов, вакуумных трубок.
Вольфрам используется для противовесов, бронебойных сердечников снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет.
Вольфрам используют в качестве электродов для аргоно-дуговой сварки.
Из сплавов Вольфрама с другими металлами делают хирургические инструменты, танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ.
Соединения фольфрама используют как смазки, для механической обработки металлов и неметаллических конструкционных материалов в машиностроении, как катализаторы и пигменты, для преобразования тепловой энергии в электрическую.
В Китае находится порядка 62% мировых запасов вольфрама. Значительные залежи этого элемента разведаны также в США (Калифорния, Колорадо), Канаде, России (на Урале, Кавказе и в Забайкалье), Южной Корее, Боливии, Бразилии, Австралии и Португалии.
На Кинг-Айленде в Австралии (2000 т в год), в австрийских Альпах (провинции Зальцбург и Штайермарк). В северо-восточной Бразилии разрабатывается месторождение (шахты Канунг и месторождение Кальзас в Юконе). Мировым лидером в разработке вольфрамового сырья является Китай (месторождения Жианьши (60% китайской добычи вольфрама), Хуньань (20%), Юннань (8%), Гуаньдонь (6%), Гуаньжи и Внутренняя Монголия (2% каждое) и другие). В Португалии основное месторождение – Панасхира. В России основные месторождения вольфрамовых руд расположены в двух регионах: на Дальнем Востоке (Лермонтовское месторождение) и на Северном Кавказе (Кабардино-Балкария, Тырныауз).
Компании - North American Tungsten Corporation, Shandong Guangming Tungsten & Molybdenum (КНР), Hazelwood Resources Австралия), Asian Resources, Wolf Minerals и др.
Никель
Наибольшее применение никель находит в производстве нержавеющей стали и сплавов. К его сплавам относятся: монель-метал, используемый в химической аппаратуре, судостроении, для изготовления отстойников и крышек; нихром и хромель, используемые в виде проволоки для реостатов, тостеров, утюгов, обогревателей; инвар, применяемый для изготовления маятников в часах и измерительных рулетках; пермаллой, используемый в технологии морских кабелей и электропередачи; нейзильбер – для изготовления домашней утвари; алнико – мощный магнитный материал, используемый для изготовления мелкого инструмента.
Используют никель для никелирования поверхности другого металла.
При использовании никеля изготовляют различные аккумуляторы.
Медицинские брекеты и протезы делают из никеля.
Половина мировой добычи никеля приходится на долю России и Канады, крупномасштабная добыча ведется также в Австралии, Индонезии, Новой Каледонии, ЮАР, на Кубе, в Китае, Доминиканской Республике и Колумбии.
Месторождения в России – Октябрьское и Талнахское (Таймырский АО), Ждановское (Мурманская область), Буруктальское (Оренбургская область).
В Канаде месторождения расположены в провинциях Онтарио и Монитоба, а также на севере страны район Квебека и Ньюфаундленда.
Есть месторождения в Новой Каледонии.
На Кубе месторождения цветного металла локализованы в провинции Ольгин.
Компании по производству никеля - российский «Норникель», «Южурал-никель» и канадская Inco Ltd ., англо-австралийская BHP Billiton , канадская Falconbridge Ltd ., французская Eramet Nickel , Ste le Nickel (филиал последней), кубинская General Nickel .
ЦВЕТНЫЕ МЕТАЛЛЫ — всё, кроме железа
Цветные металлы отличаются от черных. Цветных металлов много, а к черным относятся только железо, его сплавы. Часто к черным металлам относят ванадий, марганец, хром.
В Европе цветные металлы называют нежелезными, происхождение этих названий точнее отражает суть и свойства наших героев.
- Англичане называют их non-ferrous metals.
- Для немцев их название — Nichteisenmetalle, Buntmetalle.
- Французы обозначили цветные металлы как меtaux non-ferreux.
Разделяем металлы по свойствам и группам
Условно цветные металлы различают на 2 большие группы — тяжелые и легкие.

Более подробная классификация проводится по свойствам (физико-химическим). Есть разделение на 5 и 7 групп.
Виды цветных металлов:
- Легкие цветные металлы.
- Тяжелые металлы. .
- Редкие и малые.
- Рассеянные.
- Радиоактивные.
- Тугоплавкие.
Свойства цветных металлов разнообразны. Это устойчивость к коррозии, высокие электро-и теплопроводность, устойчивость во многих агрессивных средах.
Где применяются
Представьте мир без цветных металлов. Выбросите телефон и компьютер, вместе с ними ключи от машины. Отключите свет — ведь ток течет по проводам из цветмета. Газовую и электрическую плиту тоже придется выбросить, а готовить на костре или построить печку. Поэтому к этим разным и таким нужным человечеству металлам давайте относиться уважительно.
Невозможно представить современный мир без использования цветных металлов.
Некоторые из них добываются миллионами тонн в год, другие по несколько тонн в год. Но все они абсолютно необходимы современной промышленности и нам, потребителям.
Электротехника, легировка сталей, сенсоры, диоды, термопары, инфракрасная оптика, военно-промышленный комплекс.
Знакомство с нежелезными металлами
Список цветных металлов обширен. Руд цветных металлов в разы больше.

Важными рудами на медь являются халькозин, борнит, халькопирит. Встречается и самородная медь, но редко. Про медь читайте здесь.

Добычу медных руд производят:
Познавательно: крупнейшее месторождение в мире находится в знойной пустыне Атакама, его пока не разрабатывают.
Алюминий
Главное сырье на алюминий — бокситы. Руды бокситов — диаспор (его ювелирная разновидность султанит подробно описана здесь), гетит, бемит, каолинит. Подробнее про этот металл читайте на этой странице.

Российские месторождения бокситов находятся в областях:
- Архангельской;
- Белгородской;
- Свердловской;
- Челябинской.
Богатые запасы бокситов расположены в Корее, Венгрии, Югославии, Китае.
Значительные запасы бокситовых руд в Австралии, Бразилии, США, Франции.
Свинец
Главная руда на свинец — галенит, кроме него церуссит и англезит.

Галенит образует полиметаллические руды со сфалеритом и халькопиритом.
48 стран мира могут добывать на своей территории свинец.
Основная цинковая руда — сфалерит. Это сульфид цинка, и в природе его естественными спутниками являются галенит и халькопирит.

Главные мировые запасы цинка находятся в Канаде, немногим отстают Китай, Австралия, США.
В России цинк добывают на Каменном Поясе. Есть месторождения в Сибири и Приморье.
Магний
Этого цветного металла в земной коре около 2%.

Руд, содержащих магний, около 60, но для промышленной добычи используют:
- доломит;
- магнезит;
- брусит;
- карналлит;
- морская вода.
Каждая страна обладает запасами магния. Магнезит находят в США, Испании, Австралии, Канаде, Югославии, Греции. Карналлит используют в странах СНГ.
Огромные запасы магния находятся в воде залива Кара-Богаз-Гол.
Никель
Никелевые руды могут быть сульфидные и силикатные. Подробнее о металле читайте здесь.

- халькопирит;
- пирротин;
- магнетит;
- пентландит.
Силикатные никелевые руды:
- гарниерит;
- гетит;
- ревдинскит;
- контронит;
- асболан.
Кобальт
В природе немного кобальтсодержащих руд, особенно пригодных для промышленного использования. Среди них кобальтин, скуттерудит, линнеит, шмальтин, эритрин.

По минеральному и химическому составу кобальтовые руды делятся на сульфидные, арсенидные, оксидные. В основном все руды комплексные, собственно кобальтовые встречаются только среди мышьяковых (арсенидных) руд.
За рубежом кобальтосодержащие месторождения находятся в Канаде, Финляндии, Австралии, Африке.
В России — на Урале, в Красноярском крае, на Кольском полуострове.
Основные добытчики кобальта — Заир и Замбия.
Олово
Главные минералы для добычи олова — касситерит и станнин. Половина добычи олова приходится на месторождения Юго-Восточной Азии. Подробнее про олово написано здесь.

Немного отстает Китай, за ним идут Индонезия, Малайзия, Бразилия, Россия.
Молибден
Основной рудный минерал на молибден — молибденит. В природе «дружит» с сульфидами меди и касситеритом.

В добыче металла первенствуют США, следом идут Чили и Китай, на третьем месте — Канада.
В России тоже есть молибденовые руды, в Забайкалье, на Северном Кавказе, на юге Западной Сибири.
Вольфрам
Основные руды на вольфрам — вольфрамит и шеелит.

Китаю повезло, у него более 40% мировых запасов вольфрамита. Россия отстала не сильно, у нас шеелит есть на Кавказе, в Забайкалье, на Чукотке.
Есть месторождения в Германии, Канаде, Турции, США.
Висмут
Существует самородный висмут. В Боливии и Австралии его добывают вместе с висмутином. Подробнее о нём читайте здесь.

Боливия единственная страна, где металл добывают прямо из висмутовой руды. В основном висмут извлекают из полиметаллических руд.
Мировые лидеры по запасам:
- Перу;
- Мексика;
- Китай;
- Австралия;
- Канада.
Месторождения висмутовых руд редки и невелики по масштабам.
Сурьма
Главный источник сурьмы — антимонит. Кроме него, рудой на сурьму могут служить бертьерит, джемсонит, ливингстонит, стибиконит.

Австралия, Россия и Китай обладают залежами антимонита, остальные страны могут только облизываться на такое богатство. Среди завидующих США, КНР, ЮАР. У них есть полиметаллические месторождения.
Ртуть
Киноварь — единственный минерал для качественной добычи ртути.

Основные производители жидкого металла:
Россия обладает небольшими запасами киновари на Чукотке, Алтае, Камчатке.
У Америки с этим и того хуже — маленький рудничок в Неваде.
А вот на юге Испании известно ртуть добывают почти две тысячи лет.
Вторичное сырье
Уже понятно, что добыча цветмета не всегда обеспечивает потребности промышленности. Приходится изворачиваться. То есть организовывать пункты приема вторсырья, собирать металлолом для сдачи в этих пунктах. Кстати, за лом цветных металлов платят довольно неплохо.
Стоимость металлических отходов формируется, исходя из нескольких компонентов:
- Металл (тип, редкость).
- Габариты.
- Размер партии.
- Чистота металла, его качество.
Охотникам за металлоломом
Большим спросом у приемщиков пользуются медь, алюминий, свинец, титан.
- Медь содержат сплавы меди (латунь).
- Олово гораздо дороже меди, особенно в чистом виде, но и в виде посуды, баббита (в подшипниках, например).
- Никель металл дорогостоящий, но в чистом виде попадается редко. В мельхиоровой посуде, отработанных электродах, ТЭНах бытовых приборов.
- Свинец сдают «в виде» аккумуляторов, типографского оборудования, оплетки кабелей.
- Алюминий стоит недорого.
- Чистый цинк найти проблематично, сдают его в виде сплавов.
- Самые дорогие металлы — молибден и вольфрам.
Плюсы и минусы переработки вторсырья
Перерабатывать металлолом выгодно, это понижает себестоимость продукции.
Цветмет приходится сортировать — это самый нудный и трудоемкий этап работы.
Рассортированное сырье измельчают. Для этого применяют газовые резки, шредеры, а потом прессуют для уменьшения объемов и удобства транспортировки.
Далее подготовленное сырье отправляют на металлургические комбинаты, или продают (чаще всего на экспорт).

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Читайте также: