Температура кипения металлов в вакууме
Обновлено: 20.09.2024
Жидкие и твердые вещества обладают некоторой определенной упругостью пара. В зависимости от температуры упругость пара веществ изменяется. По мере повышения температуры упругость пара вещества возрастает сначала медленно, а по мере приближения к упругости пара, соответствующей атмосферному давлению, — быстрее. Te твердые вещества, которые обычно считаются не летучими, все же всегда имеют некоторую упругость пара, даже при комнатной температуре. Запах, например, показывает, что вещества, им обладающие, имеют заметную упругость пара. Твердые металлы при комнатной температуре имеют чрезвычайно малую упругость пара. Для меди при температуре около 230° упругость пара составляет 5,7*10в-30 ат, с другой стороны, даже для таких металлов, которые при повышенных температурах являются летучими, упругость пара при более низких температурах сравнительно очень низка. Для цинка при температуре 200° упругость пара лается paвной 1,03*10в-9 ат. Из металлов только ртуть при комнатной температуре обладает заметной упругостью пара.
По этой причине комнаты, в трещинах пола которых забилась пролитая ртуть, непригодны для жилья, так как пар ртути, вследствие значительной его упругости, будет присутствовать в атмосфере этих комнат, а вдыхать воздух, содержащий ртутный пар, опасно для здоровья человека.
Температуры кипения некоторых металлов приведены в табл. 10.

Зависимость упругости пара веществ, в том числе и металлов от температуры, имеет логарифмический вид. Графически она изображается кривыми, у которых по мере повышения температуры приращения упругостей пара возрастают больше, чем приращения температур. Характер зависимости упругости пара металлов (рис. 71, а) аналогичен тому, который известен для воды (рис. 71, б). Следовательно, и в отношении упругости пара закономерности для металла и воды одинаковы, аналогично тому, что имело место в случае закономерности растворимости газов в металлах и водных растворах.
Повышение температуры металла при плавке вызывает повышение упругости пара его. С поверхности кусков шихтовых материалов начинается переход их в парообразное состояние. Металл при этом в виде пара уходит в атмосферу. При переходе металла при, плавлении из твердого состояния в жидкое кривая упругости пара не имеет каких-либо перегибов, так как упругость пара продолжает возрастать с той же закономерностью.

Когда с повышением температуры расплавленный металл приобретает упругость пара, равную атмосферному давлению, то парообразование не ограничивается одной свободной поверхностью, а происходит по всей массе металла и в особенности в местах подвода к нему теплоты. Этим и отличается кипение от испарения, так как испарение наблюдается только по свободной поверхности жидкости.
Испарение происходит при различных температурах, тогда как при кипении температура держится постоянной до тех пор, пока есть жидкость того же состава.
При испарении теплота, подводимая к металлу, вызывает и повышение его температуры и перевод в парообразное состояние. При кипении же теплота расходуется только на перевод металла в парообразное состояние. Так как парообразование при кипении происходит по всей массе несколько перегретого металла, то температура его выше не поднимается, потому что при переводе жидкости в пар затрачивается значительное количество теплоты (теплота кипения). Иначе говоря, по условиям фазового равновесия при постоянном давлении система оказывается нонвариантной.
Чем больше поверхность ванны, тем с большей поверхности происходит переход жидкости в парообразное состояние и тем больше металла из садки будет потеряно. При кипении свободная поверхность металла такого большого значения не имеет, так как пузыри пара образуются по всему объему металла и в наибольшем количестве в тех местах, куда поступает теплота при нагревании ванны. Если весь объем металла нагрет до температуры кипения и немного даже выше, то пузыри пара все равно выйдут из металла, как бы ни была мала свободная поверхность.
В практических условиях плавки всегда имеет место некоторое испарение металла. Чем большей упругостью пара обладает металл, тем испарение его идет в большей степени. При плавке испаряются не только те металлы, которые обычно считаются летучими. Такие металлы, как медь, которая имеет температуру кипения около 2350°, при плавке все лее имеют упругость пара достаточную, чтобы заметно испаряться. Пламя при плавке меди окрашивается в зеленый цвет вследствие присутствия в атмосфере пара металла. Окрашивание пламени наблюдается далее в том случае, если металл не доведен до плавления: испарение меди с поверхности твердых нагретых кусков достаточное, чтобы вызвать окрашивание пламени.
С поверхности нагретых кусков латуни во время плавки испаряется цинк. При этом, разумеется, испаряется и медь, но в значительно меньшей степени. Если латунь представляла по структуре двойной твердый раствор α+β, то вследствие уменьшения содержания цинка в поверхностном слое, латунь в этом месте становится однофазной, состоящей только из кристаллов твердого раствора а, тогда как во внутренних частях по прежнему будут находиться кристаллы твердых растворов α и β (рис. 72).

Испарение цинка происходит eщe в большей степени после расплавления латуни, так как при более высокой температуре упругость пара выше.
В восстановительной атмосфере испарение цинка из латуни происходит энергичнее, чем в окислительной.
Если на поверхности твердых кусков латуни имелись органические вещества, например пятна масла, то в этих местах цинк испаряется быстрее. Процесс испарения цинка может идти до заметного изменения цвета латуни, до омеднения с поверхности. В окислительной атмосфере испарение цинка происходит медленнее, так как слой окислов затрудняет выход цинка на поверхность. Пар цинка задерживается в порах окиси цинка, находящейся на поверхности, создает повышенную упругость у поверхности металла и замедляет дальнейшее испарение цинка из сплава.
Точно так же испарение цинка с поверхности расплавленной латуни происходит энергичнее при отсутствии на ней окислов или шлака. Древесный уголь заметно не уменьшает испарение цинка из расплавленной латуни, так как способствует сохранению поверхности сплава свободной от окислов, а также увеличивает поверхность вследствие вдавливания кусков угля в металл. Очень сильно уменьшают испарение цинка из расплавленной латуни растворяющиеся в ней элементы, образующие на поверхности металла прочные и плотные пленки окислов. К таким элементам относятся алюминий, бериллий, кремний и др.
Температура кипения и плавления металлов. Температура плавления стали

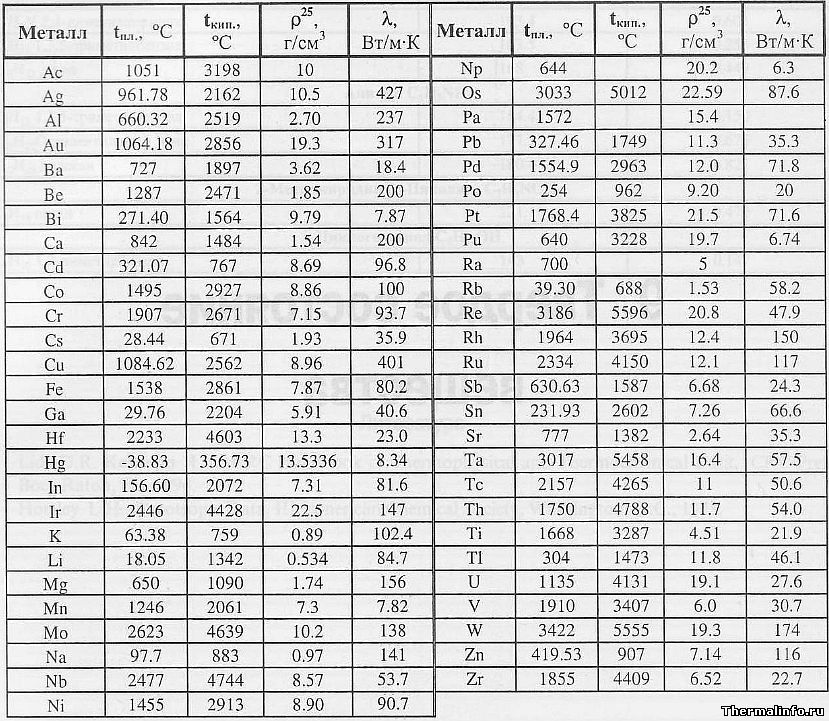
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см 3 , то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
При какой температуре плавится металл
При термическом воздействии на детали в процессе сварки важно учитывать температуру плавления металлов. От этого показателя зависят токовые параметры. Необходимо создать электрической дугу или пламя в газовой горелке такой тепловой мощности, чтобы разрушить молекулярные связи. Параметр, при котором сталь или цветной сплав плавится, учитывают при выборе конструкционных материалов для узлов, испытывающих силу трения или металлоконструкций, испытывающих термическое воздействие.

Процесс плавления
При термовоздействии на деталь изменение внутренней структуры происходит за счет накопления энергии молекулами. Скорость их движения возрастает. В критической точке нагрева начинается разрушение кристаллической структуры, межмолекулярные связи уже не могут удержать молекулы в узлах решетки. Взамен колебательным движениям в пределах узла происходит хаотическое движение, образуется ванна расплава в месте нагрева. Точку начала расплавления вещества в лабораторных условиях определяют до сотых долей градуса, причем этот показатель не зависит от внешнего давления на заготовку. В вакууме и под давлением металлические заготовки начинают плавиться при одной и той же температуре, это объясняется процессом накопления внутренней энергии, необходимой для разрушения межмолекулярных связей.
Классификация металлов по температуре плавления
В физике переход твердого тела в жидкое состояние характерен только для веществ кристаллической структуры. Температуру плавления металлов чаще обозначают диапазоном значений, для сплавов точно определить нагрев до пограничного фазового состояния сложно. Для чистых элементов каждый градус имеет значение, особенно, если это легкоплавкие элементы,
значения не имеет. Сводная таблица показателей t обычно делится на 3 группы. Помимо легкоплавких элементов, которые максимально нагревают до +600°С, указывают тугоплавкие, выдерживающие нагрев свыше +1600°С, и среднеплавкие. В этой группе сплавы, образующие ванну расплава при температуре от +600 до 1600°С.
Разница между температурой плавления и кипения
Точкой фазового перехода вещества из твердого кристаллического состояния в жидкое нередко называют температуру плавления металла. В расплаве молекулы не имеют определенного расположения, но притяжение удерживает их вместе, в жидком состоянии кристаллическое тело сохраняет объем, но теряет форму.
При кипении теряется объем, молекулы слабо взаимодействуют, хаотично движутся во всех направлениях, отрываются от поверхности. Температура кипения – это когда давление металлических паров достигает давления внешней среды.
Для наглядности разницу между критическими точками нагрева лучше представить в виде таблицы:
| Свойства | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав превращается в расплав, кристаллическая структура разрушается, исчезает зернистость | Переход в газообразное состояние, отдельные молекулы улетают за пределы расплава |
| Фазовый переход | Равновесие между жидкой и твердой фазами | Равновесие между давлением паров металла и внешним давлением воздуха |
| Влияние внешнего давления | Не меняется | Изменяется, падает при разряжении |
Таблицы температур плавления металлов и сплавов
Для удобства границы фазового перехода указаны по группам в порядке возрастания t фазового перехода из твердого в жидкое состояние. Из всех элементов выбраны часто встречающиеся.
Таблица плавления легкоплавких металлов и сплавов (расплавляются до +600°С).
Таблица плавления среднеплавких металлов и сплавов, диапазон фазового перехода от +600 до 1600°С.
Таблица плавления тугоплавких металлов и сплавов (свыше +1600°С).
Температура кипения металлов в вакууме
Испарение металлов проходит совершенно различно в зависимости от общего давления в парогазовой фазе над расплавом. Общее давление в парогазовой фазе определяет длину свободного пробега частиц. Если общее давление велико, величина свободного пробега весьма мала и составляет, например, при 10в5 Па не более 10в-4 см. В этих условиях количество испарившегося металла M выражается эмпирическим законом Дальтона:

где S — площадь свободной поверхности расплава, с которой идет испарение; р° — равновесное давление пара металла при данной температуре; р' — действительное давление пара данного металла над расплавом; робщ — общее давление в парогазовой фазе над расплавом; т — время; k — коэффициент пропорциональности.
Величину р' нельзя определить заранее, она зависит от формы сосуда, где находится металл, скорости движения газов над расплавом и других обстоятельств. Практически р' определяют опытным путем. Если р'≤р°, идет испарение металла; если р'≥р°, наблюдается обратное явление — конденсация паров.
Приведенная формула Дальтона хорошо показывает влияние общего давления в парогазовой фазе на процесс испарения. Как видно из формулы, чем оно больше, тем меньше количество испарившегося металла. Поэтому путем введения над расплавом какого-либо инертного для металла газа удается существенно замедлить процесс испарения, хотя величина парциального давления паров самого металла от этого не меняется. Она, как известно, определяется только температурой. Если рассматривается испарение какого-либо одного компонента X из жидкого сплава, в формулу Дальтона необходимо вместо р°х подставлять p°xNх, где Nx — атомная доля данного компонента в сплаве.
При понижении общего давления над расплавом длина свободного пробега частиц в газовой фазе соответственно увеличивается и, когда эта длина делается соизмеримой с размерами сосуда, где происходит испарение, процесс коренным образом меняется. При условии если стенки сосуда холодные, так что почти все долетевшие до них газовые частицы закрепляются на них и не возвращаются в газовую фазу, оказывается возможным рассчитать количество испарившегося металла. Переход к новым закономерностям испарения наблюдается при общем давлении не более 0,133 Па, т. е. при достаточно глубоком разрежении. Поэтому этот процесс называют испарением в вакууме. Он описывается формулой Ленгмюра:

где M — масса испарившегося металла за время т с площади S при температуре расплава Т; R — газовая постоянная; р°А — давление пара металла при температуре T, А — атомная масса металла. В большинстве случаев пары металлов подобно инертным газам одноатомны.
В том случае, если рассматривается испарение металла А в вакууме из жидкого сплава, в котором атомная доля данного металла составляет NА, формула Ленгмюра приобретает такой вид:

Поскольку испарение данного металла А идет из раствора, учитывается парциальное давление пара этого металла, равное произведению давления пара чистого металла P°А на его атомную долю в сплаве NА и на коэффициент активности γА. Кроме того, в формулу входит уже не просто масса испарившегося металла, а скорость испарения, выраженная как dm/dт. Это объясняется тем, что основа сплава и рассматриваемый металл обладают разными атомными массами и разными давлениями пара. Поэтому они будут испаряться по-разному. В результате содержание рассматриваемого металла в расплаве начнет сразу изменяться. Только в самый первый момент процесса испарения величина NА известна точно — это концентрация металла в исходном сплаве.
Надо отметить, что практическую значимость для плавки испарение приобретает лишь в том случае, если рассматриваемый металл, обладает при заданной температуре достаточно большим давлением пара. Когда испарение идет в среде других газов при общем давлении более 1330 Па, с этим явлением приходится считаться, если равновесное давление пара металла составляет более 100—200 Па. Для случая испарения в вакууме при остаточном общем давлении менее 0,133 Па процесс приобретает практическую значимость для приготовления сплавов, если равновесное давление паров металлов превышает 13 Па. Именно поэтому названы легколетучими цинк, магний, кальций, марганец и хром.
С кипением чистых металлов при плавке в литейном производстве встречаются редко. Однако это явление наблюдается при работе со сплавами, в состав которых входят легколетучие компоненты. Явление кипения сплавов можно рассмотреть по схеме на рис. 3. На этом рисунке изображена диаграмма состояния системы В металлов А и В, образующих непрерывные твердые и жидкие растворы. Кроме обычных областей твердого, жидкого и твердо-жидкого состояний, здесь указана и область газообразного состояния, лежащая при высоких температурах. Диаграмма соответствует равновесиям при давлении 10в5 Па. Следовательно, точки tкипА и tкипВ являются обычными температурами кипения этих чистых металлов, выше которых металлы находятся в газообразном состоянии. На диаграмме имеется область двухфазного состояния жидкость — газ. Линия tплА — t2 — tплВ показывает температуру конца плавления сплавов. Линия — t3 — изображает температуру начала кипения сплавов.

Взаимное положение этих линий определяет область существования сплавов в жидком состоянии. Например, сплав 1 начнет плавиться при полностью станет жидким при t2, начнет кипеть при t3, станет полностью газообразным выше t1. На рис. 3 видно, что температурная область жидкого состояния наиболее узка в средней части диаграммы. Как видно, температура начала кипения сплава 1, равная t3, немного ниже температуры плавления чистого компонента А. Такое расположение линий конца плавления и начала кипения вызвано тем, что компонент В значительно более легкоплавок, чем компонент А, и, кроме того, температура кипения чистого компонента В ниже температуры плавления чистого компонента А, а температура кипения чистого компонента А весьма высока. При таких условиях оказывается, что сплавы, лежащие в средней части диаграммы, обладают температурой начала кипения, очень близкой к температуре конца плавления. Поэтому обычные при приготовлении сплавов перегревы могут привести к закипанию расплава. По рис. 3 можно объяснить также явление временного вскипания расплава при вводе легкоплавкого и легколетучего компонента в жидкий труднолетучий. Например, если в чистый жидкий металл А ввести твердый металл В, то последний начнет не только плавиться, но и может вскипеть, так как tкипB≤tплА. вскипание будет кратковременным, так как идущее одновременно растворение В в А приведет к образованию сплавов, температура начала кипения которых существенно выше С подобными явлениями практически приходится встречаться при плавке латуней (сплавов меди с цинком).
В системе медь — цинк сплавы обладают следующими температурами конца плавления (температуры ликвидуса) и температурами начала кипения:

Самой малой разницей между температурами конца плавления и начала кипения обладают сплавы, содержащие 40—46 % Zn. Эта разница не превышает у них 120 °С. Следовательно, при перегреве всего на 120—130 °C эти сплавы начинают кипеть, если плавка ведется при давлении 10в5 Па. Введение в жидкую медь цинка всегда сопровождается вскипанием этого металла, так как tкип Zn = 905 °C, а жидкую медь при плавке держат при 1150— 1200 С. Такое же явление происходит при введении в жидкую медь и ее сплавы магния (tкип = 1100 °С), кадмия = 760 °С), фосфора (tкип = 280 °С). Введение магния в расплавленный чугун (с целью модифицирования и получения шаровидной формы графита) сопровождается бурным процессом кипения этого металла, так как расплав имеет температуру не менее 1300 °C, а магний, имеющий tкип = 1100°C, практически нерастворим в этом расплаве.
Вакуум целесообразно применять для процессов, протекающих с образованием летучего продукта. В этом случае, если летучий продукт реакции конденсируется в условиях процесса, как например при металлотермическом восстановлении, вакуум не влияет на условия равновесия реакции (в термодинамическом смысле) и играет чисто кинетическую роль, снижая давление остаточных газов, что способствует испарению и диффузии паров металлов. Если же выделяющийся продукт представлен в виде газа, неконденсирующегося в условиях реакции, как в случае углетермического восстановления, то вакуум, удаляющий этот газ. помимо кинетического значения, играет также термодинамическую роль, сдвигая равновесие реакции в сторону образования газообразного продукта. Поскольку в обоих случаях вакуум способствует снижению температуры процесса, его применение наиболее оправдано для трудновосстановимых (активных) и летучих металлов, таких как кальций, магний, барий, литий и др. Кинетическая роль вакуума подробно была рассмотрена в предыдущем разделе. Выводы, сделанные там, целиком относятся и к условиям металлотермического восстановления.
Ниже рассматриваются термодинамические основы металло- и углетермического восстановления металлов в вакууме. Для установления влияния вакуума на восстановительные процессы остановимся на частном случае восстановления металлов из их окислов. Металлотермическое восстановление окислов в общем виде может быть представлено уравнением
Реакция сдвигается в ту или другую сторону в зависимости от соотношения в величинах сродства MeI и МeII к кислороду. В случае большего сродства МеII к кислороду, чем МeII, реакция будет сдвинута вправо, и наоборот. Величина сродства зависит от температуры. Мерой сродства служит величина изменения изобарно-изотермического потенциала ΔZ0t или свободной энергии образования ΔF0t (в стандартных условиях) окисла металла из простых веществ (металла и кислорода).
Зависимость свободной стандартной энергии образования окислов металлов от температуры рассмотрена выше в разделе теории пирометаллургических процессов, где даны графические изображения этих зависимостей.
Заметим, что падение сродства всех металлов к кислороду при повышении температуры становится особенно значительным с момента начала кипения окислообразующего металла, когда подъем соответствующей кривой ΔF0t = f(Т) делается более резким.
Для ряда окислов кривые ΔF0t = f(Т) пересекаются между собой. В точке пересечения металлы обладают одинаковым сродством к кислороду, и выше этой точки они обмениваются восстановительными способностями.
Так, например, до 1450° сродство магния к кислороду больше, чем у алюминия, который может быть восстановлен из его окисла. Выше 1450°, наоборот, металлический алюминий будет восстанавливать магний. В то же время кальций, вплоть до 2400°, является восстановителем всех металлов и сам не может быть восстановлен ими.
Кривые ΔF0t = f(T) характеризуют зависимость от температуры стандартной свободной энергии реакции окисления (ΔF0t), когда начальные парциальные давления исходных и получающихся в результате реакции веществ равны 1 ат. Если исходные вещества и продукты реакции находятся в твердом или жидком состояниях, изменение давления их не сказывает существенного влияния на величину свободной энергии процесса, но если один или несколько участников реакции газообразны, отклонения от стандартных условий (т. е. когда начальные парциальные давления газообразных участников реакции будут меньше или больше 1 ат) вызывают изменение величины свободной энергии реакции. Величина свободной энергии окисления металлов, например, в зависимости от исходного давления кислорода может изменяться от -∞ до +∞. Свободная энергия, а следовательно, и равновесная температура процесса при пониженных давлениях будут иными, чем когда исходное парциальное давление газообразных веществ равно 1 ат.
Действительно, для реакции окисления

при температуре, не превышающей точку кипения металла, уравнение свободной энергии с учетом исходного парциального давления единственного газообразного компонента — кислорода будет иметь следующий вид (изотерма Ван-Гоффа);

В этом уравнении и при дальнейших рассуждениях положительным принято тепло, поглощенное системой, а константа равновесия представлена как отношение концентрации или активности продуктов к исходным компонентам.

Из уравнения (33) видно, что со снижением исходного парциального давления кислорода уменьшается свободная энергия образования окисла. На диаграмме ΔF = f(Т) это скажется в подъеме кривой в сторону меньших значений ΔF окисла (рис. 14).

С момента начала кипения металла, т. е. когда помимо кислорода в газообразном состоянии будет находиться и металл, уравнение свободной энергии реакции окисления металла примет уже следующий вид:

Как видно из этого равенства, к стандартной свободной энергии помимо поправки нa исходную упругость кислорода добавляют также поправку на упругость паров металла, и кривая ΔF = f(T) в этом случае будет иметь еще более крутой подъем в сторону меньших значений ΔF, чем кривая, характеризующая состояние системы при пониженном давлении до точки кипения металла.
В случае, если газообразным участником реакции будет окисел, кривая ΔF = f (Т) смещается в сторону больших значений ΔF, что легко может быть установлено из рассмотренных выше закономерностей.

Из уравнения (36) следует, что для расчета свободной энергии реакции восстановления, протекающей не в стандартных условиях и с образованием газообразного продукта, необходимо алгебраически сложить значения свободной стандартной энергии образования окислов при данной температуре и в результат внести поправку (с учетом стехиометрического коэффициента n) на исходное парциальное давление участников реакции.
Таким образом, зная исходное парциальное давление газообразного продукта и нормальную (стандартную) свободную энергию реакции, можно определить изменение свободной энергии реакции, протекающей не в стандартных условиях.
В приведенных рассуждениях везде принято парциальное давление, хотя более правильно учитывать летучесть. Однако погрешность от такого допущения невелика в связи с тем, что в рассматриваемых процессах применяются высокие температуры и пониженные (менее 1 ат) парциальные давления участников реакции.
В качестве примера приведем расчет величины свободной энергии реакции взаимодействия окиси кальция и алюминия, протекающей по следующему (упрощенному) уравнению:
Читайте также:
