Температура плавления окислов металлов
Обновлено: 21.09.2024
В работе предложен метод определения поверхностного натяжения оксидов металлов по размерной зависимости интенсивности люминесценции от размера зерна люминофора. Способ апробирован при определении поверхностного натяжения диэлектрических кристаллов KCl с примесью ионов таллия в качестве люминесцирующего зонда. По величине поверхностного натяжения предложен метод определения температуры плавления наночастицы при различных ее размерах. Для наночастиц оксидов металлов определены температуры плавления при 10, 25 и 50 нм. Показано, что с уменьшением размера частицы до 10 нм температура плавления уменьшается до 1000 К. Это необходимо учитывать при многих технологических процессах. В работе показано, что размерный параметр d определяется только фундаментальной величиной – атомным объемом вещества υ, который изменяется периодически в соответствии с таблицей Д.И. Менделеева. Предложенный метод определения поверхностного натяжения может быть использовано также для оценки энергии диспергирования оксидов металлов, которые входят в состав большого количества минералов и руд. Это важно, поскольку самая затратная операция в горной промышленности – это измельчение руд. Полученная в работе связь между температурой плавления и поверхностной энергией может быть использована для определения ее величины. Это важно, поскольку определение поверхностной энергии твердых тел – очень непростая задача.

1. Woodley S.M., Hamad S., Mejias J.A., Catlow C.R.A. Properties of small TiO2, ZrO2 and HfO2 nanoparticles. J. Mater. Chem. 2006. Vol. 16. № 20. P. 1927–1933.
2. Gupta S.M., Tripathi M. A review of TiO2 nanoparticles. Chinese Sci. Bull. 2011. Vol. 56 № 16. P. 1639–1657. DOI: 10.1007/s11434-011-4476-1.
3. Пугачевский М.А. Стабилизация наночастиц оксидов переходных металлов IV группы при лазерной абляции: дис. . д-ра физ.-мат. наук. Хабаровск, 2015. 270 с.
4. Buffat P., Borel J.P. Size effect on the melting temperature of gold particles. Phys. Rev. A. 1976. Vol. 13. P. 2287–2294.
5. Pawlow P.J. Uher die Ahhangigkeit des Schmeltzpunktes von der Oberflachenenergie eines festen Korpers. Zs. Phys. Chem. 1909. Vol. 65. P. 1–35.
6. Макаров Г.Н. Экспериментальные методы измерения температуры и теплоты плавления кластеров и наночастиц // УФН. 2010. Т. 180. № 2. P. 185–207.
7. Guisbiers G. Review on the analytical models describing melting at the nanoscale. J. Nanosci. Lett. 2012. V. 2. No. 8. P. 1–10.
8. Самсонов В.М., Сдобняков Н.Ю., Васильев С.А., Соколов Д.Н. О размерной зависимости теплот плавления металлических нанокластеров // Известия РАН. Серия физическая. 2016. Т. 80. № 5. С. 494–496.
9. Liang T., Zhou D., Wu Z., Shi P. Size-dependent melting modes and behaviors of Ag nanoparticles: a molecular dynamics study // Nanotechnology. 2017. Vol. 28. No. 48. P. 485–704.
10. Юров В.М. Температура плавления наночастиц // Вестник КарГУ: сер. Физика. 2012. № 3 (67). С. 22–27.
11. Юров В.М., Ещанов А.Н., Кукетаев А.Т. Способ измерения поверхностного натяжения твердых тел // Патент РК № 57691. Опубл. 15.12.2008. Бюл. № 12.
12. Юров В.М. Способ измерения поверхностного натяжения люминофоров // Патент РК № 23223. Опубл. 27.11.2010. Бюл. № 11.
13. Рехвиашвили С.Ш., Киштикова Е.В., Кармокова Р.Ю., Кармоков А.М. К расчету постоянной Толмена // Письма в ЖТФ. 2007. Т. 33. Вып. 2. С. 1–7.
Наночастицы оксидов многих металлов находят широкое применение в различных областях науки и техники, медицине: в качестве керамики, катализатора химических реакций, очистителя органических загрязнений, активного элемента солнечных батарей, газовых сенсоров, фармакологии и др. (например, [1–3] и библиография в них).
Важнейшая характеристика наночастиц – это температура плавления. Первой экспериментальной работой по этой проблеме является, пожалуй, работа [4], а вот первая теоретическая работа появилась еще в 1909 г. [5]. В последние годы интерес к этой проблеме не ослабевает [6–9].
В настоящей работе экспериментально определена температура плавления некоторых наночастиц оксидов металлов по методике [10–12] и предложена универсальная эмпирическая зависимость, справедливая и для более сложных наноструктур.
Материалы и методы исследования
В основе нашего подхода [11, 12] лежит размерная зависимость некоторого физического свойства [10]. В рассматриваемом случае – это размерная зависимость рентгенолюминесценции оксидов некоторых металлов [11]:
Здесь I0 – начальная интенсивность рентгенолюминесценции, I(r) – интенсивность свечения частицы радиусом r, d – параметр, который равен [11]:
где σ – поверхностное натяжение оксида, υ – молярный объем оксида, R – газовая постоянная, Т – температура.
Способ применяли для определения поверхностного натяжения диэлектрических кристаллов KCl, с примесью ионов таллия в качестве люминесцирующего зонда. Интенсивность рентгенолюминесценции определялась стандартным фотоэлектрическим методом. Размер зерна диэлектрика определялся с помощью металлографического микроскопа Эпиквант. Результаты показаны на рис. 1. В координатахTm – температура плавления.
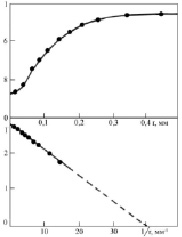
Рис. 1. Зависимость интенсивности рентгенолюминесценции KCl – Tl от размера зерна люминофора
Результаты исследования и их обсуждение
По методике, описанной выше, были исследованы размерные зависимости оксидов некоторых металлов. Пример такой зависимости показан на рис. 2.
В табл. 1 приведены значения температуры плавления массивных образцов оксидов некоторых металлов и образцов размером r = 10, 25 и 50 нм.
Температура кипения и плавления металлов. Температура плавления стали

В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
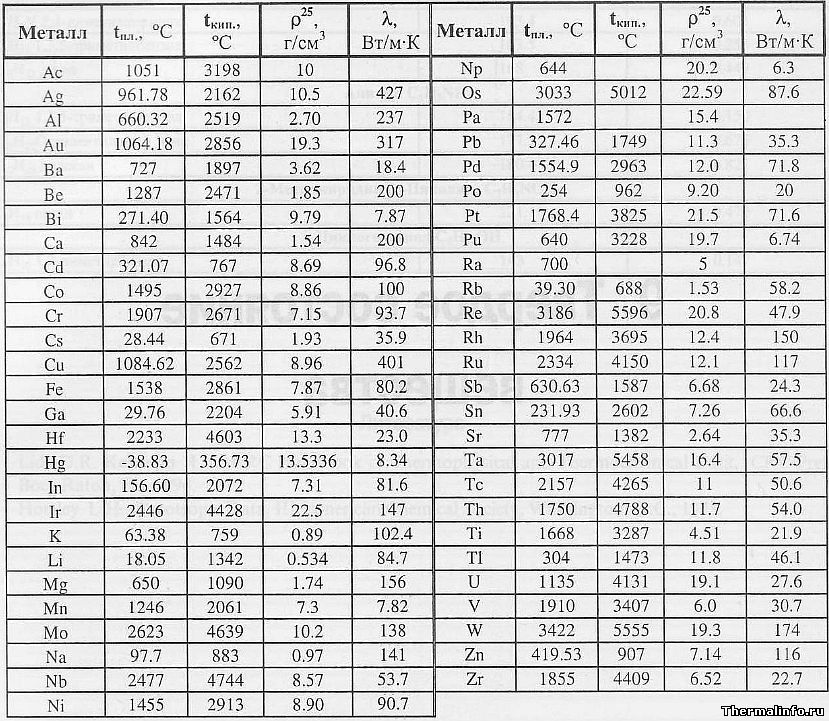
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см 3 , то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
Свойства оксидов металлов

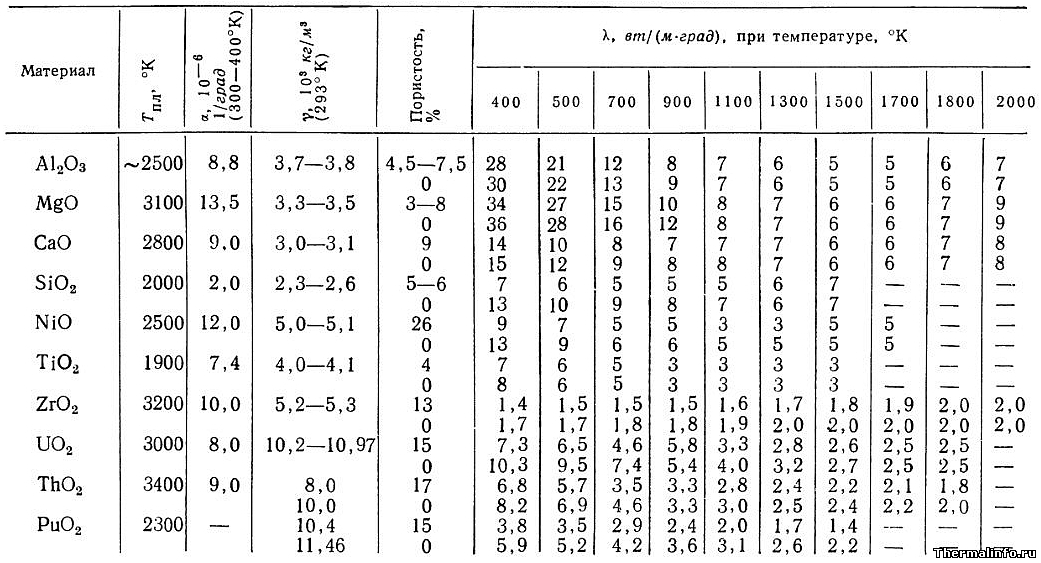
В таблице представлены теплофизические свойства оксидов (спеченных окислов) металлов при различной температуре. Даны значения свойств следующих плотных спеченных окислов: оксиды алюминия и магния Al2O3, MgO, оксид кальция CaO, оксид кремния SiO2, оксид никеля NiO, оксид титана TiO, оксид циркония ZrO2, оксид урана UO2, оксид тория ThO2, оксид плутония PuO2
Теплопроводность спеченных окислов в таблице указана при температуре от 127 до 1727 °С в зависимости от пористости. Коэффициент линейного теплового расширения (КТР) указан при температуре от 300 до 400 К. Плотность оксидов металлов дана при комнатной температуре.
Теплопроводность спеченных оксидов металлов зависит от чистоты и кристаллической структуры исходных порошков, метода и степени прессования и режимов спекания. Теплопроводность порошкообразных окислов зависит от плотности, размера зерен и влажности; для любых порошкообразных оксидов металлов (не спеченных) теплопроводность лежит в пределах 0,1…1,1 Вт/(м·град).
В таблице даны следующие свойства оксидов металлов:
- , К;
- коэффициент линейного теплового расширения (КТР), 1/град;
- плотность, кг/м 3 ;
- пористость, %;
- коэффициент теплопроводности, Вт/(м·град).
Основные свойства оксидов металлов
В таблице приведены основные свойства оксидов металлов при комнатной температуре.
Свойства указаны для следующих оксидов металлов: Al2O3, MgO, TiO, Ti2O3, TiO2, ZrO2, оксид цинка ZnO, оксиды железа FeO, Fe3O4, Fe2O3, NiO, оксид меди CuO, оксид ванадия V2O5, оксид вольфрама WO3, оксид марганца MnO2, оксид бария BaO2.
Даны следующие свойства оксидов металлов:
- молекулярная масса оксида;
- плотность, кг/м 3 ;
- температура плавления, К;
- теплота плавления, кДж/кг;
- температура кипения, К;
- теплота испарения при кипении, кДж/кг;
- температура полиморфного превращения, К;
- теплота полиморфного превращения, кДж/кг.
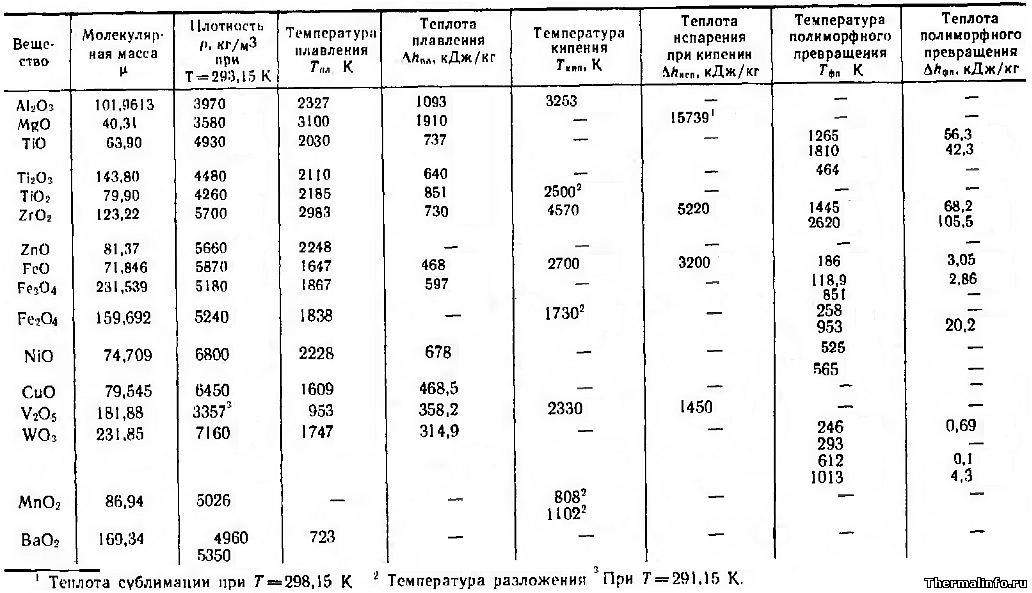
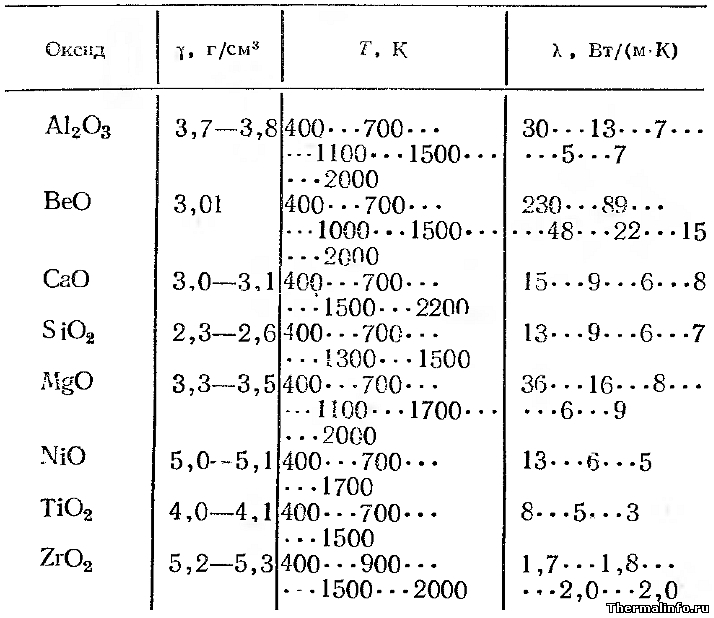
Теплопроводность плотных спеченных оксидов металлов
В таблице представлены значения теплопроводности плотных спеченных оксидов металлов (пористость равна нулю) в зависимости от температуры.
Теплопроводность дана для следующих оксидов металлов: оксид алюминия Al2O3, оксид бериллия BeO, оксид кальция CaO, оксид кремния SiO2, оксид магния MgO, оксид никеля NiO, оксид титана TiO2, оксид циркония ZrO2. Теплопроводность окислов металлов приведена при температуре от 100 до 2000 К.
Видно, что в основном, теплопроводность оксидов снижается при росте температуры. В таблице также указана плотность оксидов металлов (оксидная керамика) при комнатной температуре.
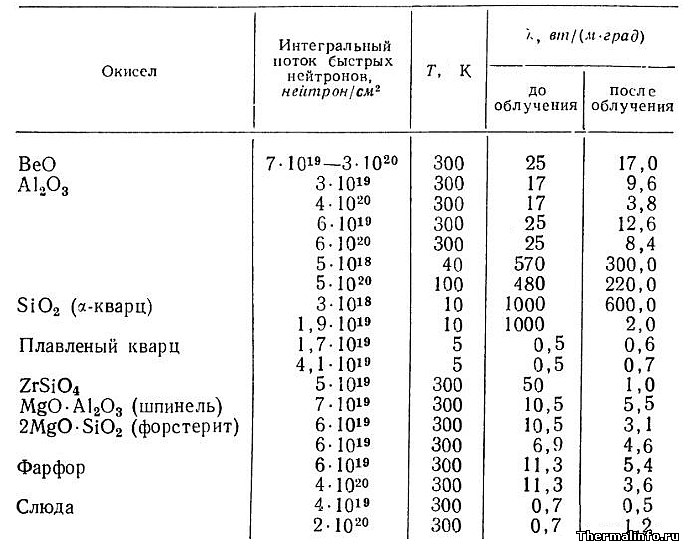
Влияние нейтронного облучения на теплопроводность спеченных оксидов металлов
В таблице представлены значения теплопроводности плотных спеченных оксидов металлов до и после облучения потоком быстрых нейтронов.
Теплопроводность оксидов дана при комнатной температуре и при сверхнизких температурах (5…100 К).
Значения указаны для следующих оксидов металлов: BeO, Al2O3, SiO2 (α-кварц), плавленый кварц, ZrSiO4, шпинель, форстерит, фарфор, слюда.
Как видно из таблицы, значение коэффициента теплопроводности оксидов металлов при их облучении потоком быстрых нейтронов, в основном снижается.
Теплоемкость оксидов металлов
В таблице указаны значения истинной и средней удельных теплоемкостей оксидов металлов в зависимости от температуры.
Теплоемкости (размерность кДж/(кг·град)) даны при температуре от 0 до 1500°С.
Значения представлены для следующих оксидов металлов (компонентов огнеупорных материалов и шлаков): SiO2, Al2O3, Fe2O3, FeO, MgO, MnO, CaO.
Примечание: Истинная теплоемкость соответствует указанной температуре, а значение средней теплоемкости Cm приведено для интервала температуры от 0°С до указанной в таблице. По данным таблицы видно, что удельная (массовая) теплоемкость оксидов металлов при увеличении их температуры также увеличивается.
Большая Энциклопедия Нефти и Газа
Оксидная изоляция алюминия относится к классу нагревостойкости С. Так как температура плавления оксида алюминия очень высока, около 2050 С, можно нагреть алюминиевый оксидированный провод до температуры плавления металла ( см. стр. Однако недостатками оксидной анодированной изоляции являются ее малая гибкость и заметная из-за пористости пленки гигроскопичность. В тех случаях, когда не требуется особо высокой нагревостойкости, оксидная изоляция может пропитываться и покрываться лаком. [17]
Физические свойства оксидов изменяются закономерно и соответственно изменению свойств элементов по периодам и группам. На рис. 80 представлена зависимость температуры плавления оксидов от порядкового номера элемента. При обычной температуре оксиды металлов - твердые кристаллические вещества, оксиды неметаллов могут быть в газообразном ( SOa, CO и др.), в жидком ( Н2О и др.) и твердом ( РаОз, Р2О5, SiO2 и др.) агрегатных состояниях. [18]
Аналогично этому ванадиевые и молибденовые катализаторы не могут легко восстанавливаться этиленом при температуре его полимеризации, поэтому для достижения высокой активности необходимо использовать промотор, служащий восстановителем. Как показано в табл. 6, температура плавления оксида резко возрастает при переходе от хрома к ванадию и молибдену. Низкая точка плавления СгО3 обеспечивает его подвижность по поверхности оксида кремния и тем самым высокую дисперсность. [20]
Приведенные условия определяют требования к металлу, обрабатываемому кислородной резкой. Прежде всего, температура плавления металла должна быть выше температуры плавления оксидов . [22]
Поведение оксида позволяет в определенной степени прогнозировать реакцию того или иного катиона при прокаливании на угле. Например, соединения марганца давать возгона не будут, так как температура плавления оксида марганца 1650 С. Возгоны таллия и германия получить можно, так как оксид таллия плавится при 300 С, давая черный возгон, а оксид германия способен возгоняться из твердого состояния при 700 С. Эти металлы не включены в приведенную выше таблицу, так как редко встречаются в практике качественного анализа. Образование королька связано со способностью оксида металла восстанавливаться углем. Например, галлий королька давать не будет, так как его оксиды не восстанавливаются углем. [23]
После общей очистки обжиговый газ, полученный из колчедана, обязательно подвергается специальной очистке для удаления остатков пыли и тумана и, главным образом, соединений мышьяка и селена, которые при этом утилизируют. В специальную очистку газа входят операции охлаждения его до температуры ниже температур плавления оксида мышьяка ( 315 С) и селена ( 340 С) в башнях, орошаемых последовательно 50 % - ной и 20 % - ной серной кислотой, удаления сернокислотного тумана в мокрых электрофильтрах и завершающей осушки газа в скрубберах, орошаемых 95 % - ной серной кислотой. Из системы специальной очистки обжиговый газ выходит с температурой 140 - 50 С. [24]
В последних трех случаях этой таблицы ( Al, Mg и Zn) температура анода и катода определяется температурой плавления оксидов , которыми соответствующие металлы покрываются при - горении дуги в воздухе. [25]
Для нормального протекания процесса кислородной резки необходимо, чтобы выполнялись следующие условия. Температура воспламенения металла должна быть ниже температуры плавления. Температура плавления оксидов металла должна быть ниже температуры плавления самого металла. Оксиды должны быть жидкотекучими. Теплота, выделяющаяся при сгорании металла, должна быть достаточно большой для поддержания непрерывного процесса. Этим условиям полностью отвечают малоуглеродистые стали. Низколегированные конструкционные стали режутся удовлетворительно. Высоколегированные хромистые и хромоникелевые стали, чугун, а также цветные металлы не поддаются обычной газо-кислородной резке. Для газовой резки этих металлов применяются флюсы, которые растворяют относительно тугоплавкие оксиды и повышают тепловыделение при резке. [26]
Защитные свойства хлоридных пленок низкие, в некоторых случаях металлы в токе хлора возгораются. В табл. 6.4 приведены температуры плавления хлоридных солей ряда металлов. Для сравнения указаны температуры плавления оксидов и сульфидов. [28]
Если рассматривать свойства металлов в состоянии со степенью окисления 5, нужно отметить следующее: оксиды - плотные, устойчивые, инертные вещества. По размерам атома и иона ниобий и тантал близки друг к другу. Это отражается и на свойствах оксидов, температура образования которых у ниобия и тантала высокая, как и температура плавления оксидов , а высшие оксиды NbsOs и Та2О5 практически нерастворимы в воде. Если сравнивать ионы одной и той же степени окисления, то можно заметить усиление металлических свойств. Кислотные свойства гидроксидов выше, чем в подгруппе титана, и падают от ванадия к танталу. Гидроксид ванадия-слабая кислота, а ниобия и тантала - соединения амфо-терные. Так как у этих элементов не заполнены d - орбитали, то значит они способны образовывать комплексные соединения. Атом ниобия в NbF5 обладает положительным зарядом, так как фтор оттягивает от Nb электроны. [29]
Сварка алюминия и его сплавов затруднена вследствие его особых теплофизических свойств. При контакте с воздухом на поверхности алюминия образуется плотная тонкая пленка оксида А12Оз, которая предохраняет металл от дальнейшей коррозии, но одновременно ухудшает условия сварки, так как температура плавления оксида алюминия 2050 С, поэтому перед сваркой надо удалить с поверхности алюминия оксид. Алюминий легко окисляется при сварке, и оксидная пленка, образующаяся на каплях и в ванне, загрязняет шов. В расплавленном состоянии алюминий хорошо растворяет водород, который при повышенной скорости охлаждения, вызванной высокой теплопроводностью металла, не успевает выделиться в момент кристаллизации и вызывает пористость. [30]
Температура плавления металла должна быть выше температуры его окисления ( горения) в кислороде, иначе металл при нагреве будет плавиться и принудительно удаляться из разреза без характерного для процесса резки окисления, являющегося главным источником тепла. [1]
Температура плавления металла должна быть выше температуры плавления образующихся в процессе резки окислов, иначе тугоплавкие окислы изолируют металл от контакта с кислородом и затруднят процесс резки. [2]
Температура плавления металла чистотой 99 996 % составляет 660 24, температура кипения - около 2500 С. Алюминий имеет высокую электропроводность и теплопроводность. Он реагирует с галоидами, кислородом, серой. Как амфотерный металл, он реагирует с кислотами и щелочами. Однако наряду с большой химической активностью алюминий легко подвергается пассивации. Кислоты - сильные окислители ( азотная кислота, концентрированная серная кислота) - не реагируют с ним, чему способствует защитная окисная пленка. [3]
Температуры плавления металлов в периодах системы Д. И. Менделеева сначала возрастают, начиная с простых веществ металлов IA-группы, и достигают максимума у простых веществ металлов VIB-группы, где находится самый тугоплавкий металл - вольфрам. [4]
Температура плавления металлов приведена на диаграмме ( рис. 58), из которой видно, что самым легкоплавким металлом является ртуть ( темп. [6]
Температура плавления металлов является достаточно хорошим показателем прочности межатомных связей в кристаллической решетке. Чем ниже температура плавления металла, тем больше коэффициент термического расширения и, следовательно, быстрее при нагреве наступает разупрочнение. Еще более жаропрочными оказываются сплавы на основе хрома, молибдена и других тугоплавких металлов. [8]
Температура плавления металла - это температура, при которой данный металл переходит из твердого состояния в жидкое. [9]
Температура плавления металла зависит от его состава и давления в процессе плавления. [10]
Температура плавления металлов является достаточно хорошим показателем прочности межатомных связей в кристаллической решетке. Чем ниже температура плавления металла, тем больше коэффициент термического расширения и, следовательно, быстрее при нагреве наступает разупрочнение. [11]
Температура плавления металлов и сплавов в известной степени может служить мерой жаропрочности их. [12]
Температура плавления металла должна быть выше температуры его воспламенения в кислороде. Для условий огневой зачистки температура воспламенения металла равна примерно 1350 С. [13]
Температура плавления металла должна быть выше темпера -, туры его окисления ( горения) в кислороде, иначе металл при нагреве будет плавиться и принудительно удаляться из разреза без характерного для процесса резки окисления, являющегося главным источником тепла. [14]
Температура плавления металла должна быть выше температуры плавления образующихся в процессе резки окислов, иначе тугоплавкие окислы изолируют металл от контакта с кислородом и затруднят процесс резки. [15]
Читайте также:
- Металлический хром получают восстановлением его оксида cr2o3 металлическим алюминием вычислите массу
- Ворота металлические раздвижные с калиткой
- На металлическую пластинку с работой выхода 2 эв падает электромагнитное излучение зависимость
- Завод обработки цветных металлов казахстан
- Металлические фигурки из гаек и болтов
