Тепловые свойства жидких металлов
Обновлено: 03.05.2024
Взаимодействие жидких металлов с данной группой материалов чрезвычайно сложно и многообразно. Это объясняется не только сложностью происходящих процессов, но и разнообразием и неоднородностью материалов. Прежде всего необходимо отметить чисто тепловое и чисто механическое воздействие металлических расплавов на материалы стенок плавильного пространства. Материал, с которым непосредственно граничит жидкий металл, должен выдерживать механические нагрузки, создаваемые расплавом при соответствующей температуре. Механическое воздействие расплавов на материалы плавильного пространства не сводится к простым статическим нагрузкам, которые определяются глубиной жидкой ванны и плотностью расплава. Значительно более важным является размывающее, эрозионное воздействие расплавов на материалы футеровки печей, ковшей и тиглей. Полное описание и оценка этого воздействия не исчерпываются обычными расчетными приемами механики и гидравлики, поскольку оно осложнено многообразными физико-химическими процессами. Поэтому большое значение имеют качественные характеристики, полученные из производственного опыта.
Взаимодействие с оксидными огнеупорными материалами. Этот класс материалов, используемых для плавильных емкостей, состоит из чистых тугоплавких оксидов или из их смесей.

В табл. 5 перечислены главные огнеупорные оксидные материалы, их состав и огнеупорность. Последнее свойство, как известно, характеризуется температурой (°C), которую способен выдержать материал при напряжении сжатия в 0,2 МПа. Там же указана более низкая температура, при которой данное напряжение вызывает начало деформации. Огнеупорность чистых оксидов значительно выше, чем их смесей. Это видно из приведенных ниже данных:

Меньшая огнеупорность смесей оксидов объясняется наличием в соответствующих системах составов с пониженными температурами плавления. Неудачный выбср материала с пониженной огнеупорностью приводит к механическому разрушению футерозки и загрязнению расплава инородными частицами неметаллических включений, которые в данном случае называют экзогенными, подчеркивая их внешнее по отношению к расплаву происхождение.
Наиболее опасным является взаимодействие металлических расплавов с оксидными огнеупорными материалами по реакции: Me + RO ⇔ MeO + [R]Me. Суть его состоит в восстановлении элементов из огнеупорных оксидов и окислении расплава. Восстановленный элемент, как правило, растворяется в металлическом расплаве и загрязняет его. Образующийся оксид металла может растворяться в расплаве, оставаться в свободном виде или же образовывать сплав с огнеупорным оксидом. В результате такого взаимодействия разрушается футеровка и загрязняется расплав. Очевидно, что подобное взаимодействие недопустимо, и при выборе огнеупорной футеровки это обстоятельство необходимо учитывать. Яркий пример такого взаимодействия можно видеть при плавке магниевых сплавов на оксидной футеровке, содержащей кремнезем (SiO2). Именно по этой причине магниевые сплавы никогда не плавят в условиях, при которых расплав может соприкасаться с SiO2. Интенсивное взаимодействие между кремнеземом и расплавом происходит при плавке специальных бронз — медных сплавов, содержащих такие активные легирующие компоненты, как хром, цирконий, магний, бор. В этом случае реакция проходит между этими легирующими добавками и кремнеземом. В результате в сплаве оказывается пониженное содержание легирующих добавок и много неметаллических включений.
Однако нередко с подобным взаимодействием приходится мириться, если оно не проявляется слишком сильно. Именно так обстоит дело при плавке алюминиевых сплавов на шамотной футеровке, где содержание кремнезема не менее 60 %. Реакция между алюминием и кремнеземом футеровки идет хотя и заметно, но довольно медленно, приводя к повышению содержания кремния в расплаве и видоизменению поверхностного слоя футеровки. Наиболее интенсивно реакция идет на новой футеровке. Затем, по мере изменений состава поверхностного слоя футеровки, интенсивность взаимодействия затухает. Если в сплаве ограничено содержание кремния, то приходится применять материалы с пониженным содержанием кремнезема, например высокоглиноземистые огнеупоры, содержащие не более 20—30 % SiO2, или магнезит.
Проблема прямой окислительно-восстановительной реакции между расплавляемым металлом и огнеупорной футеровкой становится практически неразрешимой в случае тугоплавких металлов, начиная с титана. Все тугоплавкие металлы 4, 5 и 6-й групп периодической системы элементов Д.И. Менделеева настолько активны по отношению к кислороду, что никакие огнеупорные оксиды не выдерживают воздействия подобных расплавов. Положение усугубляется еще и тем, что плавка ведется в вакууме, когда многие огнеупорные оксиды заметно испаряются. Именно эти причины в сочетании с большой тугоплавкостью рассматриваемых металлов вынуждают обращаться к совершенно особому способу плавки с применением водоохлаждаемых изложниц-кристаллизаторов, играющих одновременно роль плавильных тиглей.
В подобных плавильных установках огнеупорных материалов вообще нет, и расплав контактирует с металлической поверхностью, охлаждаемой с противоположной стороны водой.
Большую роль во взаимодействии расплавов с огнеупорными материалами играет явление смачивания. Смачивание обычно предшествует рассмотренному химическому взаимодействию. Когда же реакция не происходит, взаимодействие ограничивается простым смачиванием расплавом поверхности огнеупоров. Вообще чистые металлы при отсутствии химического взаимодействия с огнеупорными оксидами плохо их смачивают. Если расплав способен растворять в себе кислород, то такие расплавы смачивают оксидные материалы значительно лучше. Это выражается в заметном снижении краевого угла смачивания.
Химическое взаимодействие расплава с футеровкой и смачивание ее расплавом вызывают так называемую металлизацию футеровки. Внешне это выражается в том, что прилежащий к расплаву слой огнеупорной футеровки меняет свой цвет и из светлого становится темным. Существенно возрастает физическая плотность этого слоя, пористость в нем резко снижается. Все эти изменения происходят одновременно с заметными переменами в химическом составе.
В общих чертах металлизацию футеровки можно представить следующим образом. Если расплав химически не реагирует с футеровкой, то металлизация происходит только посредством смачивания. При условии плохого смачивания футеровки расплавом краевой угол θ≥90. Это значит, что расплав будет затекать в пору радиусом r только под давлением, которое определяется высотой столба расплава h, его плотностью d и земным ускорением g : р = dgh = 2σ cos θ r, где σ — поверхностное натяжение расплава при данных условиях. Для меди при h = 0,3 м, σ = 12 000 мДж м2, θ = 120° получается, что расплав сможет проникать в поры радиусом 0,05 мм и более. При неизменных условиях, для которых проведен расчет, расплав может проникнуть в толщу футеровки на неограниченную глубину. Однако, поскольку температура по толщине футеровки не постоянна, а снижается в направлении от расплава к наружной поверхности, проникновение расплава ограничивается той толщиной, где температура выше точки кристаллизации расплава.
Явление существенно меняется, если краевой угол смачивания θ≤90. При этом условии мениск в капиллярах из выпуклого становится вогнутым. Использованное ранее равенство определяет теперь уже не избыточное давление, необходимое для принудительного заполнения капилляра, а добавочное давление, возникающее в самом капилляре и способное поднять в нем расплав на высоту h. Это значит, что при θ≤90° во всех порах футеровки действует сумма давлений, металлостатического и капиллярного. Под действием этого суммарного давления расплав способен заполнить не только поры любых размеров в слоях футеровки, лежащих ниже уровня расплава, но и подняться выше этого уровня на высоту h. Глубина проникновения расплава в футеровку, как и в первом случае, определяется распределением температуры в толще футеровки и ограничивается изотермой кристаллизации расплава. Таким образом, при хорошем смачивании расплавом футеровки, когда краевой угол не превышает 90°, должны заполняться расплавом поры любых размеров. Именно этим явлением объясняется резкое усиление металлизации футеровки в случаях окисленных расплавов при плавке таких металлов, как медь, никель, железо, у которых краевой угол смачивания существенно уменьшается при увеличении содержания кислорода.
Когда между расплавом и оксидной футеровкой возможна химическая реакция, надо прежде всего учесть, что в условиях протекания химического взаимодействия между двумя фазами межфазная поверхностная энергия снижается до нуля. Это приводит к соответствующему уменьшению краевого угла смачивания и вызывает самопроизвольное втягивание расплава в поры. Действительно, все случаи возникновения толстых металлизованных слоев футеровки связаны с протеканием химического взаимодействия между расплавом и тугоплавким оксидом.
Взаимодействие металлического расплава с оксидной футеровкой может сопровождаться также такими явлениями, как разъедание футеровки и образование настылей. Настылью вообще в металлургии называют участок твердого металла или шлака, самопроизвольно возникающий в расплаве. В данном случае речь идет о самопроизвольном нарастании твердого конгломерата оксидов на стенках плавильной ванны в металлическом расплаве. Разъедание оксидной футеровки объясняется появлением жидкого сплава оксида металла MeO с оксидом футеровки RO. Появление такого жидкого сплава возможно, если в системе MeО—RO имеется область легкоплавких составов, а плавка ведется при достаточно высоких температурах, превышающих область расплавления этих легкоплавких составов.

На рис. 9 представлена схема диаграммы состояния системы MeO—RO, где имеется достаточно легкоплавкая эвтектика. Если металл плавится на футеровке из оксида RO и температура плавки равна t1, то сама футеровка при этой температуре вполне устойчива, так как точка плавления оксида RO примерно вдвое больше t1. Однако, если металл начинает окисляться и на поверхности появляется свободный оксид MeO, неизбежно будет происходить взаиморастворение оксида металла и оксида футеровки с появлением жидкого оксидного расплава, имеющего состав между точками а и b. Результатом такого взаимодействия будет разъедание футеровки и образование на поверхности металлического расплава слоя расплава оксидов. Поскольку окисление металлического расплава происходит главным образом на свободной поверхности, разъедание футеровки будет наибольшим в месте, где зеркало металлического расплава соприкасается со стенкой печи или тигля.
Подобное разъедание футеровки можно наблюдать при плавке меди и некоторых ее сплавов. Особенно легко и интенсивно разъедается шамотная футеровка при плавке бронз с большим содержанием свинца. В системе PbO—SiO2 имеются очень легкоплавкие эвтектики, вплоть до 715 °С. Поэтому взаиморастворение кремнезема и закиси свинца идет очень интенсивно, и шамотная футеровка быстро разъедается.
Образование оксидных настылей объясняется самоспеканием частиц оксидов металла, находящихся в расплаве, на отдельных участках футеровки, где имеется достаточно высокая температура. По рис. 9 этот процесс возможен, если плавка металла ведется при температуре t2. Эта температура ниже эвтектической температуры в системе MeO—RO, поэтому оплавления и разъедания футеровки происходить не может. Однако температура все же достаточно высока, так что диффузионные процессы в оксидных фазах проходят с заметной скоростью. При соприкосновении частиц MeO с футеровкой RO возможно их прилипание к ней. Если расплав непрерывно перемешивается и к данному участку футеровки поступают все новые частицы оксидов, взвешенные в расплаве, то именно здесь будет постепенно нарастать настыль. Эта настыль может быть образована не только смесью частиц MeО и RO, но и одними частицами MeО. Подобные настыли образуются при плавке алюминиевых сплавов, а также алюминиевых бронз в индукционных печах. Чтобы избежать образования настылей и тем более разъедания футеровки, необходимо подбирать такой материал для плавильной печи, при котором температура плавки была значительно ниже не только точек оплавления оксидов огнеупорного материала, но и возможных эвтектических температур в системах MeO—RO. Этот наиболее удачный случай изображен на рис. 9, когда температура плавки равна t3.
Взаимодействие с огнеупорными материалами, содержащими углерод и карборунд. Из материалов, содержащих углерод, в литейном производстве для плавки металлов чаще всего используется смесь огнеупорной глины-шамота с 30—45 % графита. Из этой смеси изготавливают так называемые графитошамотные плавильные тигли и различные блоки и пластины для футеровки плавильных ванн. В карборундовых огнеупорных изделиях содержание карборунда (карбида кремния) составляет не менее 80 %, остальное — оксидная связка. Иногда при плавке металлов используют обычный электродный графит, состоящий более чем на 98 % из чистого углерода.
Все, что было сказано о взаимодействии металлических расплавов с оксидными огнеупорами, почти полностью справедливо и для материалов, состоящих из смеси оксидных огнеупоров с графитом. При работе подобных материалов на воздухе графит в поверхностном слое довольно быстро выгорает, так что поверхность остается почти чисто оксидной. Ho все же смачивание огнеупорных материалов, содержащих углерод, металлическими расплавами значительно меньше, чем чисто оксидных. Основная особенность материалов, содержащих углерод, заключается в возможности растворения углерода в металлическом расплаве. Эта опасность возникает лишь в том случае, если плавятся металлы, способные растворять в себе углерод (марганец, никель, железо и др.). Графитошамотные тигли обычно способны работать лишь до 1400 °С, поэтому их используют для плавки цинка, алюминия, меди и их сплавов, а также сплавов на основе золота и серебра.
Карборундовые материалы обладают весьма большой огнеупорностью и начинают деформироваться под нагрузкой при 1700 °С. Они не смачиваются металлическими расплавами и не вступают с ними в химическое взаимодействие.
Электродный графит сам по себе способен работать до 2000—2200 °С. Однако на воздухе он очень быстро сгорает, начиная с 600—700 °С, а в вакууме заметно испаряется выше 2000 °C. Главная же особенность графитовых материалов состоит в возможном растворении углерода в металлических расплавах. Это приводит к загрязнению расплава и разрушению огнеупора. Графитовые огнеупоры вполне пригодны для плавки легкоплавких металлов, а также меди и ее сплавов. Однако, начиная с 600 °С, для долговременной работы необходимо защищать их от окисления. Для этого чаще всего используют защитную атмосферу из оксидов углерода и углеводородов. Железо и никель плавить в графитовых огнеупорах нельзя из-за загрязнения расплава углеродом. То же самое относится ко всем тугоплавким металлам. В графитовых тиглях плавят титан, но при этом сплавы загрязняются углеродом (до 1—1,5 %).
Из металлических материалов, используемых для изготовления плавильных емкостей, в которых находится металлический расплав, широко применяют лишь сталь и чугун. Понятно, что плавильные тигли из этих материалов можно использовать лишь для сравнительно легкоплавких металлов. Одновременно необходимо считаться и с возможностью растворения железа в приготовляемом расплаве. Все эти сведения легко можно получить по диаграмме состояния железо — расплавляемый металл.
Как уже говорилось, для плавки тугоплавких металлов используют водоохлаждаемые тигли-кристаллизаторы. Рабочие стенки кристаллизаторов делают обычно из меди. Благодаря водяному охлаждению медная стенка на рабочей поверхности нагревается не более чем до 300—400 °С. Поэтому металлический расплав, соприкасаясь с такой «холодной» стенкой, тотчас затвердевает и образуется так называемый гарниссаж. Плавка совершается практически без прямого контакта расплава с медной рубашкой.
Надо сказать, что все огнеупорные материалы, особенно оксидные, в исходном состоянии содержат много адсорбированной влаги. Поэтому перед употреблением их необходимо тщательно просушивать и прокаливать. В противном случае расплав будет насыщаться большим количеством водорода.
Тепловые свойства жидких металлов
Подавляющее большинство металлов как в жидком, так и твердом состояниях активно взаимодействует с кислородом. Конечным продуктом взаимодействия являются оксиды. Это объясняется тем, что равновесное давление кислорода над оксидами составляет величину, значительно меньшую 2*10в4 Па — парциальное давление кислорода в атмосфере воздуха (табл. 3).

Хотя с повышением температуры равновесное давление кислорода над оксидами возрастает, однако при температурах плавления чистых металлов эта величина остается очень малой. Так, для закиси меди при 1200 С равновесное давление кислорода равно всего 10 Па, а для оксидов других металлов оно намного порядков меньше. Исключение составляет закись серебра, у которой при 600 °C равновесное давление кислорода равно 10в6 Па. Следовательно, этот оксид будет неустойчив на воздухе, и плавка серебра на воздухе при 900—1000 °C не должна привести к появлению свободной закиси серебра.
Для плавки металлов важна не только возможность образования свободного оксида. He менее важным является образование растворов кислорода в расплаве, которое может предшествовать появлению свободного оксида. По этому признаку металлы можно разбить на два типа, как это сделано в приведенном ниже ряду. Металлы, не способные растворять в своем расплаве кислород в практически заметных количествах, отмечены знаком «-», а те, в которых кислород растворяется, отмечены знаком «+»:

Как видно, легкоплавкие металлы по алюминий включительно не растворяют кислород, находясь в жидком состоянии. У них взаимодействие с этим газом выражается в появлении пленки нерастворимого оксида. В олове, висмуте и свинце имеется небольшая растворимость кислорода, но для обычного процесса плавки она не имеет значения. Все остальные перечисленные в ряду более тугоплавкие металлы, начиная с серебра, растворяют заметные количества кислорода. Эта особенность хорошо видна на диаграммах состояния систем металл — кислород при давлении около 10в3 Па, где имеются обширные области жидких растворов кислорода в металле (рис. 6, 7).


Особенность поведения металлических расплавов чистых металлов, содержащих растворенный кислород, состоит в том, что при их охлаждении и кристаллизации этот газ никогда не выделяется из раствора в свободном виде, а переходит либо целиком в твердый раствор (например, в системе титан — кислород), либо в твердые соединения — оксиды, появляющиеся в результате эвтектического превращения (в системах медь — кислород, железо — кислород, никель — кислород). Это значит, что кислород в подобных металлах не вызывает появления газовой пористости. Исключение составляет серебро, оксид которого устойчив лишь до 190 °С. Поэтому при кристаллизации серебра, содержащего растворенный кислород, этот газ выделяется в свободном виде при 939 °С по так называемой газоэвтектической реакции: жидкость → кристаллы + газ. В результате в литом металле образуется газовая пористость.
В тугоплавких металлах 6-й группы (молибдене и вольфраме), по-видимому, возможно появление небольшой газовой пористости при кристаллизации расплава, содержащего растворенный кислород, но пористость образована не чистым газом, а парами оксидов этих металлов, поскольку их температуры кипения ниже, чем температуры плавления самих металлов.
Таким образом, взаимодействие жидких металлов с кислородом приводит либо к загрязнению расплава частицами нерастворимых оксидов (от олова до алюминия в приведенном выше ряду), либо к загрязнению растворенным газом (серебро и далее до молибдена). При продолжительном контакте с газом и достаточном его количестве оксиды в свободном виде могут появиться при плавке и этих металлов, за исключением серебра.
Взаимодействие жидких сплавов с кислородом проходит более сложно и приводит к различным результатам в зависимости от основы сплава и легирующих компонентов. Сплавы на основе легкоплавких металлов при любых легирующих компонентах ведут себя с кислородом подобно чистым металлам-основам, т. е. при соприкосновении таких расплавов с газовой средой, содержащей кислород, на поверхности расплавов возникает пленка нерастворимых оксидов. Состав этой пленки определяется условием наименьшего значения равновесного давления кислорода над чистыми оксидами, их соединениями или растворами между собой и содержанием компонентов в сплаве.
Жидкие сплавы из таких металлов, как серебро, медь, никель, железо, при взаимодействии с кислородом растворяют этот газ в количествах, промежуточных по сравнению с чистыми металлами. При избытке кислорода появляется свободный жидкий или твердый оксид менее благородного металла из содержащихся в сплаве. Кристаллизация этих сплавов, содержащих растворенный кислород, не сопровождается выделением газа в свободном виде. Кислород из жидкого раствора переходит в оксидную фазу по эвтектической реакции. Обычно этой фазой является закись менее благородного металла.
Сплавы на основе тех же металлов (серебра, меди, никеля, железа) с металлами, обладающими большим сродством к кислороду, такими, как олово, кадмий, свинец, цинк, магний, алюминий, титан, хром, кремний, при взаимодействии с кислородом почти неспособны растворять его, поэтому подобные расплавы сразу же покрываются пленкой нерастворимых оксидов, которые состоят в основном из кислородных соединений наиболее активного по отношению к этому газу металла. Следовательно, в результате взаимодействия рассматриваемых жидких сплавов с кислородом расплав загрязняется неметаллическими включениями оксидного характера. Подобные включения называют первичными или докристаллизационными. Несколько отличается от описанного поведение сплавов на основе железа с небольшими добавками марганца и кремния. В этих сплавах, когда они находятся в жидком состоянии, кислород способен растворяться, хотя в ограниченном количестве, причем между содержанием легирующих компонентов и содержанием кислорода наблюдается обратная пропорциональность. Эта зависимость есть следствие закона действия масс. При охлаждении такого жидкого раствора-расплава из него выделяется самостоятельная оксидная фаза до начала кристаллизации. Частицы этой фазы также образуют в расплаве взвешенные неметаллические включения докристаллизационного характера. Строго говоря, подобным же образом ведут себя все сплавы на основе серебра, меди, никеля, железа с добавками более активных по отношению к кислороду металлов. Однако количество растворенного кислорода настолько мало, что им в большинстве случаев можно пренебречь и считать, что оксидная фаза образуется сразу, как это и было сделано ранее.
Сплавы никеля и железа с углеродом взаимодействуют с кислородом формально так же, как и сплавы этих металлов с кремнием и марганцем. Существенное отличие состоит в том, что в результате этого взаимодействия образуется газ — окись углерода. Следовательно, в рассматриваемых сплавах не происходит загрязнение расплава неметаллическими включениями Однако при охлаждении и кристаллизации сплавов никеля и железа, содержащих не более 1—2%С, возможно выделение окиси углерода, вызывающей образование пор и пузырей.
Сплавы на основе тугоплавких металлов 4, 5 и 6-й групп периодической системы элементов в жидком состоянии взаимодействуют с кислородом подобно чистым металлам-основам.

Если сравнивать теплоты плавления, выраженные в джоулях на грамм, то бросается в глаза очень большая разница в величинах. У легкоплавких металлов — олова, висмута, цинка — теплота плавления составляет всего несколько десятков джоулей на 1 г, у меди, никеля, железа она измеряется величиной в 200 300 Дж/г, у магния и алюминия приближается к 400 Дж/г. Поразительно большие теплоты плавления имеют кремний и бериллий — 1800 и 1590 Дж/г, что в 20—30 раз больше, чем у олова и висмута. Однако если учесть, что теплота плавления отражает энергию, необходимую для разрушения кристаллической решетки, в узлах которой находятся атомы (у металлов — ионы), то более правильно теплоту плавления относить не к единице массы, а к единице количества вещества — молю. Эта энергия необходима для разрушения такого объема кристаллической решетки, в узлах которого находится одинаковое число атомов — 6,02*10в23 (число Авогадро). Переход к молярной теплоте плавления, выраженной в кДж/моль, дает возможность увидеть, что у типичных металлов, обладающих четко выраженной металлической связью в кристаллической решетке молярная теплота плавления составляет 4—18 кДж/моль. Как видно, наблюдается заметное возрастание этой характеристики от 4,3—6,8 кДж/моль у свинца и цинка до 13,9—17,5 кДж моль у железа и никеля. Это объясняется тем, что температура плавления также отражает энергию межатомных связей кристаллической решетки.
Как видно из приведенных выше данных, по молярной теплоте плавления выпадают олово и висмут и особенно германий и кремний. Германий и кремний имеют так называемую алмазную кристаллическую решетку с очень прочными ковалентными связями между атомами. Именно поэтому у них очень большая молярная теплота плавления, превосходящая теплоту плавления металлов в 3—4 раза. Олово и висмут обладают нехарактерными для металлов рыхлыми кристаллическими структурами, в которых имеется значительная доля ковалентных связей, что и отражается в повышенных величинах молярной теплоты плавления: 7—8,8 вместо ожидаемых 4 кДж.
Теплоемкость жидких металлов вблизи точки кристаллизации приведена ниже:

По сравнению с теплоемкостью твердого металла при точке плавления эти значения примерно в 1,1—1,5 раза больше. Какой-либо закономерности не усматривается при сравнении теплоемкости, выраженной через Дж/(г*К). Переход к молярной теплоемкости, т. е. к Дж/(моль*К), позволяет сказать, что у жидких металлов она составляет 29—40 Дж/(моль*К) и явно возрастает с увеличением температуры плавления металлов. Причины этого те же, что и в случае молярной теплоты плавления.
Теплоемкость жидких металлов, как и твердых, возрастает с повышением температуры.
Теплопроводность λ жидких металлов изучена недостаточно. Из приведенных ниже данных можно отметить, что теплопроводность жидких металлов составляет примерно 0,5—0,6 от тепло-

Теплообмен в жидких металлах осуществляется не только теплопроводностью, но и посредством свободной конвекции, которая определяется зависимостью плотности жидкого металла от температуры, вязкостью металла, его теплопроводностью и земным ускорением.
Теплота образования жидких сплавов измеряется той энергией, которая поглощается или выделяется при взаимном растворении двух жидких металлов, взятых при одинаковой температуре. В термодинамике принято считать положительной энергию, поглощенную системой, и приписывать ей знак «+». Энергия, выделившаяся из системы, считается отрицательной и обозначается знаком «-». Этот подход будет соблюден и в данном разделе. Количество энергии, поглощенное или выделенное при образовании сплавов, относят к 1 молю сплава и называют ее интегральной молярной теплотой смешения или образования.
В двухкомпонентных сплавах теплота образования, обозначаемая ΔН, обычно меняется по кривой с экстремумом. Эта кривая близка к параболе. Максимум или минимум кривой приходится на сплавы примерно эквиатомного состава, т. е. при атомной доле каждого из компонентов около 0,5 или 50 % (ат.). Это наибольшая по абсолютному значению теплота образования обозначается ΔHmax. В табл. 2 приведены величины ΔHmax для некоторых систем с указанием температуры и состава сплава, на который приходится эта величина.

Из данных табл 2 видно, что теплоты образования жидких сплавов могут иметь в различных системах положительные и отрицательные значения, при этом в последнем случае ΔHmax может достигать очень больших величин, превосходящих теплоты плавления металлов.
Из этих данных можно сделать определенные выводы. Теплота образования сплавов близка к нулю или имеет небольшую величину в том случае, если в системе наблюдаются непрерывные твердые растворы от А до В. Примером таких систем могут служить Au—Cu, Bi—Sb. Если же в системе при переходе в твердое состояние образуются два ограниченных твердых раствора с простым эвтектическим или перитектическим превращением, то ΔHmax имеет положительный знак, а абсолютное значение может доходить до нескольких килоджоулей на моль. В табл. 2 к подобным системам относятся Ag—Cu, Bi—Sn, Pb—Sn, Al—Zn. Наконец, если в системе в твердом состоянии имеются промежуточные фазы, то теплота образования жидких сплавов всегда отрицательна и может быть очень большой. В табл. 2 к таким системам относятся Mg—Sn и все расположенные ниже ее. Рекордной в этом отношении является система Y—Si, где ΔHmax достигает величины почти 80 кДж/моль, что существенно больше атомной теплоты плавления самого энергоемкого элемента при плавке — кремния.
Величина теплоты образования жидких сплавов мало меняется с повышением температуры. Теплота образования твердых сплавов последних семи систем, приведенных в табл. 2, лишь немного больше по абсолютной величине, чем жидких.
Удельная теплоемкость металлов при различных температурах

Представлена таблица значений массовой удельной теплоемкости металлов при различных температурах и постоянном давлении. Теплоемкость металлов в таблице указана при отрицательных и положительных температурах (от -253 до 3422°С). Определить удельную теплоемкость металла можно как величину, численно равную количеству теплоты, которое необходимо подвести к единице массы металла для увеличения его температуры на один градус.
Какова удельная теплоемкость металла? При средних и высоких температурах абсолютные значения и температурные зависимости удельной теплоемкости металлов различаются достаточно сильно. Так, при комнатных температурах наибольшей удельной теплоемкостью отличается литий — она равна 3390 Дж/(кг·град) при температуре 20°С. Также к металлам с высокой теплоемкостью при средних (до 350°С) температурах можно отнести такие металлы, как магний, алюминий, бериллий, натрий, плутоний.
Наименьшим значением теплоемкости обладают металлы с высокой атомной массой, например торий и уран. Удельная теплоемкость этих металлов равна, соответственно 113 и 116 Дж/(кг·град). Несмотря на столь большой диапазон изменения этой величины, имеют место некоторые схожие значения, наиболее хорошо прослеживающиеся для металлов одной подгруппы, что является следствием периодической системы Менделеева.
Следует отметить, что при низких отрицательных температурах металлы также имеют широкий диапазон значений теплоемкости. Например, при температуре -173°С по данным таблицы минимальной теплоемкостью обладает вольфрам. Теплоемкость вольфрама при этой температуре равна всего 87 Дж/(кг·град). Металлом с самой высокой теплоемкостью при отрицательных температурах является все тот же литий, имеющий низкую атомную массу.
| Металл | Температура,°С | Удельная теплоемкость, Дж/(кг·град) |
|---|---|---|
| Алюминий Al | -173…27…127…327…527…661…727…1127…1327 | 483…904…951…1037…1154…1177…1177…1177…1177 |
| Барий Ba | -173…27…127…327…527…729…927…1327 | 177…206…249…290…316…300…292…278 |
| Бериллий Be | -173…27…127…327…527…727…927…1127…1287…1327 | 203…1833…2179…2559…2825…3060…3281…3497…3329…3329 |
| Ванадий V | 27…127…327…527…727…927…1127…1527…1947 | 484…503…531…557…585…617…655…744…895 |
| Висмут Bi | 27…127…272…327…527…727 | 122…127…146…141…135…131 |
| Вольфрам W | -173…27…127…327…727…1127…1527…2127…2527…3127…3422 | 87…132…136…141…148…157…166…189…208…245…245 |
| Гадолиний Gd | 27…127…327…527…727…1127…1312 | 236…179…185…196…207…235…179 |
| Галлий Ga | -173…27…30…127…327…527…727 | 266…384…410…394…382…378…376 |
| Гафний Hf | 27…127…327…527…727…927…1127…1527…2127…2233 | 144…147…156…165…169…183…192…211…202…247 |
| Гольмий Ho | 27…127…327…527…727…927…1127…1327…1470…1527 | 165…169…172…176…193…218…251…292…266…266 |
| Диспрозий Dy | 27…127…327…527…727…927…1127…1327…1409…1527 | 173…172…174…188…210…230…274…296…307…307 |
| Европий Eu | 27…127…327…527…727…826…1127 | 179…184…200…217…250…251…251 |
| Железо Fe | -173…27…127…327…527…727…1127…1327…1537 | 216…450…490…572…678…990…639…670…830 |
| Золото Au | 27…127…327…527…727…927…1105…1127 | 129…131…135…140…145…155…170…166 |
| Индий In | -223…-173…27…127…157…327…527…727 | 162…203…235…250…256…245…240…237 |
| Иридий Ir | 27…127…327…527…727…927…1127…1327…2127…2450 | 130…133…138…144…153…161…168…176…206…218 |
| Иттербий Yb | 27…127…427…527…727…820…927 | 155…159…175…178…208…219…219 |
| Иттрий Y | 27…127…327…527…727…1127…1327…1522 | 298…305…321…338…355…389…406…477 |
| Кадмий Cd | 27…127…321…327…527 | 231…242…265…265…265 |
| Калий K | -173…-53…0…20…63…100…300…500…700 | 631…690…730…760…846…817…775…766…775 |
| Кальций Ca | -173…27…127…327…527…727…842…1127 | 500…647…670…758…843…991…774…774 |
| Кобальт Co | 27…127…327…527…727…1127…1327…1497…1727 | 421…451…504…551…628…800…650…688…688 |
| Лантан La | 27…127…327…527…727…920 | 195…197…200…218…238…236 |
| Литий Li | -187…20…100…300…500…800 | 2269…3390…3789…4237…4421…4572 |
| Лютеций Lu | 27…127…327…527…727…1127…1327…1650 | 153…153…156…163…173…207…229…274 |
| Магний Mg | -173…27…127…327…527…650…727…1127 | 648…1025…1070…1157…1240…1410…1391…1330 |
| Марганец Mn | -173…27…127…327…527…727…1127…1246…1327 | 271…478…517…581…622…685…789…838…838 |
| Медь Cu | 27…127…327…527…727…927…1085…1327 | 385…398…417…433…451…481…514…514 |
| Молибден Mo | 27…127…327…527…727…1127…1327…1527…1727…2127…2623 | 250…262…276…285…294…320…337…357…379…434…418 |
| Мышьяк As | -253…-233…-193…-123…-23…127…327…727 | 15…75…175…275…314…339…354…383 |
| Натрий Na | -173…-53…-13…20…100…300…500…700 | 977..1180…1200…1221…1385…1280…1270…1275 |
| Неодим Nd | 27…127…327…527…727…927…1024…1127 | 190…200…223…253…291…309…338…338 |
| Нептуний Np | 127 | 147 |
| Никель Ni | -173…-50…20…100…300…500…800…1000…1300…1455 | 423…442…457…470…502…530…565…580…586…735 |
| Ниобий Nb | 27…127…327…527…727…1127…1327…1527…1727…2127…2477 | 263…274…285…293…301…322…335…350…366…404…450 |
| Олово Sn | -173…27…127…232…327…527…727 | 187…229…244…248…242…236…235 |
| Осмий Os | 27…127…327…527…727…1127…1327…1527…1727…1927 | 130…132…136…140…144…152…156…160…164…168 |
| Палладий Pd | 27…127…327…527…727…927…1127…1527 | 244…249…256…264…277…291…306…343 |
| Платина Pt | 27…127…327…527…727…1127…1527…1772 | 133…136…141…147…152…163…174…178 |
| Плутоний Pu | 27…127…327…527…727 | 134…586…1500…2430…3340 |
| Празеодим Pr | 27…127…327…527…727…935 | 184…202…224…253…287…305 |
| Радий Ra | 950 | 136 |
| Рений Re | 27…127…327…527…727…927…1127…1327…1527…1927 | 136…139…145…151…157…163…168…174…180…192 |
| Родий Rh | 27…127…327…527…727…1127…1327…1727 | 243…253…273…293…311…342…355…376 |
| Ртуть Hg | -223…-173…-73…-39…27…127…227…327 | 99…121…136…141…139…137…136…135 |
| Рубидий Rb | -173…-73…20…40…127…327…527…727 | 299…321…356…364…361…356…359…368 |
| Рутений Ru | 27…127…327…527…727…1127…1327…1527…1727…1927…2334 | 238…241…251…265…278…306…325…346…367…389…414 |
| Самарий Sm | 27…127…327…527…727…1078…1227 | 197…221…272…293…300…313…334 |
| Свинец Pb | -223…-173…-73..27…127…227…328…527…727 | 103…117…123…128…133…138…146…143…140 |
| Серебро Ag | 27…127…327…527…727…962…1127 | 235…239…250…256…277…310…310 |
| Скандий Sc | 27…127…327…527…727…1127…1541…1627 | 568…586…611…647…694…815…978…978 |
| Стронций Sr | -173…27…127…327…527…768…1127 | 268…306…314…343…377…411…411 |
| Сурьма Sb | -223…-173…27…127…327…527…630…927 | 100…163…209…213…224…234…275…275 |
| Таллий Tl | -173…27…127…303…727 | 120…129…134…149…141 |
| Тантал Ta | 27…127…327…527…727…1127…1527…2127…2327…2727…3022 | 140…144…150…154…157…160…162…177…187…219…243 |
| Тербий Tb | 27…127…327…527…727…1127…1357 | 182…179…189…207…226…272…292 |
| Технеций Tc | 27…127…327…527…727…1127…1327…2127…2200 | 210…211…225…256…290…324…318…297…290 |
| Титан Ti | 27…127…327…527…727…1127…1327…1527…1671…1727 | 531…556…605…637…647…664…729…800…989…989 |
| Торий Th | -173…27…127…327…527…727…1127…1327…1750…1927 | 98…113…117…124…132…140…155…163…198…198 |
| Тулий Tm | 27…127…327…527…727…1127…1327…1545 | 159…161…163…175…186…204…213…244 |
| Уран U | -173…27…127…327…527…727…842…1127 1135…1327…1927 | 93…116…125…146…175…178…161…161…201…203…209 |
| Хром Cr | 25…127…327…527…727…1127…1327…1527…1727…1907 | 453…482…517…558…614…764…849…936…1020…962 |
| Цезий Cs | -173…27…29…127…327…527…727 | 194…244…246…241…226…219…225 |
| Церий Ce | 27…127…327…527…727…804…927 | 292…202…228…246…268…269…269 |
| Цинк Zn | 27…127…327…420…527…727 | 389…403…436…480…480…480 |
| Цирконий Zr | 27…127…327…527…727…1127…1327…1527…1727…1860 | 279…295…321…345…367…325…341…360…381…467 |
| Эрбий Er | 27…127…327…527…727…1127…1327…1505 | 168…169…174…181…192…220…238…231 |
Зависимость удельной теплоемкости металлов от температуры различна. Наиболее сильную зависимость теплоемкости от температуры имеют плутоний и бериллий. Для многих металлов увеличение температуры приводит к постоянному росту их теплоемкости. У других металлов теплоемкость при нагревании увеличивается, а при достижении температуры плавления снижается или остается практически постоянной. Удельная теплоемкость металлов в жидком (расплавленном) состоянии практически не меняется.
Металлы в таблице расположены в алфавитном порядке, величина теплоемкости соответствует указанным температурам, допускается интерполяция значений. Например, удельную теплоемкость алюминия при температуре 90°С можно определить по таблице следующим образом: 904+(951-904)/(127-27)*90=946,3 Дж/(кг·град).
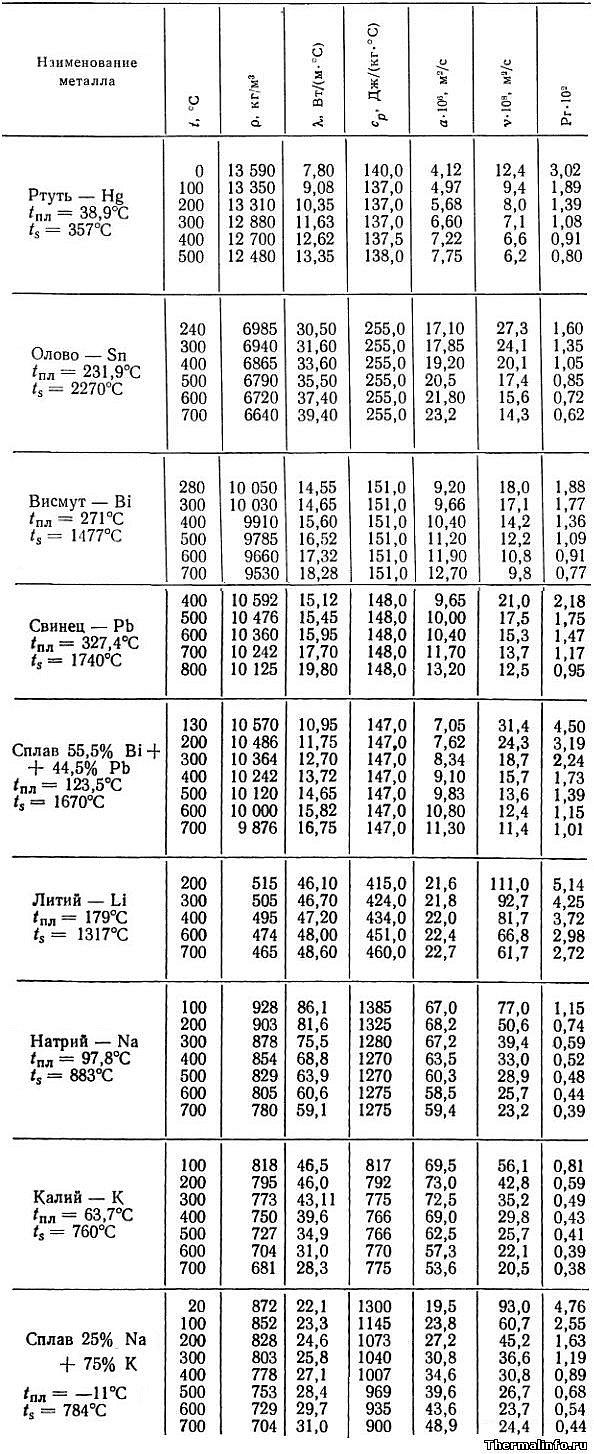
Свойства жидких металлов: плотность, теплопроводность, вязкость

В таблице представлены теплофизические свойства жидких металлов в зависимости от температуры в диапазоне от 0 до 800°С. Даны следующие свойства: плотность металлов, теплопроводность, удельная (массовая) теплоемкость, температуропроводность, кинематическая вязкость, число Прандтля.
Свойства указаны для таких жидких металлов и сплавов, как ртуть Hg, олово Sn, висмут Bi, свинец Pb, сплав висмут-свинец Bi-Pb, литий Li, натрий Na, калий K, сплав натрий-калий Na-K. Для каждого металла и сплава также указана его температура плавления и кипения.
Плотность жидких металлов, представленных в таблице, значительно различается. Металлом с минимальной плотностью является литий (литий — самый легкий металл среди существующих) — его плотность в жидком состоянии при температуре 200°С равна 515 кг/м 3 . Наиболее тяжелый из рассмотренных жидких металлов — это ртуть. Плотность ртути при 0°С равна 13590 кг/м 3 . Следует отметить, что плотность жидких металлов уменьшается при нагревании.
Теплопроводность жидких металлов увеличивается при повышении их температуры (за исключением натрия и калия, теплопроводность которых имеет обратную зависимость). Наиболее теплопроводный жидкий металл — это натрий. Теплопроводность жидкого натрия имеет величину 60…86 Вт/(м·град). В целом, щелочные металлы (литий, натрий и калий) обладают высокой теплопроводностью по сравнению с другими жидкими металлами.
Кинематическая вязкость и число Прандтля жидких металлов уменьшаются при нагревании. Теплоемкость и температуропроводность этих металлов — растет. Однако, удельная теплоемкость таких жидких металлов, как свинец, олово, висмут и сплава свинец-висмут не зависит от температуры и является постоянной величиной.
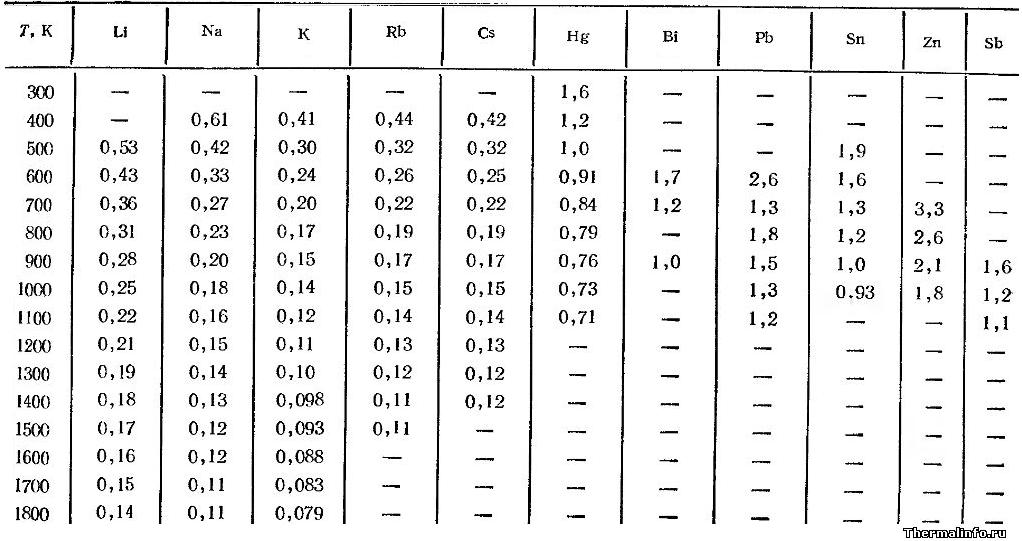
Динамическая вязкость жидких металлов
Представлены значения динамической вязкости жидких металлов в зависимости от температуры в интервале от 300 до 1800 К. Динамическая вязкость жидких металлов дана в размерности Па·с·10 3 . Например, по данным таблицы, вязкость лития при 500 К равна 0,00053 Па·с. Указана вязкость следующих металлов в жидком состоянии: литий, натрий, калий, рубидий, цезий, ртуть, висмут, свинец, олово, цинк, сурьма.
Следует отметить, что из рассмотренных металлов наиболее вязким в жидкой фазе является цинк — его коэффициент динамической вязкости составляет величину 0,0033 Па·с при температуре 700 К. Металлом, обладающим минимальной вязкостью при этой температуре, является щелочной металл калий с вязкостью 0,0002 Па·с.
Источники:
1. Михеев М.А., Михеева И.М. Основы теплопередачи.
2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.:Энергоатомиздат, 1991. — 1232 с.
Читайте также:
