Tin что за металл
Обновлено: 17.04.2024
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
Нитрид титана ( TiN ; иногда известный как тинит ) представляет собой чрезвычайно твердый керамический материал, часто используемый в качестве покрытия на титановых сплавах , стали , карбиде и алюминиевых компонентах для улучшения свойств поверхности подложки.
Нанесенный в виде тонкого покрытия, TiN используется для упрочнения и защиты режущих и скользящих поверхностей, в декоративных целях (благодаря своему золотистому виду) и в качестве нетоксичного внешнего покрытия для медицинских имплантатов . В большинстве случаев применяется покрытие толщиной менее 5 микрометров (0,00020 дюйма) .
СОДЕРЖАНИЕ
Характеристики
TiN , имеет твердость по Виккерсу от 1800-2100, а модуль упругости 251 ГПа, коэффициент теплового расширения 9,35 × 10 - 6 K -1 , и температуру сверхпроводящего перехода 5,6 К.
TiN окисляется при 800 ° C в нормальной атмосфере. TiN имеет коричневый цвет и кажется золотым при нанесении в качестве покрытия. Согласно лабораторным испытаниям, он химически стабилен при 20 ° C, но может медленно разрушаться концентрированными растворами кислоты при повышении температуры. В зависимости от материала подложки и отделки поверхности TiN будет иметь коэффициент трения от 0,4 до 0,9 относительно другой поверхности TiN (без смазки). Типичное образование TiN имеет кристаллическую структуру типа NaCl со стехиометрией примерно 1: 1 ; Однако соединения TiN x с x от 0,6 до 1,2 термодинамически стабильны.
TiN становится сверхпроводящим при криогенных температурах, критическая температура для монокристаллов достигает 6,0 К. Сверхпроводимость в тонкопленочном TiN широко изучена, причем сверхпроводящие свойства сильно варьируются в зависимости от приготовления образца, вплоть до полного подавления сверхпроводимости при переходе сверхпроводник-изолятор . Тонкая пленка TiN была охлаждена почти до абсолютного нуля , превратив ее в первый известный суперизолятор , сопротивление которого внезапно увеличилось в 100000 раз.
Естественное явление
Осборнит - очень редкая природная форма нитрида титана, встречающаяся почти исключительно в метеоритах.
Использует


Хорошо известно, что покрытие TiN используется для удержания кромок и устойчивости к коррозии на станках, таких как сверла и фрезы , часто увеличивая их срок службы в три или более раз.
Из-за металлического золотого цвета TiN его используют для покрытия бижутерии и автомобильной отделки в декоративных целях. TiN также широко используется в качестве верхнего слоя покрытия, обычно с подложками, покрытыми никелем (Ni) или хромом (Cr), на бытовой сантехнике и дверной фурнитуре. В качестве покрытия он используется в аэрокосмической и военной промышленности, а также для защиты скользящих поверхностей вилок подвески велосипедов и мотоциклов, а также амортизаторов радиоуправляемых автомобилей . TiN также используется в качестве защитного покрытия на движущихся частях многих винтовок и полуавтоматического огнестрельного оружия, поскольку он чрезвычайно прочен. Помимо долговечности, он также чрезвычайно гладкий, что значительно упрощает удаление нагара. TiN нетоксичен, соответствует рекомендациям FDA и был замечен в использовании в медицинских устройствах, таких как лезвия скальпелей и лезвия для ортопедических костных пил, где важны острота и удержание кромок. Покрытия из TiN также использовались в имплантированных протезах (особенно имплантатах для замены тазобедренного сустава ) и других медицинских имплантатах.
Хотя они менее заметны, тонкие пленки TiN также используются в микроэлектронике , где они служат проводящим соединением между активным устройством и металлическими контактами, используемыми для работы схемы, одновременно действуя как диффузионный барьер, блокирующий диффузию металла в кремний. В этом контексте TiN классифицируется как «барьерный металл» (удельное электрическое сопротивление ~ 25 мкОм · см), хотя с точки зрения химии или механических свойств это явно керамика . В последних разработках микросхем по технологии 45 нм и выше также используется TiN в качестве «металла» для улучшения характеристик транзисторов . В сочетании с диэлектриками затвора (например, HfSiO), которые имеют более высокую диэлектрическую проницаемость по сравнению со стандартным SiO 2, длину затвора можно уменьшить за счет низкой утечки , более высокого тока возбуждения и того же или лучшего порогового напряжения . Кроме того, в настоящее время рассматриваются тонкие пленки TiN для покрытия циркониевых сплавов для аварийного ядерного топлива .
Благодаря своей высокой биостойкости слои TiN также могут использоваться в качестве электродов в биоэлектронных приложениях, таких как интеллектуальные имплантаты или биосенсоры in vivo, которые должны выдерживать сильную коррозию, вызываемую жидкостями организма . Электроды из TiN уже применялись в проекте субретинального протезирования, а также в биомедицинских микроэлектромеханических системах ( BioMEMS ).
Изготовление
Наиболее распространенными методами создания тонкой пленки TiN являются физическое осаждение из паровой фазы (PVD, обычно напыление , катодно-дуговое напыление или электронно-лучевой нагрев ) и химическое осаждение из паровой фазы (CVD). В обоих методах чистый титан возгоняется и реагирует с азотом в высокоэнергетической вакуумной среде. Пленка TiN также может быть получена на заготовках из Ti путем реактивного роста (например, отжига ) в атмосфере азота . PVD является предпочтительным для стальных деталей, поскольку температуры осаждения превышают температуру аустенизации стали. Слои TiN также напыляются на различные материалы с более высокой температурой плавления, такие как нержавеющая сталь , титан и титановые сплавы . Его высокий модуль Юнга (значения от 450 до 590 ГПа описаны в литературе) означает, что толстые покрытия имеют тенденцию отслаиваться, что делает их гораздо менее прочными, чем тонкие. Покрытия из нитрида титана также можно наносить термическим напылением, тогда как порошки TiN получают путем азотирования титана азотом или аммиаком при 1200 ° C.
Объемные керамические объекты могут быть изготовлены путем упаковки порошкообразного металлического титана в желаемую форму, сжатия его до нужной плотности, а затем зажигания в атмосфере чистого азота. Тепла, выделяемого при химической реакции между металлом и газом, достаточно для спекания продукта реакции нитрида в твердый готовый предмет. См. Порошковую металлургию .
Другие коммерческие варианты

Существует несколько коммерчески используемых вариантов TiN, которые были разработаны с 2010 года, такие как нитрид титана-углерода (TiCN), нитрид титана-алюминия (TiAlN или AlTiN) и нитрид титана-алюминия-углерода, которые можно использовать индивидуально или в чередующихся слоях с TiN. . Эти покрытия предлагают аналогичные или превосходные улучшения коррозионной стойкости и твердости, а также дополнительные цвета от светло-серого до почти черного, до темного, переливающегося , синевато-пурпурного, в зависимости от точного процесса нанесения. Эти покрытия становятся обычным явлением для спортивных товаров, особенно ножей и пистолетов , где они используются как по эстетическим, так и по функциональным причинам.
Как компонент стали
Нитрид титана также производится намеренно в некоторых сталях путем разумного добавления титана в сплав . TiN образуется при очень высоких температурах из-за очень низкой энтальпии образования и даже зарождается непосредственно из расплава при вторичном производстве стали. Он образует дискретные кубические частицы микрометрового размера на границах зерен и тройных точках и предотвращает рост зерен за счет созревания Оствальда до очень высоких гомологичных температур . Нитрид титана имеет наименьшее произведение растворимости по сравнению с любым нитридом или карбидом металла в аустените, что является полезным атрибутом в формулах микролегированных сталей .
Олово

Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.Элемент состоит из 10 изотопов с массовыми числами 112, 114-120, 122, 124; последний слабо радиоактивен; изотоп 120 Sn наиболее распространен (около 33%).
СТРУКТУРА
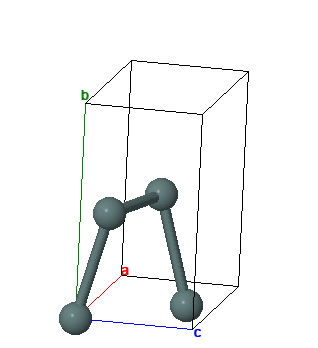
Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок (“оловянная чума”), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес.
СВОЙСТВА

Плотность b-Sn 7,29 г/см 3 , плотность a-Sn 5.85 г/см 3 ,. Температура плавления 231,9°C, температура кипения 2270°C.
Температурный коэффициент линейного расширения 23·10 -6 (0-100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), то есть 0,0536 кал/(г·°С); теплопроводность (0°С) 65,8 вт/(м·К.), то есть 0,157 кал/(см·сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10 -6 ом·м, то есть 11,5·10 -6 ом·см. Серое олово является диамагнетиком, а белое – парамагнетиком.
Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2 ); относительное удлинение 80-90%; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2 ). При изгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется.
ЗАПАСЫ И ДОБЫЧА

Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
ПРОИСХОЖДЕНИЕ

Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма: конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
ПРИМЕНЕНИЕ

Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Важнейший сплав олова — бронза (с медью). Другой известный сплав — пьютер — используется для изготовления посуды. Для этих целей расходуется около 33 % всего добываемого олова. До 60 % производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. В последнее время возрождается интерес к использованию металла, поскольку он наиболее «экологичен» среди тяжёлых цветных металлов. Используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn.
Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Титан

Титан – лёгкий прочный металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C.Титан и титановые сплавы сочетают легкость, прочность, высокую коррозийную стойкость, низкий коэффициент теплового расширения, возможность работы в широком диапазоне температур.
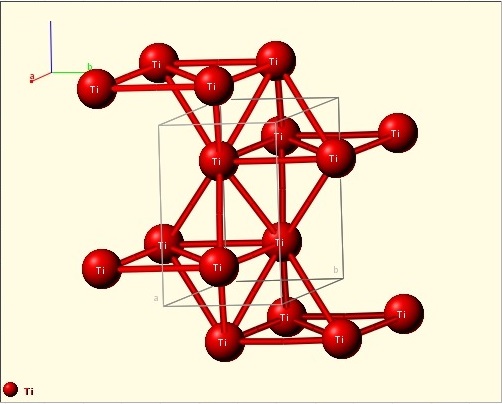
Кристаллическая структура кристалла
Титан имеет две аллотропические модификации. Низкотемпературная модификация, существующая до 882 °C, имеет гексагональную плотноупакованную решетку с периодами а = 0,296 нм и с = 0,472 нм. Высокотемпературная модификация имеет решетку объемноцентрированного куба с периодом а = 0,332 нм.
Полиморфное превращение (882 °C) при медленном охлаждении происходит по нормальному механизму с образованием равноосных зерен, а при быстром охлаждении – по мартенситному механизму с образованием игольчатой структуры.
Титан обладает высокой коррозионной и химической стойкостью благодаря защитной окисной пленке на его поверхности. Он не корродирует в пресной и морской воде, минеральных кислотах, царской водке и др.

Точка плавления 1671 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Применяемый в промышленности технический титан содержит примеси кислорода, азота, железа, кремния и углерода, повышающие его прочность, снижающие пластичность и влияющие на температуру полиморфного превращения, которое происходит в интервале 865-920 °С. Для технического Титана марок ВТ1-00 и ВТ1-0 плотность около 4,32 г/см 3 , предел прочности 300-550 Мн/м 2 (30-55кгс/мм 2 ), относительное удлинение не ниже 25%, твердость по Бринеллю 1150-1650 Мн/м 2 (115-165 кгс/мм 2 ). Является парамагнетиком. Конфигурация внешней электронной оболочки атома Ti 3d24s2.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной). Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C.

Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана их при 850 °C восстанавливают магнием.
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков.

Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках.
Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Месторождения титана находятся на территории ЮАР, России, Украины, Китая, Японии, Австралии, Индии, Цейлона, Бразилии, Южной Кореи, Казахстана. В странах СНГ ведущее место по разведанным запасам титановых руд занимает РФ (58.5%) и Украина (40.2%).

Изделия из титана
Титановые сплавы играют большую роль в авиационной технике, где стремятся получить наиболее легкую конструкцию в сочетании с необходимой прочностью. Титан легок по сравнению с другими металлами, но в то же время может работать при высоких температурах. Из титановых сплавов изготовляют обшивку, детали крепления, силовой набор, детали шасси, различные агрегаты. Также данные материалы применяются в конструкциях авиационных реактивных двигателей. Это позволяет уменьшить их массу на 10-25%. Из титановых сплавов производят диски и лопатки компрессора, детали воздухозаборника и направляющего аппарата, крепеж.
Также титан и его сплавы используют в ракетостроении. Ввиду кратковременной работы двигателей и быстрого прохождения плотных слоев атмосферы в ракетостроении в значительной мере снимаются проблемы усталостной прочности, статической выносливости и отчасти ползучести.
Технический титан из-за недостаточно высокой теплопрочности не пригоден для применения в авиации, но благодаря исключительно высокому сопротивлению коррозии в ряде случаев незаменим в химической промышленности и судостроении. Так его применяют при изготовлении компрессоров и насосов для перекачки таких агрессивных сред, как серная и соляная кислота и их соли, трубопроводов, запорной арматуры, автоклав, различного рода емкостей, фильтров и т.п. Только титан обладает коррозионной стойкостью в таких средах, как влажный хлор, водные и кислые растворы хлора, поэтому из данного металла изготовляют оборудование для хлорной промышленности. Из титана делают теплообменники, работающие в коррозионно активных средах, например в азотной кислоте (не дымящей). В судостроении титан используется для изготовления гребных винтов, обшивки морских судов, подводных лодок, торпед и т.д. На титан и его сплавы не налипают ракушки, которые резко повышают сопротивление судна при его движении.
Титановые сплавы перспективны для использования во многих других применениях, но их распространение в технике сдерживается высокой стоимостью и дефицитностью титана.
Температура плавления, ° С 231,9 Температура кипения, ° С 2625 Плотность, г/см3 7,29 Твердость (по Бринеллю) 3,9 Содержание в земной коре, % (масс.) 0,0004 Степени окисления +2, +4
Физические свойства. Олово - мягкий серебристо-белый пластичный металл (может быть прокатан в очень тонкую фольгу - станиоль) с невысокой температурой плавления (легко выплавляется из руд), но высокой температурой кипения. Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок ("оловянная чума"), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес. См. также
АЛЛОТРОПИЯ;
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ;
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ. Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов. Оловосодержащие сплавы обладают прекрасными антифрикционными свойствами в присутствии смазки, поэтому широко используются как материал подшипников.
Химические свойства. При комнатной температуре олово химически инертно к кислороду и воде. На воздухе олово постепенно покрывается защитной оксидной пленкой, которая повышает его коррозионную стойкость. С химической инертностью олова и его оксидной пленки в обычных условиях связано использование его в покрытии жестяной тары для продуктов питания, прежде всего - консервных банок. Олово легко наносится на сталь и продукты его коррозии безвредны. В соединениях олово проявляет две степени окисления: +2 и +4, причем соединения олова(II) в большинстве своем относительно нестабильны в разбавленных водных растворах и окисляются до соединений олова(IV) (их используют иногда как восстановители, например SnCl2). Разбавленные соляная и серная кислоты действуют на олово очень медленно, а концентрированные, особенно при нагревании, растворяют его, причем в соляной кислоте получается хлорид олова(II), а в серной - сульфат олова(IV). С азотной кислотой олово реагирует тем интенсивнее, чем выше концентрация и температура: в разбавленной HNO3 образуется растворимый нитрат олова(II), а в концентрированной HNO3 - нерастворимая b-оловянная кислота H2SnO3. Концентрированные щелочи растворяют олово с образованием станнитов - солей оловянистой кислоты H2SnO2; в растворах станниты существуют в гидроксоформе, например Na2[[Sn(OH)4]]. Наибольшее промышленное значение соединения олова(II) имеют в производстве гальванических покрытий. Соединения олова(IV) находят обширное промышленное применение. Оксиды олова амфотерны, проявляют и кислотные, и основные свойства. Оксид олова(IV) встречается в природе в виде минерала касситерита, а чистый SnO2 получают из чистого металла; диоксид олова SnO2 применяется для приготовления белых глазурей и эмалей. Из SnO2 при взаимодействии со щелочами получают станнаты - соли оловянной кислоты, наиболее важные из которых - станнаты калия и натрия; растворы станнатов находят широкое применение как электролиты для осаждения олова и его сплавов. SnCl4 - тетрахлорид олова, исходное соединение для многих синтезов других соединений олова, включая и оловоорганические.
Применение. В современном мире более трети добываемого олова расходуется на изготовление пищевой жести и емкостей для напитков. Жесть в основном состоит из стали, но имеет покрытие из олова обычно толщиной менее 0,4 мкм.
Сплавы. Одна треть олова идет на изготовление припоев. Припои - это сплавы олова в основном со свинцом в разных пропорциях в зависимости от назначения. Сплав, содержащий 62% Sn и 38% Pb, называется эвтектическим и имеет самую низкую температуру плавления среди сплавов системы Sn - Pb. Он входит в составы, используемые в электронике и электротехнике. Другие свинцово-оловянные сплавы, например 30% Sn + 70% Pb, имеющие широкую область затвердевания, используются для пайки трубопроводов и как присадочный материал. Применяются и оловянные припои без свинца. Сплавы олова с сурьмой и медью используются как антифрикционные сплавы (баббиты, бронзы) в технологии подшипников для различных механизмов. Современные оловянно-свинцовые сплавы содержат 90-97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.
Покрытия из олова и его сплавов. Олово легко образует сплавы со многими металлами. Оловянные покрытия имеют хорошее сцепление с основой, обеспечивают хорошую коррозионную защиту и красивый внешний вид. Оловянные и оловянно-свинцовые покрытия можно наносить, погружая специально приготовленный предмет в ванну с расплавом, однако большинство оловянных покрытий и сплавов олова со свинцом, медью, никелем, цинком и кобальтом осаждают электролитически из водных растворов. Наличие большого диапазона составов для покрытий из олова и его сплавов позволяет решать многообразные задачи промышленного и декоративного характера.
Соединения. Олово образует различные химические соединения, многие из которых находят важное промышленное применение. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические
(см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ).
Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида - вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сельскохозяйственные химикаты, для изготовления красок и консервации древесины.
ЛИТЕРАТУРА
Спиваковский В.Б. Аналитическая химия олова. М., 1975 Большаков К.А., Федоров П.И. Химия и технология малых металлов. М., 1984

Олово — химический элемент с символом Sn (от латинского: stannum) и атомным номером 50. Это постпереходный металл в группе 14 периодической таблицы элементов. Олово получают, главным образом, из минеральной оловянной руды, содержащей двуокись олова SnO2. Олово имеет химическое сходство с двумя своими соседями в группе 14, германием и свинцом, и имеет два основных окислительных состояния, +2 и немного более стабильное +4. Олово является 49-м среди наиболее распространенных элементов и имеет наибольшее количество стабильных изотопов в периодической таблице (с 10 стабильными изотопами), благодаря своему «магическому» количеству протонов. Олово имеет два основных аллотропа: при комнатной температуре, устойчивым аллотропом является β-олово, серебристо-белый, ковкий металл, но при низких температурах олово превращается в менее плотное серое α-олово, имеющее алмазную кубическую структуру. Металлическое олово не легко окисляется в воздухе. Первым сплавом, использовавшимся в больших масштабах, была бронза, изготовленная из олова и меди, начиная с 3000 года до н. э. После 600 г. до н. э. производилось чистое металлическое олово. Сплав олова со свинцом, в котором олово составляет 85-90%, обычно состоящий из меди, сурьмы и свинца, использовался для изготовления посуды с бронзового века до 20 века. В наше время, олово используется во многих сплавах, наиболее часто в мягких сплавах олово/свинец, которые, как правило, содержат 60% или более олова. Другое распространенное применение для олова — коррозионностойкое покрытие стали. Неорганические соединения олова, скорее, не токсичны. Из-за своей низкой токсичности, лужёный металл использовался для упаковки еды при помощи жестяных банок, которые, фактически, изготавливаются, главным образом, из стали или алюминия. Однако, чрезмерное воздействие олова может вызвать проблемы с метаболизмом необходимых микроэлементов, таких как медь и цинк, и некоторые оловоорганические соединения могут быть почти такими же токсичными, как цианид.
Физические
Олово — мягкий, ковкий, пластичный и высококристаллический серебристо-белый металл. Когда загибается пластина олова,можно услышать трескучий звук, известный как «оловянный треск», от двойникования кристаллов. Олово плавится при низкой температуре, около 232 °C, самой низкой в группе 14. Точка плавления далее снижается до 177,3 ° C для частиц 11 нм. 1) β-олово (металлическая форма, или белое олово, структура BCT), которое стабилизировано при комнатной температуре и выше, ковкое. Напротив, α-олово (неметаллическая форма, или серое олово), которое стабилизировано при температуре до 13.2 °C, хрупкое. α-олово имеет кубическую кристаллическую структуру, подобную алмазу, кремнию или германию. α-олово вообще не имеет металлических свойств, потому что его атомы образуют ковалентную структуру, в которой электроны не могут свободно передвигаться. Это тускло-серый порошкообразный материал, не имеющий какого-либо широкого применения, помимо нескольких специализированных полупроводниковых применений. Эти два аллотропа, α-олово и β-олово, более известны как серое олово и белое олово, соответственно. Еще два аллотропа, γ и σ, существуют при температурах выше 161 °C и давлениях выше нескольких гигапаскалей. В холодных условиях, β-олово спонтанно трансформируется в α-олово. Это явление известно как «оловянная чума». Хотя температура трансформирования α-β номинально 13.2 °С и примесей (напр. Al, Zn и др.) ниже температуры перехода ниже 0 °C и, при добавлении Sb или Bi, преобразование может вообще не происходить, увеличивая долговечность олова. 2) Коммерческие сорта олова (99,8%) сопротивляются трансформации из-за ингибирующего эффекта небольшого количества висмута, сурьмы, свинца и серебра, присутствующих в качестве примесей. Легирующие элементы, такие как медь, сурьма, висмут, кадмий, серебро, увеличивают твердость вещества. Олово довольно легко образует твердые, хрупкие межметаллические фазы, которые часто нежелательны. Олово не образует множества твердых растворов в других металлах в целом, и несколько элементов имеют заметную твердую растворимость в олове. Простые эвтектические системы, однако, наблюдаются с висмутом, галлием, свинцом, таллием и цинком. Олово становится сверхпроводником ниже 3,72 К и является одним из первых сверхпроводников, которые были изучены; эффект Мейснера, одна из характерных особенностей сверхпроводников, был впервые обнаружен в сверхпроводящих кристаллах олова. 3)
Химические свойства
Олово сопротивляется коррозии из воды, но может быть атаковано кислотами и щелочами. Олово может быть хорошо отполировано и используется в качестве защитного покрытия для других металлов. Защитный оксидный (пассивный) слой предотвращает дальнейшее окисление, такой же, который образуется на сплаве олова со свинцом и других оловянных сплавах. 4) Олово действует как катализатор, когда кислород находится в растворе и помогает ускорить химическую коррозию.
Изотопы
Олово имеет десять стабильных изотопов с атомными массами 112, 114 по 120, 122 и 124, наибольшее количество среди всех элементов. Наиболее распространенными из них являются 120Sn (почти треть всего олова), 118Sn и 116Sn, в то время как наименее распространенными являются 115Sn. Изотопы с четными массовыми числами не имеют ядерного спина, в то время как изотопы с нечетными числами имеют спин +1/2. Олово, с тремя распространенными изотопами 116Sn, 118Sn и 120Sn, является одним из самых простых элементов для обнаружения и анализа с помощью ЯМР-спектроскопии. Это большое количество стабильных изотопов считается прямым результатом атомного числа 50, «магического числа» в ядерной физике. Олово также встречается в 29 нестабильных изотопах, охватывающих все остальные атомные массы от 99 до 137. Кроме 126Sn, с полураспадом 230000 лет, все радиоизотопы имеют период полураспада менее года. Радиоактивные 100Sn, обнаруженные в 1994 году, и 132Sn, являются одними из немногих нуклидов с «двойным магическим» ядром: несмотря на нестабильность, обладающие очень неравномерным соотношением протон-нейтрон, они представляют конечные точки, за которыми стабильность быстро падает. Еще 30 метастабильных изомеров были характерны для изотопов между 111 и 131, наиболее устойчивыми являются 121мСн с периодом полураспада 43,9 года. 5) Относительные различия в обилии устойчивых изотопов олова можно объяснить их различными режимами образования в звёздном нуклеосинтезе. 116Sn через 120Sn включительно формируются в s-процессе (медленные нейтроны) в большинстве звезд и, следовательно, они являются наиболее распространенными изотопами, в то время как 122Sn и 124Sn не только образуются в R-процессе (быстрые нейтроны) в сверхновых и реже. (Изотопы 117Sn через 120Sn также получают пользу от r-процесса.) Наконец, самые редкие протонно-избыточные изотопы, 112Sn, 114Sn, и 115Sn, не могут быть произведены в значительных количествах в s - и r-процессах и считаются одними из p-ядра, происхождение которых не до конца изучено. Некоторые предполагаемые механизмы их формирования включают захват протонов, а также фоторасщепление, хотя 115Sn также может частично вырабатываться в s-процессе, оба сразу, и как «дочь» долгоживущих 115In.
Этимология
Английское слово tin (олово) является общим для германских языков и может быть прослежено в реконструированном прото-германском *tin-om; однокоренные слова включает немецкий Zinn, шведский tenn и голландский tin. Слово не встречается в других ветвях индоевропейских языков, за исключением заимствования у германского (например, ирландское слово tinne произошло от английского tin). 6) Латинское название stannum изначально означало сплав серебра и свинца, а в IV веке до н. э. оно стало означать «олово» — более раннее латинское слово для него было plumbum quandum, или «белый свинец». Слово stannum, видимо, произошло от более раннего stāgnum (то же вещество), происхождение романского и кельтского обозначения для олова. Происхождение stannum/stāgnum неизвестно; оно может быть пре-индо-европейским. 7) Согласно Энциклопедическому словарю Мейера, наоборот, считается, что stannum является производным от корнского stean и является доказательством того, что Корнуолл в первые века нашей эры был основным источником олова.
История

Экстракция и использование олова началась в бронзовом веке, около 3000 г. до н. э., когда было отмечено, что медные предметы, образованные из полиметаллических руд с различным содержанием металлов обладают различными физическими свойствами. Самые ранние бронзовые предметы содержали менее 2% олова или мышьяка и поэтому считаются результатом непреднамеренного легирования за счет трассировки содержания металла в медной руде. Добавление второго металла к меди повышает ее прочность, снижает температуру плавления и улучшает процесс литья путем создания более жидкого расплава, который при охлаждении более плотный и менее губчатый. Это позволило создавать гораздо более сложные формы закрытых предметов из бронзы. Бронзовые предметы с мышьяком появились, в первую очередь, на Ближнем Востоке, где мышьяк часто встречается в связи с медной рудой, однако, вскоре стали понятны риски для здоровья, связанные с использованием таких предметов, а поиски источников гораздо менее опасных оловянных руд начались в начале бронзового века. 8) Это создало спрос на редкое металлическое олово и сформировало торговую сеть, связывающую отдаленные источники олова с рынками культур бронзового века. Касситерит, или оловянная руда (SnO2), оксид олова, скорее всего, был исходным источником олова в древности. Другие формы оловянных руд являются менее распространенными сульфидами, такими как станнит, которые требуют более активного процесса выплавки. Касситерит часто накапливается в аллювиальных каналах в виде россыпных отложений, поскольку он тяжелее, жестче и химически устойчивее, чем гранит. Касситерит обычно черный или вообще темный по цвету, и его залежи легко видны в берегах рек. Аллювиальные (россыпные) месторождения могут быть легко собраны и разделены методами, похожими на отмывку золота.
Соединения и химия
В подавляющем большинстве, олово имеет степень окисления II или в IV.
Неорганические соединения
Галоидные соединения известны для обоих окислительных состояний. Для SN(IV), все четыре галогенида хорошо известны: SnF4, SnCl4, SnBr4, и SnI4. Три наиболее тяжелых элемента являются летучими молекулярными соединениями, в то время как тетрафторид является полимерным. Также известны все четыре галогенида для Sn(II): SnF2, SnCl2, SnBr2 и SnI2. Все это полимерные твердые вещества. Из этих восьми соединений, окрашены только йодиды. 9) Хлорид олова(II) (также известный как двуххлористое олово) является наиболее важным галоидом олова в коммерческом смысле. Хлор реагирует с металлическим оловом, создавая SnCl4 в то время как реакция соляной кислоты и олова производит SnCl2 и наводороженный газ. Кроме того, SnCl4 и Sn сочетаются с хлоридом олова посредством процесса, называемого со-пропорционирование: SnCl4 + СН → 2 Sncl2 Олово может образовывать много оксидов, сульфидов и других халькогенидных производных. Диоксид SnO2 (касситерит) образуется при нагревании олова в присутствии воздуха. SnO2 имеет амфотерный характер, что означает, что он растворяется в кислых и основных растворах. Станнаты со структурой Sn(OH)6]2, как К2[Sn(OH)6], также известны, хотя свободная оловянная кислота Н2[СН(он)6] неизвестна. Сульфиды олова существуют как в +2, так и в +4 окислительных состояниях: сульфид олова(II) и сульфид олова(IV) (мозаичное золото).
Гидриды
Станнан (SnH4), с оловом в окислительном состоянии +4, нестабилен. Оловоорганические гидриды, однако, хорошо известны, например, трибутилин гидрид (Sn(C4H9)3H). Эти соединения выпускают переходные трибутилоловые радикалы олова, которые являются редкими примерами соединений олова(III). 10)
Оловоорганические соединения
Оловоорганические соединения, иногда называемые станнанами, представляют собой химические соединения с олово–углеродными связями.Из соединений олова, органические производные являются наиболее полезными в коммерческом смысле. Некоторые оловоорганические соединения очень токсичны и используются в качестве биоцидов. Первым известным органотиновым соединением был диэтилтиндиодид (C2H5)2SnI2), который обнаружил Эдвард Франкленд в 1849 году. 11) Большинство оловосодержащих органических соединений — бесцветные жидкости или твердые вещества, устойчивые к воздействию воздуха и воды. Они принимают тетраэдрическую геометрию. Тетраалкил и тетраарилтиновые соединения могут быть изготовлены с использованием реагентов Григнарда:
Смешанные галогенид-алкилы, которые являются более распространенными и имеют большую коммерческую ценность, чем тетраоргановые производные, изготовляются путем перераспределения реакций:
Двухвалентные оловоорганические соединения являются редкостью, хотя более распространены, чем двухвалентные органогерманиумные и кремнийорганические соединения. Большая стабилизация, которую имеет Sn(II), объясняется «эффектом инертной пары». Оловосодержащие органические(II) в соединения включают как станнилены (формула: R2Sn, как видно для синглетных карбенов), так и дистаннилены (R4Sn2), которые примерно эквивалентны алкенам. Оба класса проявляют необычные реакции. 12)
Возникновение
Олово образуется в длительном s-процессе в низко-и средне-массовых звездах (с массами от 0,6 до 10 раз больше, чем масса Солнца) и, наконец, при бета-распаде тяжелых изотопов индия. Олово является самым распространенным 49-м элементом в земной коре, составляя 2 промилле по сравнению с 75 мг цинка, 50 мг / л для меди и 14 промилле на свинец. 13) Олово не встречается как самородный элемент, но должно быть извлечено из различных руд. Касситерит (SnO2) является единственным коммерчески важным источником олова, хотя небольшие количества олова извлекаются из сложных сульфидов, таких как станнит, ципиндрит, франкеит, канфилдит и тилит. Минералы с оловом почти всегда ассоциируются с гранитной породой, обычно на уровне 1% содержания оксида олова. Из-за высокого удельного веса диоксида олова, около 80% добытого олова происходит из вторичных отложений, обнаруженных из первичных залежей. Олово часто извлекается из гранул, промытых ниже по течению в прошлом и осаждаемых в долинах или море. Наиболее экономичными способами добычи олова являются вычерпывание, гидравлика или открытые карьеры. Большая часть мирового олова производится из россыпных отложений, которые могут содержать всего лишь 0,015% олова. Мировые запасы оловянных рудников (тонны, 2011) 14)
Читайте также:

