Тип связи существующий в кристаллах металлов
Обновлено: 16.05.2024
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
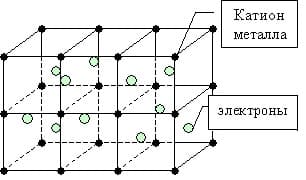
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
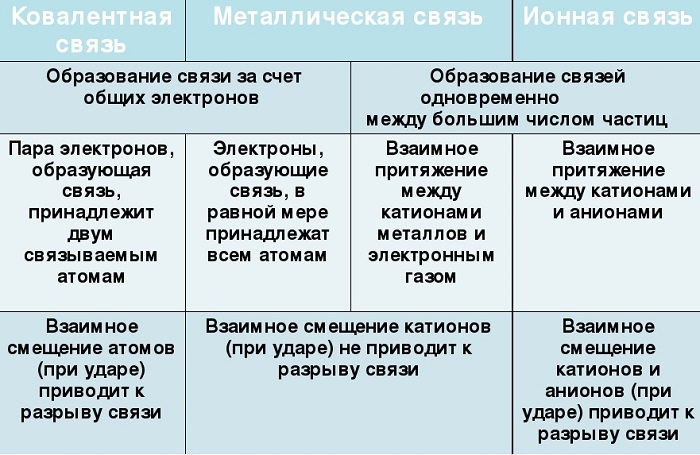
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
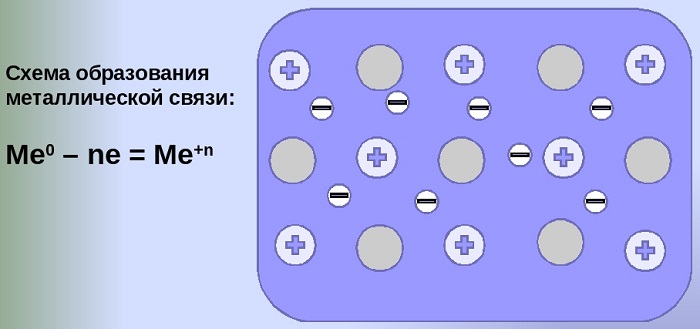
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
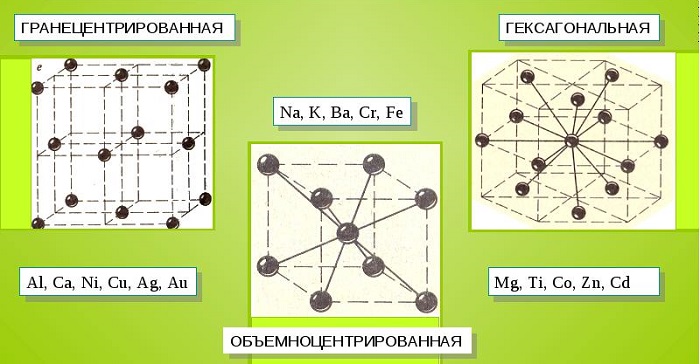
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Типы связей в кристаллах
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 15 мая 2011.
Типы химических связей в кристаллах. В зависимости от природы частиц и от характера сил взаимодействия различают четыре вида химической связи в кристаллах: ковалентную, ионную, металлическую и молекулярную.
Содержание
Ковалентная связь
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов могут служить алмаз, германий и кремний.
Ионная связь
В узлах кристаллической решётки помещаются положительно и отрицательно заряженные ионы.
Силы взаимодействия между узлами являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной.
Кристаллы с ионной связью при низких температурах являются диэлектриками. При температурах близких к температуре плавления они становятся проводниками электричества. Примером кристаллов с ионной решёткой являются кристаллы каменной соли (NaCl).
Металлическая связь
Особый тип связи, характерный для металлов и металлидов. Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность.
Большинство металлов имеет кристаллические решётки одного из трёх типов: кубическую объёмно-центрированную, кубическую гранецентрированную и, так называемую, плотную гексагональную.
Молекулярная связь
В узлах кристаллической решётки помещаются определённым образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. По этой причине их называют ван-дер-ваальсовскими силами.
Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.
Водородная связь
Особая разновидность молекулярной связи — водородная связь. При определённых условиях атом водорода может быть связан довольно прочно с двумя другими атомами. Имея лишь одну стабильную орбиталь, атом водорода способен образовывать только одну ковалентную связь. Эта связь может, однако, резонировать между двумя положениями. Наибольшее значение имеют те водородные связи, которые образуются между двумя сильно электроотрицательными атомами, в особенности между атомами азота, кислорода и фтора.
Водородные связи, образуемые молекулами воды, обусловливают удивительно высокие точки плавления льда и кипения воды, существование максимума плотности воды, расширение воды при замерзании. Многие особые свойства неорганических и органических молекул, например димеризация жирных кислот, объясняются образованием водородных связей. Водородная связь — особенно важная структура белков особенность белков и нуклеиновых кислот.
Молекулярные связи образуют, например, следующие вещества: H2, N2, O2, CO2, H2O.
Типы химической связи — это удобное упрощение. Более точно поведение электрона в кристалле описывается законами квантовой механики. Говоря о типе связи в кристалле, необходимо иметь в виду следующее:
- связь между двумя атомами никогда полностью не соответствует одному из описанных типов. В ионной связи всегда присутствует элемент ковалентной связи и т. п.
- в сложных веществах связь между разными атомами может быть разного типа. Так например, в кристалле белка связь в молекуле белка ковалентная, а между молекулами (или разными частями одной молекулы) водородная.
- Химическая связь
- Физика твёрдого тела
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Типы связей в кристаллах" в других словарях:
СТРУКТУРНЫЕ ТИПЫ КРИСТАЛЛОВ — СТРУКТУРНЫЕ ТИПЫ КРИСТАЛЛОВ, неорганических соединений, закономерное пространственное расположение атомов, ионов (иногда молекул), составляющих кристаллические вещества. Расшифровка структуры кристаллов одна из основных задач кристаллографии.… … Энциклопедический словарь
Дислокации (в кристаллах) — Дислокации в кристаллах, дефекты кристалла, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Д. и другие дефекты в кристаллах определяют многие физические свойства… … Большая советская энциклопедия
Изоморфизм в кристаллах — Понятие изоморфизм впервые введено в науку Э. Митчерлихом в 1819 г. Первоначально оно означало внешнее сходство кристаллической формы у веществ, родственных по химическому составу. Современное определение понятия изоморфизма может быть выражено… … Википедия
Физика твёрдого тела — Физика твёрдого тела раздел физики конденсированного состояния, задачей которого является описание физических свойств твёрдых тел с точки зрения их атомарного строения. Интенсивно развивалась в XX веке после открытия квантовой механики.… … Википедия
Механика твердых тел — Физика кристаллов Кристалл кристаллография Кристаллическая решётка Типы кристаллических решёток Дифракция в кристаллах Обратная решётка Ячейка Вигнера Зейтца Зона Бриллюэна Структурный фактор базиса Атомный фактор рассеяния Типы связей в… … Википедия
Физика твердого тела — Физика кристаллов Кристалл кристаллография Кристаллическая решётка Типы кристаллических решёток Дифракция в кристаллах Обратная решётка Ячейка Вигнера Зейтца Зона Бриллюэна Структурный фактор базиса Атомный фактор рассеяния Типы связей в… … Википедия
Молекулярный кристалл — Основная статья: Типы связей в кристаллах Молекулярный кристалл кристалл, образованный из молекул. Молекулы связаны между собой слабыми ван дер ваальсовыми силами, внутри же молекул между атомами действует более прочная ковалентная связь. Примеры … Википедия
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
КРИСТАЛЛОХИМИЯ — раздел кристаллографии, в к ром изучаются закономерности расположения атомов в кристаллах и природа хим. связи между ними. К. основана на обобщении результатов экспериментальных рентгенографич. и др. дифракц. методов исследований ат. структуры… … Физическая энциклопедия
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
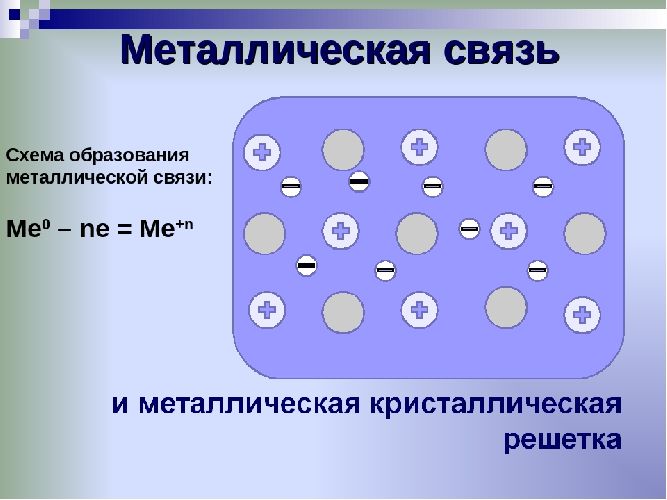
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
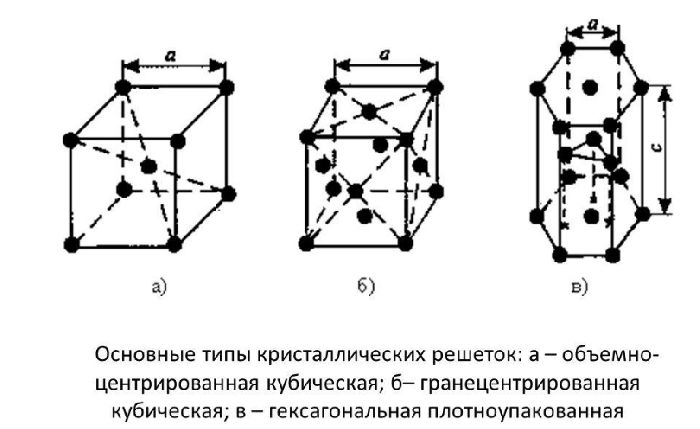
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Металлическая химическая связь

Металлическая связь образуется между атомами в кристалле металла, возникающая за счет перекрытия валентных электронов. Так, что же представляет собой этот вид связи, и в каких соединениях она присутствует?
Что такое металлическая связь?
Металлическая химическая связь существует в металлическом кристалле и в жидком расплавленном состоянии. Ее образуют элементы, атомы которых на внешнем уровне имеют мало электронов (1-3) по сравнению с общим числом внешних, энергетически близких орбиталей.

Рис. 1. Схема образования металлической связи.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Так, у атома натрия на один валентный электрон (3S1) приходится 9 свободных и энергетически близких орбиталей (одна 3s, три 3p и пять 3d).
Из-за малого значения энергии ионизации валентный электрон слабо удерживается и свободно перемещается не только в пределах 9 своих свободных орбиталей, но при плотной упаковке в кристалле и на свободных орбиталях других атомов, осуществляя связь.
Химическая связь сильно делокализована: электроны обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального, между положительно заряженными ионами.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро- и теплопроводность.
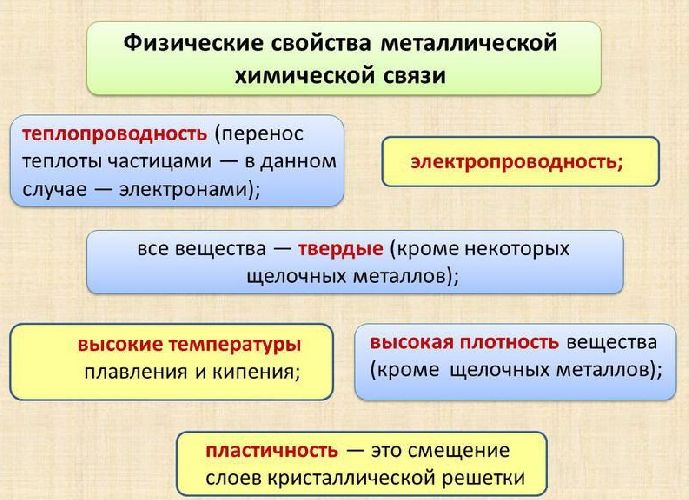
Рис. 2. Свойства металлической химической связи.
Металлы почти всегда образуют высокосимметричные решетки с плотно приближенными друг к другу атомами. Выделяют три вида кристаллических решеток:
- кубическая объемно центрированная. В таком виде решетки атомы располагаются на вершине куба и один атом в центре объема куба. Такую решетку имеют следующие металлы: натрий, литий, барий, калий, свинец и многие другие.
- кубическая гранецентрированная.
- гексагональная. В таком виде решетки атомы располагаются в вершине и центрах шестигранной оснований призмы, а три атома находятся в средней плоскости этой призмы.
Такой тип кристаллической решетки имеют следующие металлы: магний, кадмий, рений, осмий, рутений, бериллий и многие другие.
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами. В данной статье дается определение понятию «металлическая связь», а также приведены примеры металлической химической связи.
Читайте также:
