Типы фаз в металлических сплавах
Обновлено: 16.05.2024
Чистые металлы обычно имеют низкую прочность и невысокие технологические свойства. В технике применяют сплавы. Сплавами называют сложные материалы, полученные сплавлением нескольких компонентов. Компонентами сплавов могут быть металлы, неметаллы и химические соединения. В зависимости от числа компонентов сплавы могут быть двойные, тройные и т. д. При физико-химическом взаимодействии компоненты образуют фазы, число и тип которых характеризуют состояние сплава.
Фаза – однородная часть сплава, характеризующаяся определенным составом, типом кристаллической решетки и отделенная от других частей поверхностью раздела. В зависимости от количества фаз сплавы могут одно- двух- и многофазными. В жидком состоянии компоненты сплава обычно не ограничено растворяются друг в друге, образуя жидкие растворы. В твердом состоянии компоненты могут образовывать: твердые растворы, механические смеси, химические соединения.
Механические смеси. Если элементы, входящие в состав сплава, при затвердевании из жидкого состояния не растворяются друг в друге и не взаимодействуют, то образуется механическая смесь ( олово – свинец, алюминий – медь). В механических смесях существуют два типа кристаллических решеток.
Химические соединения по структуре представляют однородные твердые тела, свойства их отличаются от свойств элементов их образующих, имеют постоянную температуру плавления, их состав выражается стехиометрической пропорцией в виде простой формулы АmВn. Различают химические соединения двух типов: металл – неметалл и металл – металл. К химическим соединениям металлов с неметаллами относят фазы с ионным типом связи: сульфиды, оксиды, фосфиды, и фазы внедрения: карбиды, нитриды, бориды и гидриды. К системе металл – металл относятся электронные соединения. Электронные соединения образуются между одновалентными металлами (медь, серебро, литий) или металлами переходных групп ( железо, марганец, кобальт), с одной стороны, и металлами с валентностью от 2 до 5 ( алюминий, бериллий, магний, цинк ) с другой стороны. Электронные соединения являются фазами переменного состава. Соединения этого типа имеют определенную электронную концентрацию, т. е. определенное соотношение числа валентных электронов к числу атомов: 3/2 – обычно имеют ОЦК решетку, относятся CuZn, CuBe, Cu3Al; 21/13 – имеют сложную кубическую решетку Cu5Zn8, Co5Zn21, Fe5Zn21; 7/4 – с гексагональной решеткой CuZn3, Cu3Sn2, Cu3Si. Электронные соединения характерны для медных сплавов (латуней и бронз).
Твердые растворы – один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы других (растворяемых) компонентов располагаются в его решетке искажая ее. Твердые растворы могут быть двух типов: замещения и внедрения. Твердые растворы замещения имеют более упорядоченную структуру и по своим свойствам ближе к химическим соединениям; могут быть неограниченной растворимости. В твердых растворах внедрения растворимость ограничена.
Правило фаз Гиббса. Закономерности существования устойчивых фаз в условиях равновесия определяются правилом фаз Гиббса. Правило фаз, устанавливая количественную зависимость между числом фаз Ф, количеством компонентов К и числом степеней свободы С, дает возможность предсказать процессы, проходящие в сплавах при нагреве и охлаждении, и определить число фаз в системе при данных условиях. Правило фаз выражается следующим уравнением: С = К + Р – Ф.
Под числом степеней свободы, или вариантностью системы, понимают число внешних Р ( температура, давление) и внутренних (концентрация) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии. Для металлических сплавов внешним фактором является только температура, поэтому правило фаз: С = К + 1 – Ф.
Вариантность не может быть отрицательной, поэтому для равновесия металлических сплавов необходимо, чтобы в их структуре число фаз не превышало число компонентов более, чем на 1.
В случае кристаллизации чистого металла, когда имеются две фазы (жидкая и твердая), число степеней свободы равно 0, т.е. система инвариантна и обе фазы находятся в равновесии при строго определенной температуре. Чистый металл в жидком состоянии имеет число степеней свободы 1 (моновариантная система) т.е. имеется возможность изменять в определенных пределах температуру без изменения числа фаз.
Из правила фаз следует, что в двойных системах число одновременно существующих фаз не может быть более 3. При большем сплав не будет находится в равновесном состоянии.
2.2. Процессы диффузии в металлах и сплавах
Многие процессы, протекающие в металлах и сплавах, особенно при повышенных температурах, связаны с самодиффузией или диффузией.
Самодиффузия - переход атома металла из узла кристаллической решетки в соседний или в междоузлие под действием теплового возбуждения.
Диффузия - перенос разнородных атомов, который сопровождается изменением концентрации компонентов в отдельных зонах сплава.
Для описания процессов диффузии и самодиффузии предложено несколько механизмов : обменный, циклический, межузельный, вакансионный и др. Однако реализуется тот механизм, при котором окажется наименьшей величина энергетического барьера (энергия активации), преодолеваемого перемещающимися атомами. Энергия активации зависит от сил межатомной связи и дефектов кристаллической решетки, которые облегчают диффузионные переходы (энергия активации по границам зерен в 2 раза меньше, чем в объеме зерна). Для металлических атомов более вероятен вакансионный механизм.
Классическими законами диффузии считаются законы Фика, которые справедливы для систем с малым градиентом концентрации -Первый закон Фика:
При постоянной температуре количество диффундирующего вещества dm в единицу времени через единицу поверхности dS пропорционально градиенту концентрацииКогда градиент концентрации изменяется во времени, а коэффициент диффузии не зависит от концентрации, процесс диффузии описывается вторым законом Фика:
Коэффициент диффузии определяет скорость диффузии при перепаде концентрации, равном единице, зависит от состава сплава, размеров зерен и температуры процесса.
Для определения диапазона температур Аррениус установил экспоненциальную зависимость коэффициента диффузии от температуры:
где D0 - предэкспоненциальный множитель, зависящий от сил связи между атомами кристаллической решетки: Q - энергия активации процесса диффузии; R - газовая постоянная.
Диффузионные процессы лежат в основе кристаллизации и рекристаллизации, фазовых превращений и насыщения поверхности сплавов другими элементами.
2.3. Энергетические условия кристаллизации.
Энергетическое состояние любой системы характеризуется определенным запасом внутренней энергии, которая складывается из энергии движения молекул, атомов, внутриядерной энергии, энергии упругих искажений кристаллической решетки и др. Свободной энергией является такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Величина свободной энергии изменяется при изменении температуры, изменении фазового состояния, при полиморфных превращениях и т.д.: F = U – TS. F – свободная энергия; U - полная внутренняя энергия системы; S – энтропия.
Металл затвердевает, если меньшей свободной энергией обладает твердое состояние, и плавится, если меньшей энергией обладает жидкое состояние. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояния. Изменение свободной энергии жидкого и твердого состояния при изменении температуры показано на рис.7. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояния вещества.
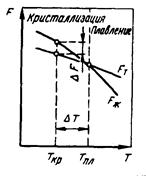
Различают теоретическую или равновесную температуру кристаллизации, при которой Fж = Fтв. При этой температуре равновероятно существование металла как в жидком так и в твердом состоянии. Реальная же кристаллизация начнется только тогда, когда этот процесс будет термодинамически выгоден системе при условии: ΔF = Fж - Fтв, для чего необходимо некоторое переохлаждение. Температура, при которой практически идет кристаллизация Ткр. Разность между теоретической и фактической температурами кристаллизации называется степенью переохлаждения: ΔТ = Тпл – Ткр.
Температурные кривые, характеризующие процесс охлаждения с различными скоростями, приведены на рис.8.
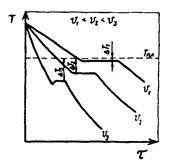
При медленном охлаждении, соответствующем кривой V1, степень переохлаждения невелика и кристаллизация протекает при температуре, близкой к равновесной. Горизонтальная площадка на температурной кривой объясняется выделением скрытой теплоты кристаллизации, которая компенсирует отвод тепла. С ростом скорости охлаждения (кривые V2, V3) степень переохлаждения растет, и процесс кристаллизации протекает при все более понижающейся температуре. Подобно тому, как при кристаллизации необходимо переохлаждение до фактической температуры кристаллизации, так и при плавлении необходим перегрев для достижения реальной температуры плавления.
Процесс кристаллизации состоит из двух элементарных процессов: 1) зарождения центров кристаллизации; 2) роста кристаллов из этих центров. Суммарная скорость кристаллизации зависит от скорости обоих элементарных процессов: скорости зарождения центров кристаллизации (СЗ) и скорости роста кристалла из этих центров (СР). Величины СЗ и СР зависят от степени переохлаждения ΔТ (рис.9).
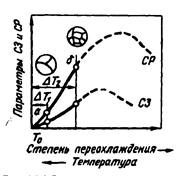
С увеличением ΔТ растет разность свободных энергий ΔF =Fж - Fтв, и при хорошей подвижности атомов СЗ и СР растут и достигают максимума. Последующее уменьшение СЗ и СР объясняется снижением подвижности атомов при снижении температуры. При очень сильном переохлаждении СЗ и СР равны нулю и жидкость не кристаллизуется, а образуется аморфное вещество. Аморфное состояние металлов достигается при скоростях охлаждения более 10 6 0 С/с.
3. ДИАГРАММЫ СОСТОЯНИЯ (ФАЗОВОГО РАВНОВЕСИЯ) СПЛАВОВ
3.1. Методика построения диаграмм фазового состояния сплавов
Элементы образующие сплав называют компонентами. Свойства сплава определяются составом компонент и их количественным соотношением. Наглядное представление дают диаграммы состояния сплава. Зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава, определить оптимальную температуру заливки, оценить жидкотекучесть и возможность получения химической неоднородности, определить режим термической обработки, необходимый для данного сплава.
Любое фазовое превращение сплава отмечается изменением физикомеханических свойств (электросопротивления, удельного объема и т.д.) либо тепловым эффектом. Переход сплава из жидкого состояния в твердое сопровождается значительным выделением теплоты, поэтому, измеряя температуру при нагреве или охлаждении в функции времени, можно по перегибам или остановкам на кривых охлаждения определить критические температуры, при которых происходят фазовые превращения.
Диаграммы состояния строят в координатах температура - химический состав сплава. Для экспериментального построения диаграммы состояния сплавов, образованных компонентами А и В, необходимо изготовить серию сплавов с различным содержанием компонентов А и В. Для каждого сплава экспериментально определяют критические точки, т.е. температуры фазовых превращений. Полученные значения температуры откладывают на вертикальных линиях в соответствии с химическим составом сплавов. Соединяя критические точки, получают линии диаграммы состояния.
Компоненты и фазы в металлических сплавах
Компоненты сплава при взаимодействии образуют фазы. Фаза – это однородная часть сплава, по составу, структуре и свойствам, отделенная от других частей границей раздела. При переходе через границу резко меняются строение и свойства. Сочетание и взаимное расположение фаз, формируемых при охлаждении сплава, образуют его структуру.
Основные фазы в сплавах:
· жидкая фаза. Большинство компонентов металлических сплавов в жидком состоянии полностью растворяются друг в друге, образуя жидкий раствор или расплав.
· твёрдые растворы,
· химические соединения.
Кроме того, фазами могут быть чистые химические элементы, например, углерод (графит) в серых чугунах.
Твёрдые растворы
Твёрдый раствор – фаза, в которой сохраняется кристаллическая решетка основного компонента (растворителя). По характеру расположения растворенных атомов в кристаллической решетке растворителя различают:
- твердые растворы замещения;
- твердые растворы внедрения.
В твёрдых растворах замещения атомы растворенного компонента (В) располагаются в узлах кристаллической решетки, замещая атомы основного компонента (А). Такие растворы образуются между металлами. Они могут быть неограниченной и ограниченной растворимости.
Условия образования неограниченных твердых растворов:
· одинаковый тип кристаллической решётки компонентов;
· различие в атомных размерах компонентов не более 8…15%;
· расположение элементов в одной и той же или соседних группах таблицы Менделеева.
Твердые растворы внедрения образуют металлы с неметаллами малого атомного радиуса – C,N,B,H. Твёрдые растворы внедрения всегда имеют ограниченную растворимость.
Твёрдые растворы обозначают α, β, γ, например, α=А(В) - твердый раствор компонента В в А.
Химические соединения
Химические соединения – фазы, которые имеют свою кристаллическую решетку, отличающуюся от решеток компонентов. Это определяет резкое отличие свойств соединений от свойств образующих его компонентов. Для химических соединений характерны высокая твёрдость, хрупкость, высокая температура плавления и др.
Валентные соединения имеют постоянный состав, соответствующий законам нормальной валентности. Это могут быть соединения между металлами (интерметаллиды), а также соединения металлов с неметаллами: MgS, Al2O3, Ni3Ti, и др.
Фазы внедрения образуют переходные металлы с неметаллами малого атомного радиуса (Rнм/Rм<0,59), например, карбиды и нитриды: Mo2C, TiC, Fe4N, VN и др.Фазы внедрения отличаются от твёрдых растворов внедрения более высокой концентрацией неметалла и простой кристаллической решёткой типа К8, К12, Г12. Фазы внедрения тугоплавки и обладают высокой твёрдостью. Их используют в легированных сталях и сплавах для упрочнения.
Электронные соединения – это химические соединения с определённой электронной концентрацией, т.е. отношением числа валентных электронов к числу атомов. Наиболее распространены соединения с электронной концентрацией 3/2: СuZn, CuBe; 7/4: CuSn3 и 21/13: Cu5Zn8 и др. Их используют как упрочняющие фазы в сплавах меди.
Виды и назначение отпуска стали. Процессы, протекающие при отпуске. Получаемые структура и свойства. Влияние легирующих элементов на температуру отпуска. Отпускная хрупкость и методы ее устранения.
Отпуск – нагрев закаленной стали до температур ниже АС1, выдержка и охлаждение. Цель отпуска – получение окончательной структуры и свойств стали. Отпуск основан на превращениях мартенсита при нагреве (см. п. 6.3), в результате которых происходит изменение структуры и свойств стали (рис. 43).
Различают три вида отпуска (табл.3). Окончательная термообработка, назначаемая изделию для придания требуемых свойств, состоит из закалки и последующего отпуска. Закалку с низким отпуском применяют для деталей машин и инструмента, от которых требуются высокая твердость и износостойкость. Закалку с последующим средним отпуском – для изделий с повышенными упругими свойствами. Закалку с высоким отпуском (улучшение) – для деталей, работающих при повышенных динамических (ударных) и циклических нагрузках.
Рис. 43. Влияние температуры отпуска на механические свойства закаленной стали
Характеристика видов отпуска
| Виды отпуска | Температура, °С | Структура | Свойства | Применение |
| Низкий | 150…250 | Мотп | HRC, σв | Инструмент, подшипники, детали после ХТО и ТВЧ |
| Средний | 350…500 | Тотп | σупр, σ-1 | Рессоры, пружины |
| Высокий | 500…680 | Сотп | КС | Валы, оси, шатуны |
Отпускная хрупкость
Существуют определенные температурные интервалы отпуска, в которых снижается ударная вязкость (Рис.44). Понижение ударной вязкости при температурах отпуска называется отпускной хрупкостью.
Отпускная хрупкость I рода (необратимая) наблюдается в температурном интервале среднего отпуска (250…400°С) у всех конструкционных сталей. Её связывают с неравномерным выделением карбидов из мартенсита по границам зёрен. Хрупкость I рода устраняется нагревом до температуры выше 400°С, снижающим, однако, твердость.
Отпускная хрупкость II рода (обратимая) проявляется при температуре 500…550°С в Cr-Ni- и Cr-Mn- улучшаемых сталях. Предполагаемая причина – скопление фосфора и элементов внедрения по границам зёрен при медленном охлаждении. Хрупкость II рода устраняется повторным отпуском с быстрым охлаждением. Для предупреждения обратимой хрупкости стали легируют молибденом (0,3%) или вольфрамом (до 1%).
Рис. 44. Влияние температуры отпуска на ударную вязкость легированной стали
Фазы в металлических сплавах
Чистые металлы обладают низкой прочностью и в ряде случаев не обеспечивают требуемых физико-химических и технологических свойств. Поэтому в технике их применяют редко. Наиболее широко используют сплавы.
Сплавы получают сплавлением или спеканием двух или более металлов или металлов с неметаллом. Вещества, образующие сплавы, называются компонентами.
Сплав может состоять из двух или большего числа компонентов и образовывать одну или несколько фаз.
Фазой называется физически и химически однородная часть системы (металла или сплава), имеющая одинаковый состав, одно и то же агрегатное состояние и отделенная от остальных частей системы поверхностью раздела.
В сплавах в зависимости от физико-химического взаимодействия компонентов могут образовываться следующие фазы: жидкие растворы, твердые растворы, химические соединения.
Твердые растворы
Рекомендуемые материалы
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого или других компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры (периоды).
Твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
Различают твердые растворы замещения (рис. 9) и твердые растворы внедрения (рис.10). При образовании твердого раствора замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке. Атомы растворенного компонента могут замещать любые атомы растворителя.
При образовании твердого раствора внедрения атомы растворенного компонента располагаются в междоузлиях (пустотах) кристаллической решетки растворителя. При этом атомы располагаются не в любом междоузлии, а в таких пустотах, где для них имеется больше свободного пространства.
При образовании твердого раствора кристаллическая решетка всегда искажается и периоды ее изменяются. При образовании твердого замещения период решетки может увеличиться или уменьшиться в зависимости от соотношения атомных радиусов растворителя и растворенного компонента. В случае твердого раствора внедрения период решетки растворителя всегда возрастает. Атомы растворенного компонента нередко скапливаются у дислокации.
В растворах замещения атомы меньшего размера (по сравнению с атомами металла растворителя) скапливаются в сжатой зоне решетки (рис.11), атомы больших размеров - в растянутой зоне решетки, при образовании твердого раствора внедрения атомы растворенного элемента располагаются в растянутой области под краем экстраплоскости; в области дислокации чужеродным атомам легче размещаться, чем в совершенной области решетки, где они вызывают значительные искажения решетки. Атомы внедрения значительно сильнее связываются с дислокациями, чем атомы замещения, образуя так называемые атмосферы Коттрелла. Образование атмосфер сопровождается уменьшением искажений решетки, что предопределяет их устойчивость. Выход или отрыв атомов из атмосферы Коттрелла требует значительной энергии.
Твердые растворы замещения с неограниченной растворимостью могут образоваться при соблюдении следующих условий:
1. Компоненты должны обладать одинаковыми по типу (изоморфными) кристаллическими решетками. Только в этом случае при изменении концентрации твердого раствора будет возможен непрерывный переход от кристаллической решетки одного компонента к решетке другого компонента.
2. Различие в атомных размерах компонентов должно быть незначительным и не превышать определенной величины— для сплавов на основе меди до 14-15 %, а для сплавов на основе железа до 9 %.
3. Компоненты должны принадлежать к одной и той же группе периодической системы элементов или к смежным родственным группам и в связи с этим обладать близким строением валентной оболочки электронов в атомах.
Твердые растворы внедрения могут возникнуть только в тех случаях, когда диаметр атома растворенного элемента невелик. Поэтому твердые растворы этого типа получаются лишь при растворении в металле (например, в железе, молибдене, хром и т.д.) углерода (атомный радиус 0,77A), азота (0,71 А), водорода (0,46 А), т. е. элементов с малым атомным радиусом. Твердые растворы внедрения могут быть только ограниченной концентрации, поскольку число пор в решетке ограничено, а атомы основного компонента сохраняются в узлах решетки. Роль этого вида твердого раствора значительна в сталях и чугунах.
Упорядоченные твердые растворы (сверхструктуры). В некоторых сплавах (например, Cu-Au, Fe-Al, Fe-Si, Ni-Mn и др.), образующих при высоких температурах растворы замещения (с неупорядоченным чередованием атомов компонентов), при медленном охлаждении или длительном нагреве при определенных температурах протекает процесс перераспределения атомов, в результате которого атомы компонентов занимают определенные положения в кристаллической решетке.
Такие твердые растворы получили название упорядоченных твердых растворов или сверхструктур. Образование сверхструктуры сопровождается изменением свойств.
Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Характерными особенностями химических соединений, образованных по закону нормальной валентности, отличающими их от твердых растворов, являются следующие:
1. Кристаллическая решетка отличается от решеток компонентов, образующих соединение. Атомы в решетке химического соединения располагаются упорядоченно, т. е. атомы каждого компонента расположены закономерно и по определенным узлам решетки. Большинство химических соединений имеет сложную кристаллическую структуру.
2. В соединении всегда сохраняется кратное массовое соотношение элементов. Это позволяет выразить их состав простой формулой, где А и В - соответствующие элементы; n и m - простые числа.
3. Свойства соединения резко отличаются от свойств образующих его компонентов.
4. Температура плавления (диссоциации) постоянная. В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток.
Примером типичных химических соединений с нормальной валентностью являются соединения магния с элементами IV —- VI групп периодической системы и др.
Соединения одних металлов с другими носят общее название интерметаллидов или интерметаллических соединений. Химическая связь между атомами в интерметаллидах чаще металлическая.
Большое число химических соединений, образующихся в металлических сплавах, имеют некоторые особенности, отличающие их от типичных химических соединений: так, некоторые из них не подчиняются законам валентности и не имеют постоянного состава.
Фазы внедрения. Переходные металлы Fe, Mn, Сг, Мо и др. образуют с углеродом, азотом, бором и водородом, т. е. элементами с малым атомным радиусом, такие соединения, как карбиды, нитриды, бориды и гидриды. Они имеют много общего в строении и свойствах; часто их называют фазами внедрения.
Фазы внедрения имеют формулу: M4X(Fe4) , M2x(Fe2N), MX(TiN) и др. Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (Rx) и металла (Rm). Если Rx/Rm 0.59, то атомы металла в этих фазах расположены по типу одной из простых кристаллических решеток: кубической (К8, К12) или гексагональной (Г12),в которую внедряются атомы неметалла, занимая в ней определенные поры.
Фазы внедрения являются фазами переменного состава, а соответствующие им химические формулы обычно характеризуют максимальное содержание в них неметалла. Фазы внедрения обладают высокой электропроводностью, уменьшающейся с повышением температуры, и металлическим блеском. Карбиды, относящиеся к фазам внедрения, плавятся при высокой температуре.
Электронные соединения. Эти соединения образуются между одновалентными элементами (Си,Ag,Au,Li,Na) или металлами переходных групп (Fe, Mn, Со и др.) и простыми металлами с валентностью от 2 до 5 (Be, Mg, Zn, Cd, Al и др.). Особенно часто электронные соединения встречаются в сплавах Си, Ag или Au.
Соединения этого типа имеют определенное отношение числа валентных электронов к числу атомов, т. е. определенную электронную концентрацию. Так, существуют соединения, у которых это отношение в одних случаях равно 3/2 (1,5); в других 21/13 (1,62), в третьих 7/4 (1,75). Каждому из указанных соотношений соответствуют и определенные типы кристаллической решетки.
Электронные соединения подобно обычным химическим соединениями имеют кристаллическую решетку, отличную от решетки образующих компонентов, но в отличие от химических соединений с нормальной валентностью электронные соединения образуют с компонентами, из которых они состоят, твердые растворы в широком интервале концентраций.
Строение и состав твердых фаз в сплавах
Свойства конструкционных материалов определяются их структурным и фазовым состоянием, которое зависит от химического состава сплавов, условий кристаллизации и фазовых превращений, протекающих при охлаждении от жидкого состояния до комнатной температуры, а также при термической обработке сплавов.
Фазовое и структурное состояние описывается графически диаграммами фазового равновесия. Важнейшую роль для характеристики состояния большого количества сплавов играют двойные, наиболее простые диаграммы, которые оказывается возможным изображать на плоскости.
Более сложными являются тройные системы. Для их графического представления требуется использование объемных изображений или их разрезов, сечений и проекций на площадь концентрационного треугольника. Трехкомпонентные диаграммы состояния более точно описывают фазовое и структурное состояние сплавов, которые чаще всего представляют собой многокомпонентные системы.
Двойные, тройные и многокомпонентные системы являются совокупностью фаз, главные из них – твердые растворы и промежуточные фазы.
Твердые фазы в металлографии принято делить на два основных вида: твердые растворы и промежуточные фазы. Среди промежуточных фаз, кроме того, можно выделить группу собственно химических соединений.
Твердые растворы – это такие твердые фазы в сплавах, которые образованы на основе кристаллической решетки компонента-растворителя (рисунок 3.1). При этом атомы растворенного вещества занимают определенные места в решетке растворителя.
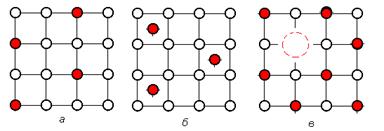 |
| Рисунок 3.1. Типы твердых растворов: а – замещения; б – внедрения; в - вычитания |
Если содержание растворенного вещества невелико, то твердый раствор по свойствам мало отличается от металла растворителя. Атомное строение твердого раствора такое же, как и металла растворителя. Различие заключается только в изменении периода решетки.
Различают твердые растворы:
непрерывные (растворы замещения), ограниченные (растворы замещения, внедрения и вычитания).
Твердые растворы замещения (рисунок 3.1, а) образуются путем замены атомов растворителя в его кристаллической решетке атомами растворенного компонента.
Образование неограниченных твердых растворов определяется рядом основных факторов.
1. Типом кристаллической решетки растворителя и растворенного вещества. При этом оба компонента должны обладать одинаковым типом кристаллических решеток. Этому условию удовлетворяют, в основном, металлы, расположенные в одних и тех же группах периодической системы Менделеева (в пределах одного периода или близких групп или периодов).
2. Электронной концентрацией твердого раствора. Под электронной концентрацией понимают отношение числа валентных электронов к числу атомов. Непрерывные твердые растворы могут быть образованы в том случае, если электронная концентрация для каждой кристаллической решетки не превышает критической. Для гранецентрированной кубической решетки эта величина составляет 1,36, для объемно-центрированной - 1,48.
3. Соотношением атомных размеров компонента раствора. Непрерывные твердые растворы могут быть образованы, если различие в диаметрах атомов компонентов не превышает 14-15%. Однако иногда даже при таких соотношениях атомных диаметров непрерывный ряд твердых растворов не образуется.
При отклонении от этих правил могут возникать ограниченные твердые растворы замещения. Твердые растворы замещения, в которых атомы растворенного вещества занимают любые из мест в кристаллической решетке растворителя, располагаясь произвольно, называют неупорядоченными.
При определенных условиях, например, в результате медленного охлаждения сплавов до температуры ниже точки Курнакова некоторые плоскости кристаллической решетки могут оказаться обогащенными атомами одного из компонентов, причем это расположение носит закономерный характер в макрообъеме сплава. Такой твердый раствор называется упорядоченным или сверхструктурой.
Упорядоченные твердые растворы по существу представляют собой фазы, промежуточные между обычными неупорядоченными растворами и химическими соединениями. При упорядочивании значительно уменьшается удельное электросопротивление, повышается твердость, предел прочности, снижается пластичность.
Иногда достижение полного порядка в твердом растворе оказывается затруднительным. В этом случае сталкиваются с понятием частичной упорядоченности. Количественная оценка этой величины выражается степенью упорядоченности, под которой понимается отношение числа атомов, расположенных упорядоченно к общему числу атомов в кристаллической решетке.Она изменяется в пределах от 0 до 1.
Твердые растворы внедрения (рисунок 3.1.б) образуются путем размещения атомов растворенного компонента в свободных промежутках между атомами решетки растворителя. Растворы внедрения получаются, если отношение атомных диаметров растворенного элемента и растворителя < 0,59. Как правило, растворы внедрения образуются на базе переходных металлов (Fe, Co, Mn и др.) в которых растворяются металлоиды (C, H, O, N) с малыми атомными диаметрами.
В таких системах образуются промежуточные фазы внедрения, которые необходимо отличать от растворов внедрения.
Твердые растворы вычитания или растворы с "дефектной" решеткой (рисунок 3.1, в) образуются только на базе химических соединений (промежуточных фаз). В твердых растворах вычитания избыточные (относительно среднего состава соединения) атомы одного из компонентов занимают нормальные места в кристаллической решетке, иногда как места, которые должны были бы быть заняты другим компонентом, оказываются частично свободными. Аналогичной структурой обладает раствор кислорода в закиси железа FeO.
Группа химических соединений и промежуточных фаз включает следующие разновидности: химические соединения с нормальной валентностью; фазы никель-арсенидного типа; электронные соединения; фазы внедрения; s - фазы (сигма- фазы); фазы Лавеса.
Химические соединения с нормальной валентностью образуются между резко металлическими свойствами и элементами, переходные к металлоидам. Формулы этих соединений могут быть подсчитаны по валентностям компонентов. Эти химические соединения образуют особую кристаллическую решетку, отличную от решеток входящих в него компонентов, с наличием ионных связей. Такие химические соединения характеризуются почти полным отсутствием растворимости компонентов в твердом состоянии. На диаграмме состояния они выражаются ординатой, соответствующей составу химического соединения. Области гомогенности, примыкающие к линии состава соединения, отсутствуют. Химические соединения, как правило, обладают более высокой твердостью, чем каждый из отдельных элементов NaCl, Mg2Si, AuAl2.
Фазы никель-арсенидного типа являются переходной ступенью от фаз металлического характера к химическим соединениях с явно выраженной ковалентной связью. Эти фазы образуются в результате взаимодействия одновалентных или двухвалентных металлов (Cu, Ag, Zn, Al) или переходных с простыми металлами с высокой валентностью (от 4 до 6) или металлоидами. Они являются фазами переменного состава; на диаграммах состояния им соответствуют однофазные области. Кристаллические решетки этих фаз могут быть типа замещения, внедрения или вычитания. Плавление происходит аналогично устойчивому или неустойчивому химическому соединению. Примеры: ZnS, AlP, BeTe, CdSe.
Фазы внедрения образуются путем соединения переходных металлов (Mo, W, Zr, Ti, Ta, Pd, V, Nb и др.) с углеродом, азотом, водородом и бором, с образованием карбидов, нитридов, гидридов и боридов. Отношение диаметров атомных радиусов металлоида и металла обычно колеблется в пределах 0,41-0,59, при этом решетки фаз внедрения могут быть: кубической гранецентрированной (К = 12), кубической объемно-центрированной (К = 8), гексагональной плотноупакованной (Г = 12), или простой гексагональной решеткой (Г = 8). При отношении диаметров атомов > 0,59 образуются соединения со сложными кристаллическими решетками, не соответствующие структуре фаз внедрения.
Особенностями фаз внедрения, в отличие от твердых растворов внедрения, является то, что они часто имеют кристаллические решетки, отличные от кристаллических решеток металла, на основе которого они образуются. Фазы внедрения имеют металлический характер. Обычно их электропроводность высока и некоторые из них обладают сверхпроводимостью. Фазы внедрения имеют переменный состав. Изменение состава происходит, в основном за счет растворения металлических компонентов. Кроме того фазы внедрения с однотипными кристаллическими решетками образуют между собой непрерывные ряды твердых растворов (TiC - VC; TiC - NiN и др.). Фазы внедрения обладают высокой температурой плавления и очень высокой твердостью, близкой к твердости алмаза.
Соединения между двумя или более типичными металлами называются интерметаллидами. Типичными интерметаллидами являются электронные соединения, s - фазы и фазы Лавеса.
Электронными соединениями называют такие соединения двух металлов, которые характеризуются постоянной электронной концентрацией, т.е. постоянным отношением числа валентных электронов к общему числу атомов.
Существуют три значения электронной концентрации, соответствующие различным фазам: 3/2; 21/13 и 7/4. CuZn (1×1 + 1×2):2 = 3/2; Cu5Sn (5×1 + 1×4):6 = 3/2; Cu3Al (3×1 + 1×3):4 = 3/2.
При концентрации 3/2 получается b - фаза. b - фаза в различных соединениях может иметь объемно-центрированную кубическую решетку CuZn (основная), сложную кубическую решетку CuSi (20 атомов) или гексагональную плотноупакованную AgZn. При концентрации 21/13 образуется g - фаза со сложной кристаллической решеткой, a - Mn, состоящей из 52 атомов (Cu5Zn8). При концентрации 7/4 образуется e - фаза с гексагональной плотноупакованной решеткой (CuZn3).
Электронные соединения способны растворять в твердом состоянии избыток каждого из компонентов и давать, таким образом, твердые растворы. Чем больше разница в атомных диаметрах, тем меньше растворимость компонентов. С другой стороны электронные соединения вплоть до температуры плавления проявляют свойства химического соединения. Они имеют резко выраженный максимум на линии ликвидуса, а также могут плавиться инконгруэнтно. Образование соединений происходит с большим выделением тепла. Однако электронные соединения нельзя отнести ни к твердым растворам, ни к химическим соединениям. Они представляют собой специфические промежуточные металлические фазы.
s - фазы образуются при взаимодействии двух переходных металлов (Fe-Mo, Fe-W, Fe-Cr, Cr-Mn и т.д.). Устойчивые s - фазы образуются, в основном, при разнице атомных размеров не более 8%. При увеличении ее выше 10% s - фаза оказывается стабильной при высокой температуре и распадающейся при охлаждении по эвтектоидной реакции. s - фаза может быть устойчивой до температуры плавления, а может распадаться по перитектической реакции. Решетка s - фазы имеет слоистую тетрагональную решетку содержащую 30 атомов.
Фазы Лавеса являются фазами практически постоянного состава. В этих фазах отсутствует или очень мала растворимость металлов-компонентов, образующих рассматриваемое соединение. Эти фазы образуются при большом различии атомных диаметров компонентов (около 20%). Их компоненты могут принадлежать к любой группе таблицы Менделеева. Образование фаз не подчиняется законам валентности. Эти соединения образуют кристаллы кубической или гексагональной симметрии. Большинство фаз Лавеса плавятся по перитектической реакции. Примеры фаз Лавеса: TiFe2, CaMg2, AgBe2 и т.д.
Читайте также:
