Титан металл как добывают
Обновлено: 01.05.2024

Титановые руды – это природные минералы, содержащие в своём составе титан (в скобках указано максимальное процентное содержание):
- рутил, модификациями которого являются анатаз и брукит (свыше 99%),
- лейкоксен (более 97%),
- ильменит (почти 93%),
- перовксит (до 57,8%),
- лопарит (доходит до 41%),
- сфен (почти 41%).
Титан – девятый в списке самых распространённых элементов земной коры, его присутствие обнаружено в 70 минералах, но наиболее интересными в плане переработки являются перечисленные выше.
Способы добычи
Более половины титана добывают из россыпей. Добыча в песчаных месторождениях не представляет никакой сложности. Процесс достаточно прост и не требует дробления и измельчения, осуществляется он драгами, земснарядами, экскаваторами, скреперами и другими гидравлическими устройствами.
Карьерный
Иное дело, когда руды залегают жилами на небольшой глубине. В зависимости от твёрдости вскрышных пород, приходится прибегать к их удалению с помощью землеройных механизмов или посредством проведения предварительных буровзрывных работ. После чего, вынутую руду забирают и подвергают дроблению и измельчению для дальнейшей переработки.
Шахтный
Шахтный способ применим при разработке коренных месторождений. Это наиболее затратный и трудоёмкий способ, требующий строительства целого комплекса сложных подземных сооружений, затраты на который окупаются получением целого набора полезных ископаемых, находящихся в составе титаносодержащих руд.
Методы обогащения
Так как процентное содержание диоксида титана (основного минерала титановых руд) изменчиво в зависимости от месторождения, то извлечённую породу подвергают обогащению, подразделяемому на две стадии: отделение пустой массы и выделение индивидуальных минералов.
Мокрое и сухое разделение по удельному весу
Благодаря различной плотности титаносодержащей породы и массы, не обладающей этим природным минералом, становится возможным их разделение в водной или воздушной среде под воздействием физических сил, созданных внутри специальных технических агрегатов. Это – так называемые гравитационные методы обогащения добытого материала.
Флотация
Способность разнообразных материалов удерживаться или не удерживаться на границе сред, пребывающих обычно в жидком и газообразном состоянии, нашла широкое применение в обогащении титановых руд.
В зависимости от первоначального минерала, используют свои специфические свойства химические вещества – образователи флотационной среды. Так, для ильменита в качестве таких сред выступают собиратели в виде жирных кислот. Рутил хорошо флотируется олеиновой кислотой или сульфированными производными углеводородов. Перовскит перед флотацией жирными кислотами необходимо обработать серной кислотой. Существует множество методов и технологий флотации, кроме того, они варьируются в зависимости от месторождений.
В последнее время широкое распространение в качестве флотационного материала получило талловое масло. Впрочем, переработчики руководствуются соображениями стоимости, доступности, минимума токсичности, при выборе материала для флотации.

Магнитная и электрическая сепарация
Отличие магнитных и электрических свойств титана от других минералов положено в основу соответствующих сепараций – технологий отделения нужного материала от пустой породы под воздействием электрических и магнитных полей в специальных аппаратах. В их список входят: сепараторы, железоотделители, намагничиватели и размагничиватели. А принцип действия этих устройств основан на изменении траектории движения в силовом магнитном или электрическом поле.
Металлургический метод
Завершающей стадией получения титанового шлака является плавка концентрата в виде прессованных брикетов в электродуговых печах при температуре 1500-1700 0 C. Образующиеся в результате металлургического метода отливки содержат до 80% титана.
Промышленное применение
С момента своего открытия в конце XVIII века, титан был оценён специалистами как металл, обладающий лёгкостью, прочностью, жаростойкостью, устойчивостью к коррозии и при этом хорошо поддающийся механической обработке.
Технический титан и его сплавы широко используется в целом ряде отраслей народного хозяйства:
- Химическая индустрия не может обходиться без титановых изделий, обладающих высокой стойкостью к агрессивному воздействию. Это – специальная арматура, ёмкости, трубы, части машин и механизмов, активно используемых в этой отрасли.
- Транспорт активно применяет этот материал, в качестве альтернативы другим металлам, благодаря его низкому удельному весу. Что существенно снижает затраты при перемещении грузов в более лёгких и компактных вагонах и поездах. Используется титан и в автомобилестроении для изготовления витых пружин и систем отвода уходящих газов.
- Незаменим этот материал и в области военной техники. Броня и трубы, глушители и теплообменники, пропеллеры и турбины, являющиеся важными элементами самоходных орудий, танков, самолётов, военно-морских судов и подводных лодок, не обходятся без использования этого минерала.
Химически чистый титан отличается очень высокой жаропрочностью и устойчивостью к механическим воздействиям. Учитывая его лёгкий вес, металл нашёл своё применение в авиации, ракетостроении, космонавтике; при изготовлении электровакуумных приборов и криогенной техники.
Отдельно можно упомянуть медицинские, спортивные и декоративные направления использования этого уникального по своим свойствам материала. Медицинские инструменты и протезы, спортивные снаряды и амуниция, разнообразные декоративно-художественные изделия, известные скульптуры – всё это вместе объединяет между собой такой удивительный материал, как титан.
Месторождения в России и мире
Территория России обладает порядка 20-ью месторождениями титановых руд, расположенными в 9-и металлогенических провинциях, крупнейшими из которых являются:
- Оклемо-Становская,
- Тиманская,
- Уральская.
Также значительными запасами обладают месторождения магматического происхождения Баладекского, Джугджурского, Коларского массивов и находящееся в Амурской области месторождение Большой Сейм. Древние морские россыпи, богатые титановыми рудами размещены на Русской плите и в Сибири. Значительные запасы имеются и на территории Карелии.
За рубежом крупные месторождения докембрийского периода обнаружены в США (Тегавус), Канаде (Лейк-Тио), Норвегии (Тельнес). Запасы ильменита присутствуют на территории Канады, Норвегии, Индии, ЮАР; рутила – в ЮАР, Индии и Австралии. Также титановыми рудами в значительном количестве обладают Бразилия, Мексика и Китай.

Мировые запасы
Подтверждённые мировые запасы диоксида титана составляют:
- Китай – 232,9 млн. тонн.
- Украина – 184 млн. тонн.
- Россия – 177 млн. тонн.
- Бразилия – 123 млн. тонн.
- Индия – 100 млн. тонн.
- Норвегия – 57 млн. тонн.
- Канада – 51,4 млн. тонн.
- ЮАР – 34,1 млн. тонн.
- Австралия – 21,4 млн. тонн.
- Остальные страны – 59,1 млн. тонн.
Если оценивать в процентном отношении залежи титановых руд, то ситуация будет несколько иная:
- Китай – 38%.
- Россия – 17%
- Австралия – 10%.
- Бразилия – 6%.
- Норвегия – 4%.
- Индия – 4%.
- Канада – 3%.
- Украина – 1%.
- Другие страны – 17%.
Различия объясняются разнообразием месторождений и трудностью объективной оценки точного количества залежей этого минерала.
Страны, добывающие титановые руды
По состоянию на 2018 год ситуация на рынке титана выглядит следующим образом:
- Крупнейшими добывающими странами являются Китай, Австралия, Индия, ЮАР.
- Ведущие производители по переработке руды и выплавке титана выглядят следующим образом: США, Россия, Япония, Китай.
Хотя, ещё в 2005-2006 годах 70% мирового производства ильменитового концентрата обеспечивали Австралия, Норвегия и Украина. А 90% рутилового концентрата выпускали в Австралии, ЮАР и на Украине.
Ситуация с течением времени меняется коренным образом: Китай наращивает как добычу, так и переработку совместно с окончательным производством столь ценного продукта, каким является титан для промышленности.
А другие страны пользуются тем, что доля сырья в окончательной стоимости произведённого продукта (титана) составляет лишь 5%, активно закупают исходные материалы по всему миру, не затрудняя себя разработкой новых месторождений. И на то есть свои объективные причины. Гораздо проще и дешевле заниматься освоением прибрежных морских россыпей, как это делают Австралия, Индия (штаты Керала и Мадрас), США (полуостров Флорида), ЮАР (месторождение прибрежных песков Ричардс-Бей), чем заниматься освоением подземных месторождений, подчас не обещающих высокое содержание нужных полезных ископаемых.
Титан

Титан – лёгкий прочный металл серебристо-белого цвета. Существует в двух кристаллических модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмно-центрированной упаковкой, температура полиморфного превращения α↔β 883 °C.Титан и титановые сплавы сочетают легкость, прочность, высокую коррозийную стойкость, низкий коэффициент теплового расширения, возможность работы в широком диапазоне температур.
СТРУКТУРА
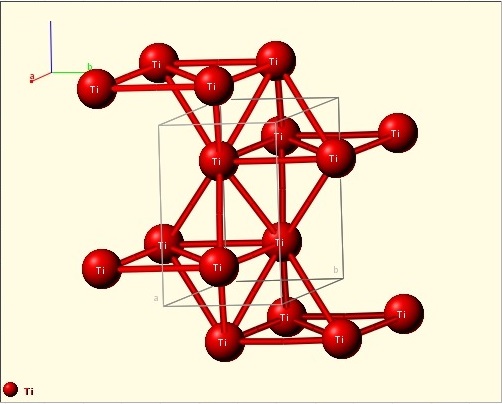
Кристаллическая структура кристалла
Титан имеет две аллотропические модификации. Низкотемпературная модификация, существующая до 882 °C, имеет гексагональную плотноупакованную решетку с периодами а = 0,296 нм и с = 0,472 нм. Высокотемпературная модификация имеет решетку объемноцентрированного куба с периодом а = 0,332 нм.
Полиморфное превращение (882 °C) при медленном охлаждении происходит по нормальному механизму с образованием равноосных зерен, а при быстром охлаждении – по мартенситному механизму с образованием игольчатой структуры.
Титан обладает высокой коррозионной и химической стойкостью благодаря защитной окисной пленке на его поверхности. Он не корродирует в пресной и морской воде, минеральных кислотах, царской водке и др.
СВОЙСТВА

Точка плавления 1671 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см³, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Применяемый в промышленности технический титан содержит примеси кислорода, азота, железа, кремния и углерода, повышающие его прочность, снижающие пластичность и влияющие на температуру полиморфного превращения, которое происходит в интервале 865-920 °С. Для технического Титана марок ВТ1-00 и ВТ1-0 плотность около 4,32 г/см 3 , предел прочности 300-550 Мн/м 2 (30-55кгс/мм 2 ), относительное удлинение не ниже 25%, твердость по Бринеллю 1150-1650 Мн/м 2 (115-165 кгс/мм 2 ). Является парамагнетиком. Конфигурация внешней электронной оболочки атома Ti 3d24s2.
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной). Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C.
ЗАПАСЫ И ДОБЫЧА

Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана их при 850 °C восстанавливают магнием.
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков.
ПРОИСХОЖДЕНИЕ

Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках.
Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Месторождения титана находятся на территории ЮАР, России, Украины, Китая, Японии, Австралии, Индии, Цейлона, Бразилии, Южной Кореи, Казахстана. В странах СНГ ведущее место по разведанным запасам титановых руд занимает РФ (58.5%) и Украина (40.2%).
ПРИМЕНЕНИЕ

Изделия из титана
Титановые сплавы играют большую роль в авиационной технике, где стремятся получить наиболее легкую конструкцию в сочетании с необходимой прочностью. Титан легок по сравнению с другими металлами, но в то же время может работать при высоких температурах. Из титановых сплавов изготовляют обшивку, детали крепления, силовой набор, детали шасси, различные агрегаты. Также данные материалы применяются в конструкциях авиационных реактивных двигателей. Это позволяет уменьшить их массу на 10-25%. Из титановых сплавов производят диски и лопатки компрессора, детали воздухозаборника и направляющего аппарата, крепеж.
Также титан и его сплавы используют в ракетостроении. Ввиду кратковременной работы двигателей и быстрого прохождения плотных слоев атмосферы в ракетостроении в значительной мере снимаются проблемы усталостной прочности, статической выносливости и отчасти ползучести.
Технический титан из-за недостаточно высокой теплопрочности не пригоден для применения в авиации, но благодаря исключительно высокому сопротивлению коррозии в ряде случаев незаменим в химической промышленности и судостроении. Так его применяют при изготовлении компрессоров и насосов для перекачки таких агрессивных сред, как серная и соляная кислота и их соли, трубопроводов, запорной арматуры, автоклав, различного рода емкостей, фильтров и т.п. Только титан обладает коррозионной стойкостью в таких средах, как влажный хлор, водные и кислые растворы хлора, поэтому из данного металла изготовляют оборудование для хлорной промышленности. Из титана делают теплообменники, работающие в коррозионно активных средах, например в азотной кислоте (не дымящей). В судостроении титан используется для изготовления гребных винтов, обшивки морских судов, подводных лодок, торпед и т.д. На титан и его сплавы не налипают ракушки, которые резко повышают сопротивление судна при его движении.
Титановые сплавы перспективны для использования во многих других применениях, но их распространение в технике сдерживается высокой стоимостью и дефицитностью титана.
Что делают из титана
Титан – серебристо-белый металл, впервые обнаруженный английским химиком Уильямом Грегором в 1791 году. Легкий и прочный, он быстро обратил на себя внимание конструкторов. Но прошло больше ста лет после его открытия, прежде чем титан начали реально применять в промышленности.
У титана много достоинств и всего один существенный недостаток – высокая стоимость. Последнее обстоятельство и привело к тому, что титан, в первую очередь, начали использовать в стратегических целях. И лишь значительно позже титан нашел применение в медицине и гражданских областях промышленности.
Удельный вес титана 4,505 грамма в кубическом сантиметре. Сравните с железом – 7,8 грамма в кубическом сантиметре и алюминием – 2,7 грамма. При этом прочность титана в два раза выше, чем у железа и почти в шесть раз выше прочности алюминия. Особенно важно свойство титана сохранять прочность при высоких температурах. Именно это обстоятельство определило широкое применение титана в авиации и ракетостроении. В современных самолетах, военных и гражданских, самые нагруженные детали выполнены из титана. Это позволяет получить значительный выигрыш в весе при сохранении необходимых прочностных характеристик. Из титана изготавливаются лопатки и многие другие детали реактивных двигателей.
Титан очень широко применяется в судостроении. Самая быстрая в мире атомная подводная лодка, советская К-162, была сделана из титана. На испытаниях в 1970 году ей удалось развить подводную скорость 44,7 узла, или 82,78 км/час. Этот рекорд скорости не побит до сих пор. Но при всех своих выдающихся характеристиках эта лодка оказалась очень дорога из-за применения титана, поэтому вошла в историю еще под одним названием – «Золотая рыбка».
Несмотря на дороговизну, титан нашел широкое применение в медицине. В частности, его применяют при изготовлении искусственных суставов и при лечении сложных переломов – поврежденную кость скрепляют с помощью титановых элементов. Такое использование титана стало возможным вследствие его высокой прочности и хорошей совместимости с тканями человека.
Титан используют в качестве легирующей добавки при производстве качественных сталей. Благодаря своей высокой коррозионной стойкости его широко используют в химической промышленности при производстве химических реакторов, емкостей, трубопроводов.
Все чаще можно встретить титан и в повседневной жизни, из него начинают изготавливать различные инструменты. Большой популярностью пользуются титановые лопаты. На такие лопаты не налипает земля, они легче стальных.
Единственным сдерживающим фактором для повсеместного распространения титана по-прежнему остается его высокая цена. Если когда-нибудь удастся найти дешевый способ получения титана, этот замечательный металл получит еще более широкое распространение.
ТИТАН — супермен среди металлов
Титаном назвали металл не зря. Имя принадлежит мифологическим древнегреческим божествам, олицетворявшим силу и мощь природы. Герой статьи делится своей силой с человеком.
Кто открыл суперметалл
История открытия рядовая. Химик и священник Грегор обнаружил оксид неизвестного металла, и дал ему название «менакеновая земля».

Чуть позже немецкий химик Клапрот, исследуя минерал рутил, обнаружил в нем новый элемент, который назвал титаном.
Интересно: Клапрот ранее открыл новый элемент, и назвал его ураном. Это имя в греческой мифологии принадлежало отцу титанидов.
Чистый титан удалось получить талантливому исследователю Берцелиусу.
Свойства титана

Титан относится к металлам; в периодической таблице Менделеева имеет № 22; он легкий, прочный, устойчив к коррозии. Внешне (цветом) похож на алюминий или нержавеющую сталь.
- На воздухе образует на поверхности оксидную пленку.
- Имеет высокую химическую и коррозионную стойкость (благодаря защитной оксидной пленке).
- Имеет две аллотропные модификации: низкотемпературная (существует до температуры 882°С) и высокотемпературная.
- Обладает парамагнитными свойствами.
- Титан образует с другими металлами интерметаллические соединений, его добавляют в сплавы.
Титановая пыль взрывается, а его стружка пожароопасна.
Металл образует с карбидами тугоплавкие высокотвердые соединения.
| Свойства атома | |
|---|---|
| Название, символ, номер | Тита́н / Titanium (Ti), 22 |
| Атомная масса (молярная масса) | 47,867(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Радиус атома | 147 пм |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Электродный потенциал | −1,63 |
| Степени окисления | 2, 3, 4 |
| Энергия ионизации (первый электрон) | 657,8 (6,8281[2]) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 4,54 г/см³ |
| Температура плавления | 1670 °C 1943 K |
| Температура кипения | 3560 K |
| Уд. теплота плавления | 18,8 кДж/моль |
| Уд. теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,1[3] Дж/(K·моль) |
| Молярный объём | 10,6 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная плотноупакованная (α-Ti) |
| Параметры решётки | a=2,951 с=4,697 (α-Ti) |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 21,9 Вт/(м·К) |
| Номер CAS | 7440-32-6 |
Месторождения
Титан называют редким металлом, что не совсем верно. По запасам титансодержащих руд элемент занимает 10 место.
Известно больше 100 таких руд. Среди них:
- рутил;
- титаномагнетит;
- ильменит;
- титанит.
Месторождения титансодержащих руд:
Добыча и переработка
Титан получают из концентрата титансодержащих руд методами пирометаллургии или сернокислотной переработки.
Концентраты из ильменитовых руд плавят в электродуговых печах.
При необходимости черновой металл рафинируют.
Марки титана и виды изделий
Виды выпускаемых титановых изделий:
Сплавы
Титановые сплавы по областям применения делятся на деформируемые и литейные.
| Марка сплава | Присадки |
| ВТ3-1 | Ti, Al, Cr, Mo, Fe, S |
| ВТ5-1 | Ti-Al-Sn |
| ПТ-7М | Ti-Al-Zr |
| ОТ4-1 | Ti-Al-Mn |
| ВТ18 | Ti-Al-Zr-Mo-Nb-Si |
| ВТ14 | Ti-A1-Мо-V |
Достоинства сплавов — сочетание высокой коррозионной стойкости с жаропрочностью и хорошей удельной прочностью.
Плюсы и минусы металла и его сплавов
Достоинства титановых сплавов:
- Соотношение прочность-плотность у титановых сплавов почти в 2 раза лучше, чем у легированных сталей.
- Высокая механическая прочность.
- Отличная коррозионная стойкость, что позволяет изделиям работать в агрессивных средах.

К недостаткам титановых сплавов можно отнести:
- Высокая цена (титан гораздо дороже многих цветных металлов).
- При обработке металла и его сплавов возникает проблема налипания, что грозит быстрым износом режущих инструментов.
- Сложности при сварке титановых изделий.
Область применения титановых изделий широка, хотя может ограничиваться ценовой составляющей.

Заготовка титанового шпангоута истребителя F-15 до и после прессования на штамповочном прессе компании Alcoa усилием 45 тыс. тонн, май 1985
Есть случаи, когда титановые сплавы — единственные, которые возможно использовать в конкретных условиях.
- Надежность продукции из титана проверялась на гоночных автомобилях.
- Металл и его сплавы незаменимы в ракето- и судостроении, химической, энергетической промышленности.
- Титановые соединения востребованы в производстве конденсаторов турбин, труб для перекачки агрессивных жидкостей, сосудов высокого давления.
- Перспективная область применения титановых сплавов — оборудование для глубокого и сверхглубокого бурения.
- Не обходятся без титановых изделий оборонная и военная промышленности.

Стоимость металла
Цена титана в порошке ПТМ-1 7500 рублей за килограмм (на 25.07.2020).

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!

Титан — химический элемент с атомным номером 22. Принадлежит к 4-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к побочной подгруппе IV группы, или к группе IVB), находится в четвёртом периоде таблицы. Атомная масса элемента 47,867(1) а. е. м . Обозначается символом Ti. Простое вещество титан — лёгкий прочный металл серебристо-белого цвета. Обладает высокой коррозионной стойкостью.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Месторождения
- 5 Запасы и добыча
- 6 Получение
- 7 Физические свойства
- 7.1 Изотопы
- 9.1 В чистом виде и в виде сплавов
- 9.2 В виде соединений
- 9.3 Анализ рынков потребления
- 9.4 Цены
![Титан]()
История
Открытие диоксида титана (TiO2) сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1791), выделил новую «землю» (оксид) неизвестного металла, которую назвал менакеновой. В 1795 году немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — оксиды одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз: французский учёный Л. Воклен обнаружил титан в анатазе и доказал, что рутил и анатаз — идентичные оксиды титана.
Первый образец металлического титана получил в 1825 году швед Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 году термическим разложением паров иодида титана TiI4.
Титан не находил промышленного применения, пока люксембуржец Г. Кролл в 1940 году не запатентовал простой магниетермический метод восстановления металлического титана из тетрахлорида; этот метод процесс Кролла до настоящего времени остаётся одним из основных в промышленном получении титана.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот в соответствии со своими взглядами на химическую номенклатуру в противовес французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре — 0,57 % по массе, в морской воде — 0,001 мг/л . В ультраосновных породах 300 г/т , в основных — 9 кг/т , в кислых 2,3 кг/т , в глинах и сланцах 4,5 кг/т . В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Титан в условиях выветривания и осаждения имеет геохимическое сродство с Al2O3. Он концентрируется в бокситах коры выветривания и в морских глинистых осадках. Перенос титана осуществляется в виде механических обломков минералов и в виде коллоидов. До 30 % TiO2 по весу накапливается в некоторых глинах. Минералы титана устойчивы к выветриванию и образуют крупные концентрации в россыпях. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит (сфен) CaTiSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Крупные коренные месторождения титана находятся на территории ЮАР, России, Украины, Канады, США, Китая, Норвегии, Швеции, Египта, Австралии, Индии, Южной Кореи, Казахстана; россыпные месторождения имеются в Бразилии, Индии, США, Сьерра-Леоне, Австралии. В странах СНГ ведущее место по разведанным запасам титановых руд занимает РФ (58,5 %) и Украина (40,2 %). Крупнейшее месторождение в России — Ярегское.
По данным на 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтверждённые запасы диоксида титана (без России) составляют около 800 млн т. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49,7—52,7 млн т. Таким образом, при нынешних темпах добычи мировых разведанных запасов титана (без учёта России) хватит более чем на 150 лет.
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений (Ярегское) находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн руды со средним содержанием диоксида титана около 10 %.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
![Титан]()
Брусок кристаллического титана (чистота 99,995 %, вес ≈283 г, длина ≈14 см, диаметр ≈25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де Бура
Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а невосстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
Кроме этого, в настоящее время начинает получать популярность так называемый процесс FFC Cambridge, названный по именам его разработчиков Дерека Фрэя, Тома Фартинга и Джорджа Чена из Кембриджского университета, где он был создан. Этот электрохимический процесс позволяет осуществлять прямое непрерывное восстановление титана из оксида в расплаве смеси хлорида кальция и негашёной извести (оксида кальция). В этом процессе используется электролитическая ванна, наполненная смесью хлорида кальция и извести, с графитовым расходуемым (либо нейтральным) анодом и катодом, изготовленным из подлежащего восстановлению оксида. При пропускании через ванну тока температура быстро достигает ~1000—1100 °C, и расплав оксида кальция разлагается на аноде на кислород и металлический кальций:
Полученный кислород окисляет анод (в случае использования графита), а кальций мигрирует в расплаве к катоду, где и восстанавливает титан из его оксида:
Образующийся оксид кальция вновь диссоциирует на кислород и металлический кальций, и процесс повторяется вплоть до полного преобразования катода в титановую губку либо исчерпания оксида кальция. Хлорид кальция в данном процессе используется как электролит для придания электропроводности расплаву и подвижности активным ионам кальция и кислорода. При использовании инертного анода (например, диоксида олова), вместо углекислого газа на аноде выделяется молекулярный кислород, что меньше загрязняет окружающую среду, однако процесс в таком случае становится менее стабильным, и, кроме того, в некоторых условиях более энергетически выгодным становится разложение хлорида, а не оксида кальция, что приводит к высвобождению молекулярного хлора.
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан йодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электронно-лучевую или плазменную переработку.
Физические свойства
Титан — лёгкий серебристо-белый металл. При нормальном давлении существует в двух кристаллических модификациях: низкотемпературный α -Ti с гексагональной плотноупакованной решёткой (гексагональная сингония, пространственная группа C6mmc, параметры ячейки a = 0,2953 нм , c = 0,4729 нм , Z = 2 ) и высокотемпературный β -Ti с кубической объёмно-центрированной упаковкой (кубическая сингония, пространственная группа Im3m, параметры ячейки a = 0,3269 нм , Z = 2 ), температура перехода α↔β 883 °C, теплота перехода ΔH =3,8 кДж/моль (87,4 кДж/кг). Большинство металлов при растворении в титане стабилизируют β -фазу и снижают температуру перехода α↔β . При давлении выше 9 ГПа и температуре выше 900 °C титан переходит в гексагональную фазу ( ω -Ti). Плотность α -Ti и β -Ti соответственно равна 4,505 г/см³ (при 20 °C) и 4,32 г/см³ (при 900 °C). Атомная плотность α-титана 5,67⋅10 22 ат/см³ .
Температура плавления титана при нормальном давлении равна 1670 ± 2 °C, или 1943 ± 2 К (принята в качестве одной из вторичных калибровочных точек температурной шкалы ITS-90. Температура кипения 3287 °C. При достаточно низкой температуре (-80 °C), титан становится довольно хрупким. Молярная теплоёмкость при нормальных условиях Cp = 25,060 кДж/(моль·K) , что соответствует удельной теплоёмкости 0,523 кДж/(кг·K) . Теплота плавления 15 кДж/моль , теплота испарения 410 кДж/моль . Характеристическая дебаевская температура 430 К . Теплопроводность 21,9 Вт/(м·К) при 20 °C. Температурный коэффициент линейного расширения 9,2·10 −6 К −1 в интервале от −120 до +860 °C. Молярная энтропия α -титана S 0 = 30,7 кДж/(моль·К). Для титана в газовой фазе энтальпия формирования ΔH 0
f = 473,0 кДж/моль , энергия Гиббса ΔG 0
f = 428,4 кДж/моль , молярная энтропия S 0 = 180,3 кДж/(моль·К) , теплоёмкость при постоянном давлении Cp = 24,4 кДж/(моль·K)Удельное электрическое сопротивление при 20 °C составляет 0,58 мкОм·м (по другим данным 0,42 мкОм·м), при 800 °C 1,80 мкОм·м. Температурный коэффициент сопротивления 0,003 К −1 в диапазоне 0…20 °C.
Пластичен, сваривается в инертной атмосфере. Прочностные характеристики мало зависят от температуры, однако сильно зависят от чистоты и предварительной обработки. Для технического титана твёрдость по Виккерсу составляет 790—800 МПа , модуль нормальной упругости 103 ГПа , модуль сдвига 39,2 ГПа . У высокочистого предварительно отожжённого в вакууме титана предел текучести 140—170 МПа, относительное удлинение 55—70 %, твёрдость по Бринеллю 716 МПа .
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Температура перехода в сверхпроводящее состояние 0,387 К. При температурах выше 73 кельвин титан парамагнитен. Магнитная восприимчивость при 20 °C составляет 3,2·10 −6 . Постоянная Холла α -титана равна +1,82·10 −13 .
Изотопы
Известны изотопы титана с массовыми числами от 38 до 63 (количество протонов 22, нейтронов от 16 до 41), и 2 ядерных изомера.
Природный титан состоит из смеси пяти стабильных изотопов: 46 Ti (изотопная распространенность 7,95 %), 47 Ti (7,75 %), 48 Ti (73,45 %), 49 Ti (5,51 %), 50 Ti (5,34 %).
Среди искусственных изотопов самые долгоживущие 44 Ti (период полураспада 60 лет) и 45 Ti (период полураспада 184 минуты).
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен. Титановая пыль имеет свойство взрываться. Температура вспышки — 400 °C. Титановая стружка пожароопасна.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4). Титан устойчив к влажному хлору и водным растворам хлора.
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6] 2− . Титан наиболее подвержен коррозии в органических средах, так как в присутствии воды на поверхности титанового изделия образуется плотная пассивная плёнка из оксидов и гидрида титана. Наиболее заметное повышение коррозионной стойкости титана заметно при повышении содержания воды в агрессивной среде с 0,5 до 8,0 %, что подтверждается электрохимическими исследованиями электродных потенциалов титана в растворах кислот и щелочей в смешанных водно-органических средах.
При нагревании на воздухе до 1200 °C Ti загорается ярким белым пламенем с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
При нагревании Ti взаимодействует с галогенами (например, с хлором — при 550 °C). Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4, содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4 водородом, алюминием, кремнием, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С азотом N2 выше 400 °C титан образует нитрид TiNx (x = 0.58—1.00). Титан — единственный элемент, который горит в атмосфере азота.
При взаимодействии титана с углеродом образуется карбид титана TiCx (x = 0.49—1.00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHx (x = 2.00—2.98). При нагревании эти гидриды разлагаются с выделением H2.
Титан образует сплавы и интерметаллические соединения со многими металлами.
Читайте также:



