Трилон б реагирует с ионами металлов в стехиометрическом соотношении
Обновлено: 16.05.2024
Комплексоны - это аминополикарбоновые кислоты и их производные (соли).
Реакции комплексообразования ионов металлов с комплексонами протекают быстро и стехиометрически количественно.
В титриметрическом анализе широко используется один из представителей класса комплексонов - динатриевая соль этилен диаминтетрауксусной кислоты (Na2H2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексоном III:
Трилон Б со многими катионами металлов образует прочные растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп.
Образование комплексного соединения можно представить схемой:
Me 2+ + H2ЭДТА 2- [MeЭДТА] 2- + 2H +
Точку эквивалентности в процессе комплексонометрического титрования устанавливают с помощью металлохромных индикаторов, которые образуют с титруемыми ионами металлов растворимые окрашенные комплексные соединения, устойчивость которых меньше, чем устойчивость комплексных соединений тех же катионов с трилоном Б.
Поэтому для более полного протекания реакций комплексообразования (связывания образующихся ионов Н + ) к исследуемому раствору при титровании добавляют аммиачный буферный раствор (NH4OH + NH4Cl), рН 9.
В данной работе используется один из универсальных металлохромных индикаторов ˗ эриохром черный Т.
Me 2+ + HInd 2- MeInd - + H +
Кн([CaInd] - ) = 3,9 . 10 -6 Кн([MgInd] - ) = 1,0 . 10 -7
При титровании исследуемого раствора трилоном Б эти комплексные соединения разрушаются, так как ионы металла связываются трилоном Б в более прочный комплекс, а освобождающиеся анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeInd - + H2ЭДТА 2- [MeЭДТА] 2- + HInd 2- + H +
винно-красный бесцветный бесцветный синий
Кн([CaЭДТА] 2- ) = 2,7 . 10 -11 Кн([MgЭДТА] 2- ) = 2,0 . 10 -9
Появление синей окраски свидетельствует об окончании титрования (точке эквивалентности).
Экспериментальная часть
Стандартизация раствора трилона Б
Так как ион металла при комплексообразовании замещает в трилоне Б два иона водорода, то молярная масса эквивалента трилона Б равна половине его молярной массы:
Порядок выполнения работы
Стандартизацию раствора трилона Б можно проводить по титрованному раствору сульфата магния или хлорида кальция.
1. Ополоснуть и заполнить бюретку раствором трилона Б.
2. В колбу для титрования из общей бюретки отмерить точный объем 10 мл рабочего раствора сульфата магния. Добавить 25-30 мл дистиллированной воды.
3. Мерным цилиндром прилить в колбу 5-10 мл аммиачного буферного раствора и на кончике шпателя внести в раствор сухой индикатор - эриохром черный Т.
4. Медленно титровать раствор сульфата магния раствором трилона Б до перехода винно-красной окраски раствора в синюю (без фиолетового оттенка).
5. Результаты титрования записать в таблицу. Повторить титрование до получения сходящихся результатов.
Хелаты и внутрикомплексные соединения
Циклические комплексные соединения, в образовании которых принимают участие полидентатные лиганды, называются хелатами. Полидентатные лиганды обычно представляют собой многоатомные спирты, амины и их производные. Электронодонорные атомы лиганда (N, O, S и др.) расположенные на некотором расстоянии друг от друга, за счет донорно-акцепторных связей образуют с комплексообразователем циклы (один или несколько). Обычно встречаются пяти- и шестичленные циклы, реже - четырехчленные.
Например, 1,2-диаминоэтан, в котором два донорных атома разделены двумя СН2-группами
с ионами кобальта Со 3+ образует хелатный комплекс:
Хелатные комплексы отличаются повышенной прочностью. Это относится как к термической прочности, так и к устойчивости внутренней сферы в водных растворах. О последнем свидетельствует сравнение величин констант нестойкости хелатного комплекса кобальта с 1,2-диаминоэтаном и иона гексамминкобальта (III), кото-рые, соответственно, равны 2×10 - 49 и 7×10 - 36 . В обоих случаях имеется связь кобальта с азотом. Разница заключается лишь в том, что в первом случае образуется циклическая структура, а во втором - нет.
Если помимо координационной связи, полидентатный лиганд связан с комплексообразователем еще и ковалентной связью, то образуется дополнительный хелатный цикл. Такие соединения называются внутрикомплексными. Соединения, которые образуют внутрикомплексные соединения с ионами металлов, называются комплексоны. Такими свойствами, например, обладают органи-ческие производные аминополикарбоновых кислот:
| Комплексон I | три(карбоксиметил)амин или нитрилоуксусная кислота |
| Комплексон II | 1,2-бис[ди(карбоксиметил)амин] или этилендиаминтетрауксусная кислота (ЭДТА) |
| Комплексон III | динатриевая соль ЭДТА или трилон Б |
На практике чаще используется трилон Б, так как эта динатриевая соль лучше растворима в воде по сравнению с ЭДТА. Трилон Б образует прочные растворимые в воде комплексы с катионами металлов, так как кроме двух ковалентных связей (при замещении ионов водорода в -СООН группах) образуются две дополнительные координационные связи с участием неподеленных пар электронов атомов азота:
где Me - Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ , Mn 2+ Fe 2+ , Cu 2+ , Zn 2+ , Pb 2+ и др.
В случае трехвалентных комплексообразователей (Al 3+ , Ga 3+ , Ce 3+ и др.) комплексы имеют более сложное октаэдрическое строение.
Внутрикомплексные соединения четырехвалентных металлов отличаются тем, что не имеют внешней сферы, т.е. не являются электролитами.
К внутрикомплексным соединениям относятся многие биоло-гические комплексы, например, хлорофилл (комплексообразователь - Mg 2+ ), гемоглобин (Fe 2+ ), витамин В12 (Co 3+ ) и многие другие.
Комплексоны используют в медицинской практике. Например, при отравлениях тяжелыми металлами (Pb 2+ , Hg 2+ ) для их связывания и выведения из организма применяют ЭДТА. Трилон Б применяется при заболеваниях, связанных с избыточным отложением солей кальция в организме (артриты, артрозы, отложение кальция в почках, венах, мышцах). Трилон Б также используют как антикоагулянт при консервировании крови.
Комплексонометрия
Метод объемного анализа, в котором в качестве рабочих раст-воров (титрантов) используют растворы комплексонов, называется комплексонометрией. Метод применяют для определения концентрации ионов металлов в растворах, в том числе в биологических жидкостях, сточных водах и т. д.
В частности, комплексонометрию используют для определения общей жесткости воды. Жесткость воды, как известно, обусловлена присутствием солей кальция и магния - гидрокарбонатов, хлоридов, сульфатов, и др. Различают временную жесткость, вызванную нали-чием гидрокарбонатов, и постоянную, причиной возникновения которой является, в основном, присутствие хлоридов и сульфатов. Общая жесткость воды складывается из временной и постоянной жесткости и выражается суммарной молярной концентрацией эквивалента катионов Ca 2+ и Mg 2+ (ммоль/л). Использование жесткой воды приводит к образованию накипи в котлах и отопительных приборах, повышает расход моющих средств. Верхний предел жесткости воды в системах водоснабжения составляет, как правило, 7 ммоль/л.
Точку эквивалентности в методекомплексонометрии фиксируют при помощи металлоиндикаторов (эриохром черный Т, мурексид и др.). Металлоиндикаторы представляют собой однозамещенные соли слабых многоосновных органических кислот.
Так, эриохром черный Т имеет структуру:
которую можно кратко представить как NaH2Ind.
Кислотность этого соединения обусловлена наличием фенольных групп, величины которых равны 7,7 и 9,5. В водных растворах этот индикатор может находится в виде трех форм, соотношение которых зависит от pH среды. Это находит отражение в изменении окраски раствора:
Н2Ind - ⇄ Н + HInd 2 - ⇄ 2Н + Ind 3 - .
красный синий желтый
Отличительной особенностью этих соединений является способ-ность образовывать с ионами металлов окрашенные, малопрочные и растворимые в воде комплексы. Так, при добавлении эриохрома черного Т к водопроводной воде при рН = 7÷11 образуется красный комплекс индикатора с ионами Са 2+ и Mg 2+ :
HInd 2 - (cиний) + Ca 2+ ⇄ [CaInd] - (красный) + H +
HInd 2 - (cиний) + Mg 2+ ⇄ [MgInd] - (красный) + H +
Образующиеся при этом ионы H + нейтрализуются аммиачным буфером и в системе поддерживается постоянство pH на уровне 7÷11.
Полученные при этом комплексы характеризуются меньшей прочностью по сравнению с внутрикомплексными соединениями. Действительно, значения [MgInd] - и [MgTr] 2 - соответственно равны 2,8·10 5 и 5·10 8 . Поэтому при добавлении трилона Б конкуренцию за ионы Ме 2+ выигрывает комплексон, так при этом образуется более прочный комплекс:
Ме 2+ + H2Tr 2 - MeTr 2 - + 2H +
В точке эквивалентности ярко окрашенный комплекс металла с индикатором полностью разрушается и индикатор выделяется в индивидуальной форме:
МеInd - + H2Tr 2 - MeTr 2 - + HInd 2 - + H + ,
цвет которой определяется рН раствора.
Таким образом, если применять индикатор эриохром черный Т, то точку эквивалентности можно зафиксировать по переходу окраски раствора из красной в синюю.
Комплексонометрическое титрование
В аналитической химии широко применяется метод анализа, основанный на использовании реакций, сопровождающихся образованием внутрикомплексных (хелатных) соединений с органическими соединениями - комплексонами. Комплексонами называют аминополикарбоновые кислоты и их производные.

В анализе используют ее динатриевую соль Na2H2L 2Н2О, которая в отличие от кислоты хорошо растворима в воде и находит более широкое применение.
Комплексоны являются полидентатными лигандами, которые образуют со многими катионами (Са 2+ , Ва 2+ , Sr 2+ , Mg 2+ , Со 2+ , Сu 2+ , Bi 3+ , Al 3+ , Zn 2+ , Fe 3+ , Ni 2+ и др.) очень прочные, хорошо растворимые в воде, бесцветные внутрикомплексные (хелатные) соединения. Внутрикомплексные соли образуются всегда в тех случаях, когда катионы металла - комплексообразователя замещают активные атомы водорода функциональных групп органического соединения, а также с определенными его группами образуют координационные (донорно-акцепторные) связи.
К группам, в которых атомы водорода способны замещаться на ионы металла, относятся -СООН, - SО3Н, - ОН, = NOH и др. Донорно-акцепторную связь с ионами комплексообразователя способны образовывать группы - NH2, = NH, - NOH, = S, = СО и др.
Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
В растворе трилон Б диссоциирует на ионы:
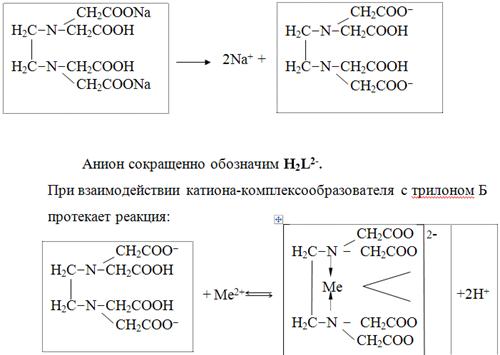
Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями:
H2L 2- + Ме 2+ ↔ [MeL] 2- + 2Н +
H2L 2- + Ме 3+ ↔ [MeL] - + 2Н +
H2L 2- + Ме 4+ ↔ [MeL] + 2Н +
Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
При этом комплекс катиона с индикатором и свободный индикатор имеют различную окраску:
H2Ind - + Ме 2+ ↔ [Ме Ind] -
(окраска 1) (окраска 2)
При комплексонометрическом титровании к анализируемому раствору прибавляют металлоиндикатор, который образует с определяемыми катионами комплекс, имеющий определенную окраску. В процессе титрования трилоном Б комплекс катионов металла с индикатором разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном Б, а в раствор переходят ионы свободного индикатора:
[Ме Ind] - + H2L 2 - ↔ [MeL] 2 - + H2Ind -
(окраска 2) (окраска 1)
Конечную точку титрования определяют по собственной окраске индикатора (окраска 1).
Условия комплексонометрическоro титрования:
1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной.
2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б.
В процессе титрования при взаимодействии катионов с трилоном Б в раствор переходят ионы Н + , в результате чего рН раствора понижается, что приводит к смешению реакции комплексообразования влево и делает реакцию обратимой. Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б в присутствии аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2.
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами:
При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.).
В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НС1, Н2SО4) и сильных оснований (КОН, NaOH).
В зависимости от природы титранта кислотно-основное титрование включает два основных метода: ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант - раствор щелочи, а применяется для определения кислот,
Титранты кислотно-основного титрования относятся к титрантам второго типа - стандартизированные или с установленным титром (см.3.3). В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту.
Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований.
В кислотно-основном методе титрования различают три случая титрования:
1. Титрование сильной кислоты сильной щелочью и наоборот:
НСl + NaOH = NaCl + H2O; H + + OH - = H2O
Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу.
2. Титрование слабой кислоты сильной щелочью:
В точке эквивалентности образуется соль слабой кислотой и сильного основания, которая вступает в реакцию гидролиза:
СH3COONa + HOH ↔ CH3COOH + NaOH
В растворе накапливаются ионы ОН - и точка эквивалентности будет находиться в щелочной среде (рН > 7 ), не совпадая с точкой нейтральности.
3. Титрование слабого основания сильной кислотой:
Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н + , что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности.
Поскольку кислотно-основное титрование не сопровождается внешним эффектом, например, изменением окраски, для фиксирования точки эквивалентности применяют индикаторы.
Индикаторы в кислотно-основном титровании
титрование осадительный тицианометрия индикатор
Индикаторы кислотно-основного титрования представляют собой слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются окраской. В процессе диссоциации эти две формы находятся в равновесии. Изменение рН в кислотно-основном титровании нарушает равновесие процесса диссоциации индикатора, что вызывает накопление в растворе одной из форм индикатора, окраску которой можно визуально наблюдать. Окраска двух форм кислотно-основных индикаторов представлена в таблице 1.
Окраска некоторых индикаторов
| Индикатор | Окраска недиссоциированных молекул | Окраска анионов |
| Метиловый оранжевый | красная | желтая |
| Метиловый Красный | красная | желтая |
| Фенолфталеин | бесцветная | малиновая |
| Лакмус | красная | синяя |
Для каждого индикатора есть свой интервал значений рН, в пределах которого индикатор изменяет свою окраску. Этот интервал называется областью перехода окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода, которое называют показателем титрования этого индикатора.
Важнейшие индикаторы имеют следующие области перехода и показатели титрования:
Область перехода Показатель титрования (рТ) рН рТ
Метиловый оранжевый 3,1 – 4,4 4,0
Метиловый красный 4,4 – 6,2 5,5
Лакмус 5,0 – 8,0 7,0
Фенолфталеин 8,0 – 10,0 9,0
Для правильного выбора индикатора в различных случаях титрования необходимо знать предел скачка рН на кривой титрования. Для каждого случая титрования пригодны только те индикаторы, показатели титрования которых входят в пределы скачка рН на кривой.
Предел скачка рН для случая титрования сильной кислоты сильной щелочью составляет 4 – 10. Так как рТ всех индикаторов входят в предел скачка рН, фиксирование точки эквивалентности для данного случая титрования возможно всеми вышеперечисленными индикаторами.
Предел скачка рН для случая титрования слабой кислоты сильным основанием составляет 8 – 10. В этот предел скачка рН входит только рТ индикатора фенолфталеина. Для данного случая титрования точку эквивалентности можно зафиксировать только с фенолфталеином.
Предел скачка рН для случая титрования слабого основания сильной кислотой составляет 4 – 6,2. В этот предел скачка рН входят рТ метилового оранжевого и метилового красного с помощью которых можно точно зафиксировать точку эквивалентности для данного случая титрования.
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Сущность метода комплексонометрии:
Комплексонометрия (хелатометрия) – метод титриметрического анализа, основанный на реакциях взаимодействия определяемых ионов металла с органическими реагентами (комплексонами) с образованием растворимых, бесцветных прочных внутрикомплексных соединений.
Комплексоны -органические соединения, производные аминополикарбоновых кислот, простейшей из которых является иминодиуксусная кислота
Наиболее распространены следующие комплексоны:
Комплексон I, или нитрилотриуксусная кислота
Комплексон II, или этилендиаминтетрауксусная кислота (ЭДТА),
2C CH2COOН
2С CH2COOН,
имеющая бетаионовое строение (два протона связаны с атомами азота)
2С CH2COOН,
Эту четырехосновную кислоту часто сокращенно обозначают символом Н4Y.
Вследствие низкой растворимости в воде сама кислота не подходит для приготовления раствора титранта. Для этого обычно используют дигидрат ее двунатриевой соли Na2H2Y*2H2O (комплексон III)
Комплексон III называют также ЭДТА (этилендиаминтетраацетат), трилон Б, который наиболее широко используется в титриметрии. Комплексонов в настоящее время известно несколько десятков, но они применяются редко.
Высокая устойчивость комплексов металлов с ЭДТА обусловлена наличием в молекуле ЭДТА шести функциональных групп с донорными атомами азота и кислорода, посредством которых молекула ЭДТА связана с ионом металла с образованием симметричной малонапряженной структуры с несколькими пятичленными циклами. Комплекс трилона Б с ионами металлов образуются путем замещения металлом атомов водорода карбоксильных групп и взаимодействия катиона с атомами азота аминогрупп. Комплекс трилона Б с ионами двухвалентных металлов схематично можно представить так
Трилон Б используется для определения многих ионов металлов Ca 2+ , Mg 2+ ,Ba 2+ , Co 2+ , Cu 2+ , Zn 2+ , Ni 2+ , Al 3+ и другие.
Реакции взаимодействия различных катионов с ЭДТА в растворе можно представить уравнениями:
Me 2+ + H2Y 2- = MeY 2- + 2H +
Me 3+ + H2Y 2- = MeY - + 2H +
Me 4+ + H2Y 2- = MeY + 2H +
H2Y 2- - анион двунатриевой соли ЭДТА. Из уравнений видно, что независимо от заряда катиона образуются комплексы с соотношением компонентов 1:1. Следовательно, молярная масса эквивалента ЭДТА и определяемого иона металла равны их молекулярным массам.
Степень протекания реакции зависит от рН и константы устойчивости комплексоната. Катионы, образующие устойчивые комплексонаты, например,
Fe (III), могут быть оттитрованы в кислых растворах. Ионы Са(II), Mg(II) и другие, образующие сравнительно менее устойчивые комплексонаты, титруют при рН 9 и выше.
Точку эквивалентности в комплексонометрии можно определять различными способами:
1) алкалиметрическим титрованием ионов водорода, выделившиеся при эквивалентном взаимодействии ионов металла с комплексоном;
2) физико – химическими способами (спектрофотометрическим, амперометрическим, потенциометрическим);
3) индикаторным способом с помощью металл - индикаторов.
Металл-индикаторы - это хромофорные органические соединения (красители), образующие с катионами металлов интенсивно окрашенные непрочные комплексные соединения:
Me 2+ + Hind 2- ↔ MeInd - + H +
бесц. синий винно-красный
При титровании раствором трилона Б, комплекс MeInd – разрушается, т.к. происходит связывание ионов металла комплексоном в более прочный комплекс, а анионы индикатора Hind 2- накапливаются в растворе, сообщая ему синюю окраску.
MeInd - + [H2Tr] 2- → [MeTr] 2- + Hind 2- + H +
винно-красный бесцв. бесцв. синяя
Лабораторная работа 8 Стандартизация раствора трилона б. Определение общей жесткости воды.
Комплексоны - это аминополикарбоновые кислоты и их производные (соли).
Реакции комплексообразования ионов металлов с комплексонами протекают быстро и стехиометрически количественно.
В титриметрическом анализе широко используется один из представителей класса комплексонов - динатриевая соль этилен диаминтетрауксусной кислоты (Na2H2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексоном III:
Трилон Б со многими катионами металлов образует прочные растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп.
Образование комплексного соединения можно представить схемой:
Me 2+ + H2ЭДТА 2- [MeЭДТА] 2- + 2H +
Точку эквивалентности в процессе комплексонометрического титрования устанавливают с помощью металлохромных индикаторов, которые образуют с титруемыми ионами металлов растворимые окрашенные комплексные соединения, устойчивость которых меньше, чем устойчивость комплексных соединений тех же катионов с трилоном Б.
Поэтому для более полного протекания реакций комплексообразования (связывания образующихся ионов Н + ) к исследуемому раствору при титровании добавляют аммиачный буферный раствор (NH4OH + NH4Cl), рН 9.
В данной работе используется один из универсальных металлохромных индикаторов ˗ эриохром черный Т.
Me 2+ + HInd 2- MeInd - + H +
Кн([CaInd] - ) = 3,9 . 10 -6 Кн([MgInd] - ) = 1,0 . 10 -7
При титровании исследуемого раствора трилоном Б эти комплексные соединения разрушаются, так как ионы металла связываются трилоном Б в более прочный комплекс, а освобождающиеся анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeInd - + H2ЭДТА 2- [MeЭДТА] 2- + HInd 2- + H +
винно-красный бесцветный бесцветный синий
Кн([CaЭДТА] 2- ) = 2,7 . 10 -11 Кн([MgЭДТА] 2- ) = 2,0 . 10 -9
Появление синей окраски свидетельствует об окончании титрования (точке эквивалентности).
Экспериментальная часть
Стандартизация раствора трилона Б
Так как ион металла при комплексообразовании замещает в трилоне Б два иона водорода, то молярная масса эквивалента трилона Б равна половине его молярной массы:
Порядок выполнения работы
Стандартизацию раствора трилона Б можно проводить по титрованному раствору сульфата магния или хлорида кальция.
1. Ополоснуть и заполнить бюретку раствором трилона Б.
2. В колбу для титрования из общей бюретки отмерить точный объем 10 мл рабочего раствора сульфата магния. Добавить 25-30 мл дистиллированной воды.
3. Мерным цилиндром прилить в колбу 5-10 мл аммиачного буферного раствора и на кончике шпателя внести в раствор сухой индикатор - эриохром черный Т.
4. Медленно титровать раствор сульфата магния раствором трилона Б до перехода винно-красной окраски раствора в синюю (без фиолетового оттенка).
5. Результаты титрования записать в таблицу. Повторить титрование до получения сходящихся результатов.
Читайте также:
