Тритий металл или неметалл
Обновлено: 20.09.2024
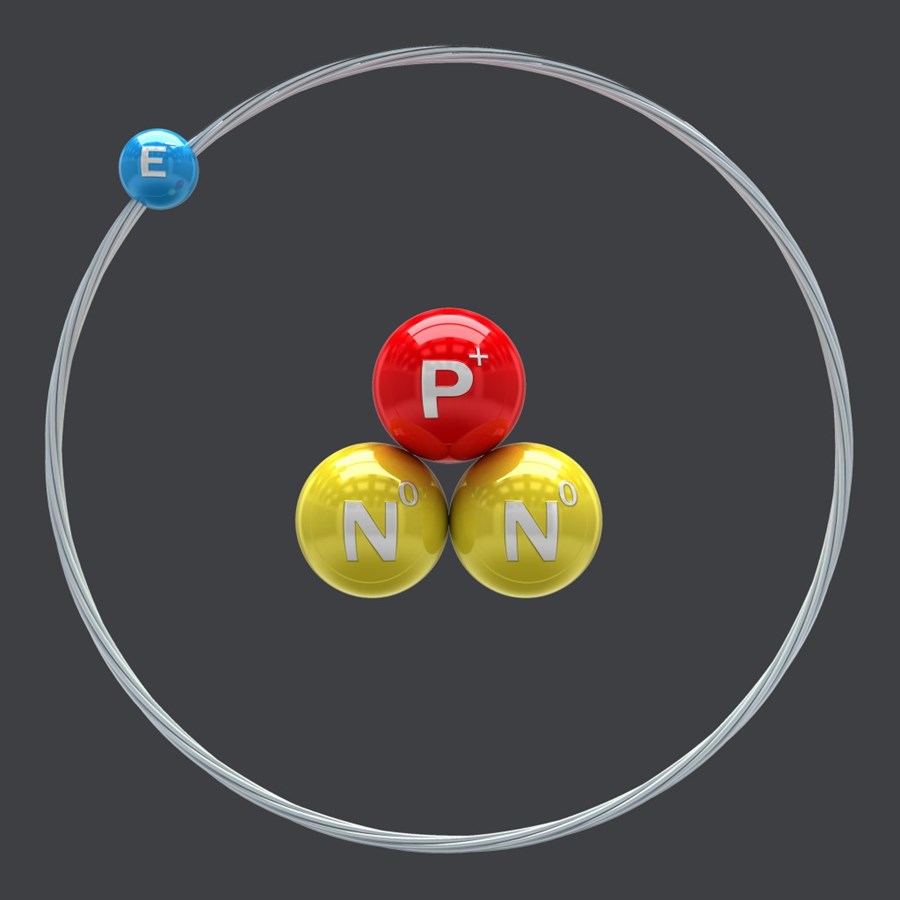
ТРИТИЙ (от греч. tritos - третий) T, или 3 1 H, радиоактивный тяжелый изотоп водорода с мас. ч. 3. Ядро атома трития- тритон с массой 3,016050 состоит из одного протона и двух нейтронов, энергия связи 8,1-8,4 МэВ. При b -распаде трития образуется легкий изотоп гелия: -частиц трития с в-вом возникает тормозное фотонное излучение, к-рое используют для количеств. определения трития в разл. средах.
Молекула трития двухатомна, мол. м. 6,03210; основная частота колебаний атомов 2548,36 см -1 ; константа диссоциации
Т ритий образуется в верх. слоях атмосферы в результате взаимод. космич. излучения гл. обр. с ядрами N и O, напр.:
Большое кол-во трития образуется при ядерных и, гл. обр., термоядерных взрывах. Взрыв водородной бомбы с тротиловым эквивалентом 1 MT приводит к выделению (2,6-7,4)*10 8 ГБк трития. С начала испытания термоядерного оружия (1954) содержание трития в дождевой воде возросло с 0,5-5,0 до 500 Т.E.: Т.E. - тритиевая единица, равная отношению числа атомов Т/Н = 10 -18 , или 0,12 Бк на 1 л воды. При подземных ядерных взрывах тритий также превращ. в оксид и частично выходит на пов-cть. По оценкам (1970), общее содержание трития в биосфере: в мировом океане 250 кг, в континентальных водах 45 кг, в воздухе 3 кг.
Свойства. Нек-рые св-ва трития приведены в табл. 1. Ур-ние температурной зависимости давления насыщ. пара жидкого н-Т 2 в интервале 25-40 К:
Tабл. 1. - СВОЙСТВА HT, DT и н-Т 2
AH исп при т. кип., Дж/моль
Плотн. жидкости (кг/м 3 ) вдоль линии насыщения:
Давление пара HT м. б. вычислено по ф-ле: Коэф. диффузии HT в жидком H 2 м.б. вычислен по ур-нию D = 3,05*10 -4 exp(-36/T). Идеальный коэф. разделения изотопов водорода при равновесии жидкость-пар Р-ции изотопного обмена водорода (константы равновесия при 298,15 К равны соотв. 2,57 и 3,82) протекают вследствие выделения энергии при радиоактивном распаде трития, скорость их зависит от концентрации трития, а также от присутствия катализаторов. Тритий окисляется O 2 при обычной т-ре и без катализаторов вследствие
Табл.2.- ЗНАЧЕНИЯ
21,0 22,0 23,0 24,0
2,19 2,06 1,95 1,86
1,30 1,27 1,25 1,23
1,690 1,613 1,563 1,513
Оксиды трития T 2 O (мол.м. 22,03150), прототрития НТО (20,02335) и дейтеротрития DTO (21,02955) имеют уд. активность соотв. 98050, 53650 и 51430 ГБк/г. Для T 2 O т. кип. 274,70 К, т-ра тройной точки 277,64 К; плотн. 1,21459 г/см 3 (293,15 К), макс. плотн. 1,21502 (286,55 К); отношение значений давления паров H 2 O и T 2 O в интервале 264-387 К:
Давление пара НТО ) р-ров DTO в D 2 О в интервале 313,15-373,15 К:
Константы равновесия К изотопного обмена H 2 O+ при 300 К соотв. равны 3,699 и 3,972. Образование НТО может происходить при изотопном обмене
В результате радиоактивного распада трития в его соед. имеют место радиац. эффекты. Вода, содержащая тритий, подвергается радиолизу с образованием H 2 и H 2 O 2 . Вода, содержащая 100% трития, разлагается на 50% через 5,24 сут. Рекомендуемая Международной комиссией радиологич. зашиты условная граница допустимого содержания трития в воде (при к-ром практически не наблюдается ее саморазложение) 3,7*10 3 ГБк/л.
Тритиды подобны гидридам (незначит. отличия проявляются в таких св-вах, как плотность и параметры кристаллич.решетки): получают их теми же методами, что и гидриды. Наиб. важны LiT (Li 2 DT), TiT 2 , ZrT 2 , UT 3 . Обьем (см 3 ) T 2 , связываемого 1 г металла: Li 1,6*10 3 , Ti 4,7*10 2 , Zr2,5-10 2 , U 1,4*10 2 . В любом водородсодержащем соед. замещение одного атома H на атом T приводит к образованию соед. с уд. активностью 107,7-10 4 ГБк/моль.
Применение. Тритий- компонент топлива для термоядерного синтеза:
Техника безопасности и контроль. Макс. пробег -частицы трития полностью поглощаются роговыми слоями кожи и внеш. облучение организма тритием и его соед. не представляет опасности. Тритий опасен при попадании в организм через кожу, легкие или при приеме пищи и воды. Период полувыведения трития при поглощении в виде газа 3,3 мин, а в виде воды 10-12 сут. Независимо от путей поступления в организм через 2-3 ч наблюдается равномерное распределение НТО в жидкой фазе организма (кровь, моча, выдыхаемые пары воды). Для газообразного трития и НТО (T 2 O) категория радиац. опасности Г, минимально значимая активность 3,7 · 10 6 Бк. Допустимые концентрации трития в воздухе рабочей зоны ДК А и в атм. воздухе или воде ДК Б , предельно допустимое поступление через органы дыхания ПДП, предел годового поступления в организм ПГП приведены в табл. 3.
В ядерных реакторах, работающих на тепловых нейтронах, в результате побочных процессов образуется тритий, к-рый может попадать в окружающую среду с газообразными или жидкими отходами, как непосредственно на АЭС, так и при дальнейшей переработке облученного ядерного топлива. Количеств. оценка поступления трития в окружающую среду с газообразными и жидкими отходами АЭС, ГБк/МВт(электрич.)*год: реакторы ВВЭР (водно-водяной энергетич. реактор) - в атмосферу 7,4-33, в гидросферу 33; реакторы РБМК (реактор большой мощности канальный) - соотв. 22 и 1,5. Существенно более высокие выбросы трития наблюдаются на АЭС с тяжеловодными реакторами. Осн. источник поступления трития в окружающую среду в ядерной технологии - заводы по переработке ядерного топлива. Так, напр., завод по переработке ядерного топлива с производительностью 1500 т UO 2 в год м.б. источником трития- (1,11-2,96)·10 16 Бк в год.
Тритий: что это такое, особенности, свойства и производство
Энергия реакций распада и синтеза в ядре атома давно нашла применение в науке и технике. Она используется в промышленности, оружии, геологии, на атомных электростанциях. Процессы ядерных реакций могут приносить как пользу, так и огромный вред. В статье речь пойдет о том, что это такое - тритий, как он добывается, о его использовании в атомной энергетике и какие опасности связаны с его применением.
Изотопы водорода
Прежде чем объяснить, что это такое тритий, необходимо познакомиться с понятием изотопа.
Атом любого вещества состоит из ядра и электронов (отрицательно заряженных частиц), движущихся по орбитам вокруг него. Ядро атома содержит положительно заряженные частицы - протоны, и частицы с нейтральным зарядом - нейтроны.
В обычном атоме число электронов и протонов совпадает, а вот количество нейтронов может отличаться. В этом случае элементы, имеющие разное число нейтронов в ядре, называются изотопами элемента.
Водород имеет заряд 1, то есть в нем содержится один электрон и один протон. Его изотопы - протий, дейтерий и тритий. Слово "протий" образовано от греческого слова "первый". Этот элемент имеет лишь один протон в ядре. По сути, он представляет собой привычный нам водород.
Дейтерий означает "второй". В его ядре имеется один протон и один нейтрон. А тритий переводится как "третий" и содержит в ядре опять же один протон, но два нейтрона.
Краткий ответ на вопрос "Тритий - что это такое?" выглядит так: это третий изотоп химического элемента водорода.
История открытия
Названия для изотопов 1Н и 2Н - протия и дейтерия - были предложены американским физиком Гарольдом Юри. Обнаружив существование дейтерия, ученые сразу предположили наличие третьего изотопа водорода, имеющего два нейтрона в ядре. Юри для исследований использовал метод спектрального анализа. Однако результатов он не дал. Оказалось, что концентрация трития слишком мала, чтобы его можно было обнаружить традиционными способами. В природе это вещество практически невозможно найти. Поэтому для исследований стали использоваться другие методы, например, масс-спектрометрия.

В 1934 году Эрнест Резерфорд сумел искусственно получить третий изотоп при помощи ядерных реакций. Само собой, название было выбрано заранее, и, по аналогии с протием и дейтерием, он стал называться тритием.
Свойства
В нормальных условиях физические свойства трития примерно такие же, как у обычного водорода. Он имеет газообразное состояние; вкус, запах и цвет отсутствуют. При понижении температуры до -250 °C он становится легкой бесцветной жидкостью. А при нагревании он напоминает снег.
Атомная масса трития равняется примерно 3 а.е.м.
Тритий является радиоактивным веществом. Период полураспада составляет 12 лет, что является очень удобным в исследованиях. Канал распада элемента - бета. Тритий превращается в изотоп гелий-3. При этом происходит испускание электронов и антинейтрино.
Дефект масс и энергия связи трития
Одним из ключевых в физике элементарных частиц является понятие энергии связи атомных ядер. Под энергией связи ядра трития понимают то количество энергии, которое необходимо, чтобы произошло расщепление его ядра на отдельные нуклоны. Поскольку ядра удерживаются так называемым сильным взаимодействием, требуется большое количество энергии, чтобы их расщепить.
Чтобы высчитать энергию связи ядра, необходимо знать массу субатомных частиц. Известно, что масса покоя ядра меньше суммарной массы нуклонов в его составе. Разницу между массами ядра и суммами его нуклонов называют дефектом масс.
Дефект массы трития, как и других ядер, рассчитывается по формуле:
Z - число протонов;
N - число нейтронов;
mp - масса протона;
mn - масса нейтрона;
Удельная энергия связи для элемента трития составляет 2 827,2 кэВ на нуклон.
Тритий в природе
Количество этого изотопа в природе является ничтожным. Связано это с его радиоактивностью, то есть нестабильностью ядра.
В природе он вырабатывается в основном в верхних слоях атмосферы. Его формирование осуществляется при сталкивании частиц космических лучей с ядрами атомов, например, азота. Поскольку тритий образуется в атмосфере, его источники на Земле - осадки (дождь и снег).
По подсчетам ученых, в чистом виде трития на Земле содержится едва ли более 1 кг. Поэтому его вырабатывают искусственно, в лабораторных условиях.

Производство трития
В настоящее время получение данного изотопа не представляет трудностей, но является чрезвычайно дорогостоящим процессом. Для изготовления одного килограмма вещества требуются затраты в размере 30 млн долларов.
В качестве сырья используют чаще всего литий. Реже - бериллий или бор. Литий подвергают нейтронному облучению на циклотроне. Затем его растворяют в воде, получая водород, в составе которого имеется тритий. Половина лития приходит в негодность в результате этого процесса и отравляется в утиль.
Для получения водорода с тритием из бериллия и бора их обрабатывают серной кислотой.
Еще одним способом получения изотопа является облучение тяжелой воды дейтронами. Тяжелая вода - вещество, образующееся из дейтерия (другое название - оксид дейтерия). После облучения такую воду подвергают электролизу и затем извлекают тритий.
В настоящее время элемент производится в основном на территории США, Канады и России.

Радиоактивность
Тритий является радиоактивным. При его распаде выделяется бета-излучение, представляющее собой поток электронов.
При внешнем облучении организма тритий не наносит серьезного вреда. Однако при попадании внутрь с водой, пищей или воздухом он может нанести существенный ущерб здоровью. Дело в том, что являясь изотопом водорода, тритий способен замещать его в химических соединениях. Таким образом, он попадает внутрь живых клеток и встраивается в их структуру. Это сказывается на генетической информации клетки.
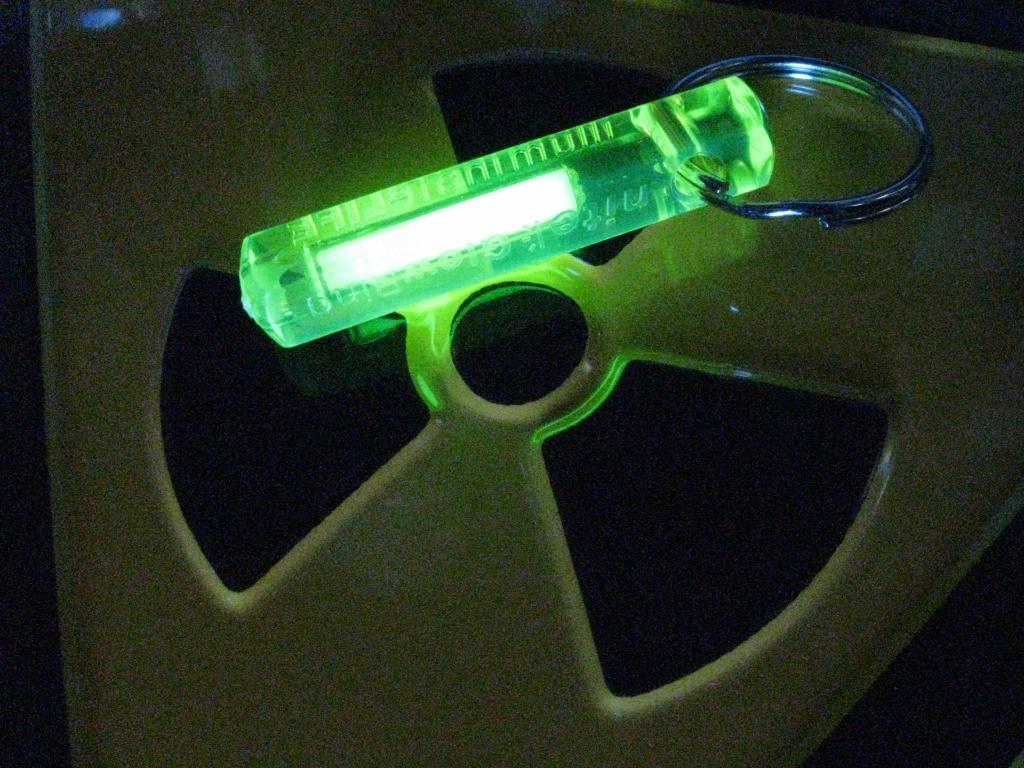
Как было сказано, в природе тритий практически не встречается, поэтому едва ли может нанести вред живым организмам. Однако предприятия атомной промышленности становятся источником искусственной выработки этого изотопа. Атомные электростанции выбрасывают тритий в жидком и газообразном состоянии. Причина этого в том, что изотоп практически не фильтруется. В год на АЭС образуется до 4 кг трития. Результатом выбросов становится радиоактивное загрязнение почвы, воздуха и воды. Таким образом, он является потенциальным источником заражения живых организмов. Именно поэтому тритий был занесен в список контролируемых параметров при оценке качества питьевой воды.
Применение
Основное направление использования трития - атомная промышленность. Дело в том, что реакция слияния дейтерия и трития приводит к управляемому термоядерному синтезу. Энергия связи трития настолько велика, что в ходе термоядерных реакций вырабатывается в огромном количестве, в разы больше, чем при реакциях распада атомных ядер, поэтому управляемые термоядерные реакции могут стать главным источником энергии на Земле на многие годы. В связи с этим ученые в настоящее время работают над строительством термоядерного реактора, в котором процессы синтеза ядер происходили бы в крупных масштабах. Наиболее известный проект такого реактора - строящийся в настоящее время ITER (ИТЭР) во Франции.

Производство трития может успешно применяться для военных целей, например, при создании термоядерного оружия.
С использованием трития изготавливаются специальные светящиеся краски. Это обусловлено радиолюминесценцией - явлением свечения элемента при радиоактивном распаде. Светящиеся краски наносят на шкалы приборов, а также используются для изготовления брелоков и часов. Количество трития в них не настолько велико, чтобы нести угрозу для здоровья.
Тритий применяется в качестве индикатора химических реакций.
Наконец, этот изотоп используется для определения возраста объектов, которым не более 100 лет, например, вин.
Тритий
Три́тий (др.-греч. τρίτος «третий»), сверхтяжёлый водород, обозначается символами T и 3 H — радиоактивный изотоп водорода. Ядро трития состоит из протона и двух нейтронов, его называют тритоном и обозначают t.
В природе тритий образуется в верхних слоях атмосферы при соударении частиц космического излучения с ядрами атомов, например, азота. В процессе распада тритий превращается в 3 He с испусканием электрона и антинейтрино (бета-распад), период полураспада — 12,32 года. Доступная энергия распада очень мала (18,59 кэВ), средняя энергия электронов 6,5 кэВ.
Тритий открыт английскими учёными Эрнестом Резерфордом, Маркусом Олифантом и Паулем Хартеком в 1934 году. Используется в биологии и химии как радиоактивная метка, в экспериментах по исследованию свойств нейтрино, в термоядерном оружии как источник нейтронов и одновременно термоядерное горючее, в геологии для датирования природных вод. Промышленный тритий получают облучением лития-6 нейтронами в ядерных реакторах по следующей реакции:
^_Li> + \mathrm^_n> \rightarrow \mathrm^_H> + \mathrm^_He>" />
.
Содержание
Радиационная опасность трития
В силу малой энергии распада трития, испускаемые электроны хорошо задерживаются даже простейшими преградами типа одежды или резиновых хирургических перчаток. Тем не менее, этот изотоп представляет радиационную опасность при вдыхании, поглощении с пищей, впитывании через кожу. Единичный случай употребления тритиевой воды не приводит к длительному накоплению трития в организме, так как его период полувыведения — от 7 до 14 дней [3] [4] .
Интересные факты


- Производство одного килограмма трития обходится в 30 млн долларов [5] .
- Используется в источниках света.
Примечания
- ↑ 1234 G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ 12 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑Backgrounder on Tritium, Radiation Protection Limits, and Drinking Water Standards (англ.) . U.S.NRC (февраль 2011). Архивировано из первоисточника 14 октября 2012.Проверено 5 октября 2012.
- ↑R. V. OsborneReview of the Greenpeace report: «Tritium Hazard Report: Pollution and Radiation Risk from Canadian Nuclear Facilities» (англ.) (pdf). Canadian Nuclear Association (август 2007). Архивировано из первоисточника 14 октября 2012.Проверено 5 октября 2012.
- ↑BBC News — Is fusion power really viable?
Ссылки
Стабильные: 1 H: Протий, D, 2 H: Дейтерий
10—10 000 лет: T, 3 H: Тритий
Нестабильные (менее суток): 4 H: Водород-4, 5 H: Водород-5, 6 H: Водород-6, 7 H: Водород-7
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Тритий" в других словарях:
ТРИТИЙ, Т — ТРИТИЙ, Т, радиоактивный тяжелый изотоп водорода с массовым числом 3, период полураспада 12,35 года; газ, tкип 250,23шC. Тритий используют в термоядерном синтезе, как изотопный индикатор и др.; входит в состав термоядерного заряда. Открыт… … Современная энциклопедия
Тритий — ТРИТИЙ, Т, радиоактивный тяжелый изотоп водорода с массовым числом 3, период полураспада 12,35 года; газ, tкип 250,23°C. Тритий используют в термоядерном синтезе, как изотопный индикатор и др.; входит в состав термоядерного заряда. Открыт… … Иллюстрированный энциклопедический словарь
ТРИТИЙ — (лат. Tritium от греч. tritos третий), Т, 3Н, сверхтяжелый радиоактивный изотоп водорода с массовым числом 3. Ядро атома состоит из протона и 2 нейтронов; период полураспада 12,35 года. Открыт английскими учеными Э. Резерфордом, М. Л. Олифантом и … Большой Энциклопедический словарь
ТРИТИЙ — (символ Т), радиоактивный изотоп водорода, ядро которого состоит из одного протона и двух нейтронов. В природе на 1017 атомов водорода приходится только один атом трития. Соединения трития используются как изотопный индикатор при радиоактивном… … Научно-технический энциклопедический словарь
ТРИТИЙ — (Tritium), Т, 3 Н радиоакт. сверхтяжёлый радионуклид водорода с массовым числом 3. Ядро Т. состоит из одного протона и двух нейтронов и наз. тритоном. Т. b излучатель, Т 1/2 = 12,35 года. Природный Т. образуется, напр., при бомбардировке азота… … Физическая энциклопедия
тритий — (Н3) – сверхтяжелый радиоактивный изотоп водорода с массовым числом 3. Широко используется в качестве радиоактивной метки в биол. исследованиях. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
тритий — сущ., кол во синонимов: 2 • водород (10) • изотоп (7) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Тритий — Т Tritium «тяжелый» изотоп водорода с атомной массой 3. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
ТРИТИЙ — сверхтяжёлый радиоактивный (см.) водорода с массовым числом 3; символ Т или 3Н. Период полураспада 12,262 года; при распаде испускает мягкие бета частицы. Т. используют как горючее в термоядерных бомбах и в ядерной энергетике. Кроме того, он… … Большая политехническая энциклопедия
ТРИТИЙ
ТРИТИЙ – (сверхтяжелый водород), один из изотопов водорода, в ядре которого содержатся один протон и два нейтрона. Радиоактивен, период полураспада – 12,26 года; при бета-распаде превращается в гелий-3. Температура плавления – 252,2° С, температура кипения – 248,1° С.
В погоне за тритием.
Почти сразу же после открытия дейтерия (см. ДЕЙТЕРИЙ И ТЯЖЕЛАЯ ВОДА) начались поиски в природе трития – третьего сверхтяжелого изотопа водорода, в ядре которого помимо одного протона есть два нейтрона. Физикам было очевидно, что если тритий есть в обычном водороде, он будет концентрироваться вместе с дейтерием. Поэтому сразу несколько групп исследователей, которые наладили получение тяжелой воды или имели доступ к ней, включились в погоню за новым изотопом, используя для поисков разные методы. Впоследствии обнаружилось, что почти все методы принципиально не могли дать положительных результатов, так как не обладали нужной чувствительностью.
Уже в первой работе Г.Юри, в которой был открыт дейтерий, была сделана попытка обнаружить и тритий – точно таким же образом, по заранее предсказанному теорией положению спектральных линий. Однако на спектрограммах не было даже намека на эти линии, что, в общем, не удивило исследователей. Если дейтерия в обычном водороде всего сотые доли процента, то вполне вероятно, что трития намного меньше. Вывод был ясен: надо увеличивать как чувствительность анализа, так и степень обогащения водорода его тяжелыми изотопами.
В начале 1933 известный американский физикохимик, автор теории электронных пар Гилберт Льюис совместно с химиком Франком Спеддингом повторил опыт Юри. На этот раз в распоряжении исследователей был сильно обогащенный образец, содержащий 67% дейтерия. Такой образец уже при 2-минутной экспозиции в спектрографе давал на фотопластинке четкие линии дейтерия. Но и за 40 часов экспозиции то место на пластинке, где по теории должны были проявиться линии трития, оставалось совершенно чистым. Это означало, что содержание в обычном водороде трития по крайней мере меньше, чем 1:6·10 6 , т.е. менее одного атома 3 H на 6 миллионов атомов 1 H. Отсюда был сделан такой вывод: надо брать еще более концентрированные образцы, то есть подвергать электролизу уже не обычную воду для накопления D2O, а тяжелую воду для накопления Т2О (или, по крайней мере, DТО). На практике это означало, что исходной тяжелой воды надо было взять столько, сколько раньше брали обычной воды для получения тяжелой!
После неудач спектроскопистов в поиски включились специалисты по масс-спектрометрии. Этот чрезвычайно чувствительный метод позволяет анализировать ничтожные количества вещества в виде ионов. Для опытов воду сконцентрировали в 225 тысяч раз. Исследователи надеялись найти в образце ионы (DT) + с массой 5. Ионы с такой массой были обнаружены, но оказалось, что они принадлежат трехатомным частицам (НDD) + , без какого-либо участия трития. Стало очевидным, что трития, если он и присутствует в природе, намного меньше, чем думали раньше: не больше, чем 1:5·10 8 , то есть уже 1 атом Т на 500 миллионов атомов Н!
Синтез трития.
В 1933 лабораторию в Кембридже посетил Г.Льюис из Беркли, который подарил Резерфорду три крошечные стеклянные ампулки почти чистой тяжелой воды. Их общий объем был всего 0,5 мл. Олифант получил из этой воды немного чистого дейтерия, который служил для получения пучков ионов D + , разгонявшихся в разрядной трубке до высоких энергий. А Хартек синтезировал соединения, в которых атомы водорода были частично заменены атомами дейтерия. Так были получены ничтожные количества «утяжеленного» хлорида аммония путем обменных реакций NH4Cl + D2O NH3DCl + HDO, NH3DCl + D2O NH2D2Cl + HDO и т.д. При бомбардировке дейтерированного хлорида аммония разогнанными ионами D + наблюдался очень интенсивный поток новых частиц. Как оказалось, это были ядра нового изотопа водорода – трития (их назвали тритонами). Стало очевидным также, что впервые в истории удалось наблюдать ядерный синтез: два атома дейтерия, сливаясь вместе, образовывали неустойчивое ядро гелия-4, которое затем распадалось с образованием трития и протона: 4 He ® 3 H + 1 H.
В том же году Резерфорд уже демонстрировал новые ядерные превращения на своих лекциях: счетчик частиц был соединен через усилитель с громкоговорителем, так что в аудитории раздавались громкие щелчки, которые по мере повышения напряжения на разрядной трубке становились все чаще. При этом на каждый миллион дейтериевых «снарядов», попадающих в мишень, получался один атом трития – это очень много для ядерных реакций такого типа.
Итак, первый тритий был получен искусственно, в результате ядерных реакций. Вопрос о существовании его в природе оставался открытым. Искусственный синтез трития в Кембридже только подхлестнул исследователей, проводивших концентрирование тяжелой воды во все больших и больших масштабах в надежде найти тритий в природном источнике. Так, физики и химики из Принстонского университета, объединив усилия, в 1935 подвергли электролизу уже 75 тонн воды – почти две железнодорожные цистерны! В результате титанических усилий была получена крохотная ампула с остатком обогащенной воды объемом всего 0,5 мл. Это было рекордное концентрирование – в 150 миллионов раз! Масс-спектральный анализ этого остатка не дал ничего нового – в спектре по-прежнему присутствовал пик, отвечающий массе 5, который был приписан ионам (DT) + , а оценка содержания трития в природе с учетом огромного концентрирования дала отношение Т:Н ~ 7:10 10 , то есть не больше одного атома Т на 70 миллиардов атомов Н.
Таким образом, для обнаружения трития надо было еще больше увеличить степень концентрирования воды. Но это требовало уже гигантских затрат. К решению проблемы подключили самого Резерфорда. Используя свой огромный авторитет, он обратился с личной просьбой к норвежцам, чтобы они провели невиданный доселе по масштабам эксперимент: получили бы тяжелую воду, сконцентрировав обычную в миллиард раз! Сначала было подвергнуто электролизу 13 000 тонн обычной воды, из которых получили 43,4 кг тяжелой воды с содержанием D2O 99,2%. Далее это количество путем почти 10-месячного электролиза уменьшили до 11 мл. Условия электролиза были выбраны так, чтобы способствовать концентрированию предполагаемого трития. Таким образом, из 13 тысяч тонн воды (а это 5 железнодорожных составов по 50 цистерн в каждом!) была получена всего одна пробирка обогащенной воды. Мир не знал еще столь грандиозных опытов!
Возникла проблема, как лучше всего поступить с этим драгоценным образцом. Вероятно, единственным человеком в мире, способным непосредственно различить в масс-спектрометре очень близкие по массе ионы (DT) + и «маскирующиеся» под них ионы (DDH) + , был нобелевский лауреат Ф.У.Астон – выдающийся специалист в области масс-спектрометрического анализа. Именно ему было решено передать образец для анализа. Результат был обескураживающим: не было никаких следов присутствия ионов DT + ! Соответственно оценка отношения T:H было снижено до 1:10 12 . Стало очевидным, что если тритий и присутствует в природных источниках, то в таких ничтожных количествах, что его выделение из них сопряжено с неимоверными, если вообще преодолимыми трудностями.
Обнаружение природного трития.
Может ли тритий быть радиоактивным? Уже Резерфорд после неудачи со своим грандиозным опытом не исключал такой возможности. Расчеты также говорили о том, что ядро трития должно быть нестабильным и, следовательно, он должен быть радиоактивным. Именно радиоактивностью трития со сравнительно небольшим временем жизни можно было объяснить ничтожные его количества в природе. Действительно, вскоре радиоактивности у трития была обнаружена экспериментально. Конечно, это был искусственно полученный тритий. В течение 5 месяцев не было заметно спада радиоактивности. Из этого следовало, с учетом точности экспериментов, что период полураспада трития не меньше 10 лет. Современные измерения дают для периода полураспада трития 12,262 года.
При распаде тритий испускает бета-частицы, превращаясь в гелий-3. Энергия излучения трития настолько мало, что оно не может пройти даже через тоненькую стенку счетчика Гейгера. Поэтому анализируемый на присутствие трития газ необходимо запускать внутрь счетчика. С другой стороны, малая энергия излучения имеет свои преимущества – с соединениями трития (если они нелетучи) работать не опасно: испускаемые им бета-лучи проходят в воздухе всего несколько миллиметров.
Для отработки методов анализа трития потребовались значительные его количества. Поэтому стали появляться новые способы его синтеза, например, 9 Be + 2 H ® 8 Be + 3 H, 6 Li + 1 n ® 4 He + 3 H и другие. А точность анализа чрезвычайно повысилась. Стало возможным, например, анализировать образцы, в которых происходил всего один распад атома трития в секунду – в таком образце трития содержится меньше, чем 10 –15 моль! Теперь в руках физиков был исключительно чувствительный метод анализа – в довоенные годы он был примерно в миллион раз чувствительнее, чем масс-спектрометрический. Настало время вернуться к поискам трития в природных источниках.
Тритий в природе.
В 1946 известный авторитет в области ядерной физики, лауреат Нобелевской премии У.Ф.Либби предположил, что тритий непрерывно образуется в результате идущих в атмосфере ядерных реакций. Первые измерения радиоактивности природного водорода, хотя и были неудачными, показали, что отношение Н:Т на 5 порядков меньше, чем думали раньше и составляет не более 1:10 17 . Стала очевидной невозможность обнаружения трития масс-спектрометрически даже при самых больших обогащениях: к началу 50-х годов масс-спектрометры позволяли определять концентрации примесей при их содержании не менее 10 –4 %.
В 1951 группа американских физиков из Чикагского университета с участием У.Либби достала хранившуюся «резерфордовскую» ампулу с 11 мл сверхобогащенной тяжелой воды, в которой Астон когда-то пытался обнаружить тритий масс-спектрометрически. И хотя с момента выделения этого образца из природной воды прошло полтора десятка лет и от содержащегося в нем трития осталось меньше половины, результат не заставил себя ждать: тяжелая вода была радиоактивна! Измеренная активность с учетом обогащения при получении образца соответствовала природному содержанию трития 1:10 18 .
Чтобы застраховаться от возможной ошибки, решили повторить все с самого начала, тщательно следя за каждым шагом этого решающего эксперимента. Авторы попросили норвежскую компанию приготовить еще несколько образцов обогащенной воды. Воду взяли из горного озера на севере Норвегии в январе 1948. Из нее путем электролитического концентрирования получили 15 мл тяжелой воды. Ее перегнали и ввели в реакцию с оксидом кальция: СаО + D2O ® Ca(OD)2. Восстановлением цинком при температуре красного каления из дейтероксида кальция получили дейтерий: Ca(OD)2 + Zn ® CaZnO2 + D2. Масс-спектрометрический анализ показал, что получен чистейший дейтерий, который и запустили в счетчик Гейгера для измерения его радиоактивности. Газ оказался радиоактивным, а это означало, что вода, из которой был выделен дейтерий, содержала тритий. Аналогично было приготовлено и проанализировано еще несколько образцов, чтобы уточнить, сколько же трития содержится на самом деле в природном водороде.
Исключительная тщательность работы не оставляла никаких сомнений в полученных результатах. Но еще за год до окончания этой работы вышла статья Ф.Фалтингса и того же П.Хартека из Физико-химического института при Гамбургском университете, в которой сообщалось об обнаружении трития в атмосферном водороде. Таким образом, Хартек дважды участвовал в открытии трития: сначала – искусственного, а через 16 лет – природного.
Воздух – не самый богатый источник водорода – его в нем всего 0,00005% (на уровне моря). Поэтому по заказу немецких физиков фирма «Линде» переработала сто тысяч кубометров воздуха, из которого путем сжижения и ректификации был выделен водород, а из него окислением на оксиде меди получено 80 г воды. С помощью электролиза эта вода была сконцентрирована в несколько десятков раз, затем ею был «погашен» карбид кальция: CaC2 + 2H2O ® Ca(OH)2 + С2H2, а ацетилен прогидрирован оставшимся водородом до этана: С2Н2 + 2Н2 ® С2Н6. Полученный этан, в который переходил весь исходный тритий, затем анализировали на радиоактивность. Расчет показал, что в воздухе трития (в виде молекул НТ) исключительно мало: в 20 куб. см воздуха содержится одна молекула трития, т.е. во всей атмосфере его должно быть всего. 1 моль или 3 г. Однако если учесть, что водорода в воздухе исключительно мало, то получается, что атмосферный молекулярный водород обогащен тритием в 10 000 раз больше, чем водород в составе дождевой воды. Отсюда следовало, что свободный и связанный водород в атмосфере имеют разное происхождение. Подсчет показал также, что во всех водоемах Земли трития содержится всего лишь 100 кг.
Значение, полученное в Чикаго для содержания трития в воде (Н:Т = 1:10 18 ), стало общепринятым. Такое содержание атомов трития получило даже специальное название – «тритиевая единица» (ТЕ). В 1 л воды в среднем содержится 3,2·10 –10 г трития, в 1 л воздуха – 1,6·10 –14 г (при абсолютной влажности 10 мг/л). Образуется тритий в верхних слоях атмосферы с участием космического излучения со скоростью 1200 атомов в секунду в расчете на 1 м 2 земной поверхности. Таким образом, в течение тысячелетий содержание трития в природе было почти постоянным – непрерывное его образование в атмосфере компенсировалось естественным распадом. Однако с 1954 (начало испытаний термоядерных бомб) положение резко изменилось и в дождевой воде содержание трития увеличилось в тысячи раз. И это не удивительно: взрыв водородной бомбы мощностью 1 мегатонна (Мт) приводит к выделению от 0,7 до 2 кг трития. Общая мощность воздушных взрывов составила за 1945–1962. 406 Мт, а наземных – 104 Мт. При этом общее количество трития, поступившее в биосферу в результате испытаний, составило сотни килограммов! После прекращения наземных испытаний уровень трития пошел на убыль. В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
Современные радиохимические методы позволяют с большой точностью определять содержание трития в сравнительно небольшом количестве воды, взятой из того или иного источника. Для чего это нужно? Оказывается, радиоактивный тритий с весьма удобным временем жизни – чуть больше 10 лет – может дать много ценной информации. У.Либби назвал тритий «радиоводородом», по аналогии с радиоуглеродом. Тритий может служить прекрасной меткой для изучения различных природных процессов. С его помощью можно определять возраст растительных продуктов, например, вин (если им не больше 30 лет), поскольку виноград поглощает тритий из почвенных вод, а после снятия урожая содержание трития в виноградном соке начинает снижаться с известной скоростью. Сам Либби провел множество подобных анализов, переработав сотни литров различных вин, поставленных ему виноделами из разных местностей. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.
Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, поэтому осадки, например, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного. Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, например, в воздухе над океаном этот срок составляет в среднем 9 дней.
Запасы природного трития ничтожны. Поэтому весь тритий, используемый для различных целей, получают искусственно, путем облучения лития нейтронами. В результате стало возможным получить значительные количества чистого трития и изучить его свойства, а также свойство его соединений. Так, сверхтяжелая вода Т2О имеет плотность 1,21459 г/см 3 . Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Например, сульфид цинка, содержащий небольшое количество соединений трития (примерно 0,03 мг на 1 г светосостава), непрерывно излучает зеленый свет. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу (12%). Интересно, что газообразный Т2 в 500 раз менее токсичен, чем сверхтяжелая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации. В среднем организм человека содержит 5·10 –12 г трития, что дает вклад 0,13 мбэр в общую дозу годового облучения (это в сотни раз меньше облучения от других источников радиации). Интересно, что у людей, носящих часы, в которых стрелки и цифры покрыты тритиевым люминофором, содержание трития в теле в 5 раз выше среднего.
А еще тритий является одним из основных компонентов взрывчатого вещества термоядерных (водородных) бомб, а также весьма перспективен для проведения управляемой термоядерной реакции по схеме D + T > 4 He + n.
Структура, свойства и использование трития
тритий это имя, которое было дано одному из изотопов химического элемента водорода, символ которого обычно Т или 3 Н, хотя его еще называют водородом-3. Это широко используется в большом количестве приложений, особенно в ядерной области.
Кроме того, в 1930-х годах этот изотоп возник впервые, начиная с бомбардировки частицами высокой энергии (так называемыми дейтронами) другого изотопа того же элемента, называемого дейтерием, благодаря ученым П. Хартеку, М. Л. Олифанту и Э. Резерфорду.

Эти исследователи не добились успеха в выделении трития, несмотря на их испытания, которые дали конкретные результаты в руках Корнога и Альвареса, в свою очередь обнаружив радиоактивные свойства этого вещества..
На этой планете производство трития крайне редко встречается в природе и происходит только в таких малых пропорциях, что следы рассматриваются посредством атмосферных взаимодействий с космическим излучением..
- 1 структура
- 1.1 Некоторые факты о тритии
структура
Когда мы говорим о структуре трития, первое, что следует отметить, это его ядро, которое имеет два нейтрона и один протон, что придает ему массу, в три раза превышающую массу обычного водорода..
Этот изотоп имеет физические и химические свойства, которые отличают его от других видов изотопов от водорода, несмотря на его структурное сходство.
Помимо атомного веса или массы около 3 г, это вещество проявляет радиоактивность, кинетические характеристики которой показывают период полураспада приблизительно 12,3 года..
На верхнем изображении сравниваются структуры трех известных изотопов водорода, которые называются протий (наиболее распространенные виды), дейтерий и тритий..
Структурные характеристики трития позволяют ему сосуществовать с водородом и дейтерием в воде, которая исходит от природы, образование которой возможно связано с взаимодействием между космическим излучением и азотом атмосферного происхождения..
В этом смысле это вещество присутствует в воде природного происхождения в пропорции 10 -18 по отношению к обычному водороду; то есть крошечное изобилие, которое можно распознать только как следы.
Несколько фактов о тритии
Несколько способов производства трития были исследованы и использованы из-за их высокого научного интереса из-за радиоактивных свойств и использования энергии, которую они представляют..
Таким образом, следующее уравнение показывает общую реакцию, которую производит этот изотоп, от бомбардировки атомов дейтерия дейтронами высокой энергии:
Точно так же это может быть осуществлено как экзотермическая или эндотермическая реакция посредством процесса, называемого нейтронной активацией определенных элементов (таких как литий или бор), и в зависимости от обрабатываемого элемента.
В дополнение к этим методам, тритий редко может быть получен в результате ядерного деления, которое состоит из деления ядра атома, считающегося тяжелым (в данном случае изотопы урана или плутония), для получения двух или более ядер второстепенных размер, производя огромное количество энергии.
В этом случае получение трития дается как побочный продукт или побочный продукт, но это не является целью этого механизма..
За исключением процесса, который был ранее описан, все эти процессы производства этого изотопного вида осуществляются в ядерных реакторах, в которых контролируются условия каждой реакции.
свойства
- Он производит огромное количество энергии, когда он исходит из дейтерия.
- Представляет свойства радиоактивности, которая продолжает вызывать научный интерес к исследованиям ядерного синтеза.
- Этот изотоп представлен в его молекулярной форме как T2 или 3 H2, чей молекулярный вес составляет около 6 г.
- Подобно протию и дейтерию, это вещество с трудом удерживается.
- Когда этот вид соединяется с кислородом, образуется оксид (представленный как T2O) который находится в жидкой фазе и широко известен как сверхтяжелая вода.
- Он способен испытывать слияние с другими видами света легче, чем это проявляется обычным водородом..
- Он представляет опасность для окружающей среды, если он используется массово, особенно в реакциях процессов синтеза.
- Это может сформировать с кислородом другое вещество, известное как полупроницаемая вода (представленный как HTO), которое является также радиоактивным.
- Он считается генератором частиц низкой энергии, известным как бета-излучение..
- Когда были случаи потребления тритиевой воды, наблюдалось, что их средняя продолжительность жизни в организме сохраняется в диапазоне от 2,4 до 18 дней, выделяется позже.
приложений
В число применений трития входят процессы, связанные с ядерными реакциями. Ниже приведен список наиболее важных применений:
- В области радиолюминесценции тритий используется для производства приборов, которые обеспечивают освещение, особенно ночью, в различных устройствах для коммерческого использования, таких как часы, ножи, огнестрельное оружие, среди прочего, посредством самоподачи..
- В области ядерной химии реакции этого типа используются в качестве источника энергии при изготовлении ядерного и термоядерного оружия, в дополнение к тому, что они используются в сочетании с дейтерием для контролируемых процессов ядерного синтеза..
- В области аналитической химии этот изотоп может использоваться в процессе радиоактивного мечения, когда тритий помещается в конкретный вид или молекулу, и его можно отслеживать для исследований, которые вы хотите практиковать таким образом..
- В случае биологической среды тритий используется в качестве индикатора переходного типа в океанических процессах, что позволяет исследовать эволюцию океанов на Земле в физических, химических и даже биологических полях..
- Среди других применений, этот вид был использован для изготовления атомной батареи для производства электрической энергии.
Читайте также:
