У металлов электроотрицательность как правило
Обновлено: 17.05.2024
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).

Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.

Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
- Таблица Менделеева.
- Шкала Малликена.
- Шкала Полинга.
- Шкала Олреда-Рохова.
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
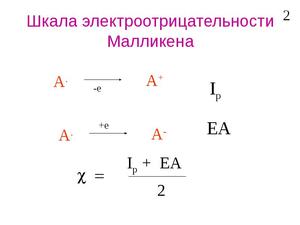
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
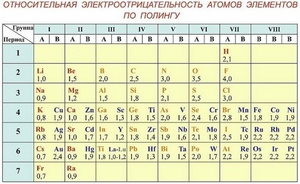
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
- хлор (3,16);
- азот (3,04);
- бром (2,96);
- йод (2,66);
- ксенон (2,60);
- и так далее.
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
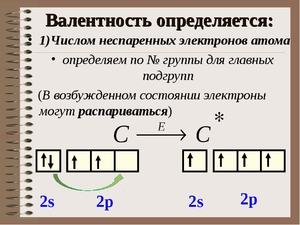
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
- У щелочного металла натрия на внешней оболочке всего только один электрон, принимающий участие в химической связи между элементами. Исходя из этого, мы определяем, что он одновалентен.
- У щелочноземельного металла на внешней оболочке уже два электрона. Это означает, что его валентность равна двум.
- У амфотерного металла алюминия ровно три электрона на внешней оболочке. Его валентность так же, как и у предыдущих элементов, соответствует этому числу.
- У кремния четыре электрона, он четырехвалентен.
- Фосфор может образовывать различные связи и иметь разные валентности, но высшая валентность фосфора равна пяти.
- Сера точно так же, как и фосфор, может иметь разные валентности, но высшая равняется шести.
- Возьмем хлор. Когда, к примеру, он состоит в молекуле соляной кислоты (HCl), он находится в одновалентном состоянии. А вот в молекуле хлорной кислоты (HClO4) он сразу же становится семивалентным.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
- кобальт;
- платина;
- палладий;
- родий;
- иридий.
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Таблица электроотрицательности химических элементов

Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.
Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.

Рис. 1. Действия окислителя и восстановителя в реакциях.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента
Элемент
Символ
Электроотрицательность
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

Рис. 2. Ряд электроотрицательности.
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
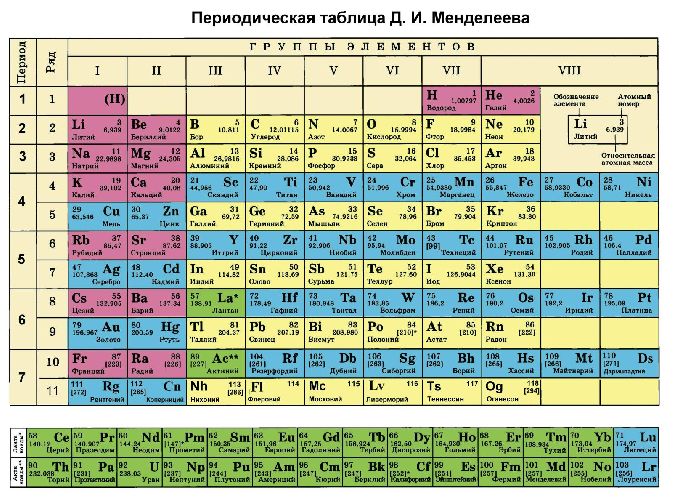
Рис. 3. Таблица Менделеева.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Электроотрицательность химических элементов

При взаимодействии элементов образуются электронные пары за счёт принятия или отдачи электронов. Способность атома оттягивать электроны была названа Лайнусом Полингом электроотрицательностью химических элементов. Полинг составил шкалу электроотрицательности элементов от 0,7 до 4.
Что такое электроотрицательность?
Электроотрицательность (ЭО) – количественная характеристика элемента, показывающая, с какой силой притягиваются электроны ядром атома. ЭО также характеризует способность удерживать валентные электроны на внешнем энергетическом уровне.
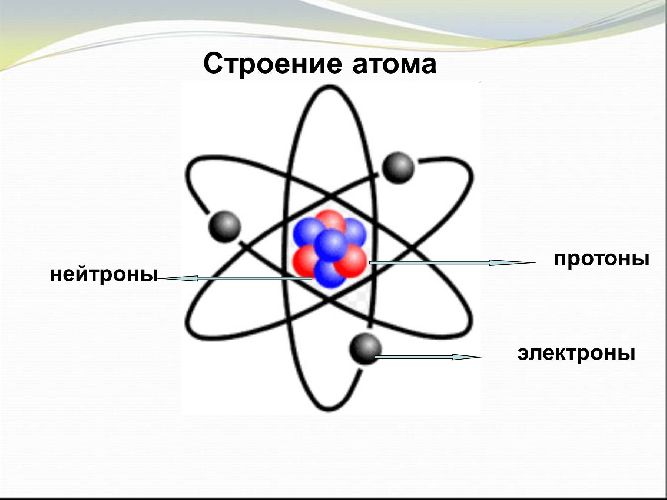
Рис. 1. Строение атома.
Возможность отдавать или принимать электроны определяет принадлежность элементов к металлам или неметаллам. Ярко выраженными металлическими свойствами обладают элементы, легко отдающие электроны. Элементы, принимающие электроны проявляют неметаллические свойства.
Электроотрицательность проявляется в химических соединениях и показывает смещение электронов в сторону одного из элементов.
Электроотрицательность увеличивается слева направо и уменьшается сверху вниз в периодической таблице Менделеева.
Как определить
Определить значение можно с помощью таблицы электроотрицательности химических элементов или шкалы Полинга. За единицу принята электроотрицательность лития.
Наибольшей ЭО обладают окислители и галогены. Значение их электроотрицательности больше двух. Рекордсменом является фтор с электроотрицательностью 4.

Рис. 2. Таблица электроотрицательности.
Наименьшую ЭО (меньше двух) имеют металлы первой группы периодической таблицы. Активными металлами считаются натрий, литий, калий, т.к. им легче расстаться с единственным валентным электроном, чем принять недостающие электроны.
Некоторые элементы занимают промежуточное положение. Их электроотрицательность близка к двум. Такие элементы (Si, B, As, Ge, Te) проявляют металлические и неметаллические свойства.
Для удобства сравнения ЭО используется ряд электроотрицательности элементов. Слева располагаются металлы, справа – неметаллы. Чем ближе к краям, тем активнее элемент. Самый сильным восстановителем, легко отдающим электроны и имеющим наименьшую электроотрицательность, является цезий. Активным окислителем, способным притягивать электроны, является фтор.

Рис. 3. Ряд электроотрицательности.
В неметаллических соединениях притягивают электроны элементы с большей ЭО. Кислород с электроотрицательностью 3,5 притягивает атомы углерода и серы с электроотрицательностью 2,5.
Что мы узнали?
Электроотрицательность показывает степень удержания ядром атома валентных электронов. В зависимости от значения ЭО элементы способны отдавать или принимать электроны. Элементы с большей электроотрицательностью оттягивают электроны и проявляют неметаллические свойства. Элементы, атомы которых легко отдают электроны, обладают металлическими свойствами. Некоторые элементы имеют условно нейтральную ЭО (около двух) и могут проявлять металлические и неметаллические свойства. Степень ЭО увеличивается слева направо и снизу вверх в таблице Менделеева.
Электроотрицательность
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s 2 2p 5 ) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
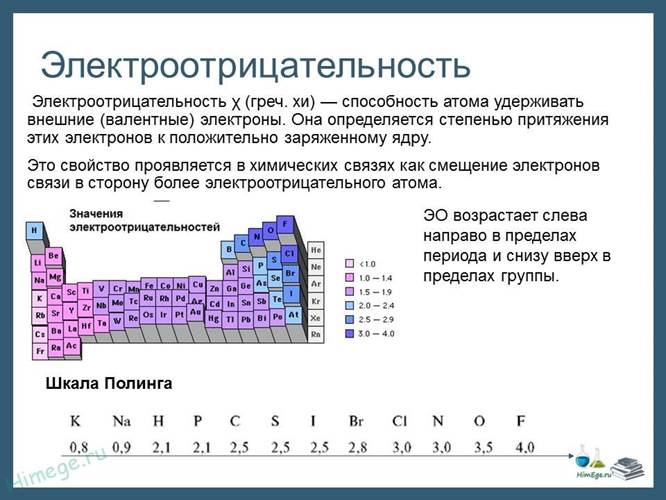
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
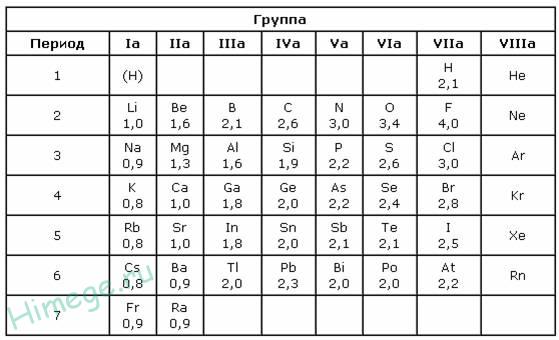
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО)— это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.


При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды. При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl). Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
На этом рисунке изображены степени окисления, характерные для первых 20 элементов.
Обратите внимание. Высшая СО как правило равна номеру группы в таблице Менделеева. У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО. Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
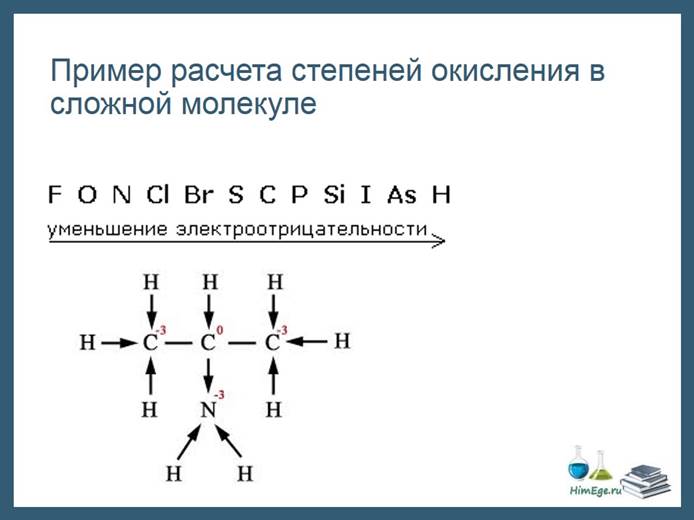
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Читайте также:
