Угольная кислота с металлами
Обновлено: 20.05.2024
При растворении в водной среде углекислый газ образует слабую двухосновную угольную кислоту. Угольная кислота характеризуется наличием ряда органических и неорганических производных: соли, гидрокарбонаты и карбонаты. Соединение является неустойчивым и при обычных условиях не выделяется в свободном состоянии из водных растворов.
Угольной кислотой называют слабую двухосновную кислоту, химическая формула которой имеет вид H 2 C O 3 , образуется в малых количествах в процессе растворения углекислого газа в воде.
С помощью угольной кислоты получают:
- соли (карбонаты и гидрокарбонаты);
- другие более слабые органические и неорганические кислоты (например, кремниевую);
- разнообразные органические производные.
При рассмотрении структурной (графической) формулы угольной кислоты можно сделать вывод о последовательности связей между атомами внутри молекулы:
Молекула угольной кислоты характеризуется плоским строением. Центральный углеродный атом имеет s p 2 -гибридизацию. В гидрокарбонат- и карбонат-анионах можно наблюдать делокализацию π -связи. Длина связи C — O в карбонат-ионе равна 130 пм.
Химическая формула угольной кислоты:
Молекула угольной кислоты включает в состав:
- два атома водорода (Ar = 1 а.е.м.);
- один атом углерода (Ar = 12 а.е.м.);
- три атома кислорода (Ar = 16 а.е.м.).
Исходя из химической формулы, определяют молекулярную массу угольной кислоты:
M r ( H 2 C O 3 ) = 2 × A r ( H ) + A r ( C ) + 3 × A r ( O ) ;
M r ( H 2 C O 3 ) = 2 × 1 + 12 + 3 × 16 = 2 + 12 + 48 = 62
Угольную кислоту формально допустимо рассматривать в виде карбоновой кислоты. При этом гидроксильная группа заменяет углеводородный остаток. В данной форме вещество способно образовывать все производные, которые характерны для карбоновых кислот. Некоторые из подобных соединений:
Угольная кислота, являясь слабым электролитом, обладает способностью в небольшой степени диссоциировать на ионы в водном растворе по уравнению:
H 2 C O 3 ↔ H + + ( H C O 3 ) -
Ионная формула угольной кислоты:
Электронная формула угольной кислоты:
Физические и химические свойства
Физические свойства угольной кислоты:
- безводная угольная кислота имеет вид кристаллического вещества без цвета;
- вещество является устойчивым только при низких температурах;
- температура сублимации кристаллов составляет –30 °C. Если повышение температуры продолжается, кристаллы разлагаются в полной степени;
- молярная масса 62,025 г/моль;
- плотность 1 , 668 г / с м 3 ;
- характеристика растворимости в воде 0,21 г/100 мл.
Угольная кислота может существовать в виде раствора водной среды. При этом вещество уравновешивает гидрат диоксида углерода С О 2 . В данном случае можно наблюдать сдвиг равновесного состояния в достаточно сильной степени в сторону разложения кислоты:
C O 2 · H 2 O ( p ) ⇄ H 2 C O 3 ( p ) C O 2 · H 2 O ( p ) ⇄ H 2 C O 3 ( p )
Постоянная состояния равновесия при температурном режиме в 25 °C:
K p = [ H 2 C O 3 ] [ C O 2 · H 2 O ] = 1 , 70 · 10 - 3 K p = [ H 2 C O 3 ] [ C O 2 · H 2 O ] = 1 , 70 · 10 - 3
Прямая реакция протекает со скоростью 0,039 с−1, обратная — 23 с−1.
С другой стороны, растворенный гидрат диоксида углерода пребывает в состоянии равновесия с газообразным диоксидом углерода С О 2 :
C O 2 · H 2 O ( p ) ⇄ C O 2 ↑ + H 2 O C O 2 · H 2 O ( p ) ⇄ C O 2 ↑ + H 2 O
Рассматриваемое равновесие при нагревании сдвигается в правую сторону, а при повышении давления — в левую сторону.
Угольная кислота является слабым электролитом. Это объясняется тем, что в водном растворе вещество диссоциирует частично, то есть обладает небольшой степенью диссоциации:
H 2 C O 3 + H 2 O ⇄ H C O 3 - + H 3 O + H 2 C O 3 + H 2 O ⇄ H C O 3 - + H 3 O +
Константа кислотности при 25 °C:
K a 1 = [ H C O 3 - ] · [ H 3 O + ] [ H 2 C O 3 ] = 2 , 5 · 10 - 4 K a 1 = [ H C O 3 - ] · [ H 3 O + ] [ H 2 C O 3 ] = 2 , 5 · 10 - 4
Стоит отметить, что на практике при расчетах применяют кажущуюся постоянную кислотности с учетом равновесного состояния угольной кислоты и гидрата диоксида углерода:
K a ' = [ H C O 3 - ] · [ H 3 O + ] [ C O 2 · H 2 O ] = 4 , 27 · 10 - 7 K a ' = [ H C O 3 - ] · [ H 3 O + ] [ C O 2 · H 2 O ] = 4 , 27 · 10 - 7
Гидрокарбонат-ион подвергается дальнейшей диссоциации в соответствии с уравнением реакции:
H C O 3 - + H 2 O ⇄ C O 3 2 - + H 3 O + H C O 3 - + H 2 O ⇄ C O 3 2 - + H 3 O +
Константа кислотности при 25 °C:
K a 2 = [ C O 3 2 - ] · [ H 3 O + ] [ H C O 3 - ] = 4 , 68 · 10 - 11 K a 2 = [ C O 3 2 - ] · [ H 3 O + ] [ H C O 3 - ] = 4 , 68 · 10 - 11
В результате в растворах, которые содержат угольную кислоту, формируется система в равновесном состоянии сложной структуры, которую можно записать в общем виде таким образом:
C O 2 ⇄ H 2 O C O 2 · H 2 O ⇄ H 2 C O 3 ⇄ - H + H C O 3 - ⇄ - H + C O 3 2 - ( * ) C O 2 ⇄ H 2 O C O 2 · H 2 O ⇄ H 2 C O 3 ⇄ - H + H C O 3 - ⇄ - H + C O 3 2 - ( * )
Характеристика водородного показателя pH в рассматриваемой системе, которая соответствует насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., определяют по формуле:
pH ≈ - 1 2 lg ( K a ' · L ) = 3 , 9 p H ≈ - 1 2 lg ( K a ' · L ) = 3 , 9
где L = 0 , 034 моль/л — определяется, как показатель растворимости C O 2 в водной среде при заданных параметрах.
Когда раствор нагревают и/или снижают парциальное давление диоксида углерода, наблюдается смещение равновесия в сторону разложения угольной кислоты на воду и диоксид углерода. В процессе кипения раствора происходит полное разложение угольной кислоты:
H 2 C O 3 ⟶ H 2 O + C O 2 ↑ H 2 C O 3 ⟶ H 2 O + C O 2 ↑
Угольная кислота вступает в реакции нейтрализации с растворами оснований. В результате такого взаимодействия образуются средние и кислые соли в виде карбонатов (например, N a 2 C O 3 ) и гидрокарбонатов (например, N a H C O 3 ):
H 2 C O 3 + 2 N a O H H 2 C O 3 + 2 N a O H
⟶ N a 2 C O 3 + 2 H 2 O ⟶ N a 2 C O 3 + 2 H 2 O
H 2 C O 3 + N a O H H 2 C O 3 + N a O H ( р а з б . )
⟶ N a H C O 3 + H 2 O ⟶ N a H C O 3 + H 2 O
H 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 H 2 O H 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 H 2 O
H 2 C O 3 + N H 3 · H 2 O ⟶ N H 4 H C O 3 + H 2 O H 2 C O 3 + N H 3 · H 2 O ⟶ N H 4 H C O 3 + H 2 O
Химическая реакция угольной кислоты с карбонатами сопровождается образованием гидрокарбонатов:
H 2 C O 3 + N a 2 C O 3 ⟶ 2 N a H C O 3 H 2 C O 3 + N a 2 C O 3 ⟶ 2 N a H C O 3
H 2 C O 3 + C a C O 3 ⟶ C a ( H C O 3 ) 2 H 2 C O 3 + C a C O 3 ⟶ C a ( H C O 3 ) 2
Способы получения и сфера применения
Образование угольной кислоты в процессе растворения в воде диоксида углерода:
C O 2 + H 2 O ⇄ C O 2 · H 2 O ⇄ H 2 C O 3 C O 2 + H 2 O ⇄ C O 2 · H 2 O ⇄ H 2 C O 3
Концентрация угольной кислоты в растворе повышается в условиях понижения температуры раствора и увеличения давления углекислого газа.
Другим способом получения угольной кислоты является взаимодействие ее солей (карбонатов и гидрокарбонатов) с более сильной кислотой. В результате образовавшаяся угольная кислота в большей степени при разложении образует воду и диоксид углерода:
N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 C O 3 N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 C O 3
H 2 C O 3 → H 2 O + C O 2 ↑ H 2 C O 3 → H 2 O + C O 2 ↑
Угольная кислота всегда присутствует в водных растворах углекислого газа.
В области биохимии высоко ценится способность равновесной системы изменять давление углекислого газа С О 2 (диоксида углерода) пропорционально изменению содержания ионов гидроксония H 3 O + (кислотности среды) в условиях постоянной температуры. Данное свойство позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Угольная кислота нашла широкое применение в пищевой промышленности, является важным компонентом в производстве разнообразных шипучих напитков.
Физические и химические свойства угольной кислоты
При растворении в водной среде углекислый газ образует слабую двухосновную угольную кислоту. Угольная кислота характеризуется наличием ряда органических и неорганических производных: соли, гидрокарбонаты и карбонаты. Соединение является неустойчивым и при обычных условиях не выделяется в свободном состоянии из водных растворов.
Угольной кислотой называют слабую двухосновную кислоту, химическая формула которой имеет вид H 2 C O 3 , образуется в малых количествах в процессе растворения углекислого газа в воде.
С помощью угольной кислоты получают:
- соли (карбонаты и гидрокарбонаты);
- другие более слабые органические и неорганические кислоты (например, кремниевую);
- разнообразные органические производные.
При рассмотрении структурной (графической) формулы угольной кислоты можно сделать вывод о последовательности связей между атомами внутри молекулы:
Молекула угольной кислоты характеризуется плоским строением. Центральный углеродный атом имеет s p 2 -гибридизацию. В гидрокарбонат- и карбонат-анионах можно наблюдать делокализацию π -связи. Длина связи C — O в карбонат-ионе равна 130 пм.
Химическая формула угольной кислоты:
Молекула угольной кислоты включает в состав:
- два атома водорода (Ar = 1 а.е.м.);
- один атом углерода (Ar = 12 а.е.м.);
- три атома кислорода (Ar = 16 а.е.м.).
Исходя из химической формулы, определяют молекулярную массу угольной кислоты:
M r ( H 2 C O 3 ) = 2 × A r ( H ) + A r ( C ) + 3 × A r ( O ) ;
M r ( H 2 C O 3 ) = 2 × 1 + 12 + 3 × 16 = 2 + 12 + 48 = 62
Угольную кислоту формально допустимо рассматривать в виде карбоновой кислоты. При этом гидроксильная группа заменяет углеводородный остаток. В данной форме вещество способно образовывать все производные, которые характерны для карбоновых кислот. Некоторые из подобных соединений:
Угольная кислота, являясь слабым электролитом, обладает способностью в небольшой степени диссоциировать на ионы в водном растворе по уравнению:
H 2 C O 3 ↔ H + + ( H C O 3 ) -
Ионная формула угольной кислоты:
Электронная формула угольной кислоты:
Физические и химические свойства
Физические свойства угольной кислоты:
- безводная угольная кислота имеет вид кристаллического вещества без цвета;
- вещество является устойчивым только при низких температурах;
- температура сублимации кристаллов составляет –30 °C. Если повышение температуры продолжается, кристаллы разлагаются в полной степени;
- молярная масса 62,025 г/моль;
- плотность 1 , 668 г / с м 3 ;
- характеристика растворимости в воде 0,21 г/100 мл.
Угольная кислота может существовать в виде раствора водной среды. При этом вещество уравновешивает гидрат диоксида углерода С О 2 . В данном случае можно наблюдать сдвиг равновесного состояния в достаточно сильной степени в сторону разложения кислоты:
C O 2 · H 2 O ( p ) ⇄ H 2 C O 3 ( p ) C O 2 · H 2 O ( p ) ⇄ H 2 C O 3 ( p )
Постоянная состояния равновесия при температурном режиме в 25 °C:
K p = [ H 2 C O 3 ] [ C O 2 · H 2 O ] = 1 , 70 · 10 - 3 K p = [ H 2 C O 3 ] [ C O 2 · H 2 O ] = 1 , 70 · 10 - 3
Прямая реакция протекает со скоростью 0,039 с−1, обратная — 23 с−1.
С другой стороны, растворенный гидрат диоксида углерода пребывает в состоянии равновесия с газообразным диоксидом углерода С О 2 :
C O 2 · H 2 O ( p ) ⇄ C O 2 ↑ + H 2 O C O 2 · H 2 O ( p ) ⇄ C O 2 ↑ + H 2 O
Рассматриваемое равновесие при нагревании сдвигается в правую сторону, а при повышении давления — в левую сторону.
Угольная кислота является слабым электролитом. Это объясняется тем, что в водном растворе вещество диссоциирует частично, то есть обладает небольшой степенью диссоциации:
H 2 C O 3 + H 2 O ⇄ H C O 3 - + H 3 O + H 2 C O 3 + H 2 O ⇄ H C O 3 - + H 3 O +
Константа кислотности при 25 °C:
K a 1 = [ H C O 3 - ] · [ H 3 O + ] [ H 2 C O 3 ] = 2 , 5 · 10 - 4 K a 1 = [ H C O 3 - ] · [ H 3 O + ] [ H 2 C O 3 ] = 2 , 5 · 10 - 4
Стоит отметить, что на практике при расчетах применяют кажущуюся постоянную кислотности с учетом равновесного состояния угольной кислоты и гидрата диоксида углерода:
K a ' = [ H C O 3 - ] · [ H 3 O + ] [ C O 2 · H 2 O ] = 4 , 27 · 10 - 7 K a ' = [ H C O 3 - ] · [ H 3 O + ] [ C O 2 · H 2 O ] = 4 , 27 · 10 - 7
Гидрокарбонат-ион подвергается дальнейшей диссоциации в соответствии с уравнением реакции:
H C O 3 - + H 2 O ⇄ C O 3 2 - + H 3 O + H C O 3 - + H 2 O ⇄ C O 3 2 - + H 3 O +
Константа кислотности при 25 °C:
K a 2 = [ C O 3 2 - ] · [ H 3 O + ] [ H C O 3 - ] = 4 , 68 · 10 - 11 K a 2 = [ C O 3 2 - ] · [ H 3 O + ] [ H C O 3 - ] = 4 , 68 · 10 - 11
В результате в растворах, которые содержат угольную кислоту, формируется система в равновесном состоянии сложной структуры, которую можно записать в общем виде таким образом:
C O 2 ⇄ H 2 O C O 2 · H 2 O ⇄ H 2 C O 3 ⇄ - H + H C O 3 - ⇄ - H + C O 3 2 - ( * ) C O 2 ⇄ H 2 O C O 2 · H 2 O ⇄ H 2 C O 3 ⇄ - H + H C O 3 - ⇄ - H + C O 3 2 - ( * )
Характеристика водородного показателя pH в рассматриваемой системе, которая соответствует насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., определяют по формуле:
pH ≈ - 1 2 lg ( K a ' · L ) = 3 , 9 p H ≈ - 1 2 lg ( K a ' · L ) = 3 , 9
где L = 0 , 034 моль/л — определяется, как показатель растворимости C O 2 в водной среде при заданных параметрах.
Когда раствор нагревают и/или снижают парциальное давление диоксида углерода, наблюдается смещение равновесия в сторону разложения угольной кислоты на воду и диоксид углерода. В процессе кипения раствора происходит полное разложение угольной кислоты:
H 2 C O 3 ⟶ H 2 O + C O 2 ↑ H 2 C O 3 ⟶ H 2 O + C O 2 ↑
Угольная кислота вступает в реакции нейтрализации с растворами оснований. В результате такого взаимодействия образуются средние и кислые соли в виде карбонатов (например, N a 2 C O 3 ) и гидрокарбонатов (например, N a H C O 3 ):
H 2 C O 3 + 2 N a O H H 2 C O 3 + 2 N a O H
⟶ N a 2 C O 3 + 2 H 2 O ⟶ N a 2 C O 3 + 2 H 2 O
H 2 C O 3 + N a O H H 2 C O 3 + N a O H ( р а з б . )
⟶ N a H C O 3 + H 2 O ⟶ N a H C O 3 + H 2 O
H 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 H 2 O H 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 H 2 O
H 2 C O 3 + N H 3 · H 2 O ⟶ N H 4 H C O 3 + H 2 O H 2 C O 3 + N H 3 · H 2 O ⟶ N H 4 H C O 3 + H 2 O
Химическая реакция угольной кислоты с карбонатами сопровождается образованием гидрокарбонатов:
H 2 C O 3 + N a 2 C O 3 ⟶ 2 N a H C O 3 H 2 C O 3 + N a 2 C O 3 ⟶ 2 N a H C O 3
H 2 C O 3 + C a C O 3 ⟶ C a ( H C O 3 ) 2 H 2 C O 3 + C a C O 3 ⟶ C a ( H C O 3 ) 2
Способы получения и сфера применения
Образование угольной кислоты в процессе растворения в воде диоксида углерода:
C O 2 + H 2 O ⇄ C O 2 · H 2 O ⇄ H 2 C O 3 C O 2 + H 2 O ⇄ C O 2 · H 2 O ⇄ H 2 C O 3
Концентрация угольной кислоты в растворе повышается в условиях понижения температуры раствора и увеличения давления углекислого газа.
Другим способом получения угольной кислоты является взаимодействие ее солей (карбонатов и гидрокарбонатов) с более сильной кислотой. В результате образовавшаяся угольная кислота в большей степени при разложении образует воду и диоксид углерода:
N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 C O 3 N a 2 C O 3 + 2 H C l ⟶ 2 N a C l + H 2 C O 3
H 2 C O 3 → H 2 O + C O 2 ↑ H 2 C O 3 → H 2 O + C O 2 ↑
Угольная кислота всегда присутствует в водных растворах углекислого газа.
В области биохимии высоко ценится способность равновесной системы изменять давление углекислого газа С О 2 (диоксида углерода) пропорционально изменению содержания ионов гидроксония H 3 O + (кислотности среды) в условиях постоянной температуры. Данное свойство позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Угольная кислота нашла широкое применение в пищевой промышленности, является важным компонентом в производстве разнообразных шипучих напитков.
Угольная кислота. Свойства, получение, применение и цена угольной кислоты
Ее сложно увидеть. Угольная кислота известна науке в форме раствора. В воде размешен углекислый газ . Последнее вещество – это диоксид углерода с формулой CO2. Химическая запись воды, как известно, — H2O.
Вместе получается угольная кислота. Формула вещества записывается как H2CO3. Однако, выделить кислоту в виде порошка, как многие, не получается. Максимум – льдинки. Почему? Давайте разбираться.
Свойства угольной кислоты
Раствор угольной кислоты легко составляется и столь же просто распадается на изначальные компоненты. Особенно активно углекислый газ выделяется при нагреве. При пониженных температурах диссоциация угольной кислоты замедляется.
Вещество превращается в прозрачные кристаллы . Но, температуры, делающие кислоту стабильной, нетипичны для обычных условий. Поэтому, героиню статьи считают слабой, не способной сохранить собственную структуру и с трудом взаимодействующей с другими веществами.
Так, с растворами щелочей, металлами и их оксидами угольная кислота реагирует минимум в 2-е ступени. Сильная угольная кислота лишь в связке с еще более слабыми кислотами . Их героиня статьи вытесняет из растворов солей . «Капитулировать» приходится, к примеру, метакремниевой кислоте .
Химические свойства угольной кислоты являются робким выражением свойств двухосновных кислот . Героиня статьи относится к ним, поскольку содержит в структуре 2 атома водорода . Если точнее, в молекуле угольного соединения есть 2-е группы COOH.
Это, в частности, заставляет героиню статьи проявлять электролитические свойства. Проводить ток позволяет частичное распадение кислоты на ионы. У твердых электролитов они движутся внутри кристаллических решеток. Угольная кислота выделяет ионы только в растворах.
Как и прочие двухосновные вещества, угольная кислота в реакции вступает, дающие два ряда солей . Это бикарбонаты и простые карбонаты. Последние нерастворимы в воде и известны людям под видом мрамора , мела , известняка . Все три камня основаны на карбонате кальция с формулой CaCO3.
Угольная кислота и ее соли бесцветны. Помните, что мел, известняк и мрамор, зачастую, белые ? В растворе героиня кислоты тоже белеса, находится, в основном, в свободном виде.
Так именуют отдельное существование молекул воды и распределенного в ней углекислого газа. Но, встречаются в растворах и карбонатные ионы CO 32- и бикарбонатные частицы HCO3. Все вместе представляет долю кислоты в воде.
Система отличается кинетическим равновесием, то есть, неизменной концентрацией составляющих. Если допускается избыточное содержание диоксида углерода, вода становится агрессивной. Такой раствор расщепляет металлы , бетоны, различные конструкции и камни .
В обычных условиях доля угольной кислоты в воде мала, как и в воздухе, почве. В земле вещества, к примеру, от 0,0002 до 0,0005 частей. Ученые считают, что так было не всегда.
Ища причины гигантских размеров древних растений, исследователи пришли к выводу, что в прошлые эпохи и в почве, и в атмосфере, героини статьи было в несколько раз больше.
Растения способны усваивать вещество и пользуются его влиянием на растворимость в земле минеральных веществ, необходимых травам, кустам и деревьям для питания.
Проводились опыты выращивания растений в атмосферах с разным содержанием угольной кислоты. Рекорды показали экземпляры, находящие в воздухе с содержанием H2CO3 от 5-ти до 10-ти процентов.
Получение угольной кислоты
Важно не столько получение угольной кислоты, сколько ее соединений. Одно из них, к примеру, сода . Она является солью угольного соединения. Сода – кристаллическое вещество.
Но, как засечь образование чистой кислоты , раз она бесцветна? Отличить раствор от простой воды поможет лакмусовая бумажка . Она фиолетовая . В нейтральной среде цвет не меняется. Кислота окрасит лакмус в красный .
Раз героиня статьи получается добавлением в воду диоксида углерода, для начала нужно получить его. Поможет соляная кислота . Она сильная, с легкостью растворяет многие камни, в том числе и мрамор. Реакция ведет к выделению углекислого газа. С водой он смешается самостоятельно.
Получение углекислой кислоты , кстати, налажено в человеческом организме. Героиня статьи входит в буферные системы крови . Они контролируют постоянный pH организма.
Если извне поступают продукты с явной кислотностью или щелочной средой, буферные агенты удерживают нужный pH, пока «гости» переработаются и выведутся с потом, калом, мочой.
Лишние ионы блокируются и нейтрализуются. Это делают белковый, бикарбонатный, фосфатный и гемоглобиновый буферы. Каждый из них состоит из слабой кислоты , одной из ее солей и сильного основания.
В промышленности углекислоту получают 5-ю путями. Первый – извлечение вещества, как сопутствующего углеводородам при их откачке из скважин. При сжигании нефти , угля , кокса, кислоту тоже получают. Получается углекислота и при производстве аммиака . Героиня статьи становится побочным продуктом реакции.
Побочным продуктом углекислота является, так же, при брожении. Так что, соединением запасаются, к примеру, во время изготовления вина. Еще один источник углекислоты – выпуск гашеной извести.
Правда, от нее «отлетают» еще и азот, прочие примеси. Они же затрудняют получение реагента при сжигании углеводородов и на аммиачных заводах . Так что, эффективными способами промышленного получения героини статьи считаются лишь три из перечисленных.
Применение угольной кислоты
В чистом виде угольная кислота нужна не только организму человека растениям, но и на производствах. В процессе сварки, к примеру, героиня статьи служит защитной средой, подобно аргону.
Правда, углекислое соединение приходится раскислять. Для этого используют марганец и кремний . Иначе, нагрев при сварке провоцирует выделение из диоксида углерода активного кислорода.
Он провоцирует коррозию металлов. Именно из-за необходимости обработки угольной кислоты в качестве защитной среды чаще выбирают газ аргон. В пищевой промышленности углекислота – антиокислитель. Его добавляют в чаи , сыры, кофе . Примесь консервирует их, способствуя продолжительному хранению.
Пожарные бригады знают героиню статьи, как средство борьбы с огнем . Кислотой заполняют емкости, из которых соединение поступает к соплам. Для этого используют распределительные трубопроводы. Сопла находятся в защищаемых помещениях.
Выходя «на свободу» кислота превращается в пар, поглощая тепло окружающей среды, заполняя площади. В открытых помещениях системы углекислого пожаротушения не используют, лишь в трюмах, кладовых, насосных, отсеках электростанций. Принцип действия сводится к снижению уровня кислорода до 8%. Горение при таком показатели прекращается.
Раз угольная кислота нужна организму, ее используют медики, фармацевты. Вещество применяется в производстве аспирина, добавляется при некоторых видах анестезии, к примеру, в кислородные маски .
К угнетению дыхательного центра прибегают, в основном, при отравлениях летучими ядами и асфиксии новорожденных. Асфиксия – удушение. У младенцев вызывается, обычно, рвотными массами и первородным калом. Углекислота способствует сокращению легочных тканей, восстановлению их функции.
Применяют медики и углекислый снег. Это те самые кристаллы кислоты , которые получают при низких температурах. Так что, врачам удается увидеть героиню статьи в кристаллическом виде.
Удается это, так же, больным волчанкой, бородавками, лепрозными узлами. Соприкасаясь с кислотным льдом, пораженные участки кожи разрушаются. Грубо говоря, угольная кислота вырезает лишнее, подобно лазеру.
В жидком виде углекислота тоже может выступать хладагентом, используется в морозильном оборудовании. Еще одно поле применения – умягчение воды. Ее, правда, улучшает не чистая кислота, а одна из ее солей – атронная известь.
Цена угольной кислоты
Структурная формула угольной кислоты вмещается промышленниками в баллоны и цистерны. Прежде чем поместить героиню статьи в них, ее охлаждают. Это помогает сгустить вещество.
Предложений купить его единицы. Чаще, реализуют углекислые соединения. За димитилкарбонат, к примеру, просят около 1 500 рублей за килограмм. Вещество растворяет эфиры целлюлозы, а посему, применяется в органическом синтезе.
За натриевую соль, а попросту соду, приходится выкладывать 80-200 рублей за килограмм. Ценники разнятся в зависимости от производителей и добавок к продукту. Так, бывает, к примеру, кальцированная сода.
Если смотреть в глобальных масштабах, угольная кислота бесценна. Именно она является источником углерода для живых материй, причем, единственным. Углерод есть и в нефти, вулканических выбросах.
Элемент составляет ряд минералов, к примеру, графит и алмаз . Но, там элемент непотребен для животных . Они, как и растения, развиваются за счет угольной кислоты.
Есть даже мнение, что атланты – не чудо-люди или пришельцы из космоса, а всего лишь достойные «дети» атмосферы, насыщенной соединением воды и углекислого газа. Но, это теория в стиле «РенТВ». Сосредоточимся на научных фактах.
Роль угольной кислоты в жизни человека , животных, растений, ученые осознали и изучили около 3-ех столетий назад. С тех пор соединение и стали именовать бесценным. Наибольший вклад в изучение углекислоты внес Ян Ингенхоуз.
Угольная кислота и ее соли
Диоксид углеродаСО2 (углекислый газ) - при обычных условиях это газ без цвета и запаха, слегка кисловатого вкуса, тяжелее воздуха примерно в 1,5 раза, растворим в воде, достаточно легко сжижается (при комнатной температуре под давлением около 60 ∙ 10 5 Па его можно превратить в жидкость). При охлаждении до −56,2ºС жидкий диоксид углерода затвердевает и превращается в снегообразную массу.
Во всех агрегатных состояниях состоит из неполярных линейных молекул. Химическое строение молекулы СО2 определяется sp-гибридизацией центрального атома углерода и образованием дополнительных πр-р-связей: О = С = О.
Некоторая часть растворенного в воле СО2 взаимодействует с ней сообразованием угольной кислоты:
Углекислый газ очень легко поглощается растворами щелочей с образованием карбонатов и гидрокарбонатов:
Молекулы СО2 очень устойчивы термически, распад начинается только при температуре 2000ºС. Поэтому диоксид углерода не горит и не поддерживает горения обычного топлива. Но в его атмосфере горят некоторые простые вещества, атомы которых проявляют большое сродство к кислороду, например, магний при нагревании загорается в атмосфере СО2.
Угольная кислота H2CO3 – соединение непрочное, существует только в водных растворах. Большая часть растворенного в воде углекислого газа находится в виде гидратированных молекул CO2, меньшая – образует угольную кислоту.
Водные растворы, находящиеся в равновесии с CO2 атмосферы, являются кислыми: [CO2] = 0,04 М и рН ≈ 4.
Угольная кислота – двухосновная, относится к слабым электролитам, диссоциирует ступенчато (К1 = 4, 4 ∙ 10 −7 ; К2 = 4, 8 ∙ 10 −11 ). При растворении CO2 в воде устанавливается следующее динамическое равновесие:
При нагревании водного раствора углекислого газа растворимость газа понижается, CO2 выделяется из раствора, и равновесие смещается влево.
Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония.
В воде карбонаты подвергаются гидролизу, и поэтому их растворы имеют щелочную реакцию:
Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет.
Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8).
Карбонат аммония (NH4)2CO3 отличается большой летучестью при повышенной и даже при обычной температуре, особенно в присутствии паров воды, которые вызывают сильный гидролиз.
Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту:
В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Они менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты:
Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты:
Из солей угольной кислоты наибольшее значение имеют карбонат натрия (сода), карбонат калия (поташ), карбонат кальция (мел, мрамор, известняк), гидрокарбонат натрия (питьевая сода) и основной карбонат меди (CuOH)2CO3 (малахит).
Основные соли угольной кислоты в воде практически нерастворимы и при нагревании легко разлагаются:
Термическая устойчивость карбонатов зависит от поляризационных свойств ионов, входящих в состав карбоната. Чем больше поляризующее действие оказывает катион на карбонат-ион, тем ниже температура разложения соли. Если катион способен легко деформироваться, то карбонат-ион сам также будет оказывать поляризующее действие на катион, что приведет к резкому снижению температуры разложения соли.
Карбонаты натрия и калия плавятся без разложения, а большинство остальных карбонатов при нагревании разлагаются на оксид металла и углекислый газ:
Оксид углерода (II)
Молекула СО имеет следующую структуру
:С≡О:
Две связи образованы за счет спаривания 2р-электронов атомов углерода и кислорода, третья связь образована по донорно-акцепторному механизму за счет свободной 2р-орбитали углерода и 2р-электронной пары атома кислорода. Дипольный момент молекулы незначителен, при этом эффективный заряд на атоме углерода отрицательный, а на атоме кислорода – положительный.
Поскольку строение молекулы СО сходно со строением молекулы азота, похожи их физические свойства. СО имеет очень низкие температуры плавления (- 204ºС) и кипения (- 191,5ºС), это бесцветный, очень ядовитый газ, без запаха, совсем немного легче воздуха. Плохо растворим в воде, и с ней не взаимодействует.
СО считается несолеобразующим оксидом, т.к. при обычных условиях не взаимодействует ни с кислотами, ни со щелочами. Он образуется при горении угля и углеродистых соединений при ограниченном доступе кислорода, также при взаимодействии углекислого газа с раскаленным углем: СО2 + С = 2СО.
В лаборатории его получают из мурвьиной кислоты действием на нее концентрированной серной кислоты при нагревании:
Можно использовать также и щавелевую кислоту. Серная кислота в этих реакциях выступает как водоотнимающее средство.
В обычных условиях СО химически достаточно инертен, но при нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии для получения некоторых металлов: Fe2O3 + 3CO = 2Fe + 3CO2.
На воздухе СО горит голубоватым пламенем с выделением большого количества теплоты: 2СО + О2 = 2СО2 + 569 кДж.
Помимо кислорода на прямом солнечном свету или в присутствии катализатора (активного угля) СО соединяется с хлором, образуя фосген:
Фосген – бесцветный газ с характерным запахом. В воде он малорастворим, но как хлорангидрид угольной кислоты постепенно гидролизуется по схеме: COCl2 + 2H2O = 2HCl + H2CO3. Вследствие высокой токсичности фосген применяли как боевое отравляющее средство в первую мировую войну. Обезвредить его можно с помощью гашеной извести.
При нагревании СО окисляется и серой: СО + S = COS.
Молекула СО может выступать в качестве лиганда в различных комплексных соединениях. За счет несвязывающей электронной пары углерода она проявляет σ-донорные свойства, а за счет свободных π-разрыхляющих орбиталей проявляет π-акцепторные свойства. Особый интерес представляют карбонильные комплексы d-металлов, т.к. термическим разложением карбонилов получают металлы высокой чистоты.
Гидроксиды угольной и кремневой кислот
Формулы угольной и кремниевой кислот, их химические свойства по отношению к металлам,оксидам,основаниям, специфические свойства.
Н2СО3 — существует только в растворе:
Н2SiO3— твердое вещество, практически нерастворимо в воде, поэтому катионы водорода в воде практически не отщепляются. В связи с этим такое общее свойство кислот, как действие на индикаторы, Н2SiO3 не обнаруживает, она еще слабее угольной кислоты.
Н2SiO3 — непрочная кислота и при нагревании постепенно разлагается:
Н2CO3 реагирует с металлами, оксидами металлов, основаниями:
б) Н2CO3 + СаО = СаСO3 + Н20
Карбонаты, соли угольной кислоты H2CO3.
Различают нормальные (средние) карбонаты, с анионом СО3 2- (например, KHCO3), кислые карбонаты (гидрокарбонаты или бикарбонаты), с анионом НСО - 3 (например, КНСОз) и основные карбонаты [например, Cu2(OH)2СОз — минерал малахит]. В воде растворимы только нормальные карбонаты щелочных металлов, аммония и таллия. В результате значительного гидролизарастворы их показывают щелочную реакцию. Наиболее трудно растворимы нормальные карбонаты кальция,стронция, бария и свинца (2-валентного). Кислые карбонаты хорошо растворимы в воде.
При нагревании карбонаты, как правило, разлагаются (CaCO3 = CaO + CO2) ещё до достижения точки плавления; исключение представляют карбонаты щелочных металлов и таллия. Гидрокарбонаты при нагревании переходят в нормальные карбонаты (2NaHCO3 = Na2CO3 + H2O + CO2). Сильными кислотами нормальные и кислые карбонаты разлагаются с выделением CO2 (K2CO3 + H2SO4 = K2SO4 + H2O + CO2).
| Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ): ns2np2.Углерод и кремний углерод …2s2 2p2 кремния … 2S22P63S23p2 Со:-4,+2,+4 Оксиды 2С+О2=2СО 2СО+О2=2СО2 при восстановлении диоксида углерода раскалённым углём: СО2+С2CO Кислотные свойства: СО2 восст-ые св-ва СО: 2Mg + CO2 = 2MgO + C PdCl2+CO+H2OPd+CO2+2HCl CO2 + H2O ↔ H2CO3 Ca(OH)2 + CO2 = CaCO3↓ + H2O Fe2O3+CO2Fe+3CO2 KOH + CO2 → KHCO3 SiO2+ C=CO+ SiO Гидроксид: формально C(OH)4(H4CO4) моментально отщепляет воду и превращается вH2CO3 SiO неустойчив,диспропорционирование: 2 SiO(г)= SiO2(кр)+ Si(кр) Si+O2=SiO2 Na2SiO3(HCl,-NaCl)H4SiO4(H2O)mSiO2*nH2O(осадок,гидроксид) Кислотные свойства: SiO2— кислотный оксид, не реагирующий с водой.SiO2+CaO=CaSiO3 SiO2+MgSi+MgO SiO2+4NaOH=Na4SiO4+2H2O SiO2+4HF=SiF4+2H2O SiO2+Na2CO3(сплав)Na2SiO3(жидкое стекло)+CO2 Примеры растворимых и малорастворимых карбонатов Растворимые карбонаты: K2CO3, Na2CO3, Li2CO3,(NH4)2CO3 Сa(HCO3)2(определяет времен.жесткость воды)CaCO3+CO2+H2O Малорастворимые карбонаты: BaCO3, СaCO3, СоCO3 |
44. Получение и химические свойства галогеноводородных кислот
Галогеноводороды
Соединения галогенов с водородом НХ, где X — любой галоген, называются галогеноводородами. Вследствие высокой электроотрицательности галогенов связующая электронная пара смещена в их сторону, поэтому молекулы этих соединений полярны.
Галогеноводороды — бесцветные газы, с резким запахом, легко растворимы в воде. 1При 0°С в 1 объеме воды растворяете 500 объемов НС1, 600 объемов HBr и 450 объемов HI. Фтороводород смешивается с водой в любых соотношениях. Высокая растворимость этих соединений в воде позволяет получать концентрированные растворы.
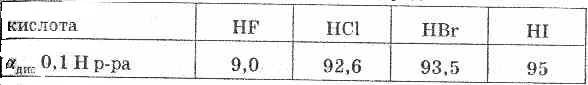
При растворении в воде галогеноводороды диссоциируют по типу кислот. HF относится к слабо диссоциированным соединениям, что объясняется особой прочностью связи в куле. Остальные же растворы галогеноводородов относятся к числу сильных кислот. HF — фтороводородная (плавиковая) кислота НС1 — хлороводородная (соляная) кислота HBr — бромоводородная кислота HI — иодоводородная кислота
Сила кислот в ряду HF — НСl — HBr — HI возрастает, что объясняется уменьшением в том же направлении энергии связи и увеличением межъядерного расстояния. HI — самая сильная кислота из ряда галогеноводородных кислот.
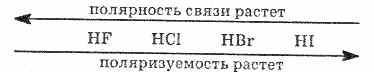
Поляризуемость растет вследствие того, что вода поляризует
больше ту связь, чья длина больше. Соли галогеноводородных кислот носят соответственно следующие названия: фториды, хлориды, бромиды, иодиды.
Химические свойства галогеноводородных кислот
В сухом виде галогеноводороды не действуют на большинство металлов.
1. Водные растворы галогеноводородов обладают свойствами бескислородных кислот. Энергично взаимодействуют со многими металлами, их оксидами и гидроксидами; на металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, не действуют. Взаимодействуют с некоторыми солями и газами.

Фтороводородная кислота разрушает стекло и силикаты:
Поэтому она не может храниться в стеклянной посуде.
2. В окислительно-восстановительных реакциях галогеноводородные кислоты ведут себя как восстановители, причем восстановительная активность в ряду Сl-, Br-, I- повышается.
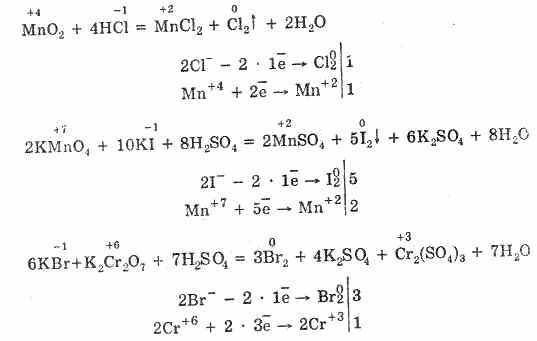
Фтороводород получают действием концентрированной серной кислоты на плавиковый шпат:
Хлороводород получают непосредственным взаимодействием водорода с хлором:
Это синтетический способ получения.
Сульфатный способ основан на реакции концентрированной
серной кислоты с NaCl.
При небольшом нагревании реакция протекает с образованием НСl и NaHSO4.
При более высокой температуре протекает вторая стадия реакции:
Но аналогичным способом нельзя получить HBr и HI, т.к. их соединения с металлами при взаимодействии с концентрировавной серной кислотой окисляются, т.к. I- и Br- являются сильными восстановителями.
Бромоводород и иодоводород получают гидролизом PBr3 и PI3: PBr3+3Н2O=3HBr+Н3PO3 PI3+3Н2О=3HI+Н3РO3
45. Гибридизация атомных орбиталей. Геометрическое строение молекул и ионов. Влия- ние неподеленной электронной пары на геометрическую конфигурацию и химические свойства молекул и ионов. (из прошлого экзамена взято)
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Читайте также:
