Укажите металл довольно устойчивый к окислению на воздухе
Обновлено: 18.05.2024
В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относят к семейству щелочноземельных металлов.
Распределение электронов по энергетическим уровням в атомах этих металлов приведено в табл. 20.
Если провести сравнение радиусов атомов элементов главной подгруппы II группы с I, то легко заметить, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-оболочка внешнего электронного слоя у них завершена, поэтому электроны ими удерживаются сильнее. Этим объясняется ряд химических свойств этих элементов. Щелочноземельные металлы, как и щелочные, образуют окислы, взаимодействующие с водой, и растворимые в воде гидроокиси.
Наиболее легкий элемент группы — бериллий образует окись и гидроокись амфотерного характера. Валентных электронов у металлов главной подгруппы II группы два. Располагаются они на внешнем электронном слое. Типичная степень окисления этих металлов +2. Физические свойства бериллия, магния и щелочноземельных металлов приведены в табл. 21.
В окислительно-восстановительных реакциях щелочноземельные металлы ведут себя как сильные восстановители. Из этой группы мы рассмотрим лишь магний и кальций как наиболее распространенные.
■ 40. Как объяснить, почему у атомов элементов главной подгруппы II группы происходит застройка s-оболочки внешнего слоя, а не d-оболочки предвнешнего слоя? (См. Ответ)
41. Выпишите в два столбца радиусы атомов щелочных металлов и металлов главной подгруппы второй группы. Сравните между собой соответствующие элементы, стоящие в одних и тех же периодах. Что можно сказать о сравнительной величине их атомных радиусов?
42. У каких металлов большая прочность металлической связи: в главной подгруппе I группы или в главной подгруппе II группы? Дайте обоснованный ответ.
43. Ответив на предыдущий вопрос, укажите, как можно, сравнивая между собой физические свойства металлов этих двух групп,
обосновать сделанный вывод.
44. У каких металлов — щелочных или металлов главной подгруппы II группы ярче выражена электроположительность?
45. Почему гидроокиси металлов главной подгруппы II группы хуже растворяются в воде, чем гидроокись щелочных металлов.
46. Что можно сказать о поведении металлов II группы в окислительно-восстановительных реакциях? (См. Ответ)
Магний и его соединения
Электронная конфигурация атома магния 1s 2 2s 2 2p 6 3s 2 . Структура его внешнего электронного слоя

Магний Mg — легкий серебристо-белый металл, довольно устойчивый к окислению, так как на воздухе покрывается защитной пленкой окиси. Магний поступает в лаборатории в виде порошка или лент.
Магний является сильнейшим восстановителем. Если магниевую ленту поджечь, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Поэтому магниевые вспышки применяются в фотографии, в изготовлении осветительных ракет, при поджигании термитных смесей и т. д. При горении магния, как и прочих щелочноземельных металлов, образуется его окись:
2Mg + O2 = 2МgO
При горении магния развивается такая высокая температура, что он может гореть даже в двуокиси углерода, разлагая ее:
2Mg + СО2 = 2MgO + С
При горении на воздухе наряду с окисью магния образуется нитрид магния:
3Mg + N2 = Mg3N2
Магний является более активным металлом, чем водород, поэтому может реагировать с водой, вытесняя из нее водород:
Mg + 2Н2О = Mg(OH)2 + Н2 или Mg + Н2O = MgO + Н2
Реакция лучше происходит с горячей водой. С кислотами магний реагирует весьма бурно, вытесняя водород.
• Составьте самостоятельно уравнение реакции.
Металлический магний широко используется при изготовлении легких сплавов. Примером может служить сплав «электрон», содержащий 80% Mg, 10% Al, 6% Zn, 0,2% Мn и прочие добавки. Этот сплав применяется в авто- в авиастроении.
Среди кислородных соединений магния нужно отметить окись магния MgO, называемую также жженой магнезией, которая применяется в изготовлении огнеупорных кирпичей, так как ее температура плавления 2800º. Используется жженая магнезия и в медицинской практике.
Гидроокись магния Mg(OH)2 является типичным основанием: весьма мало растворяется в воде.
Среди солей особый интерес представляет хлорид магния MgCl2, широко применяющийся при электролитическом получении магния. В природе хлорид магния встречается в составе минерала карналлита KCl · MgCl · 6Н2O, откуда и извлекается.
Карбонат магния, или белая магнезия, встречается в природе в виде минерала магнезита MgCO3, а также входит в состав некоторых горных пород, например доломита MgCO3 СаСO3 в соединении с карбонатом кальция. Из них и получают прокаливанием чистую жженую магнезию.
MgCO3 = MgO + CO2
В природных водах встречается бикарбонат магния Mg(CO3)2, придающий воде жесткость, о чем подробнее сказано ниже.
Интересны силикаты магния — тальк 3MgO · 4SiO2 · Н2O и асбест CaO · 3MgO · 4SiO2, обладающие высокой огнестойкостью. Асбест имеет волокнистое строение, поэтому его можно прясть и изготавливать из него спецодежду для работы при высоких температурах. Карбонаты и силикаты магния в воде нерастворимы.
■ 47. Чем объяснить сравнительную устойчивость магния к окислению на воздухе? (См. Ответ)
48. Перечислите химические свойства магния, приведя уравнения реакций.
49. Напишите уравнения реакций (в молекулярной и ионных формах), с помощью которых можно получить сульфат магния всеми известными способами.
50. Составьте и заполните таблицу.
51. Опишите химические процессы, протекающие при получении магния электролизом расплава хлорида
52. Что такое «жженая магнезия» и «белая магнезия»?
53. Перечислите, где применяются соединения магния. (См. Ответ)
Кальций. Окись кальция. Гашеная известь
Кальций — элемент четвертого периода. Электронная конфигурация внешнего и предвнешнего электронных слоев атома кальция 3s 2 3p 6 4s 2 .

Кальций — один из наиболее распространенных элементов земной коры. Кроме силикатных пород, он встречается в виде карбоната СаСO3 (мел, мрамор, известняк) и сульфата CaSO4 (гипс).
Кальций представляет собой белый, легко окисляющийся на воздухе металл, поэтому его, подобно калию и натрию, хранят под слоем керосина. Кальций довольно тверд. При окислении кальция на воздухе образуется окись кальция, или, как ее называют, жженая (негашеная ) известь СаО:
2Са + О2 = 2СаО
Предварительно нагретый кальций горит в кислороде, но не так ярко, как магний. Кальций энергично реагирует с горячей водой, вытесняя из нее водород и образуя гидроокись кальция, или гашеную известь, Са(ОН)2:
Са + 2Н2О = Са(ОН)2 + Н2
С азотом кальций, подобно магнию, образует нитрид, но в двуокиси углерода гореть не может. Кальций, подобно магнию, проявляет ярко выраженные восстановительные свойства. Широкого применения металлический кальций не находит.
Окись кальция СаО, как и жженая магнезия, имеет очень высокую температуру плавления — около 3000°. Если облить СаО водой, то идет весьма бурная реакция, сопровождающаяся шипением, сильным разогреванием и увеличением объема. В результате этого процесса, называемого гашением извести, получается гашеная известь — гидроокись кальция
СаО + Н2О = Са(ОН)2
Гашеная известь широко используется в строительстве как связующее вещество и для изготовления штукатурки. Гашеная известь, взболтанная в воде, называется известковым молоком и применяется в производстве сахара при его очистке от посторонних примесей. Бесцветный прозрачный раствор гашеной извести называется известковой водой и применяется как реактив на двуокись углерода, а также для смягчения временной жесткости воды, вызываемой бикарбонатом кальция Са(HCО3)2
Гашеную известь получают из негашеной, а негашеную — обжигом известняка в известковообжиговых печах (рис. 79). Смесь известняка и кокса, загружаемая через верх печи, называется шихтой. Кокс нужен для поддержания в печи температуры 1200°. Для горения кокса необходим воздух, который подается снизу. Постепенно проходя в печи через зону подогрева и зону охлаждения, известняк нагревается и разлагается:
СаСО3 = СаО + СО2
Негашеная известь охлаждается встречными потоками воздуха и извлекается из нижней части печи. Таким «образом, печь работает непрерывно. Для того чтобы она могла выдержать столь высокий нагрев, ее футеруют изнутри огнеупорным кирпичом. Летучие соединения кальция окрашивают пламя горелки в кирпично-красный цвет.
■ 54. Приведите несколько уравнений реакций, доказывающих, что кальций обладает восстановительными свойствами. (См. Ответ)
55. Какой объем водорода может быть вытеснен кальцием из 20 мл 3 н. соляной кислоты?
56. К какой группе реакций (экзотермическим или эндотермическим) относится процесс гашения извести?
57. Как осуществить следующие превращения: (См. Ответ)

58. Сколько кубических метров двуокиси углерода получится при прокаливании 5 кг известняка, содержащего 10% примесей?
59. Почему для получения двуокиси углерода в аппарате Киппа пользуются соляной кислотой, обрабатывая ее мрамор, и никогда не пользуются серной?
60. Какие химические процессы протекают в известково-обжиговой печи?
61. Почему жженую известь нельзя длительное время хранить на воздухе?
62. В банке находится твердое белое вещество. Есть предположение, что это либо жженая, либо гашеная известь. Как определить, что в банке? (См. Ответ)
Жесткость воды и способы ее устранения
Протекая по известковым горным породам, вода, соединяясь с двуокисью углерода, переводит карбонаты кальция и магния в соответствующие растворимые кислые соли:
СаСО3 + Н2О + СО2 = Са(НСО3)2
СаСО3 + Н2О + СО2 = Са 2+ + 2HCO3 —
MgCО3 + Н2О + СО2 = Mg(HCO3)2
MgCО3 + Н2О + СО2 = Mg 2+ + 2НСО3 —
Бикарбонаты значительно лучше растворимы в воде, чем карбонаты; они переходят в раствор, и вода становится жесткой. В такой воде плохо мылится мыло, плохо развариваются овощи, а при использовании такой воды в паровых котлах образуется накипь, которая может привести к взрыву котла. Жесткую воду перед употреблением необходимо смягчать.
Существует три вида жесткости: карбонатная, или временная, вызываемая присутствием бикарбонатов магния и кальция; постоянная, вызываемая присутствием в воде сульфатов и хлоридов магния и кальция; смешанная, которая вызывается наличием тех и других солей.
При устранении жесткости стремятся так или иначе удалить бикарбонаты магния или кальция из раствора, переводя их в нерастворимое состояние. Например, временную жесткость можно устранить кипячением раствора. При этом бикарбонаты кальция и магния разлагаются:
Са(НСО3)2 = СаСО3 + Н2О + СО2
Mg(HCО3)2 = MgCО3 + Н2О + СО2
Образующиеся карбонаты кальция и магния выпадают в осадок, и вода теряет жесткость.
Карбонатную жесткость нетрудно устранить прибавлением известковой воды:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Эти способы неприменимы к воде с постоянной жесткостью. Для ее устранения кальций и магний осаждают содой:
CaSО4 + Na2CО3 = CaCО3 + Na2SO4
Такой способ вполне применим и для устранения карбонатной, а следовательно, и смешанной жесткости:
Са(НСО3)2 + Na2CО3 = 2NaHCО3 + CaCО3
• Приведенные уравнения реакций устранения жесткости следует самостоятельно написать в ионной форме.
Жесткость воды выражается в градусах жесткости. Градусы жесткости показывают количество миллиграмм-эквивалентов ионов магния и кальция в 1 л воды.
■ 63. Какие виды жесткости воды вам известны? (См. Ответ)
64. Как можно устранить временную жесткость воды? Дайте обоснованный ответ.
65. Как можно устранить постоянную жесткость воды? Дайте обоснованный ответ.
66. Как устранить смешанную жесткость воды? Дайте обоснованный ответ.
67. При кипячении воды с временной жесткостью образуется накипь. Каков состав накипи? Как можно снять накипь химическим путем?
68. Можно ли устранить постоянную жесткость воды с помощью карбоната калия? Дайте обоснованный ответ.
69. Как измеряется жесткость воды?
70. Как распознать карбонат и сульфат кальция?
71. Как распознать сульфит и карбонат кальция?
72. Можно ли устранить временную жесткость воды соляной кислотой? Дайте обоснованный ответ, приведя уравнение реакции в молекулярной и ионных формах. (См. Ответ)
Статья на тему Металлы главной подгруппы II
Похожие страницы:
Содержание статьи1 ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ1.1 ГЛАВНАЯ ПОДГРУППА ВТОРОЙ ГРУППЫ1.2 Общая характеристика главной подгруппы второй группы1.3 Важнейшие физические константы элементов.
Легкие металлы это Легкими металлами принято называть цветные металлы, имеющие небольшую плотность. К ним относят алюминий, магний, бериллий, кальций, стронций.
Содержание статьи1 Металлы виды1.1 Щелочные металлы1.2 Щёлочноземельные металлы1.3 Переходные металлы1.4 Лёгкие металлы1.5 Полуметаллы1.6 Благородные металлы1.7 Лантаноиды1.8 Актиноиды1.9 Список всех металлов.
КАЛЬЦИЙ ХЛОРИСТЫЙ Соль кальция встречается в природе намного реже, чем карбонат, сульфат или фосфат кальция. Ее получают как побочный продукт.
Кальций Calcium Ат. вес 40,08. Кальций очень широко распространен в природе в виде различных соединений. В свое время мы уже.
Магний (Magnesium) Ат. вес 24,32. Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы.
4 типа металлов устойчивые к коррозии или нержавеющие
Мы обычно думаем о ржавчине как о оранжево-коричневых хлопьях, которые образуются на открытой стальной поверхности, когда молекулы железа в металле реагируют с кислородом в присутствии воды с образованием оксидов железа. Металлы также могут реагировать в присутствии кислот или агрессивных промышленных химикатов. Если ничто не остановит коррозию, чешуйки ржавчины будут продолжать отламываться, подвергая металл дальнейшей коррозии, пока он не распадется.
Не все металлы содержат железо, но они могут коррозировать или потускнеть в других окислительных реакциях. Чтобы предотвратить окисление и разрушение металлических изделий, таких как поручни, резервуары, приборы, кровля или сайдинг, вы можете выбирать металлы, которые «устойчивы к ржавчине» или, точнее, «устойчивы к коррозии». В эту категорию попадают четыре основных типа металлов:
- Нержавеющая сталь
- Алюминиевый металл
- Медь, бронза или латунь
- Оцинкованная сталь
Нержавеющая сталь
Типы нержавеющей стали такие, как 304 или 316, представляют собой смесь элементов и большинство из них содержат некоторое количество железа, которое легко окисляется с образованием ржавчины. Но многие сплавы нержавеющей стали также содержат высокий процент хрома (не менее 18%), который даже более активен, чем железо. Хром быстро окисляется, образуя защитный слой оксида хрома на поверхности металла. Этот оксидный слой противостоит коррозии и в то же время предотвращает попадание кислорода на нижележащую сталь. Другие элементы сплава, такие как никель и молибден, повышают его устойчивость к ржавчине.

Рекомендуем эффективный удалитель ржавчины с металлических поверхностей — «РжавоМед-У»
Алюминиевый металл
Многие самолеты сделаны из алюминия, как и детали автомобилей и мотоциклов. Это связано с его небольшим весом, а также с устойчивостью к коррозии. Алюминиевые сплавы почти не содержат железа, а без железа металл не может ржаветь, но окисляется. Когда сплав подвергается воздействию воды, на поверхности быстро образуется пленка оксида алюминия. Слой твердого оксида довольно устойчив к дальнейшей коррозии и защищает лежащий под ним металл.
Медь, бронза и латунь
Эти три металла содержат мало железа или вовсе его не содержат, поэтому не ржавеют, но могут вступать в реакцию с кислородом. Медь со временем окисляется, образуя зеленую патину, которая фактически защищает металл от дальнейшей коррозии. Бронза представляет собой смесь меди и олова, а также небольшого количества других элементов, и, естественно, гораздо более устойчива к коррозии, чем медь. Латунь – это сплав меди, цинка и других элементов, которая также устойчива к коррозии.
Оцинкованная сталь
Оцинкованная сталь долго ржавеет, но со временем она ржавеет. Это углеродистая сталь, оцинкованная или покрытая тонким слоем цинка. Цинк действует как барьер, не позволяющий кислороду и воде достигать стали, поэтому она защищена от коррозии. Даже если цинковое покрытие поцарапано, оно продолжает защищать близлежащие участки лежащей под ним стали за счет катодной защиты, а также путем формирования защитного покрытия из оксида цинка. Как и алюминий, цинк очень реактивен по отношению к кислороду в присутствии влаги, а покрытие предотвращает дальнейшее окисление железа в стали.
Металлы главной подгруппы II группы
В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относят к семейству щелочноземельных металлов.
Распределение электронов по энергетическим уровням в атомах этих металлов приведено в табл. 20.
Если провести сравнение радиусов атомов элементов главной подгруппы II группы с I, то легко заметить, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-оболочка внешнего электронного слоя у них завершена, поэтому электроны ими удерживаются сильнее. Этим объясняется ряд химических свойств этих элементов. Щелочноземельные металлы, как и щелочные, образуют окислы, взаимодействующие с водой, и растворимые в воде гидроокиси.
Наиболее легкий элемент группы — бериллий образует окись и гидроокись амфотерного характера. Валентных электронов у металлов главной подгруппы II группы два. Располагаются они на внешнем электронном слое. Типичная степень окисления этих металлов +2. Физические свойства бериллия, магния и щелочноземельных металлов приведены в табл. 21.
В окислительно-восстановительных реакциях щелочноземельные металлы ведут себя как сильные восстановители. Из этой группы мы рассмотрим лишь магний и кальций как наиболее распространенные.
■ 40. Как объяснить, почему у атомов элементов главной подгруппы II группы происходит застройка s-оболочки внешнего слоя, а не d-оболочки предвнешнего слоя? (См. Ответ)
41. Выпишите в два столбца радиусы атомов щелочных металлов и металлов главной подгруппы второй группы. Сравните между собой соответствующие элементы, стоящие в одних и тех же периодах. Что можно сказать о сравнительной величине их атомных радиусов?
42. У каких металлов большая прочность металлической связи: в главной подгруппе I группы или в главной подгруппе II группы? Дайте обоснованный ответ.
43. Ответив на предыдущий вопрос, укажите, как можно, сравнивая между собой физические свойства металлов этих двух групп,
обосновать сделанный вывод.
44. У каких металлов — щелочных или металлов главной подгруппы II группы ярче выражена электроположительность?
45. Почему гидроокиси металлов главной подгруппы II группы хуже растворяются в воде, чем гидроокись щелочных металлов.
46. Что можно сказать о поведении металлов II группы в окислительно-восстановительных реакциях? (См. Ответ)
Магний и его соединения
Электронная конфигурация атома магния 1s 2 2s 2 2p 6 3s 2 . Структура его внешнего электронного слоя

Магний Mg — легкий серебристо-белый металл, довольно устойчивый к окислению, так как на воздухе покрывается защитной пленкой окиси. Магний поступает в лаборатории в виде порошка или лент.
Магний является сильнейшим восстановителем. Если магниевую ленту поджечь, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Поэтому магниевые вспышки применяются в фотографии, в изготовлении осветительных ракет, при поджигании термитных смесей и т. д. При горении магния, как и прочих щелочноземельных металлов, образуется его окись:
2Mg + O2 = 2МgO
При горении магния развивается такая высокая температура, что он может гореть даже в двуокиси углерода, разлагая ее:
2Mg + СО2 = 2MgO + С
При горении на воздухе наряду с окисью магния образуется нитрид магния:
3Mg + N2 = Mg3N2
Магний является более активным металлом, чем водород, поэтому может реагировать с водой, вытесняя из нее водород:
Mg + 2Н2О = Mg(OH)2 + Н2 или Mg + Н2O = MgO + Н2
Реакция лучше происходит с горячей водой. С кислотами магний реагирует весьма бурно, вытесняя водород.
• Составьте самостоятельно уравнение реакции.
Металлический магний широко используется при изготовлении легких сплавов. Примером может служить сплав «электрон», содержащий 80% Mg, 10% Al, 6% Zn, 0,2% Мn и прочие добавки. Этот сплав применяется в авто- в авиастроении.
Среди кислородных соединений магния нужно отметить окись магния MgO, называемую также жженой магнезией, которая применяется в изготовлении огнеупорных кирпичей, так как ее температура плавления 2800º. Используется жженая магнезия и в медицинской практике.
Гидроокись магния Mg(OH)2 является типичным основанием: весьма мало растворяется в воде.
Среди солей особый интерес представляет хлорид магния MgCl2, широко применяющийся при электролитическом получении магния. В природе хлорид магния встречается в составе минерала карналлита KCl · MgCl · 6Н2O, откуда и извлекается.
Карбонат магния, или белая магнезия, встречается в природе в виде минерала магнезита MgCO3, а также входит в состав некоторых горных пород, например доломита MgCO3 СаСO3 в соединении с карбонатом кальция. Из них и получают прокаливанием чистую жженую магнезию.
MgCO3 = MgO + CO2
В природных водах встречается бикарбонат магния Mg(CO3)2, придающий воде жесткость, о чем подробнее сказано ниже.
Интересны силикаты магния — тальк 3MgO · 4SiO2 · Н2O и асбест CaO · 3MgO · 4SiO2, обладающие высокой огнестойкостью. Асбест имеет волокнистое строение, поэтому его можно прясть и изготавливать из него спецодежду для работы при высоких температурах. Карбонаты и силикаты магния в воде нерастворимы.
■ 47. Чем объяснить сравнительную устойчивость магния к окислению на воздухе? (См. Ответ)
48. Перечислите химические свойства магния, приведя уравнения реакций.
49. Напишите уравнения реакций (в молекулярной и ионных формах), с помощью которых можно получить сульфат магния всеми известными способами.
50. Составьте и заполните таблицу.
51. Опишите химические процессы, протекающие при получении магния электролизом расплава хлорида
52. Что такое «жженая магнезия» и «белая магнезия»?
53. Перечислите, где применяются соединения магния. (См. Ответ)
Кальций. Окись кальция. Гашеная известь
Кальций — элемент четвертого периода. Электронная конфигурация внешнего и предвнешнего электронных слоев атома кальция 3s 2 3p 6 4s 2 .

Кальций — один из наиболее распространенных элементов земной коры. Кроме силикатных пород, он встречается в виде карбоната СаСO3 (мел, мрамор, известняк) и сульфата CaSO4 (гипс).
Кальций представляет собой белый, легко окисляющийся на воздухе металл, поэтому его, подобно калию и натрию, хранят под слоем керосина. Кальций довольно тверд. При окислении кальция на воздухе образуется окись кальция, или, как ее называют, жженая (негашеная ) известь СаО:
2Са + О2 = 2СаО
Предварительно нагретый кальций горит в кислороде, но не так ярко, как магний. Кальций энергично реагирует с горячей водой, вытесняя из нее водород и образуя гидроокись кальция, или гашеную известь, Са(ОН)2:
Са + 2Н2О = Са(ОН)2 + Н2
С азотом кальций, подобно магнию, образует нитрид, но в двуокиси углерода гореть не может. Кальций, подобно магнию, проявляет ярко выраженные восстановительные свойства. Широкого применения металлический кальций не находит.
Окись кальция СаО, как и жженая магнезия, имеет очень высокую температуру плавления — около 3000°. Если облить СаО водой, то идет весьма бурная реакция, сопровождающаяся шипением, сильным разогреванием и увеличением объема. В результате этого процесса, называемого гашением извести, получается гашеная известь — гидроокись кальция
СаО + Н2О = Са(ОН)2
Гашеная известь широко используется в строительстве как связующее вещество и для изготовления штукатурки. Гашеная известь, взболтанная в воде, называется известковым молоком и применяется в производстве сахара при его очистке от посторонних примесей. Бесцветный прозрачный раствор гашеной извести называется известковой водой и применяется как реактив на двуокись углерода, а также для смягчения временной жесткости воды, вызываемой бикарбонатом кальция Са(HCО3)2
Гашеную известь получают из негашеной, а негашеную — обжигом известняка в известковообжиговых печах (рис. 79). Смесь известняка и кокса, загружаемая через верх печи, называется шихтой. Кокс нужен для поддержания в печи температуры 1200°. Для горения кокса необходим воздух, который подается снизу. Постепенно проходя в печи через зону подогрева и зону охлаждения, известняк нагревается и разлагается:
СаСО3 = СаО + СО2
Негашеная известь охлаждается встречными потоками воздуха и извлекается из нижней части печи. Таким «образом, печь работает непрерывно. Для того чтобы она могла выдержать столь высокий нагрев, ее футеруют изнутри огнеупорным кирпичом. Летучие соединения кальция окрашивают пламя горелки в кирпично-красный цвет.
■ 54. Приведите несколько уравнений реакций, доказывающих, что кальций обладает восстановительными свойствами. (См. Ответ)
55. Какой объем водорода может быть вытеснен кальцием из 20 мл 3 н. соляной кислоты?
56. К какой группе реакций (экзотермическим или эндотермическим) относится процесс гашения извести?
57. Как осуществить следующие превращения: (См. Ответ)

58. Сколько кубических метров двуокиси углерода получится при прокаливании 5 кг известняка, содержащего 10% примесей?
59. Почему для получения двуокиси углерода в аппарате Киппа пользуются соляной кислотой, обрабатывая ее мрамор, и никогда не пользуются серной?
60. Какие химические процессы протекают в известково-обжиговой печи?
61. Почему жженую известь нельзя длительное время хранить на воздухе?
62. В банке находится твердое белое вещество. Есть предположение, что это либо жженая, либо гашеная известь. Как определить, что в банке? (См. Ответ)
Жесткость воды и способы ее устранения
Протекая по известковым горным породам, вода, соединяясь с двуокисью углерода, переводит карбонаты кальция и магния в соответствующие растворимые кислые соли:
СаСО3 + Н2О + СО2 = Са(НСО3)2
СаСО3 + Н2О + СО2 = Са 2+ + 2HCO3 —
MgCО3 + Н2О + СО2 = Mg(HCO3)2
MgCО3 + Н2О + СО2 = Mg 2+ + 2НСО3 —
Бикарбонаты значительно лучше растворимы в воде, чем карбонаты; они переходят в раствор, и вода становится жесткой. В такой воде плохо мылится мыло, плохо развариваются овощи, а при использовании такой воды в паровых котлах образуется накипь, которая может привести к взрыву котла. Жесткую воду перед употреблением необходимо смягчать.
Существует три вида жесткости: карбонатная, или временная, вызываемая присутствием бикарбонатов магния и кальция; постоянная, вызываемая присутствием в воде сульфатов и хлоридов магния и кальция; смешанная, которая вызывается наличием тех и других солей.
При устранении жесткости стремятся так или иначе удалить бикарбонаты магния или кальция из раствора, переводя их в нерастворимое состояние. Например, временную жесткость можно устранить кипячением раствора. При этом бикарбонаты кальция и магния разлагаются:
Са(НСО3)2 = СаСО3 + Н2О + СО2
Mg(HCО3)2 = MgCО3 + Н2О + СО2
Образующиеся карбонаты кальция и магния выпадают в осадок, и вода теряет жесткость.
Карбонатную жесткость нетрудно устранить прибавлением известковой воды:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Эти способы неприменимы к воде с постоянной жесткостью. Для ее устранения кальций и магний осаждают содой:
CaSО4 + Na2CО3 = CaCО3 + Na2SO4
Такой способ вполне применим и для устранения карбонатной, а следовательно, и смешанной жесткости:
Са(НСО3)2 + Na2CО3 = 2NaHCО3 + CaCО3
• Приведенные уравнения реакций устранения жесткости следует самостоятельно написать в ионной форме.
Жесткость воды выражается в градусах жесткости. Градусы жесткости показывают количество миллиграмм-эквивалентов ионов магния и кальция в 1 л воды.
■ 63. Какие виды жесткости воды вам известны? (См. Ответ)
64. Как можно устранить временную жесткость воды? Дайте обоснованный ответ.
65. Как можно устранить постоянную жесткость воды? Дайте обоснованный ответ.
66. Как устранить смешанную жесткость воды? Дайте обоснованный ответ.
67. При кипячении воды с временной жесткостью образуется накипь. Каков состав накипи? Как можно снять накипь химическим путем?
68. Можно ли устранить постоянную жесткость воды с помощью карбоната калия? Дайте обоснованный ответ.
69. Как измеряется жесткость воды?
70. Как распознать карбонат и сульфат кальция?
71. Как распознать сульфит и карбонат кальция?
72. Можно ли устранить временную жесткость воды соляной кислотой? Дайте обоснованный ответ, приведя уравнение реакции в молекулярной и ионных формах. (См. Ответ)
Статья на тему Металлы главной подгруппы II
Похожие страницы:
Содержание статьи1 ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ1.1 ГЛАВНАЯ ПОДГРУППА ВТОРОЙ ГРУППЫ1.2 Общая характеристика главной подгруппы второй группы1.3 Важнейшие физические константы элементов.
Легкие металлы это Легкими металлами принято называть цветные металлы, имеющие небольшую плотность. К ним относят алюминий, магний, бериллий, кальций, стронций.
Содержание статьи1 Металлы виды1.1 Щелочные металлы1.2 Щёлочноземельные металлы1.3 Переходные металлы1.4 Лёгкие металлы1.5 Полуметаллы1.6 Благородные металлы1.7 Лантаноиды1.8 Актиноиды1.9 Список всех металлов.
КАЛЬЦИЙ ХЛОРИСТЫЙ Соль кальция встречается в природе намного реже, чем карбонат, сульфат или фосфат кальция. Ее получают как побочный продукт.
Кальций Calcium Ат. вес 40,08. Кальций очень широко распространен в природе в виде различных соединений. В свое время мы уже.
Магний (Magnesium) Ат. вес 24,32. Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы.
Коррозия металлов
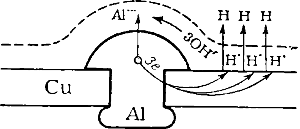
Почти все металлы, приходя в соприкосновение с окружающей их газообразной или жидкой средой, более или менее быстро подвергаются с поверхности разрушению. Причиной его является химическое взаимодействие металлов с находящимися в воз духе газами, а также с водой и растворенными в ней веществами.
Всякий процесс химического разрушения металлов под действием окружающей среды называется коррозией.
Проще всего протекает коррозия при соприкосновении металлов с газами. На поверхности металла образуются соответствующие соединения: окислы, сернистые соединения, основные соли угольной кислоты, которые нередко покрывают поверхность плотным слоем, защищающим металл от дальнейшего воздействия тех же газов.
Иначе обстоит дело при соприкосновении металла с жидкой средой — водой и растворенными в ней веществами. Образующиеся при этом соединения могут растворяться, благодаря чему коррозия распространяется дальше вглубь металла. Кроме того, вода, содержащая растворенные вещества, является проводником электрического тока, вследствие чего постоянно возникают электрохимические процессы, которые являются одним из главных факторов, обусловливающих и ускоряющих коррозию.
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде почти не ржавеет. Но обыкновенные технические металлы всегда содержат различные примеси, что создает благоприятные условия для коррозии.
Чтобы понять, почему примеси влияют на коррозию металлов, посмотрим, что происходит, когда два различных металла соприкасаются друг с другом, находясь во влажном воздухе.
Положим, например, что в медном листе находится алюминиевая заклейка (рис. 129). Так как все твердые тела адсорбируют на своей поверхности влагу из воздуха, то и поверхность наших металлов будет покрыта тончайшей пленкой воды. Но вода, как известно, диссоциирует, хотя и в ничтожной степени, на ионы Н • и ОН’; кроме того, растворенный в воде углекислый газ образует угольную кислоту, диссоциирующую по уравнению:
Следовательно, медь и алюминий будут как бы погружены в раствор, содержащий ионы H • , ОН’ и НСО3‘. Получается гальванический элемент, в котором отрицательным электродом служит алюминий, а положительным — медь. Ввиду тесного соприкосновения обоих металлов элемент этот замкнут и непрерывно работает: алюминий посылает свои ионы в раствор, а избыточные электроны переходят к меди, у поверхности которой они разряжают ионы водорода. В растворе ионы Аl ••• соединяются с ионами ОН’, образуя Аl(ОН)3, выделяющийся у поверхности алюминия:
2Аl—6е — = 2Аl ••• 6Н • + 6e — = 3Н2
Таким образом, алюминий довольно быстро подвергается коррозии.
Несколько сложнее происходит коррозия железа, находящегося в контакте с каким-нибудь менее активным металлом, например с той же медью. Железо посылает в раствор двухвалентные ионы Fe •• , которые, соединяясь с гидроксильными ионами, превращаются в Fе(ОН)2. В то же время электроны железа переходят к меди и разряжают у ее поверхности ионы водорода.
Рис 130. Растворение в кислотах химически чистого цинка при контакте с медной или платиновой проволочкой.
В присутствии кислорода воздуха и воды Fe(ОН)2 окисляется в гидрат окиси железа Fe(OH)3 , образующий ржавчину:
В разобранных нами случаях причиной коррозии алюминия и железа являлся контакт с менее активным металлом — медью. Такую же роль, как и медь, играют различные примеси, всегда содержащиеся в технических металлах и обусловливающие их коррозию. Например, обыкновенная сталь при исследовании ее под микроскопом оказывается состоящей из мелких зерен чистого железа, тесно перемешанных с зернами карбида железа — цементита Fe3C — и других примесей. Получается бесконечное множе ство так называемых гальванических пар, в которых зерна цементита играют роль положительных электродов, а зерна железа — отрицательных. При соприкосновении с влажным воздухом возникают гальванические токи, вызывающие коррозию стали. Аналогичным образом примеси способствуют коррозии и других металлов.
Коррозия алюминия, цинка, железа и вообще металлов, стоящих в ряду напряжений слева от водорода, сводится по существу к вытеснению ионов водорода из раствора и переходу самого металла в раствор в виде ионов. Ускоряющее влияние контакта с менее активным металлом при таких процессах можно наглядно иллюстрировать следующим опытом.
В пробирку с разбавленным раствором кислоты бросим кусочек химически чистого цинка. Выделения водорода почти не наблюдается. Отсутствие реакции объясняется тем, что начинающие переходить в раствор ионы Zn •• гидратируются и образуют вокруг цинка слой положительно заряженных ионов. Этот слой не дает возможности ионам водорода подходить вплотную к поверхности цинка и получать от него электроны, вследствие чего дальнейшее растворение цинка приостанавливается. Но стоит только коснуться поверхности цинка платиновой или медной проволочкой, как вследствие образования гальванической пары тотчас же начинается энергичное выделение водорода у поверхности проволочки. Электроны переходят от цинка к платине (или меди) и с нее на ионы водорода, а цинк постепенно растворяется, посылая новые ионы в раствор (рис. 130).
Такой же эффект вызывает прибавление к раствору кислоты нескольких капель раствора сернокислой меди CuSO4. Цинк вытесняет медь и покрывается с поверхности рыхлым слоем металлической меди. Получается гальваническая пара цинк —медь, работающая, как в элементе Вольта. Поэтому «омедненный» цинк энергично вытесняет водород из кислоты, но выделение водорода происходит у поверхности меди, а не у поверхности цинка (рис. 131).
Продажный цинк, содержащий примеси, действует аналогичным образом.
На скорость растворения металла в кислоте, помимо примесей, влияют и другие факторы: структура металла, способ его обработки, свойства кислоты и т. п. Но во всех случаях процесс растворения может быть замедлен прибавлением к кислоте некоторых веществ, главным образом органических, получивших название ингибиторов (замедлителей коррозии).

Действие ингибиторов иногда настолько эффективно, что некоторые металлы и сплавы становятся практически нерастворимыми в кислотах, к которым прибавлен соответствующий ингибитор.
Замедляя растворение металла, ингибиторы в то же время совершенно не влияют на скорость растворения окислов металлов, их гидроокисей и других веществ. Поэтому прибавление ингибиторов позволяет освобождать с помощью кислот поверхность металла от покрывающих ее соединений (например, удалять ржавчину с железа, накипь со стенок котлов), почти не затрагивая самого металла.
Так как элементы расположены в ряду напряжений по убывающей активности, то следовало бы ожидать, что чем левее стоит элемент в ряду напряжений, тем легче он будет подвергаться корро-зии. В действительности это не всегда имеет место. Например, алюминий, стоящий недалеко от начала ряда, довольно хорошо сопротивляется атмосферной коррозии. Причиной такой устойчивости является образование на поверхности алюминия тонкой, но очень плотной и эластичной пленки окиси алюминия, предохраняющей алюминий от соприкосновения с окружающей средой. И действительно, стоит только тем или иным способом уничтожить эту пленку, как алюминий начинает быстро корродировать.
Смочим хорошо вычищенную наждачной бумагой алюминиевую пластинку раствором сулемы HgCl2. Алюминий вытесняет ртуть, которая образует с ним сплав — ртутную амальгаму, препятствующую возникновению защитной пленки. Поэтому оставленная на воздухе пластинка быстро покрывается рыхлыми хлопьями гидрата окиси алюминия — продуктом коррозии алюминия.
В данном случае коррозия усиливается еще и вследствие контакта алюминия с малоактивным металлом — ртутью.
Понятно, что образующийся на поверхности металла слой окислов или каких-либо других соединений может служить защитой только в том случае, если он является достаточно плотным, прочным и нерастворимым в воде. В противном случае он не может помешать коррозии. Так, например, появляющаяся на железе ржавчина совершенно не защищает его от дальнейшей коррозии, так как слой ее оказывается очень рыхлым, хрупким и слабо пристающим к поверхности металла.
Вещества, способствующие возникновению на металле защитной пленки, носят название пассивирующих агентов. Таковыми для большинства металлов являются сильные окислители. Для железа хорошим пассивирующим агентом служат также ионы ОН’.
Как уже указывалось раньше , многие довольно активные металлы становятся пассивными после обработки их концентрированной азотной кислотой вследствие образования на поверхности металла тончайшего невидимого слоя окиси, препятствующего дальнейшему окислению. Существование таких «оксидных пленок» доказано различными методами: поляризацией отраженного света, рентгенографическим путем и др. Теория «оксидных пленок» была подробно развита в начале нынешнего столетия В. А. Кистяковским (1865—1952), работы которого имели большое значение для борьбы с коррозией.
Некоторые вещества разрушают или ослабляют защитную пленку металла, тем самым способствуя коррозии. Такие вещества называются активирующими агентами или активаторами.
Наиболее энергичным активатором для всех металлов является ион Cl. Быстрое разрушение подводных металлических частей морских судов объясняется главным образом присутствием ионов Сl’ в морской воде. Очень энергичными активаторами для многих металлов являются ионы водорода. Кислород, растворенный в воде, также сильно ускоряет коррозию, связывая первичные продукты реакции (например, окисляя Fe(OH)2 в Fe(OH)3 в случае коррозии железа) и тем самым предотвращая возможность обратной: реакции.
Убытки, причиняемые коррозией металлов, огромны. Вычиc-лено, например, что вследствие коррозии ежегодно гибнет такое количество железа, которое равно приблизительно 1 /4 всей мировой его добычи за год. Поэтому изучению процессов коррозии и отысканию наилучших средств ее предотвращения уделяется очень много внимания.
Способы борьбы с коррозией чрезвычайно разнообразны. Наиболее простой из них заключается в защите поверхности металла от непосредственного соприкосновения с окружающей средой путем покрытия масляной краской, лаком, эмалью или, наконец,, тонким слоем другого металла. Особенный интерес с теоретической точки зрения представляет покрытие одного металла другим. Посмотрим, к каким результатам оно приводит.
Так как коррозия всегда возникает на поверхности металла, то до тех пор, пока слой защищающего металла является сплошным, изделие ведет себя так, как если бы оно целиком состояло из защищающего металла. Но если в защитном слое появляются царапины, трещины и т. п., обнажающие поверхность защищаемого металла, то в этих местах сейчас же создаются условия, благоприятствующие коррозии. Однако процесс коррозии будет протекать совершенно различно в зависимости от относительного положения обоих металлов в ряду напряжений.
Разберем сперва случай так называемого катодного по крытия, когда защищающий металл стоит в ряду напряжений правее защищаемого. Типичным примером может служить корро зия луженого, т.е. покрытого оловом, железа (белая жесть).
Олово само по себе очень устойчиво и хорошо защищает металл, пока слой его на железе является сплошным. При нарушении целостности защитного слоя и соприкосновении обнаженного места с влагой образуется гальваническая пара, в которой положительным электродом (катодом) служит олово , а отрицательным (анодом) —железо. Поток электронов направляется от обнаженной поверхности железа к олову и здесь разряжает ионы водорода, а железо подвергается разрушению, посылая все новые и новые ионы в раствор (рис. 132, а). Таким образом, в месте повреждения луженое железо ржавеет гораздо быстрее, чем нелуженое.

Совершенно иначе протекает коррозия, если защищающий металл стоит в ряду напряжений левее защищаемого, как, например, при покрытии железа цинком (анодное покрытие). В этом случае при повреждении защитного слоя тоже получается гальваническая пара, но теперь железо служит катодом, а анодом — цинк, и электроны переходят от цинка к железу; поэтому цинк разрушается, а железо остается защищенным (рис. 132, б). Защита действует до тех пор, пока не будет разрушен весь слой цинка, на что потребуется довольно много времени.
Из сказанного ясно, что для защиты от коррозии целесообразнее покрывать поверхность металла слоем более активного металла, чем слоем менее активного. Однако другие соображения нередко заставляют применять также покрытия из менее активных металлов.
На практике чаще всего приходится принимать меры к защите железа, как металла, особенно подверженного коррозии. Кроме цинка, из более активных металлов для этой цели иногда применяют кадмий, действующий подобно цинку. Из менее активных металлов для покрытия железа чаще всего применяют олово, медь и никель.
Покрытые никелем железные изделия имеют красивый вид, чем объясняется широкое распространение никелирования.
При повреждении слоя никеля коррозия происходит менее-интенсивно, чем при повреждении слоя меди (или олова), так как разность потенциалов для пары никель — железо гораздо меньше, чем для пары медь — железо.
Из других способов борьбы с коррозией упомянем еще о способе, протекторов, заключающемся в том, что защищаемый металлический объект приводится в контакт с большой поверхностью более активного металла. Так, в паровые котлы вводят листы цинка, находящиеся в контакте со стенками котла и образующие с ними гальванический элемент.
Вы читаете, статья на тему Коррозия металлов
Похожие страницы:
Содержание статьи1 Коррозия металлов и защита металлов от коррозии1.1 Условия коррозии металлов1.2 Электрохимическая коррозия1.3 Коррозия железа в кислой среде1.4 Замедлитель.
Содержание статьи1 Химические свойства металлов1.1 Удельный вес и температура плавления некоторых металлов1.2 Почему типичные металлы восстановители1.3 Вытеснение металлов из соединений.
Гидрид натрия NaH Основное получение гидрида натрия пропускание водорода через нагретый натрий при температуре до 360 — 400°C , а.
Механизм возникновения тока в гальванических элементах. Электродные потенциалы металлов Существует несколько теорий, объясняющих возникновение тока в гальванических элементах. Наиболее простая.
Сернистые металлы Соли сероводородной кислоты называются сернистыми металлами или сульфидами. Они могут быть получены непосредственным соединением металлов с серой. Смешав.
Получение металлов высокой чистоты Развитие в последние годы ряда новых отраслей техники ставит перед промышленностью задачу получения металлов значительно более.
Коррозия металлов

Почти все металлы, приходя в соприкосновение с окружающей их газообразной или жидкой средой, более или менее быстро подвергаются с поверхности разрушению. Причиной его является химическое взаимодействие металлов с находящимися в воз духе газами, а также с водой и растворенными в ней веществами.
Всякий процесс химического разрушения металлов под действием окружающей среды называется коррозией.
Проще всего протекает коррозия при соприкосновении металлов с газами. На поверхности металла образуются соответствующие соединения: окислы, сернистые соединения, основные соли угольной кислоты, которые нередко покрывают поверхность плотным слоем, защищающим металл от дальнейшего воздействия тех же газов.
Иначе обстоит дело при соприкосновении металла с жидкой средой — водой и растворенными в ней веществами. Образующиеся при этом соединения могут растворяться, благодаря чему коррозия распространяется дальше вглубь металла. Кроме того, вода, содержащая растворенные вещества, является проводником электрического тока, вследствие чего постоянно возникают электрохимические процессы, которые являются одним из главных факторов, обусловливающих и ускоряющих коррозию.
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде почти не ржавеет. Но обыкновенные технические металлы всегда содержат различные примеси, что создает благоприятные условия для коррозии.
Чтобы понять, почему примеси влияют на коррозию металлов, посмотрим, что происходит, когда два различных металла соприкасаются друг с другом, находясь во влажном воздухе.
Положим, например, что в медном листе находится алюминиевая заклейка (рис. 129). Так как все твердые тела адсорбируют на своей поверхности влагу из воздуха, то и поверхность наших металлов будет покрыта тончайшей пленкой воды. Но вода, как известно, диссоциирует, хотя и в ничтожной степени, на ионы Н • и ОН’; кроме того, растворенный в воде углекислый газ образует угольную кислоту, диссоциирующую по уравнению:
Следовательно, медь и алюминий будут как бы погружены в раствор, содержащий ионы H • , ОН’ и НСО3‘. Получается гальванический элемент, в котором отрицательным электродом служит алюминий, а положительным — медь. Ввиду тесного соприкосновения обоих металлов элемент этот замкнут и непрерывно работает: алюминий посылает свои ионы в раствор, а избыточные электроны переходят к меди, у поверхности которой они разряжают ионы водорода. В растворе ионы Аl ••• соединяются с ионами ОН’, образуя Аl(ОН)3, выделяющийся у поверхности алюминия:
2Аl—6е — = 2Аl ••• 6Н • + 6e — = 3Н2
Таким образом, алюминий довольно быстро подвергается коррозии.
Несколько сложнее происходит коррозия железа, находящегося в контакте с каким-нибудь менее активным металлом, например с той же медью. Железо посылает в раствор двухвалентные ионы Fe •• , которые, соединяясь с гидроксильными ионами, превращаются в Fе(ОН)2. В то же время электроны железа переходят к меди и разряжают у ее поверхности ионы водорода.
Рис 130. Растворение в кислотах химически чистого цинка при контакте с медной или платиновой проволочкой.
В присутствии кислорода воздуха и воды Fe(ОН)2 окисляется в гидрат окиси железа Fe(OH)3 , образующий ржавчину:
В разобранных нами случаях причиной коррозии алюминия и железа являлся контакт с менее активным металлом — медью. Такую же роль, как и медь, играют различные примеси, всегда содержащиеся в технических металлах и обусловливающие их коррозию. Например, обыкновенная сталь при исследовании ее под микроскопом оказывается состоящей из мелких зерен чистого железа, тесно перемешанных с зернами карбида железа — цементита Fe3C — и других примесей. Получается бесконечное множе ство так называемых гальванических пар, в которых зерна цементита играют роль положительных электродов, а зерна железа — отрицательных. При соприкосновении с влажным воздухом возникают гальванические токи, вызывающие коррозию стали. Аналогичным образом примеси способствуют коррозии и других металлов.
Коррозия алюминия, цинка, железа и вообще металлов, стоящих в ряду напряжений слева от водорода, сводится по существу к вытеснению ионов водорода из раствора и переходу самого металла в раствор в виде ионов. Ускоряющее влияние контакта с менее активным металлом при таких процессах можно наглядно иллюстрировать следующим опытом.
В пробирку с разбавленным раствором кислоты бросим кусочек химически чистого цинка. Выделения водорода почти не наблюдается. Отсутствие реакции объясняется тем, что начинающие переходить в раствор ионы Zn •• гидратируются и образуют вокруг цинка слой положительно заряженных ионов. Этот слой не дает возможности ионам водорода подходить вплотную к поверхности цинка и получать от него электроны, вследствие чего дальнейшее растворение цинка приостанавливается. Но стоит только коснуться поверхности цинка платиновой или медной проволочкой, как вследствие образования гальванической пары тотчас же начинается энергичное выделение водорода у поверхности проволочки. Электроны переходят от цинка к платине (или меди) и с нее на ионы водорода, а цинк постепенно растворяется, посылая новые ионы в раствор (рис. 130).
Такой же эффект вызывает прибавление к раствору кислоты нескольких капель раствора сернокислой меди CuSO4. Цинк вытесняет медь и покрывается с поверхности рыхлым слоем металлической меди. Получается гальваническая пара цинк —медь, работающая, как в элементе Вольта. Поэтому «омедненный» цинк энергично вытесняет водород из кислоты, но выделение водорода происходит у поверхности меди, а не у поверхности цинка (рис. 131).
Продажный цинк, содержащий примеси, действует аналогичным образом.
На скорость растворения металла в кислоте, помимо примесей, влияют и другие факторы: структура металла, способ его обработки, свойства кислоты и т. п. Но во всех случаях процесс растворения может быть замедлен прибавлением к кислоте некоторых веществ, главным образом органических, получивших название ингибиторов (замедлителей коррозии).

Действие ингибиторов иногда настолько эффективно, что некоторые металлы и сплавы становятся практически нерастворимыми в кислотах, к которым прибавлен соответствующий ингибитор.
Замедляя растворение металла, ингибиторы в то же время совершенно не влияют на скорость растворения окислов металлов, их гидроокисей и других веществ. Поэтому прибавление ингибиторов позволяет освобождать с помощью кислот поверхность металла от покрывающих ее соединений (например, удалять ржавчину с железа, накипь со стенок котлов), почти не затрагивая самого металла.
Так как элементы расположены в ряду напряжений по убывающей активности, то следовало бы ожидать, что чем левее стоит элемент в ряду напряжений, тем легче он будет подвергаться корро-зии. В действительности это не всегда имеет место. Например, алюминий, стоящий недалеко от начала ряда, довольно хорошо сопротивляется атмосферной коррозии. Причиной такой устойчивости является образование на поверхности алюминия тонкой, но очень плотной и эластичной пленки окиси алюминия, предохраняющей алюминий от соприкосновения с окружающей средой. И действительно, стоит только тем или иным способом уничтожить эту пленку, как алюминий начинает быстро корродировать.
Смочим хорошо вычищенную наждачной бумагой алюминиевую пластинку раствором сулемы HgCl2. Алюминий вытесняет ртуть, которая образует с ним сплав — ртутную амальгаму, препятствующую возникновению защитной пленки. Поэтому оставленная на воздухе пластинка быстро покрывается рыхлыми хлопьями гидрата окиси алюминия — продуктом коррозии алюминия.
В данном случае коррозия усиливается еще и вследствие контакта алюминия с малоактивным металлом — ртутью.
Понятно, что образующийся на поверхности металла слой окислов или каких-либо других соединений может служить защитой только в том случае, если он является достаточно плотным, прочным и нерастворимым в воде. В противном случае он не может помешать коррозии. Так, например, появляющаяся на железе ржавчина совершенно не защищает его от дальнейшей коррозии, так как слой ее оказывается очень рыхлым, хрупким и слабо пристающим к поверхности металла.
Вещества, способствующие возникновению на металле защитной пленки, носят название пассивирующих агентов. Таковыми для большинства металлов являются сильные окислители. Для железа хорошим пассивирующим агентом служат также ионы ОН’.
Как уже указывалось раньше , многие довольно активные металлы становятся пассивными после обработки их концентрированной азотной кислотой вследствие образования на поверхности металла тончайшего невидимого слоя окиси, препятствующего дальнейшему окислению. Существование таких «оксидных пленок» доказано различными методами: поляризацией отраженного света, рентгенографическим путем и др. Теория «оксидных пленок» была подробно развита в начале нынешнего столетия В. А. Кистяковским (1865—1952), работы которого имели большое значение для борьбы с коррозией.
Некоторые вещества разрушают или ослабляют защитную пленку металла, тем самым способствуя коррозии. Такие вещества называются активирующими агентами или активаторами.
Наиболее энергичным активатором для всех металлов является ион Cl. Быстрое разрушение подводных металлических частей морских судов объясняется главным образом присутствием ионов Сl’ в морской воде. Очень энергичными активаторами для многих металлов являются ионы водорода. Кислород, растворенный в воде, также сильно ускоряет коррозию, связывая первичные продукты реакции (например, окисляя Fe(OH)2 в Fe(OH)3 в случае коррозии железа) и тем самым предотвращая возможность обратной: реакции.
Убытки, причиняемые коррозией металлов, огромны. Вычиc-лено, например, что вследствие коррозии ежегодно гибнет такое количество железа, которое равно приблизительно 1 /4 всей мировой его добычи за год. Поэтому изучению процессов коррозии и отысканию наилучших средств ее предотвращения уделяется очень много внимания.
Способы борьбы с коррозией чрезвычайно разнообразны. Наиболее простой из них заключается в защите поверхности металла от непосредственного соприкосновения с окружающей средой путем покрытия масляной краской, лаком, эмалью или, наконец,, тонким слоем другого металла. Особенный интерес с теоретической точки зрения представляет покрытие одного металла другим. Посмотрим, к каким результатам оно приводит.
Так как коррозия всегда возникает на поверхности металла, то до тех пор, пока слой защищающего металла является сплошным, изделие ведет себя так, как если бы оно целиком состояло из защищающего металла. Но если в защитном слое появляются царапины, трещины и т. п., обнажающие поверхность защищаемого металла, то в этих местах сейчас же создаются условия, благоприятствующие коррозии. Однако процесс коррозии будет протекать совершенно различно в зависимости от относительного положения обоих металлов в ряду напряжений.
Разберем сперва случай так называемого катодного по крытия, когда защищающий металл стоит в ряду напряжений правее защищаемого. Типичным примером может служить корро зия луженого, т.е. покрытого оловом, железа (белая жесть).
Олово само по себе очень устойчиво и хорошо защищает металл, пока слой его на железе является сплошным. При нарушении целостности защитного слоя и соприкосновении обнаженного места с влагой образуется гальваническая пара, в которой положительным электродом (катодом) служит олово , а отрицательным (анодом) —железо. Поток электронов направляется от обнаженной поверхности железа к олову и здесь разряжает ионы водорода, а железо подвергается разрушению, посылая все новые и новые ионы в раствор (рис. 132, а). Таким образом, в месте повреждения луженое железо ржавеет гораздо быстрее, чем нелуженое.

Совершенно иначе протекает коррозия, если защищающий металл стоит в ряду напряжений левее защищаемого, как, например, при покрытии железа цинком (анодное покрытие). В этом случае при повреждении защитного слоя тоже получается гальваническая пара, но теперь железо служит катодом, а анодом — цинк, и электроны переходят от цинка к железу; поэтому цинк разрушается, а железо остается защищенным (рис. 132, б). Защита действует до тех пор, пока не будет разрушен весь слой цинка, на что потребуется довольно много времени.
Из сказанного ясно, что для защиты от коррозии целесообразнее покрывать поверхность металла слоем более активного металла, чем слоем менее активного. Однако другие соображения нередко заставляют применять также покрытия из менее активных металлов.
На практике чаще всего приходится принимать меры к защите железа, как металла, особенно подверженного коррозии. Кроме цинка, из более активных металлов для этой цели иногда применяют кадмий, действующий подобно цинку. Из менее активных металлов для покрытия железа чаще всего применяют олово, медь и никель.
Покрытые никелем железные изделия имеют красивый вид, чем объясняется широкое распространение никелирования.
При повреждении слоя никеля коррозия происходит менее-интенсивно, чем при повреждении слоя меди (или олова), так как разность потенциалов для пары никель — железо гораздо меньше, чем для пары медь — железо.
Из других способов борьбы с коррозией упомянем еще о способе, протекторов, заключающемся в том, что защищаемый металлический объект приводится в контакт с большой поверхностью более активного металла. Так, в паровые котлы вводят листы цинка, находящиеся в контакте со стенками котла и образующие с ними гальванический элемент.
Вы читаете, статья на тему Коррозия металлов
Похожие страницы:
Содержание статьи1 Коррозия металлов и защита металлов от коррозии1.1 Условия коррозии металлов1.2 Электрохимическая коррозия1.3 Коррозия железа в кислой среде1.4 Замедлитель.
Содержание статьи1 Химические свойства металлов1.1 Удельный вес и температура плавления некоторых металлов1.2 Почему типичные металлы восстановители1.3 Вытеснение металлов из соединений.
Гидрид натрия NaH Основное получение гидрида натрия пропускание водорода через нагретый натрий при температуре до 360 — 400°C , а.
Механизм возникновения тока в гальванических элементах. Электродные потенциалы металлов Существует несколько теорий, объясняющих возникновение тока в гальванических элементах. Наиболее простая.
Сернистые металлы Соли сероводородной кислоты называются сернистыми металлами или сульфидами. Они могут быть получены непосредственным соединением металлов с серой. Смешав.
Получение металлов высокой чистоты Развитие в последние годы ряда новых отраслей техники ставит перед промышленностью задачу получения металлов значительно более.
Читайте также:
