Уравнение нернста для металлических и газовых электродов
Обновлено: 01.05.2024
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под электродом понимают лишь одну электронно-проводящую фазу. При пропускании тока от внешнего источника через систему из двух электродов, соединенных друг с другом через электролит, на электродах протекают два процесса: заряжение двойного электрического слоя и электрохимическая реакция.
В отличие от фазовых контактов металл-металл, металл-полупроводник, полупроводник-полупроводник и т. п. на фанице фаз, составляющих электрохимическую систему, вид носителей тока меняется, т. к. в электролите ток переносится ионами, а в электронно-проводящей фазе - электронами.
Непрерывность прохождения тока через фаницу фаз в этом случае обеспечивается электродной реакцией. Электрод называется анодом, если на его поверхности преобладает реакция, приводящая к генерированию электронов, т. е. происходит окисление веществ, содержащихся в электролите, либо ионизация металла анода. Электрод называется катодом, если с его поверхности электроны металла переходят на частицы реагирующих веществ, которые при этом восстанавливаются.
Классификация электродов проводится по природе окислителей и восстановителей, которые участвуют в электродном процессе. Электродом 1-го рода называют металл (или неметалл), погруженный в электролит, содержащий ионы этого же элемента. Металл электрода является восстановленной формой вещества, а его окисленной формой - простые или комплексные ионы этого же металла. Например, для системы СuСоответствующее такому электродному процессу Нернста уравнение для электродного потенциала Е имеет вид:
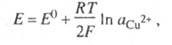
где E° - стандартный потенциал при т-ре Т; Tl(Hg). В такой системе могут изменяться концентрации и окисленной, и восстановленной форм, поэтому уравнение Нернста имеет вид:
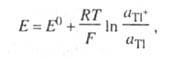
где aтl, - термодинамическая активность таллия в амальгаме.
Электроды 2-го рода - системы из металла М, покрытого слоем его же труднорастворимой соли (или оксида) и погруженного в раствор, содержащий анионы этой соли (для оксида -ионы ОН-). Окисленной формой является соль а восстановленная форма представлена металлом М и анионом A z- :

Уравнение Нернста имеет вид:
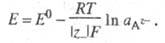
К электродам 2-го рода относятся многие электроды сравнения, например каломельный, хлорсеребряный, оксидно-ртутный.
Металл электрода может не участвовать в реакциях, а служить лишь передатчиком электронов от восстановленной формы вещества к окисленной; такие электроды называют окислительно-восстановительными или редокс-электродами. Например, платиновый электрод в растворе, содержащем ионы [Fe(CN)6] 4- и [Fe(CN)6] 3- , осуществляет перенос электронов между этими ионами в качестве передатчика (медиатора).
Среди окислительно-восстановительных электродов выделяют газовые электроды, состоящие из химически инертного металла (обычно Pt), к которому подводится электрохимически активный газ (например, Н2 или С12). Молекулы газа адсорбируются на поверхности металла, распадаясь на адсорбированные атомы, которые непосредственно участвуют в переносе электронов через границу раздела фаз.
Наиболее распространен водородный электрод, на поверхности которого образуются адсорбированные атомы Надс и устанавливается равновесие: Н2 2Надс 2Н+ + 2е. Различают типы электродов можно объединить в рамках так называемой концепции электронного равновесия на границе металл-электролит, согласно которой каждому равновесному электродному потенциалу соответствует определенная термодинамическая активность электронов в электролите.
Электроды называют идеально поляризуемым, если вследствие термодинамических или кинетических причин переход электронов через межфазную границу невозможен. При изменении потенциала такого электрода происходит только изменение строения двойного электрического слоя, что сопровождается протеканием тока заряжения, спадающего до нуля, когда перестройка двойного электрического слоя заканчивается. Для неполяризуемых, или обратимых, электродов переход электронов через границу фаз, напротив, незаторможен, и при пропускании тока через такой электрод его потенциал практически не изменяется.
По функциям в электрохимической системе электроды подразделяют на рабочие, вспомогательные и электроды сравнения. Рабочим называют электрод, на котором происходит исследуемый электрохимический процесс. Вспомогательный электрод (или противоэлектрод) обеспечивает возможность пропускания тока через электрохимическую ячейку, а электрод сравнения - возможность измерения потенциала рабочего электрода.
Специфика широко используемых в электрохимии жидких электродов (ртуть, амальгамы, галлий, жидкие сплавы на основе Ga -галламы, расплавы металлов и т. п.) связана с идеальной гладкостью их поверхности, истинная площадь которой совпадает с ее геометрической величиной, а также с энергетической однородностью и изотропностью свойств поверхности электродов и возможностью растворения выделяющихся металлов в материале электрода.
На практике электроды классифицируют по химической природе материала (металлические, неметаллические, оксидные, электроды из соединений с ковалентной связью, углеграфитовые и т.д.), форме (сферические, плоские, цилиндрические, дисковые и т. д.), условиям функционирования (неподвижные, вращающиеся и т. п.), размерам (микро- и ультрамикроэлектроды), пористости, гидрофильности, участию электродного материала в электродном процессе (расходуемые и нерасходуемые) и др. признакам.
Использование капельного ртутного электрода лежит в основе полярографии. Вращающийся дисковый электрод представляет интерес как система, для которой существует строгое решение диффузионной кинетические задачи. К особо практически важным электродам следует отнести каталитически активные и высоко коррозионностойкие оксидные рутениево-титановые аноды (ОРТА), применение которых революционизировало самое широкомасштабное электрохимическое производство – электролитическое получение хлора и щелочей.
Модифицирование электроды, получившее широкое распространение в электрокатализе, производстве химических источников тока, электрохимических сенсоров и т. п., основано как на физических (ионная имплантация, разрыхление поверхности, выращивание монокристаллических граней, создание монокристаллических структур, физическая адсорбция ионов и молекул и др.), так и химических методах. В частности, химически модифицированные электроды представляют собой проводящий или полупроводниковый материал, покрытый мономолекулярными (в т. ч. субатомными), полимолекулярными, ионными, полимерными слоями, в результате чего электрод проявляет химические, электрохимические и оптические свойства слоя.
Химическое модифицирование достигается хемосорбцией на поверхности электрода ионов и молекул, ковалентным связыванием различных агентов с поверхностными атомными группами, покрытием поверхности органическим, металлорганическим или неорганическим полимерными слоями, созданием композитов из электродного материала и вещества -модификатора.
Микроэлектроды имеют по крайней мере один из размеров настолько малый, что свойства электродов оказываются размерно зависимыми. Размеры микроэлектродов лежат в интервале 0,1-50 мкм, минимальная площадь составляет 10-14 м 2 (ультрамикроэлектроды), тогда как в большинстве электроаналитических экспериментов применяют электроды с площадью 5 х 10-5м 2 , в лабораторном электросинтезе - 10-2 м 2 . Основное преимущество микроэлектродов - возможность снизить с их помощью диффузионные ограничения скорости электродного процесса и, следовательно, изучать кинетику очень быстрых электродных реакций.
Из-за малой величины токов электрохимической ячейки с микроэлектродами характеризуются незначительным падением потенциала, что позволяет изучать системы с высокими концентрациями реагирующих частиц, обычно используемые в технологических процессах, применять высокие скорости сканирования потенциала при вольтамперометрических измерениях, проводить работы в плохо проводящих средах и т. п. Микроэлектроды используют для анализа ультрамалых проб, исследования процессов в живых организмах, в клинических целях. Ультрамикроэлектроды применяют в туннельной сканирующей микроскопии и в электрохимической нанотехнологии.
Электрохимические процессы. Уравнение Нернста. Электродные потенциалы металлических, газовых и окислительно-восстановительных электродов.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
где - электродный потенциал, E0 - стандартный электродный потенциал, измеряется в вольтах;
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— число Фарадея, равное 96485,35 Кл/моль;
— число моль электронов, участвующих в процессе;
и — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Стандартные потенциалы окислительно-восстановительных реакций. Возможность протекания любой окислительно-восстановительной реакции в реальных условиях обусловлена рядом причин: температурой, природой окислителя и восстановителя, кислотностью среды, концентрацией веществ, участвующих в реакции, и т. д. Учесть все эти факторы бывает трудно, но, помня о том, что любая окислительно-восстановительная реакция протекает с переносом электронов от восстановителя к окислителю, можно установить критерий возможности протекания такой реакции.
Количественной характеристикой окислительно-восстановительных процессов являются нормальные окислительно-восстановительные потенциалы окислителей и восстановителей (или стандартные потенциалы электродов).
Чтобы понять физико-химический смысл таких потенциалов, необходимо проанализировать так называемые электрохимические процессы.
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
При погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы.
У изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
Абсолютное значение электродного потенциала нельзя измерить непосредственно. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл - раствор. Такие пары называют полуэлементами. Условились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С.
44. Понятие об электродном потенциале.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
45. Электродный потенциал. Уравнение Нернста.
Вывод уравнения Нернста
E — электродный потенциал, E0 — стандартный электродный потенциал, измеряется в вольтах;
R — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура;
F — постоянная Фарадея, равная 96485,35 Кл·моль −1 ;
т — число моль электронов, участвующих в процессе;
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при46. Газовые электроды. Уравнение Нернста для расчета потенциалов газовых электродов
Газовые электроды состоят из проводника 1-го рода, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Проводник 1-го рода служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Проводник 1-го рода не должен посылать в раствор собственные ионы. Лучше всего удовлетворяют этому условию платина и платиновые металлы, поэтому они чаще всего используются при создании газовых электродов. Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то электродные потенциалы этих электродов зависят от парциальных давлений газов. Это можно показать на примерах водородного и кислородного электродов. Равновесие на водородном электроде выражается уравнением 2Н + +3е↔Н2. Уравнение для расчетов потенциалов водородного электрода можно вывести так же, как было введено уравнение для расчета потенциала металлического электрода. Оно имеет вид: или для 298 К
47. Гальванический элемент. Расчет эдс гальванического элемента.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ- химический источник тока, в котором лектрическаяэнергиявырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией. В состав гальванического элемента входят два разнородных электрода (один- содержащий окислитель, другой - восстановитель), контактирующие с электролитом. Различают гальванические элементы одноразового использования (т. н. первичные элементы, напр.Лекланше элемент), многоразового действия (электрические аккумуляторы) и с непрерывной подачей реагентов (топливные элементы). Ранеетермин"гальванический элемент" относился только к первичным элементам.
ЭДС гальванического элемента определяется как разность электродных потенциалов. По уравнению НЕРНСТА
8. Потенциалы металлических и газовых электродов. Уравнение Нернста
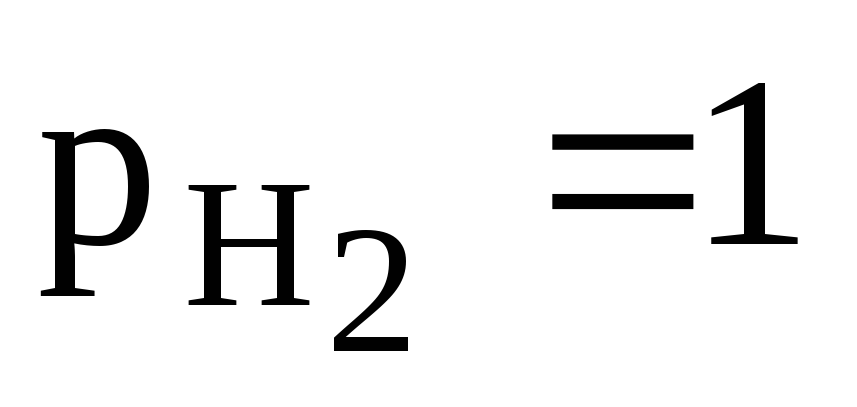
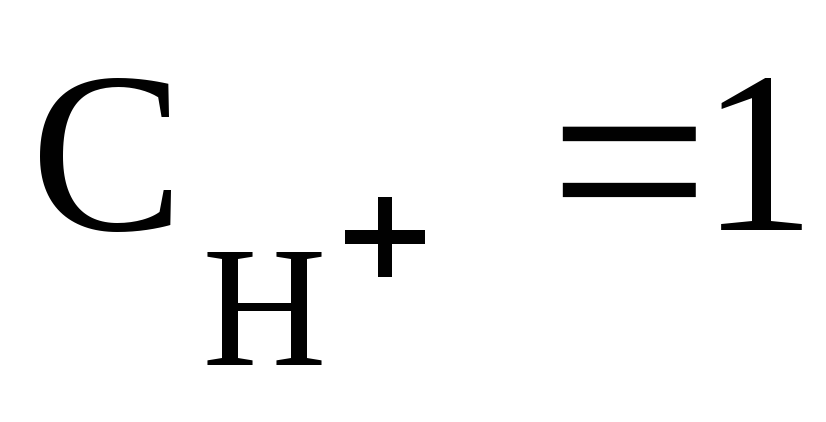
Так как по условию и, то для данного электрода уравнение (3) имеет вид:

(4)
Уравнение (4) называют уравнением Нернста. Переходя от натуральных логарифмов к десятичным и подставляя в уравнение (4) Т = 298К и значенияRиF, получаем:
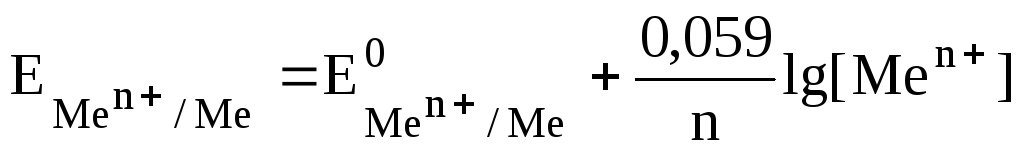
(5)
Величина - стандартный электродный потенциал металла.
Стандартным электродным потенциалом называют потенциал металлического электрода в растворе собственных ионов с концентрацией 1 моль/л.
На основе стандартных электродных потенциалов построен ряд напряжений металлов. Стандартный электродный потенциал является мерой восстановительной способности металла и окислительной способности его ионов. Чем меньше алгебраическое значение потенциала металла, тем сильнее его восстановительные свойства и тем слабее окислительная способность его ионов.
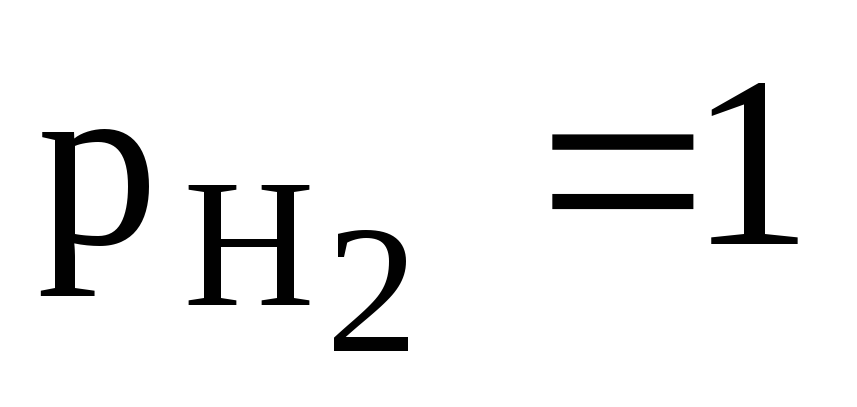
Для водородного электрода при уравнение Нернста имеет вид:
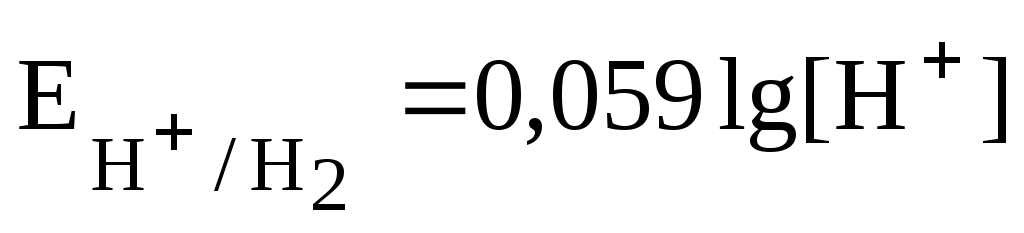
Учитывая, что рН = -lg[H + ], получаем:
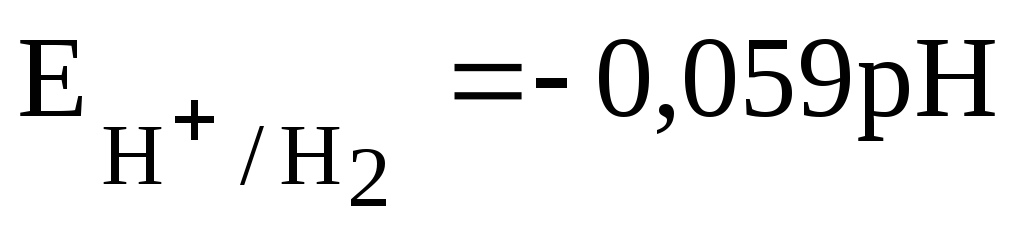
9. Окислительно-восстановительные электроды. Направление самопроизвольного протекания окислительно-восстановительных реакций
Окислительно-восстановительный электрод представляет собой пластину из инертного материала (Pt), которая контактирует с раствором, содержащим окисленную (Ox) и восстановленную (Red) формы вещества.
На электроде устанавливается равновесие:
Материал электрода не участвует в окислительно-восстановительном процессе, а является лишь проводником электронов. Разность потенциалов между пластиной и раствором возникает за счет обмена электронами.
Уравнение Нернста для окислительно-восстановительного электрода имеет вид:

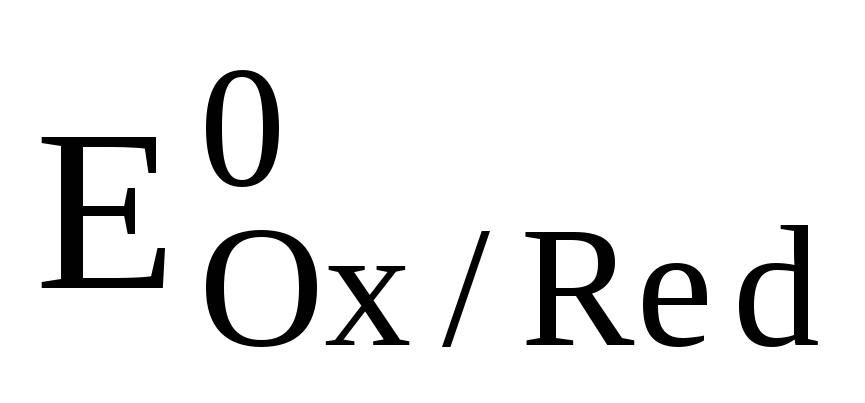
где -стандартный окислительно-восстановительный потенциал, измеренный при концентрациях всех участников электродной реакции, равных 1.
Например, для окислительно-восстановительной системы
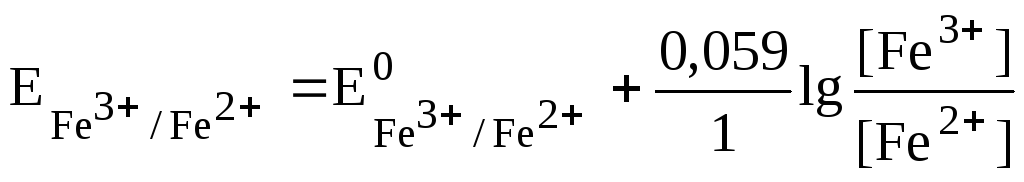
В более сложных системах потенциал зависит от рН среды. Например, для системы
= E° +
Стандартные окислительно-восстановительные потенциалы (редокс-потенциалы) приводятся в таблицах и являются мерой окислительной и восстановительной способности системы.
Окислительная способность системы возрастает со сдвигом потенциала в сторону положительных значений. Например, стандартный потенциал систем:
уменьшается в ряду фтор, хлор, бром, иод. Это означает, что наиболее сильным окислителем в этом ряду является фтор (), а наиболее слабым окислителем – иод ().
Восстановительная способность системы, напротив, растет со сдвигом потенциала в сторону отрицательных значений. Так, ряду галогенид-анионов наилучшим восстановителем является иодид-ион, в то время как фторид-анион восстановительных свойств практически не проявляет.
Значение окислительно-восстановительных потенциалов можно использовать для определения направления самопроизвольного протекания окислительно-восстановительных процессов. Согласно IIзакону термодинамики условием самопроизвольности процесса при изобарно-изотермических условиях является убыль энергии Гиббса системы (G и, следовательно, самопроизвольно будут протекать процессы, для которыхE >0 или
Е окислителя > Е восстановителя.
Таким образом, система с высоким окислительно-восстановительным потенциалом будет окислителем по отношению к системе с низким потенциалом.
Задача: Какая реакция будет протекать в системе FeCl2, FeCl3, SnCl2, SnCl4 при стандартном состоянии, если , а
Система Fe 3+ /Fe 2+ обладает более высоким значением потенциала и, следовательно, будет окислителем по отношению к системеSn 4+ /Sn 2+ . Таким образом, в данной системе будет протекать реакция окисления олова (II) соединением железа (III):
Использование стандартных потенциалов характеризует направление реакции при концентрациях всех участников реакции равных 1 моль/л. Как следует из уравнения Нернста, изменение концентраций окисленной и восстановленной форм, а в некоторых случаях и рН среды влияет на значение электродного потенциала и, следовательно, может влиять на направление протекания процесса.
Значительное влияние на редокс-потенциал системы оказывает комплексообразование и осаждение.
Рассмотрим влияние комплексообразования на редокс-потенциална примере взаимодействия ртути с иодоводородной кислотой. Как известно, ртуть не растворяется в разбавленных кислотах, так как редокс-потенциал системы
Hg 2+ +2e=Hgзначительно превышает потенциал водородного электрода:
2H + + 2e=H2Е 0 = 0 В
Однако в ртуть растворяется в иодоводородной кислоте, так как при избытке иодид-ионов образует устойчивый комплексный ион HgI4 2- с константой нестойкости Кн=10 -30 .
Уменьшение концентрации свободных ионов Hg 2+ за счет комплесообразования приводит к значительному снижению редокс-потенциала, который может быть рассчитан с учетом величины Кн.
При стандартном состоянии [HgI4 2- ]=1 моль/л и [I - ]=1 моль/л, а [Hg 2+ ]=Кн. Отсюда
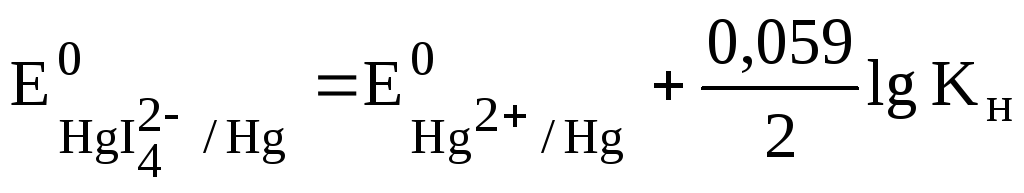
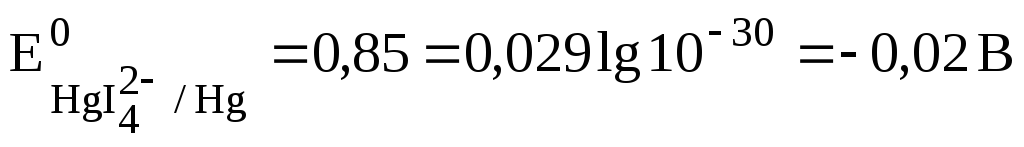
Снижение редокс-потенциала до отрицательных значений делает процесс растворения ртути в иодоводородной кислоте термодинамических возможным.
Уравнение Нернста и его различные формы
соответствует наиболее общая форма уравнения Нернста:
Если заменить натуральный логарифм десятичным и подставить соответствующие значения постоянных величин в предлогарифмическом сомножителе, то для температуры 298 К уравнение имеет вид
В дальнейшем будем пользоваться округленным значением числовой константы в логарифмическом слагаемом, что значительно упрощает расчеты, не внося в их результат существенной ошибки:
Например, для полуреакции
Sn 4+ + 2e – D Sn 2+
В различных частных случаях, в зависимости от характера полуреакции, уравнение Нернста записывается по-разному:
aA + bB + . + ne – D mM + nN + .
потенциал выражается уравнением
Обратим внимание на то, что в достаточно разбавленных водных растворах концентрацию воды можно считать величиной постоянной, поэтому она не фигурирует в знаменателе дроби, но в неявном виде входит в состав константы Е 0 . Данная форма уравнения Нернста соответствует тому весьма распространенному и важному случаю, когда окислительно-восстановительное равновесие протекает с участием среды.
2. Если окислительно-восстановительная система включает в себя малорастворимое вещество, то его концентрация, будучи также величиной постоянной, не включается в логарифмический член уравнения Нернста. Так, для полуреакции
уравнение Нернста имеет вид
3. Для металлических электродов, то есть для окислительно-восстановительных систем, представляющих собой металл, контактирующий с раствором, содержащим катионы этого же металла, например, для электрода
уравнение Нернста включает только концентрацию катионов металла в растворе, то есть
4. Если окислительно-восстановительная система включает в себя малорастворимый в воде газ (H2, O2, N2 и т.д.), то в уравнение Нернста входит не концентрация этого газа, а его парциальное давление. Например, для системы
уравнение Нернста должно быть записано следующим образом:
Однако в обычных условиях парциальное давление газа равно атмосферному, раствор насыщен этим газом, следовательно, еcть величина постоянная, и она входит в константу Е 0 , поэтому для данного случая
29. Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
| Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au |
30.Схема гальванического элемента
На аноде протекает процесс окисления цинка:
В результате этого атомы цинка превращаются в ионы, которые переходят в раствор, а цинковый анод растворяется, и его масса уменьшается. Обратите внимание, что анод в гальваническом элементе является отрицательным электродом (за счет электронов, полученных от атомов цинка) в отличие от процесса электролиза, где он подключается к положительном полюсу внешней батареи.
Электроны от атомов цинка по внешней электрической цепи (металлическому проводнику) движутся к катоду, где протекает процесс восстановления ионов меди из раствора ее соли:
В результате этого образуются атомы меди, которые осаждаются на поверхности катода, и его масса увеличивается. Катодом в гальваническом элементе является положительно заряженный электрод.
Суммарное уравнение реакции, протекающей в медно-цинковом гальваническом элементе, можно представить так:
Zn + Cu 2+ = Zn 2+ + Cu.
Фактически протекает реакция замещения меди цинком в ее соли. Эту же реакцию можно осуществить и иным способом — погрузить цинковую пластинку в раствор CuSO4. При этом образуются те же самые продукты — медь и ионы цинка. Но отличие реакции в медно-цинковом гальваническом элементе в том, что процессы отдачи и присоединения электронов пространственно разделены. Процессы отдачи (окисление) и присоединения (восстановление) электронов происходят не при непосредственном контакте атома Zn с ионом Сu 2+ , а в разных местах системы — соответственно на аноде и на катоде, которые соединены металлическим проводником. При таком способе проведения этой реакции электроны перемещаются от анода к катоду по внешней цепи, представляющей собой металлический проводник. Направленный и упорядоченный поток заряженных частиц (в данном случае электронов) и естьэлектрический ток. Во внешней цепи гальванического элемента возникает электрический ток.
31. Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом. При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu 2+ + Zn o ––> Сu o + Zn 2+
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента.
32. Электролиз. Последовательность разрядов ионов на электродах. Явление перенапряжения. Электролиз с растворимыми и нерастворимыми электродами.
Электролизом называется ОВ процесс, протекающий при пропускании постоянного электрического тока через раствор или расплав электролита. Возможные процессы: на катоде могут восстанавливаться ионы водорода, если среда кислая, ионы водорода из воды, если щелочная, ионы металла, на аноде могут окисляться кислотные остатки, могут окисляться гидроксид ионы, если среда щелочная, воды - если кислая или нейтральная.
Из растворов солей химически активные Ме, стоящие в ряду стандартных потенциалов до аллюминия включительно, на электроде не восстанавливаются, а восстанавливаются ионы водорода. На катоде легче всего восстанавливаются ионы менее активныхМе, стоящих в РСП после водорода. Из растворов солей Ме, которые расположены между аллюминием и водородом, восстанавливаются, но и возможно восстановление ионов водорода.
Процессы, протекающие при электролизе обратны процессам, идущим при работе гальвонического элемента: при электролизе химическоя реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Таким образом при электролизе возникает ГЭ (зарядка).
При рассмотрении анодных процессов следует иметь в виду, что на аноде может идти процесс окисления материала самого электрода. В связи с этим различают электролиз с растворимым и нерастворимым анодом. Нерастворимым называется анод, материал которого не претерпевает окисления в ходе электролиза. Растворимым называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для первого случая чаще всего применяют графит, уголь, платину. На нерастворимом аноде при электролизе водных растворов щелочей и фторидов происходит электрохимическое окисление воды с выделением кислорода. При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы (отрицательно заряженные ионы). Эта аномалия связана со значительным перенапряжением второго из этих процессов - материал анода оказывает тормозящее действие на процесс выделения кислорода.В случае растворимого анода число конкурирующих окислительных процессов возрастает до трёх : электрохимическое окисление воды с выделением кислорода, разряд аниона и электрохимическое окисление металла анода. Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в РСП раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Перенапряжение - это дополнительное напряжение, необходимое для того, чтобы прцесс электролиза пошёл. Чтобы процесс электролиза протекал, внешнее напряжение должно быть по крайней мере равно ЭДС возникшего ГЭ. Это напряжение называется теоретическим потенциалом разложения. Но на практике внешнее напряжение должно быть несколько больше, чем ЭДС возникшего ГЭ и подбирается практически.
Существует таблица перенапряжений. Перенапряжением выделения водорода называется смещение или сдвиг потенциала выделения водорода в сторону более отрицательных значений при при его выделении на данном материале по сравнению с выделением его на чернёной платине.
33. Электролиз находит применение в очистке сточных вод. Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия , хлора, хлорорганических соединений[источник не указан 220 дней], диоксида марганца[1], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии,биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.).
Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов.
Электролиз может осуществляться с растворимыми анодами - процесс электрорафинирования или с нерастворимыми - процесс электроэкстракции.
Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах.
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др.
Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми, либо переходят в электролит и удаляются.
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника пожразделяется на гальваностегию и гальванопластику.
Гальваностегия (от греч.покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера.
Перед покрытием изделия необходимо его поверхность тщательно очистить (обезжирить и протравить), в противном случае металл будет осаждаться неравномерно, а кроме того, сцепление (связь) металла покрытия с поверхностью изделия будет непрочной. Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях. При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
Гальванопластика– получение путем электролиза точных, легко отделяемых металлических копий относительно значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами.
С помощью гальванопластики изготовляют бюсты, статуи и т. д.
Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование "накладного" слоя никеля, серебра, золота и т. д.).
34. Фарадея законы, основные законы электролиза, отражающие общий закон сохранения вещества в условиях протекания электрохимической реакции. Установлены M. Фарадеем в 1833-34.
Согласно 1-му закону, масса вещества г, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролизаt, то есть количеству пропущенного электричества Q = It(предполагается, что I не зависит от t; в противном случае масса гпропорциональна t1 и t2 - моменты включения и выключения тока).
Согласно 2-му закону, для разных электродных процессов при одинаковом количестве пропущенного электричества Q массы прореагировавших веществ относятся друг к другу так же, как эквиваленты химические этих веществ. Оба закона Фарадея объединяются одним уравнением:
где M - молярная масса вещества, участвующего в электролизе, z - число элементарных зарядов, соответствующее превращению одной молекулы этого вещества, 1/F- коэффициент пропорциональности, общий для всех веществ, F - постоянная Фарадея, равная 96484,56 Кл/моль.
Законы Фарадея законы относятся к числу строгих законов, но в ряде случаев могут наблюдаться кажущиеся отклонения от них, вызываемые следующими причинами:
1) в нестационарных условиях электролиза часть электричества затрачивается на заряжение двойного электрического слоя.
2) если электролит обладает электронной проводимостью (например, раствор металлического Na в жидком аммиаке), то часть тока через электролит переносят электроны, а не ионы, и соответствующее количество электричества не участвует в процессе электролиза;
3) наряду с основным процессом электролиза, например образованием металлического Zn по реакции Zn 2+ + 2е 3O + + 2е = H2 + 2H2O; O2 + 4е + 4H3O + = 6H2O.
Системы, в которых полностью исключены указанные причины кажущихся отклонений от законов Фарадея, получили название кулонометров; их использование позволяет по количеству образовавшихся продуктов электролиза точно определить кол-во пропущенного электричества. В кулонометрах обычно применяют электрохимические реакции Ag + + е = Ag или 3I - = I3 - + 2е.
Законы Фарадея законы сыграли важную роль в понимании природы химической связи и развития атомно-молекулярной теории. Их используют при выводе всех уравнений, описывающих электрохимические превращения веществ на границах раздела проводников 1-го и 2-го рода. Практическое применение законы Фарадея законы находят в кулонометрии, а также при определении выхода реакции по току, то есть отношения теоретического количества электричества, рассчитанного на основе законов Фарадея законы, к количеству электричества, реально затраченному на получение данного вещества в процессе электролиза.
Читайте также:
