В химических реакциях металлы 2 группы главной подгруппы
Обновлено: 04.10.2024
С ростом заряда ядра многие важнейшие характеристики элементов изменяются немонотонно, в том числе и атомный радиус. Соответственно, свойства простых веществ, оксидов, гидроксидов и других соединений этих элементов имеют неоднозначный характер изменения. Особенно резко выделяется первый элемент подгруппы - бор, являющийся единственным неметаллом среди s 2 p 1 -элементов. Бор проявляет диагональное сходство с элементом главной подгруппы IV группы - кремнием Si.
Алюминий - важнейший элемент подгруппы, также имеет целый ряд специфических особенностей, отличающих его от бора, с одной стороны, и от подгруппы галлия, с другой стороны.
Характеристические соединения
Отношение к воде
слабая кислота 1-основная
амфотерный (идеальный амфолит)
основный со слабыми признаками амфотерности
амфотерный (основные свойства преобладают)
основание (подобен щелочам)
Алюминий
13Аl [Ne] 3s 2 3p 1
1 стабильный изотоп 27 Al
Кларк в земной коре 8,8 % по массе, самый распространенный металл. В свободном виде не встречается.
Основная форма нахождения в природе - Аl2O3 (в составе различных силикатов, полевых шпатов и глин). Встречается также в виде двойных солей: KAl(SO4)2, Na3[AlF6] и др.

Физические свойства
Простое вещество алюминий - лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. По электропроводности занимает 4-е место после Сu, Аg, Аu.
Способы получения
1. Электролиз расплава AlCl3:
2. Основной промышленный способ - электролиз расплава Al2O3 (глинозема) в криолите 3NaF • AlF3:
AlCl3 + ЗК = Al + 3KCl
Химические свойства
Аl - очень химически активный металл, однако при обычных условиях ведет себя довольно инертно - имеет высокую температуру воспламенения, со многими веществами реагирует только при высокой температуре; все реакции с участием Al проходят через первоначальный замедленный период. Такое химическое поведение алюминия объясняется наличием на его поверхности очень тонкой, прочной, газо- и водонепроницаемой пленки Al2O3. При нарушении цельности этой пленки AI реагирует со многими веществами как активный восстановитель:
Al 0 - Зе - → Аl 3+
В подавляющем большинстве соединений атомы алюминия связаны с соседними атомами ионными связями.
1. Взаимодействие с кислородом и другими неметаллами (галогенами, серой, азотом, углеродом).
Наиболее активно реагирует порошкообразный Al (алюминиевая пудра).
При обычной температуре реакция протекает только на поверхности. После нагревания до температуры воспламенения измельченный Аl сгорает с высоким экзотермичным эффектом.
б) 2Al + 3Cl2 = 2АlСl3 хлорид
Реакция с I2 протекает в присутствии воды. С F2 реакции нет. т. к. в первый же момент образуется прочный поверхностный слой AlF3.
2Al + N2 = 2AlN нитрид
4Al + ЗС = АlС3 карбид
г) C Н2 алюминий непосредственно не соединяется.
2. Взаимодействие с водой в присутствии щелочи.
1) растворение оксидной пленки Al2O3;
2) предотвращение образования нерастворимого гидроксида Аl(ОН)3.
Na[Al(OH)4] - тетрагидроксо-алюминат натрия
В отсутствие щелочи алюминий может вытеснять Н2 из воды в следующих условиях:
1) если его поверхность амальгамировать (покрыть ртутью);
2) в вакууме или в среде инертного газа после предварительной очистки поверхности металла от оксидной пленки.
3. Взаимодействие с «неокисляющими» кислотами (HCl, H2SO4 разб. и др.)
2Al + 6Н + → 2Al 3+ + 3H2↑
4. Взаимодействие с очень концентрированными HNO3 и H2SO4
При обычной Т реакции не протекают, т. к. происходит пассивирование поверхности Al, связанное с внедрением в нее атомарного или молекулярного кислорода, а также образованием его нерастворимых соединений с Al.
При нагревании реакции протекают довольно активно:
5. Взаимодействие с разбавленной HNO3
Реакция медленно протекает при обычной Т, при нагревании - более быстро.
6. Взаимодействие с органическими кислотами
Реакции протекают с разбавленными уксусной и лимонной кислотами при нагревании, ускоряются в присутствии NaCl:
Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Общая характеристика подгруппы
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
- постоянная валентность II
- постоянная степень окисления +2
- легкость образования 2-зарядных ионов Me +2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
- энергия ионизации Еион уменьшается
- сродство атомов к электрону уменьшается
- металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название - щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
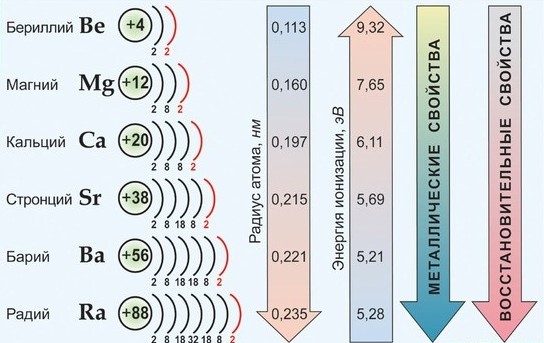
Среди s 2 -элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s 2 -элементы - белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
не растворимый, не взаимодействует
хорошо растворимые, взаимодействуют
Магний
Изотопы 24 Mg (78.60 %)
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
- магнезит MgCO3 - доломит СаСО3 • МgСО3
- карналлит КСl • МgСl2 • 6Н2O
- горькая (английская) соль MgS04• 7H2O В виде катионов Mg 2+ находится в природных водах (в 1 м 3 морской воды содержится около 1 кг Mg 2+ ). Наряду с ионами Са 2+ обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний - единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
В чистом виде магний - блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Mg - химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Взаимодействие с кислородом и азотом при горении на воздухе
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
Взаимодействие с водой
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой - нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой - это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Взаимодействие с углекислым газом и др. оксидами
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
Взаимодействие с оксидами и солями металлов
См. «Основные способы получения металлов. Магнийтермия».
Взаимодействие с галогенопроизводными УВ (в среде безводного эфира)
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223 Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li + к Cs + . Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li + лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку. Исследования показали, что в водном растворе катион лития Li + окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере). По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С. С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М + = Na + , К + , Rb + , Cs + соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М + , входящих в состав практически всех химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М 2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.
Маленький радиус иона Li + и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже:
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s 2 | [Ne]3s 2 | [Ar]4s 2 | [Kr]5s 2 | [Xe]6s 2 | [Rn]7s 2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: |
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s 2 -пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M 2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы. Так, ион Be 2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4] 2+ , (Bе(OH)4] — ), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns 2 nр 1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp 2 -гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp 3 -гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство. У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s 2 2p 1 | [Ne]3s 2 3p 1 | [Ar]3d 10 4s 2 4p 1 | [Kr]4d 10 5s 2 5p 1 | [Xe]4f 14 5d 10 6s 2 6p 1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s 2 .
Читайте также:
