В образовании металлической кристаллической решетки принимают участие ионы металлов
Обновлено: 26.04.2024
Металлы в кристаллическом состоянии образуют металлическую кристаллическую решетку , в узлах которой находятся атомы металла, а электроны металла ( валентные) обладают повышенной подвижностью и могут свободно перемещаться в пределах кристалла. [17]
Полинг предположил, что связи в металлической кристаллической решетке находятся в резонансе и валентные электроны в кристалле распределены статистически ( равномерно) между всеми соседними атомами. Согласно теории Полинга, между атомами металлов устанавливаются двухэлектронные связи, которые непрерывно разрываются и восстанавливаются между различными парами соседних атомов в решетке. В образовании металлических связей в кристаллическом натрии принимает участие один валентный электрон от каждого атома. [19]
Результатом связывания атомов является образование более сложных структур - молекул, молекулярных ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решеток . [20]
Охарактеризуйте отличительные физические свойства веществ, которые имеют: а) молекулярную кристаллическую решетку; б) ионную кристаллическую решетку; в) атомную кристаллическую решетку; г) металлическую кристаллическую решетку . [21]
Ушедшие с оксидной фазы электроны компенсируются электронами, поступающими на эту фазу из металла. При этом в металлической кристаллической решетке облегчается подвижность катиона металла, который по ка-тионным вакансиям оксидной фазы продвигается к ее поверхности и, захватывая анион кислорода, превращается в оксид. В результате слой оксида металла увеличивается в размерах в том направлении, откуда поступает кислород. Говорят, что кислород как бы всасывает металл через оксидный слой, выводя все новые и новые его порции на поверхность. [23]
Большинство металлов в твердом состоянии относится к кристаллическим веществам. На рис. 3.4 показана металлическая кристаллическая решетка натрия . В узлах кристаллической решетки расположены атомы металла. Из рисунка видно, что каждый атом натрия окружен восемью такими же атомами. [24]
Большинство кристаллических органических соединений имеют молекулярную решетку. В твердом состоянии металлы образуют металлические кристаллические решетки . [26]
В данном случае рассматривается внедрение легких атомов в искаженную решетку, не отвечающую исходному металлу. Если же атомы неметалла внедряются в исходную металлическую кристаллическую решетку , то образуется просто твердый раствор внедрения. [27]
Простейшими видами дефектов, наблюдаемых даже в случае кристаллической решетки идеально чистых химических веществ являются так называемые дефекты по Френкелю и по Шоттки. При некоторых определенных условиях атом ( рассмотрим лишь случай металлической кристаллической решетки , так как для других типов решеток картина будет аналогичной) может покинуть занимаемый им узел в кристаллической решетке и переместиться в некоторую ее другую часть, причем так далеко, что взаимодействие между полем этого атома и полями атомов, окружающих освободившееся место, будет крайне мало. Если при этом удаленный атом займет в новом месте положение в междоузлии, то образующийся дефект, представляющий пару дырка - атом в междоузлии, не взаимодействующей между собой, будет называться дефектом по Френкелю. [28]
Дело в том, что в наше время, характеризующееся стыком различных наук, в частности химии и физики, ни химику практически немыслимо отмежеваться хотя бы от некоторого контакта с физикой, ни физику - от контакта с химией. Может ли преподающий или изучающий свойства металлов не иметь представления о своеобразии металлической кристаллической решетки , о термоэлектронном и фотоэлектрическом эффектах, об электродных потенциалах, о механизме полупроводимости, о физико-химическом анализе, о нехимических методах получения отсутствующих в природе элементов. Ответ может быть только отрицательным. И вот автор, зная на основе своего многолетнего общения с учителями химии в институте усовершенствования ( МГИУУ) их слабую сторону, заключающуюся как раз в стремлении отмежеваться от всех тех вопросов, которые хотя бы в слабой степени контактируют с физикой и техникой, сделал попытку помочь им преодолеть ее. Значительный акцент, сделанный на смежные для химии и физики вопросы, составляет, по мнению автора, вторую особенность этой книги. [29]
Существует несколько типов кристаллических решеток. В зависимости от того, из какого сорта частиц построен кристалл, различают атомные, ионные, молекулярные и металлические кристаллические решетки . [30]
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
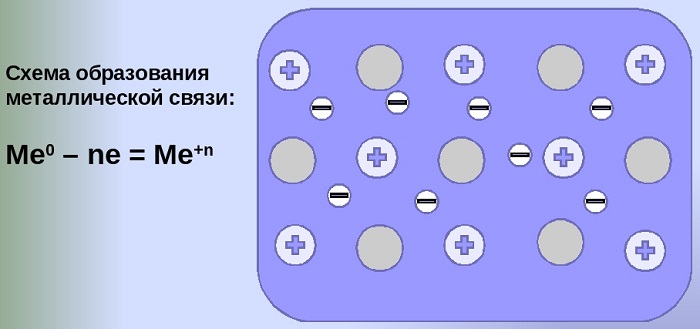
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
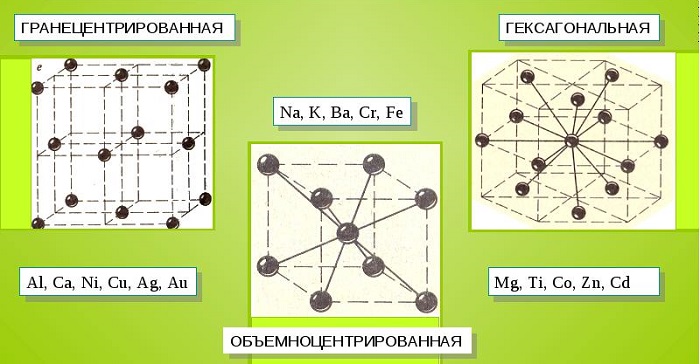
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
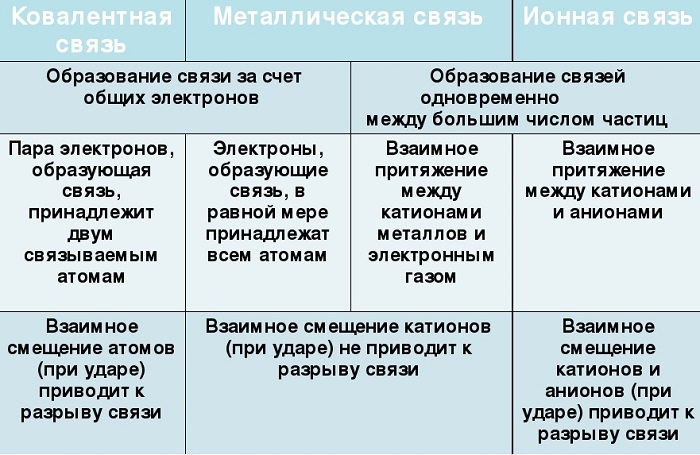
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
1. Типы кристаллических решёток
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой .
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную , металлическую , атомную и молекулярную .
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na + и хлора Cl − , а в узлах решётки сульфата калия чередуются простые ионы калия K + и сложные сульфат-ионы S O 4 2 − .
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые , тугоплавкие , нелетучие . Такие вещества хорошо растворяются в воде .

Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск , ковкость , пластичность , хорошо проводят электрический ток и тепло .

Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит , кремний , бор и германий , а также сложные вещества, например, карборунд SiC и кремнезём , кварц , горный хрусталь , песок , в состав которых входит оксид кремния(\(IV\)) Si O 2 .
Таким веществам характерны высокая прочность и твёрдость . Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения . Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.

Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость , низкие температуры плавления и кипения .
Такие вещества летучи . Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами ( He , Ne , Ar , Kr , Xe , Rn ), а также неметаллы с двух- и многоатомными молекулами ( H 2 , O 2 , N 2 , Cl 2 , I 2 , O 3 , P 4 , S 8 ).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд , иод , твёрдые аммиак , кислоты , оксиды большинства неметаллов . Большинство органических соединений тоже представляют собой молекулярные кристаллы ( нафталин , сахар , глюкоза ).


Попробуем определить, каковы примерно температуры плавления у фторида натрия , фтороводорода и фтора .
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF , HF и F 2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
Большая Энциклопедия Нефти и Газа
Образования кристаллической решетки при электролизе со ртутным катодом не происходит, и, следовательно, процесс не связан с энергетическими затратами, неизбежными при образовании новой поверхности кристалла. [1]
Образование кристаллической решетки при затвердевании жидкого металла называется процессом кристаллизации. На рис. 24, а показана кривая охлаждения кристаллического тела, горизонтальный участок на которой соответствует собственно процессу кристаллизации. [3]
Образование кристаллической решетки атомами металлов обусловлено наличием между ними металлической связи. Сущность ее заключается в следующем. Согласно теории металлического состояния, у всех или некоторых атомов, расположенных в узлах кристаллической решетки, отдельные валентные электроны, находящиеся на наружной электронной оболочке, отрываются и свободно перемещаются между образовавшимися при отрыве электронов положительно заряженными ионами и сохранившимися нейтральными атомами, образуя электронный газ. Эти электроны при непрерывном перемещении в кристаллической решетке одновременно притягиваются к нескольким положительно заряженным ионам, что и обеспечивает металлическую связь между ними. [4]
Образование кристаллической решетки сопровождается уменьшением запаса внутренней энергии тела. [5]
Образование кристаллической решетки и характер ее обусловливаются наличием определенного рода связи между металлическими атомами. Атомы металла образуют кристалл благодаря наличию так называемой металлической связи. [7]
Образование кристаллической решетки атомами металлов обусловлено наличием между ними металлической связи. Сущность ее заключается в следующем. Согласно теории металлического состояния, у всех или некоторых атомов, расположенных в узлах кристаллической решетки, отдельные валентные электроны, находящиеся на наружной электронной оболочке, отрываются и свободно перемещаются между образовавшимися при отрыве электронов положительно заряженными ионами и сохранившимися нейтральными атомами, образуя электронный газ. Эти электроны при непрерывном перемещении в кристаллической решетке одновременно притягиваются к нескольким положительно заряженным ионам, что и обеспечивает металлическую связь между ними. [8]
После образования кристаллической решетки по всему сечению шва доминирующее значение приобретают диффузионные процессы в твердой фазе, протекающие по двум противоположным законам: выравниванию химического состава и восходящей диффузии, обусловленной химическим сродством элементов друг к другу. Последнее приводит к тому, что углерод, имеющий малый диаметр атома и большую скорость диффузии, диффундирует в зоны, где его концентрация максимальна, но имеются малоподвижные карбидообразующие элементы. Главное значение в этом процессе имеет скорость диффузии отдельных элементов в объемах с ГЦК - и ОЦК-решетками. При всех температурах диффузионная подвижность углерода в Fe-a заметно выше, чем в более плотноупакованной решетке Fe - y, а коэффициент диффузии углерода в Fe-a выше, чем в Fe - y, при 900; 755 и 500 С соответственно в 39; 126 и 835 раз. [9]
После образования кристаллической решетки по всему сечению шва доминирующее значение приобретают диффузионные процессы в твердой фазе, протекающие по двум противоположным законам: выравнивания химического состава и восходящей диффузии, обусловленной химическим сродством элементов между собой. Последнее приводит к тому, что углерод, имеющий малый диаметр атома и большую скорость диффузии, диффундирует в зоны, где его концентрация выше, но имеются малоподвижные свободные карбидообразующие элементы. [10]
Теплота образования кристаллической решетки из ионного пара может быть найдена более точно, если дополнительно учесть взаимную поляризуемость ионов соли. [11]
Теплота образования кристаллической решетки из ионного пара может быть найдена более точно, если дополнительно учесть взаимную поляризуемость ионов соли. [12]
Энергия образования кристаллических решеток из газообразных ионов типа Na и С1 - составляют значения порядка сотен кДж / моль, что значительно превышает значения энергии образования молекул типа NaCl в газовой фазе. [13]
С образованием кристаллической решетки в реальных кау-чуках существенно меняется характер деформации. [14]
При образовании кристаллической решетки из атомов Л и В не была учтена кинетическая энергия валентных электронов. Из данных, приведенных в табл. 1, следует, что если электронное сродство приближается по величине к энергии сцепления, эта кинетическая энергия погашается действием кулонов-ских сил притяжения, возникающих при переводе электрона от атома А к атому В. В щелочногалоид-ных соединениях кинетическая энергия вносит существенный вклад в энергию сцепления. [15]
Читайте также:
