В окислительно восстановительных реакциях щелочные металлы являются
Обновлено: 19.05.2024
Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений, называются окислительно-восстановительными. Под степенью окисления (с.о.) понимают заряд элемента в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов.
Степень окисления элемента в простом веществе, например в Zn, Сa, H2, Вг2, S, O2, равна нулю.
Определение степени окисления элемента в соединении проводят, используя следующие положения:
1. Степень окисления кислорода в соединениях обычно равна –2. Исключения составляют пероксиды H2 +1 O2 –1 , Na2 +1 O2 –1 и фторид кислорода О +2 F2.
2. Степень окисления водорода в большинстве соединений равна +1, за исключением солеобразных гидридов, например, Na +1 H -1 .
3. Постоянную степень окисления имеют металлы IА группы (щелочные металлы) (+1); металлы IIА группы (бериллий, магний и щелочноземельные металлы (+2)); фтор (–1).
4. Алгебраическая сумма степеней окисления элементов в нейтральной молекуле равна нулю, в сложном ионе – заряду иона.
В качестве примера рассчитаем степень окисления марганца в соединении К2MnO4 и в анионе (MnO4) − . Сначала поставим степень окисления над теми элементами, для которых она известна. В нашем примере постоянную степень окисления имеют калий (+1) и кислород (-2). Степень окисления марганца обозначим через х. Далее составляем алгебраическое уравнение. Для этого индекс при каждом элементе умножаем на степень окисления этого элемента, все складываем и приравниваем правую часть нулю:
К2 +1 Mn х O4 –2 2∙(+1)+ x + 4 (–2) = 0 x = + 6
Таким образом, степень окисления хрома в К2MnO4 равна +6.
Чтобы определить степень окисления марганца в анионе (MnO4) ‾ поступаем точно также, только правую часть приравниваем заряду иона, в нашем случае -1
(Mn х O4 −2 ) ‾ x + 4 (–2) = –1 x = + 7.
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим.Окисление – процесс отдачи электронов, сопровождающийся повышением степени окисления элемента. Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления элемента. Окисление и восстановление – взаимосвязанные процессы, протекающие одновременно. Окислителями называют вещества (атомы, молекулы или ионы), которые в процессе реакции присоединяют электроны, восстановителями – вещества, отдающие электроны.
восстановитель Ca 0 –2ē → Ca +2 окисление
окислитель Cl2 0 +2ē → 2Cl – восстановление.
Окислителями могут быть:
1. Простые вещества - неметаллы: галогены F2,Cl2, Br2, I2, кислород O2, сера S.
2. Положительно заряженные ионы металлов Fe 3+ , Au 3+ , Hg 2+ , Cu 2+ , Ag + .
4. Атомы неметаллов в положительной степени окисления HN +5 O3, концентрированная H2S +4 O4, HCl +1 O, KCl +5 O3, NaBr +1 O и др.).
Типичными восстановителями являются:
1. Простые вещества - металлы. У металлов на внешнем уровне находится 1, 2, 3 электрона, которые они легко отдают М 0 −nē → М n + ,
где n – число отданных электронов, равное 1, 2, 3, М – металл (Na, Ca, Mg, Al и др.)
2. Простые вещества - неметаллы (углерод, водород, кремний, бор).
3. Отрицательно заряженные ионы неметаллов (S 2- , I - , Br - , Cl - и др.).
4. Положительно заряженные ионы металлов в низшей степени окисления (Sn 2+ , Fe 2+ , Cr 2+ , Mn 2+ , Cu + и др.).
Соединения, содержащие элементы в максимальной и минимальной степенях окисления, могут быть соответственно или только окислителями (KMnO4, K2Cr2O7, HNO3, H2SO4, PbO2), или только восстановителями (KI, Na2S, NH3). Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем. Например, нитрит калия KNO2, содержащий азот в степени окисления +3, пероксид водорода H2O2, содержащий кислород в степени окисления -1, в присутствии сильных окислителей проявляют восстановительные свойства, а при взаимодействии с активными восстановителями являются окислителями.
Восстановители и окислители
Для протекания химической ОВР необходимо присутствие атомов, молекул или ионов, взаимно противоположных по способности отдавать или присоединять электроны.
Окислительно-восстановительные свойства элементов зависят от их положения в периодической системе элементов Д. И. Менделеева и от их степени окисления в составе веществ.
В периодах системы Д. И. Менделеева с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, в 3-м периоде натрий – самый активный восстановитель , а хлор- самый активный окислитель. Объясняется это строением атомов элементов (раздел 2.13).
В группах периодической системы Д. И. Менделеева с повышением порядкового номера элемента, т. е. сверху вниз, возрастают восстановительные свойства простых веществ, а окислительные - убывают. Так, в главной подгруппе VI группы кислород – окислитель, сера проявляет слабые окислительные свойства, а теллур в некоторых реакциях уже является восстановителем. Это объясняется возрастанием сверху вниз числа энергетических уровней атомов, их радиус становится больше и, следовательно, внешние электроны слабее удерживаются.
Атомы металлов присоединять электроны не могут, они обладают только восстановительными свойствами, поэтому металлы часто называют элементами - восстановителями. Атомы металлических элементов содержат на внешнем уровне главным образом по 1-2 электрона. Таковыми являются элементы главных подгрупп 1-2 группы, элементы побочных подгрупп, лантаноиды и актиноиды.
Для неметаллов более характерно присоединение электронов, поэтому часто неметаллы называют элементами – окислителями. Атомы неметаллических элементов содержат на внешнем уровне 4-7 электронов, как правило. Наиболее активно присоединяют электроны атомы фтора, который имеет саму высокую электроотрицательность, является самым сильным окислителем и в реакциях не отдаёт электронов. За ним по величине электроотрицательности и, следовательно, по окислительной способности идёт кислород, атомы которого могут отдавать электроны только атомам фтора. Другие неметаллы могут не только принимать, но и отдавать электроны, а значит, проявляют не только окислительные, но и восстановительные свойства. Последние, однако, у них выражены много слабее, чем окислительные. Все зависит от того, с каким веществом вступает в реакцию данный неметалл. Если это восстановитель, то атом неметалла проявляет окислительные свойства. Например, сера является окислителем в реакции взаимодействия с железом; при взаимодействии с кислородом, наоборот, сера проявляет свойства восстановителя:
Наиболее ярко восстановительные и окислительные свойства выражены у атомов элементов «крайних» групп периодической системы – щелочных металлов и галогенов. Лучшие восстановители – щелочные металлы и наиболее активный из них - франций. Лучшие окислители – галогены и наиболее активный из них фтор. По мере приближения к середине периодической системы, к 4 группе, как восстановительные, так и окислительные свойства атомов становятся менее ярко выраженными.
Элементы в составе соединений, находящиеся в высшей степени окисления, могут в ОВР выступать только в качестве окислителей, степень окисления элемента может в этом случае только понижаться. Соответственно молекулы, ионы, содержащие атомы элементов (металлов и неметаллов) в высшей степени окисления, также являются окислителями.
Например, MnO4 - , Cr2O7 2- , NO3 - , CO2 и др. Элементарные ионы металлов (Na + , Ca 2+ , Fe 3+ , Сu 2+ , и т.д.) в высшей степени окисления могут обладать только окислительными свойствами, которые тем сильнее выражены, чем меньше активность металла. Катионы щелочных и щелочно-земельных металлов почти не проявляют окислительных свойств. Напротив, ионы малоактивных металлов в высшей степени окисления (Ag + , Au 3+ , и т.д.) – окислители.
Элементы в составе соединений, находящиеся в низшей степени окисления, могут быть, наоборот, только восстановителями; здесь степень окисления может только повышаться. Элементарные анионы проявляют только восстановительные свойства. Например, СI, Br, I, S 2- , теряя в процессе реакции электроны, окисляются, соответственно, в свободный хлор, бром, йод, серу. Чем активнее неметаллы как окислители, тем менее активны их элементарные анионы как восстановители. Так, в ряду СI, Br, I, восстановительная способность возрастает. Ионы металлов в низшей степени окисления Mn 2+ , Fe 2+ , Сu + , Sn 2+ также могут проявлять восстановительные свойства.
Если же элемент находится в промежуточной степени окисления, то его атомы могут, в зависимости от условий, как принимать, так и отдавать электроны. В первом случае степень окисления элемента будет понижаться, во втором – повышаться. Поэтому соединения, содержащие элементы в промежуточных степенях окисления, обладают окислительно-восстановительной двойственностью – способностью вступать в реакции как с окислителями, так и восстановителями. Например, азотистая кислота HNO2 и ее соли, где степень окисления азота равна (+3), вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В качестве примеров окислительно-восстановительной двойственности азотистой кислоты и ее солей можно привести реакции:
Наиболее часто применяемые восстановители и окислители приведены в табл. 9.1.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Металлы IA группы
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
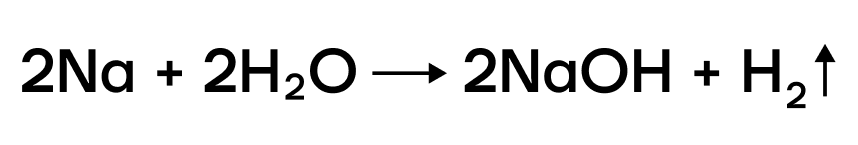
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
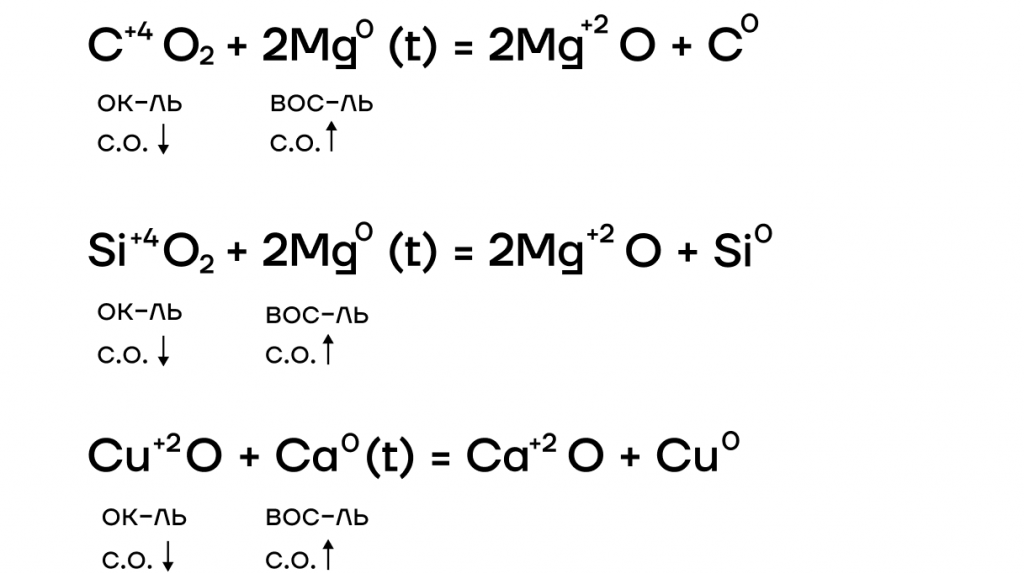
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
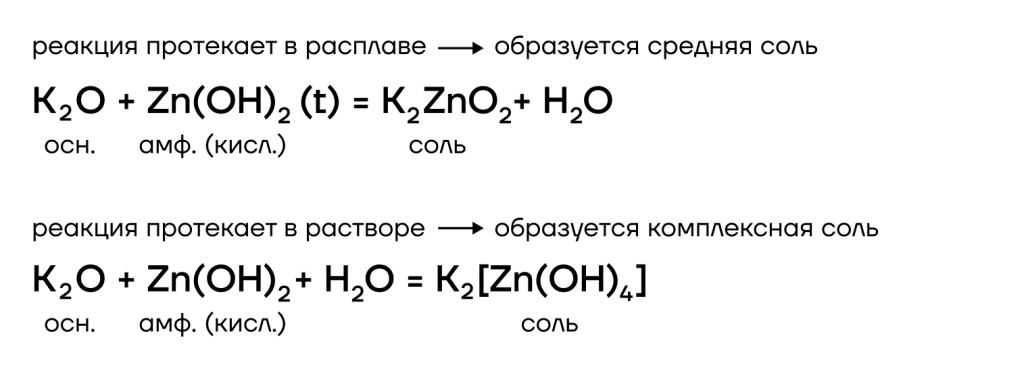
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
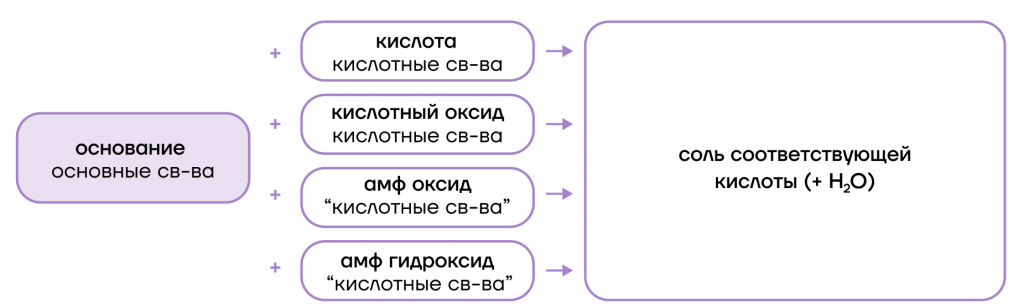
- вступают в реакции ионного обмена с кислотами и солями:
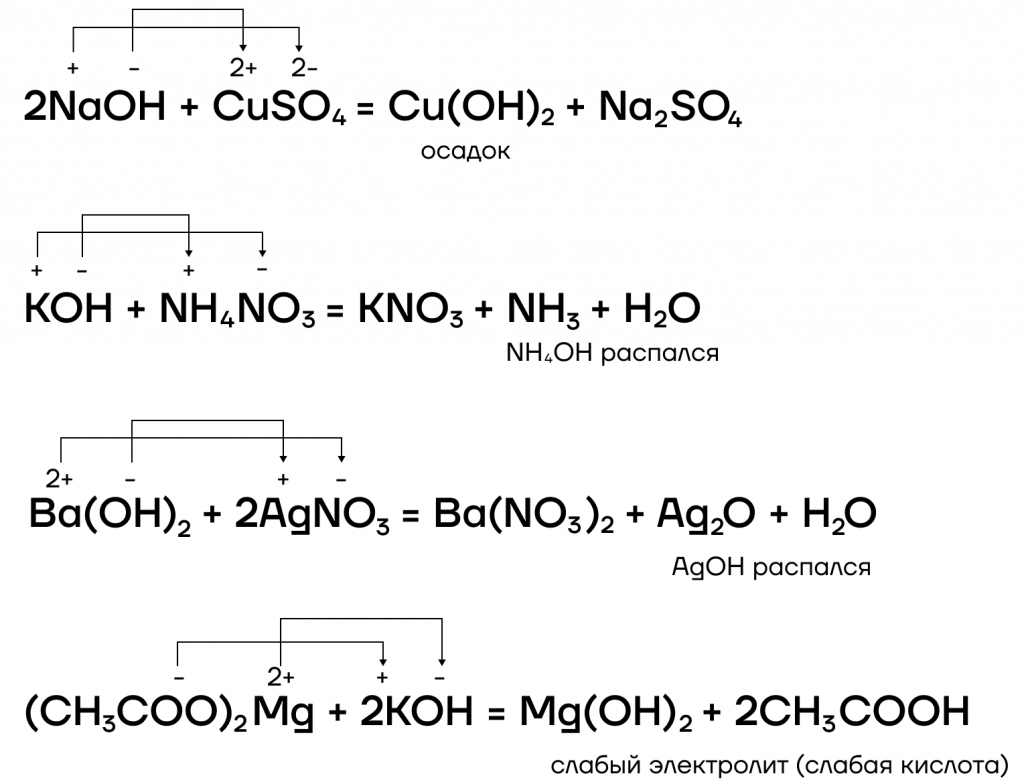
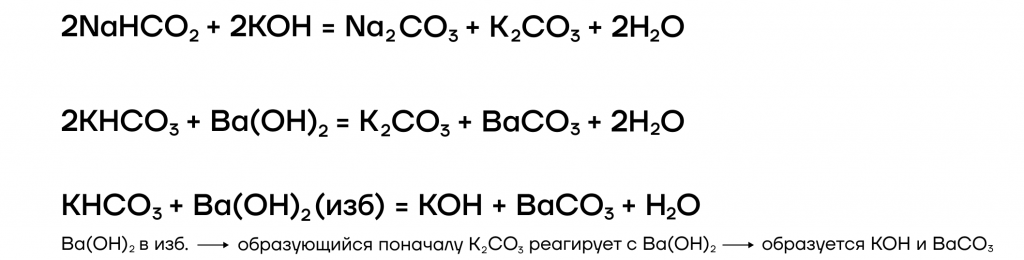
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
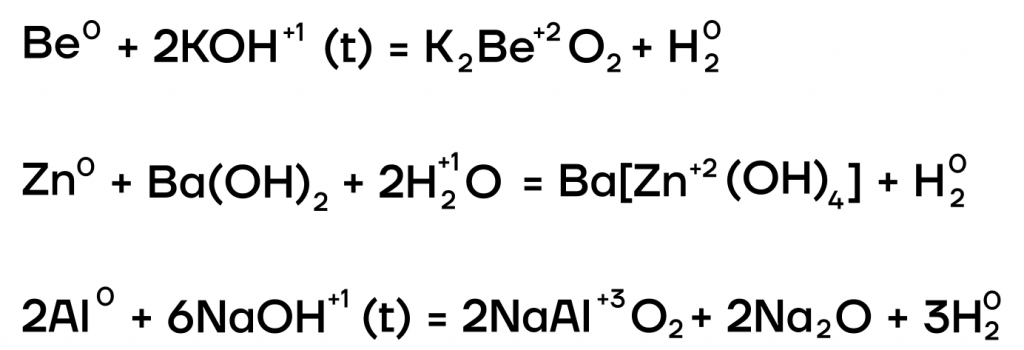
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Читайте также:
