В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах
Обновлено: 22.04.2024
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода ( II), водород, метан. [16]
Пирометаллургия охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В основе пирометаллургии лежат реакции восстановления металлов из их окислов. [17]
Пирометаллургия занимает ведущее место в металлургической промышленности. Суть метода заключается § получении металлов из руд с помощью восстановителей при высоких температурах. [18]
Пирометаллургией называется способ получения металла из руд, основанный на их нагревании, например, в печах, продуваемых воздухом. Этот способ используется в двух из трех восстановительных процессов, приведенных в таблице. Нагрев при этом происходит либо на воздухе ( обжиг), либо в присутствии восстановителя. Обычно используются уголь ( кокс) или моноксид углерода, поскольку они недороги и доступны. Если оба этих вещества не годятся, в качестве восстановителя можно использовать более активный металл. Пирометаллургия - наиболее важный и старейший способ получения металлов из руд. [19]
В пирометаллургии материалом, с помощью к-рого ведется В. [20]
Если пирометаллургия основана на химических процессах, протекающих в расплаве сырья при высоких температурах, и для разделения его компонентов используется различное их сродство к шлакообразующим, кислороду или к сере, то гидрометаллургия основана на извлечении соединений металлов из: руд и концентратов водными растворами различных реагентов при низких температурах. При селективном действии реагентов в раствор переходят главным образом полезные компоненты; пустые породы практически не растворяются в реагентах. Этим гидрометаллургия выгодно отличается от пирометаллургии, при которой переплавляется вся масса руды. Такое отличие особенно важно при переработке бедных руд, содержание полезного компонента в которых мало. [21]
В пирометаллургии используют также способность сульфидов металлов восстанавливать их оксиды, что приводит к самовосстановлению металлов из смеси их соединений. Это происходит при получении меди и свинца из их сульфидных руд. [22]
В пирометаллургии и электротермии также широко применяют трубчатые конденсаторы ( иногда состоящие из одной трубы), однако паро-газовую смесь подают внутрь труб. Благодаря этому для них более характерным является ламинарное движение паро-газовой смеси, для которого схема Прандтля непригодна. [23]
Если пирометаллургия основана на химических процессах, протекающих в расплаве сырья при высоких температурах, и для разделения его компонентов используется различное их сродство к шлакообразующим, кислороду или к сере, то гидрометаллургия основана на извлечении соединений металлов из руд и концентратов водными растворами различных реагентов при низких температурах. При селективном действии реагентов в раствор переходят главным образом полезные компоненты; пустые породы практически не растворяются в реагентах. Этим гидрометаллургия выгодно отличается от пирометаллургии, при которой переплавляется вся масса руды. Такое отличие особенно важно при переработке бедных руд, содержание полезного компонента в которых мало. [24]
В пирометаллургии велики расходы на топливо, электроэнергию и огнеупорные материалы. [25]
Применяют пирометаллургии , ( см. Рафинирующие переплавы, хим. и электролитич. [26]
К пирометаллургии относятся методы восстановления металлов из руд при повышенной температуре. [27]
В пирометаллургии материалом, с помощью к-рого ведется В. [28]
В пирометаллургии цинка для окисления сульфидных концентратов применяют агломерирующий обжиг. Одностадийный агломерирующий обжиг обеспечивает необходимую десульфуризацию только при шихте, содержащей около 80 % оборотного агломерата. Признано более целесообразным обжиг перед дистилляцией проводить в две стадии. [29]
В пирометаллургии цинка огнеупоры применяют для агломерирующего обжига цинковых концентратов на агломерационных машинах, для печей дистилляции цинка в горизонтальных ретортах, для вертикальных реторт, в установках КИВЦЭТ, при электротермическом способе получения цинка в дуговых электропечах, в футеровке шахтных печей для восстановительной плавки цинкового агломерата, в вельц-печах для доизвлечения цинка из раймовки, в отражательных печах и ректификационных колоннах для рафинирования цинка. [30]
Подготовка к итоговой аттестации
тест по химии (11 класс) на тему
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
А 1 . Атом металла, высший оксид которого Ме 2 О 3 , имеет электронную формулу внешнего энергетического уровня
1) ns 2 пр 1 2) ns 2 пр 2 3) ns 2 np 3 4) ns 2 np 5
А 2. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
А 3. Какое из предложенных соединений имеет металлическую связь:
1) мел 2) сода 3) поваренная соль 4) латунь
А 5. Вещества твердые, прочные, с высокой температурой плавления, при обычных условиях и в расплавах проводят электрический ток, имеют кристаллическую решетку
А 7. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
2) хлорида кальция
3) нитрата цинка
4) азотной кислоты
А 9. Без нагревания вода реагирует с
1) серебром 2) кальцием 3) медью 4) железом
А 10. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А 11. Гидроксид калия взаимодействует с каждым из двух веществ
1) NH 3 и HCl 2) CO 2 и CuCl 2 3) H 2 SO 4 и NaNO 3 4) MgO и HNO 3
А 29. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из
руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид
углерода (II) и кокс.
В3. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора.
ФОРМУЛА СОЛИ УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА
А) RbSO 4 1) метан
Б) CH 3 COOK 2) сернистый газ
В) BaBr 2 3) кислород
Г) CuSO 4 4) водород
6) этан и углекислый газ
В5. . Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
A) AI 2 O 3 + NaOH сплавление
Б) А1 2 0 3 + NaOH + Н 2 0
2) NaA1O 2 + Н 2 O
В) Аl 2 О 3 + Na 2 CO 3 сплавление
3) NaA1O 2 + СO 2
Г) А1 2 0 3 + HC1
5) AIC1 3 + Н 2 O
С1. Используя метод электронного баланса, составьте уравнение реакции:
Zn + KMnO 4 + … → … + MnSO 4 + K 2 SO 4 + … .
Определите окислитель и восстановитель.
С2. Даны четыре вещества: медь, концентрированная азотная кислота, оксид железа (II) и углерод. Напишите четыре уравнения реакции между этими веществами
С3. Напишите 5 уравнений химических реакций с органическими веществами, в которых участвуют металлы, основные оксиды, щелочи или соли металлов, укажите условия протекания реакций .
С4. Железо массой 5,6г растворили в 200 мл раствора соляной кислоты (p =1,05г/мл) с массовой долей 10%. Вычислите массовую долю соли в полученном растворе.
С5 . При взаимодействии 3,92 г сульфата трёхвалентного металла с хлоридом бария образовалось 6.99 г осадка. Установите формулу исходного сульфата металла.
А1. Одинаковую электронную конфигурацию внешнего уровня имеют Са 2+ и
1) К 2) Аr 3) Ва +2 4) F -
А2. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
А3 . Химический элемент, в атоме которого электроны по слоям распределены так:
2, 8, 8, 2 образуют между собой химическую связь
2) ковалентную неполярную
А5. Металлическую кристаллическую решетку имеет
А7. . К основным гидроксидам относится каждое из двух веществ:
1) Fe(OH) 3 и Си(ОН) 2
2) Fe(OH) 3 и Сг(ОН) 2
3) Fe(OH) 2 и Ca(OH) 2
4) Fe(OH) 3 и Сг(ОН) 3
А9. . Медь взаимодействует с раствором соли
1) KNO 3 2) Fe(NO 3 ) 3 3) FeSO 4 4) CaSO 4
А10. Верны ли следующие суждения об оксидах цинка и алюминия?
А. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
Б. Эти оксиды взаимодействуют как с кислотами, так и со щелочами.
1) верно толь ко А
А11. .Гидроксид хрома (III) реагирует с каждым из двух веществ
2) SiO 2 и Cu(OH) 2
4) H 2 SO 4 и NaOH
А29. Верны ли следующие суждения о промышленных способах получения металлов?
Б. В промышленности в качестве восстановителей используют оксид углерода (IV)
В3. Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе её водного раствора.
А) KCl 1) 2H 2 O – 4e → O 2 + 4H +
Б) AlBr 3 2) 2H 2 O + 2e → H 2 + 2OH -
В) CuSO 4 3) 2Cl - -2e → Cl 2 0
Г) AgNO 3 4) 2Br - - 2e → Br 2 0
5) 2SO 4 2- -2e → S 2 O 8 2-
6) 2NO 3 - -2e → 2NO 2 + O 2
В5. Установите соответствие между реагирующими веществами и продуктами реакции.
Вопрос А-29 (Понятие о металлургии: общие способы получения металлов.)
тест (химия, 11 класс) по теме
Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, переработка углеводородов. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.
| Вложение | Размер |
|---|---|
| a-29_khimicheskie_proizvodstva.doc | 51 КБ |
Подтяните оценки и знания с репетитором Учи.ру
А-29;Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, переработка углеводородов. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки.
1. Для получения аммиака в промышленности используют
1) хлорид аммония
2) нитрат аммония
3) атмосферный азот
4) азотную кислоту
2. Сырьём для промышленного производства серной кислоты является
1) сульфид углерода
3) оксид cepы (VI)
4) сернистая кислота
3. Катализатор используется при
1) поглощении оксида cepы (VI)
2) обжиге пирита
3) перегонке нефти
4) синтезе аммиака
4. Плёнку для парников изготавливают из
5. Смещения химического равновесия необходимо добиваться в процессе
1) обжиге пирита
2) перегонке нефти
3) синтезе метанола
4) поглощении оксида серы (VI)
6. Принцип циркуляции непрореагировавшей смеси веществ применяется в
1) синтезе метанола и синтезе аммиака
2) синтезе аммиака и обжиге пирита
3) обжиге пирита и окислении оксида серы (IV)
4) окислении оксида cepы (IV) и перегонке нефти
7. Повышение давления для увеличения выхода продукта используется на производстве при
4) окислении оксида cepы (IV)
8. Продуктом полимеризации является
2) ацетатное волокно
3) вискозное волокно
4) полиэфирное волокно
9. Для смешения равновесия в сторону образования аммиака в процессе синтеза аммиака нужно
1) повысить температуру и повысить давление
2) повысить давление и понизить температуру
3) понизить температуру и понизить давление
4) понизить давление и повысить температуру
10. Контактный аппарат используется
1) на первой стадии производства серной кислоты
2) на второй стадии производства серной кислоты
3) на третьей стадии производства серной кислоты
4) в производстве аммиака
11. Синтетический каучук получают из
12. Для промышленного получения метанола из синтез-газа не является характерным
3) использование селективных катализаторов
4) использование низких давлений
13. Мономером для получения искусственного каучука по способу Лебедева служит
14. Продуктами обжига пирита FeS 2 являются
3) Fe 2 O 3 и SO 2
4) Fe 2 O 3 и SO 3
15. Экологически чистым топливом является
3) каменный уголь
4) природный газ
16. В промышленности повышение выхода аммиака обеспечивается
1) действием высоких температур
2) проведением процесса при низких давлениях
3) использованием катализатора
4) циркуляцией азотно-водородной смеси
17. Для получения синтетического каучука можно использовать вещество, формула которого
1) СН 3 -СН 2 -СН 2 -СН 3
2) СН 2 -СН-СН 2 -СН 3
3) СН 3 -СН=СН-СН 3
4) СН 2 =СН-СН=СН 3
18. Полипропилен получают из вещества, формула которого
3) СН 3 -СН 2 -СН 3
19. Фосфат-ионы (РО 4 3- ) из сточных вод можно удалить с помощью
1) КОН 2) NaCl 3) HNО 3 4) Са(ОН) 2
20. Заключительную стадию производства серной кислоты осуществляют в
1) контактном аппарате
2) сушильной башне
3) поглотительной башне
21. Верны ли следующие суждения о промышленных способах получения металлов?
22. В производстве серной кислоты на стадии окисления SО 2 для увеличения выхода продукта
1) повышают концентрацию кислорода
2) увеличивают температуру
3) понижают давление
4) вводят катализатор
23. Технологический принцип «кипящего слоя» применяется в производстве
3) серной кислоты
24. Уравнение химической реакции
С 20 Н 42 — 550 С — > С 10 Н 22 + С 10 Н 20 соответствует процессу
25. При производстве аммиака в качестве сырья используется
2) метан и воздух
3) метан и оксид углерода (II)
4) азот и водород
26. В промышленности ацетальдегид получают
1) восстановлением уксусной кислоты
2) каталитическим окислением этилена
3) окислением этана
4) гидратацией этилена
27. Верны ли следующие суждения о переработке нефти?
А. В результате перегонки нефти получают бензин, керосин и метан.
Б. Крекинг нефтепродуктов сопровождается разрывом связей С - С.
28. Одна из наиболее легкокипящих фракций нефти называется
29. Верны ли следующие суждения о производстве аммиака?
А. В промышленности аммиак получают взаимодействием хлорида
аммония и оксида кальция
Б. Синтез аммиака в промышленности осуществляется под высоким
30. Олеум — это раствор
1) оксида серы (IV) в воде
2) оксида серы (VI) в серной кислоте
3) оксида серы (IV) в сернистой кислоте
4) оксида серы (VI) в воде
31. Структурным звеном поливинилхлорида
3) -CH 2 -CCI = CH -CH 2 -
4) - CH 2 =CC 1- CH = CH -
32. Образование фенолформальдегидной смолы относится к реакциям
33. Реакция крекинга начинается с разрыва связи
1) С-Н 2) С-С 3) Н-Н 4) С-О
34. Водород образует взрывчатые смеси с
3) углекислый газом
35. Остаток от перегонки нефти называется
36. Верны ли следующие суждения о производстве серной кислоты?
А. В промышленности серную кислоту получают из пирита
Б. Реакция окисления SO 2 в SO 3 – экзотермическая
По теме: методические разработки, презентации и конспекты

презентация по теме "Способы получения металлов. Сплавы"
Способы получения металлов
Тест в программе PowerPoint. Указывает затраченное время, количество ошибок, оценка.

Тест по теме: «Металлы. Общая характеристика. Получение металлов».
Тест в 2-х вариантах по теме: «Металлы. Общая характеристика. Получение металлов" для контроля знаний учащихся 9 класса по линиям учебника Рудзитиси, Фельдмана.
Урок по теме "Общие способы получения металлов"
Урок в курсе химии 9 класса к учебнику О.С.Габриеляна.

Урок в 9 классе "Общие способы получения металлов"
В помощь учителю материал можно использовать для подготовки отрытого урока.

Урок химии в 11 классе по теме: «Металлы в природе. Общие способы получения металлов»
"Человек не может обойтись без металлов. Если бы не было металлов, люди влачили бы самую жалкую жизнь среди диких зверей. ".

Методическая разработка урока по химии «Металлы в природе. Общие способы получения металлов» 9 класс (базовый курс, О.С. Габриелян)
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт.
Большая Энциклопедия Нефти и Газа
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода ( II), водород, метан. [2]
Пирометаллургия объединяет методы, основанные на восстановлении металлов из руд при высоких температурах с помощью угля или оксида углерода ( II); иногда в этих целях используют алюминий, кремний и водород. [3]
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода ( II), водород, метан. [4]
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. [5]
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода ( II), водород, метан. Так, например, уголь и оксид углерода ( II) восстанавливают медь из. [6]
Пирометаллургия объединяет методы, основанные на восстановлении металлов из руд при высоких температурах с помощью углерода или оксида углерода ( II); иногда в этих целях используют алюминий, кремний и водород. [7]
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода ( II), водород, метан. В основе этого метода лежит реакция восстанов-ния металла из его оксида. [8]
Пирометаллургия объединяет методы, основанные на восстановлении металлов из руд при высоких температурах. Чаще всего оно осуществляется при помощи углерода или окиси углерода, но иногда в этих же целях используют алюминий и водород. [9]
Пирометаллургия - металлургия, процессы, проводимые при высоких темп - pax. [10]
Пирометаллургия имеет целый ряд недостатков, как наличие ртутных паров, представляющих опасность для обслуживающего персонала, сравнительно высокая стоимость оборудования ( большие капитальные затраты), сравнительно высокая стоимость получаемой ртути. [11]
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода ( II), еодород, метан. [12]
Пирометаллургия объединяет методы, основанные на восстановлении металлов из руд при высоких температурах. Чаще всего оно осуществляется при помощи углерода или окиси углерода, но иногда в этих же целях используют алюминий и во - Дород. [13]
Пирометаллургия - древнейшая по времени возникновения, до сих пор является важнейшей отраслью металлургии. Извлечение металлов из руд осуществляется при высоких температурах. [15]
Основные способы получения металлов - урок в 11 классе

электрометаллургические - электролиз раствора или расплава.
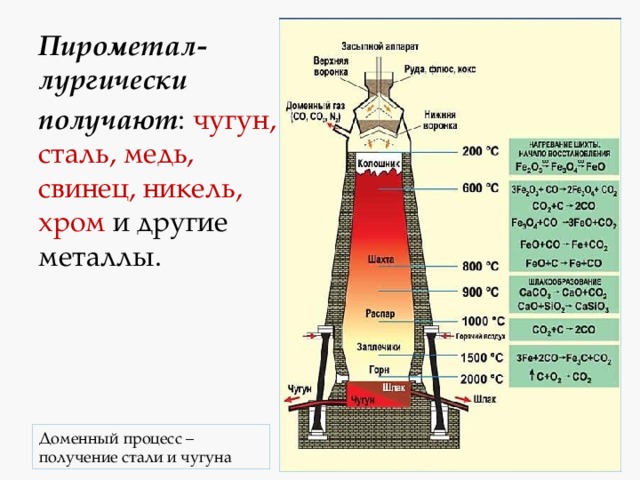
Пирометал-лургически
получают : чугун, сталь, медь, свинец, никель, хром и другие металлы.
получение стали и чугуна

Гидрометаллургически получают : золото, цинк, никель и некоторые другие металлы.
Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др.
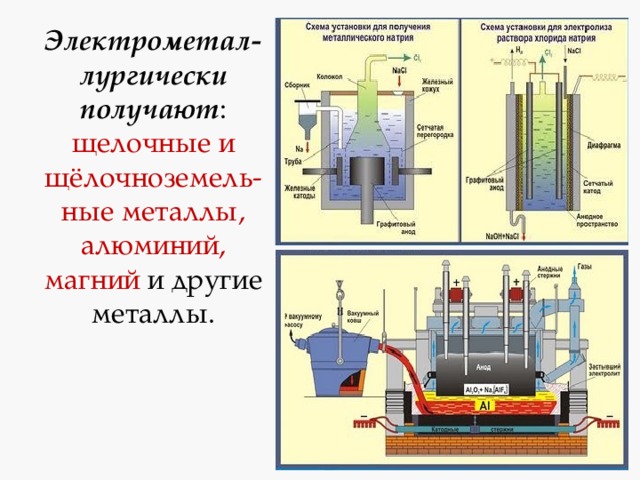
Электрометал-лургически получают : щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы.

Общие способы получения металлов
1. Восстановление металлов из оксидов углем или угарным газом
Mе x O y + C = CO 2 + Me,
1. ZnO y + C t = CO + Zn
Mе x O y + C = CO + Me,
2. Fe 3 O 4 + 4CO t = 4CO 2 + 3Fe
3. MgO + C t = Mg + CO
Mе x O y + CO = CO 2 + Me
Не подходит для металлов, образующих карбиды с углём.
получают : Fe, Cu, Pb, Sn, Cd, Zn

2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия –
Mе x S y +O 2 = Mе x O y +SO 2
1. 2ZnS + 3O 2 t = 2ZnO + 2SO 2 ↑
2 стадия –
Mе x O y + C = CO 2 + Me или
2. MgCO 3 t = MgO + CO 2 ↑

3 Алюмотермия ( в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида )
1. 4SrO + 2Al t = Sr(AlO 2 ) 2 + 3Sr
Mе x O y + Al = Al 2 O 3 + Me
получают: Mn, Cr, Ti, Mo, W, V и др
2. 3MnO 2 + 4Al t = 3Mn + 2Al 2 O 3
3. 2Al + 3BaO t = 3Ba + Al 2 O 3 (получают барий высокой чистоты)

4. Водородотермия - для получения металлов особой чистоты
1. WO 3 + 3H 2 t = W + 3H 2 O↑
Mе x O y + H 2 = H 2 O + Me
2. MoO 3 + 3H 2 t = Mo + 3H 2 O↑
Получают металлы большей чистоты : Cu, Ni, W, Fe, Mo, Cd, Pb

Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей ( хлоридов ):
2NaCl расплав, электр. ток. 2 Na + Cl 2 ↑
CaCl 2 расплав, электр. ток. Ca + Cl 2 ↑
расплавов гидроксидов :
4NaOH расплав, электр. ток. 4Na + O 2 ↑ + 2H 2 O
(. используют изредка для Na)

Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
2Al 2 O 3 расплав в криолите, электр. ток. 4Al + 3 O 2 ↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO 4 +2H 2 O раствор, электр. ток. 2Cu + O 2 + 2H 2 SO 4
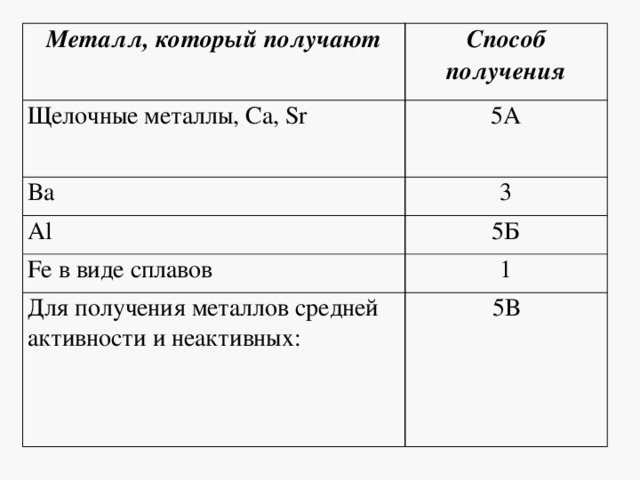
Металл, который получают
Способ получения
Щелочные металлы, Ca, Sr
Fe в виде сплавов
Для получения металлов средней активности и неактивных:

Примеры заданий по теме : «Общие способы получение металлов»
Задания с выбором ответа ( А10, А24, А29).
А1. Реакция возможна между
1) Ag и K 2 SO 4 (р-р)
3) Mg и SnCl 2 (р-р)
4) Ag и CuSO 4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg

A3. Какой из металлов вытесняет медь из сульфата меди (II)?
1) Zn 2) Ag 3) Hg 4) Au
A4. Формула вещества, восстанавливающего оксид меди (II) - это
1) CO 2 2) H 2 3) HNO 3 4) Cl 2
A5. Формула вещества, не восстанавливающего оксид железа (III) -
1) HCl 2) Al 3) H 2 4) C

А6. Для осуществления превращений в соответствии со схемой:
Al(OH) 3 → AlCl 3 → Al необходимо последовательно использовать
1) хлор и водород
2) хлорид натрия и водород
3) хлороводород и цинк
4) соляную кислоту и калий
А7. Пирометаллургический метод получения металлов отражает реакция:
1) HgS + O 2 → Hg + SO 2
2) CuSO 4 + Fe → FeSO 4 + Cu
3) 2NaCl (ток)→ 2Na + Cl 2
4) CuSO 4 + Zn → ZnSO 4 + Cu

А8. Гидрометаллургический метод получения металлов отражает реакция:
4) AlCl 3 + 3K → Al + 3KCl
А9. В качестве восстановителя при выплавке железа в промышленности
наиболее часто используют

А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с
1) N 2 2) H 2 S 3) Fe 4) Fe 2 O 3
Задания с кратким ответом (В3)
В1. При электролизе раствора AgNO 3 на катоде выделяется
3) серебро и водород
4) кислород и водород

В2. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
Б) NaNO 3 2) Ag, O 2 , HF
B) Pb(NO 3 ) 2 3) H 2 , O 2
Г) NaF 4) Pb, O 2 , HNO 3
5) H 2 , NO 2 , O 2
6) NaOH, H 2 , F 2

В3. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРА
А) HgCl 2 1) металл, хлор
Б) AlCl 3 2) водород, хлор, гидроксид
В) Hg(ClO 4 ) 2 металла
Г) Na 2 SO 3 3) водород, кислород
4) металл, кислород, кислота
5) металл, сернистый газ
6) водород, сернистый газ

В4. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
А) нитрат цинка 1) цинк, кислород, азотная кислота
Б) бромид цинка 2) водород, кислород
В) бромид калия 3) водород, оксид азота (IV)
Г) нитрат калия 4) цинк, бром
5) водород, бром, гидроксид калия
7) калий, оксид азота (IV)
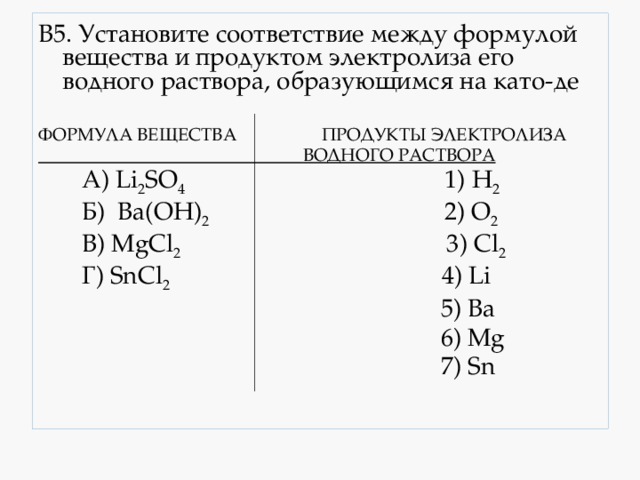
В5. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, образующимся на като-де
А) Li 2 SO 4 1) H 2
В) MgCl 2 3) Cl 2

В6. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
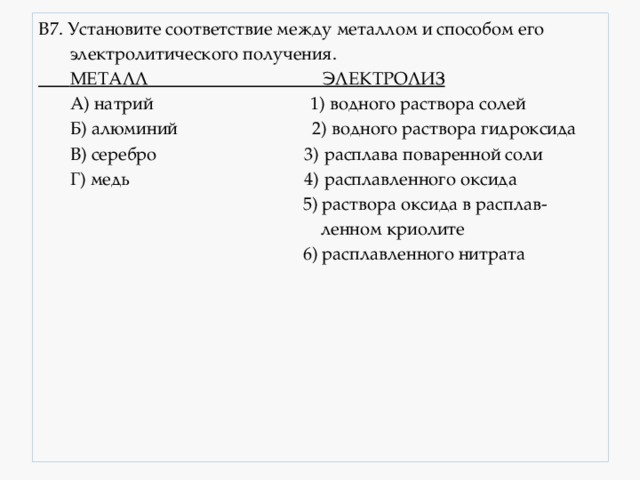
В7. Установите соответствие между металлом и способом его
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплав-
6) расплавленного нитрата

В8. Установите соответствие между металлом и способом его электролитического получения.
А) калий 1) расплавленного нитрата
Б) магний 2) водного раствора гидроксида
В) медь 3) расплава хлорида
Г) свинец 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) водного раствора солей

В9. Установите соответствие между металлом и способом его электролитического получения.
А) хром 1) водного раствора солей
В) литий 3) расплава соли
Г) барий 4) расплавленного оксида

Задания с развёрнутым ответом (С2)
С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Cu → Cu(NO 3 ) 2 → Cu(OH) 2 → Х → Сu → CuSO 4
Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота.
Читайте также:
