В периодической системе типичные металлы расположены в верхней части
Обновлено: 08.05.2024
1. Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Роль железа в современной технике. Сплавы железа.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется за счет потери двух 4s-электронов. Степень окисления +3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавко, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства. Железо реагирует со многими неметаллами:
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО•Fe2О3.
Реагирует с кислотами с выделением водорода:
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
Соединения железа. FeО — основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe2О3 — амфотерный оксид, реагирует также с рас творами щелочей.
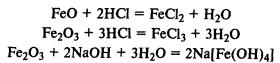
Гидроксиды железа. Fe(ОН)2 — типичный основной оксид, Fe(ОН)3 обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.
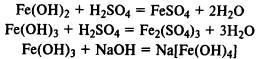
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:
Сплавы железа. Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй — различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода — в чугунах содержится около 4% углерода, а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Чугун. Чугун, предназначенный для переработки в сталь, называют передельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3—1,5% Si, 1,5—3,5% Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный'для получения отливок, называется литейным чугуном, В доменных печах выплавляются также ферросплавы, применяемые преимущественно в производстве сталей в качестве добавок. Ферросплавы имеют, по сравнению с передельным чугуном, повышенное содержание кремния (ферросилиций), марганца (ферромарганец), хрома (феррохром) и других элементов.
Стали. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали—для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость — образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость—хрупкость стали при обыкновенной температуре. -
Легированные стали. Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали — легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения. Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так,хромомолибденовые и хромованадиевые стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях '
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значигельно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
2. Белкикак биополимеры. Первичная, вторичная и третичная структуры белков. Свойства и биологические функции белков.
Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот.
Белки, подобно полисахаридам, являются биологическими полимерами. Большинство белковых молекул достигает гигантских размеров по сравнению с другими органическими соединениями и имеет очень большую молекулярную массу:
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.
презентация по химии по теме
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.
Цель урока : 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки). 2.Обобщить и расширить знания о физических свойствах металлов и их классификаций. 3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.
МЕДЬ Иду на мелкую монету, В колоколах люблю звенеть, Мне ставят памятник за это И знают: имя мое-….
ЖЕЛЕЗО Пахать и строить - все он может, если ему уголек в том поможет…
Металлы – это группа веществ с общими свойствами.
Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп I группа II группа III группа IV группа V группа VI группа VII группа VIII группа Na Mg Al Ti V Cr Mn Fe
Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He )
Положение элемента в ПС отражает строение его атомов ПОЛОЖЕНИЕ ЭЛЕМЕНТА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ СТРОЕНИЕ ЕГО АТОМОВ Порядковый номер элемента в периодической системе Заряд ядра атома Общее число электронов Номер группы Число электронов на внешнем энергетическом уровне. Высшая валентность элемента, степень окисления Номер периода Число энергетических уровней. Число подуровней на внешнем энергетическом уровне
Модель атома натрия
Электронное строение атома натрия
Задание 2. Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно по примеру с атомом натрия.
Вывод: 1. Металлы – элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже 4-6. 2. Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Металлическая химическая связь характеризуется: - делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно связывают множество ядер; - валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален; - металлическая связь не обладает направленностью и насыщенностью.
Кристаллические решетки металлов
Видеоинформация о кристаллах металлов
Свойства металлов определяются строением их атомов. Свойство металла Характеристика свойства твердость Все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло. плотность Металлы делятся на лёгкие (плотность 5г/см) и тяжелые (плотность больше 5г/см). плавкость Металлы делятся на легкоплавкие и тугоплавкие электропроводность, теплопроводность Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. металлический блеск Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло пластичность . Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Проверьте усвоение знаний на уроке тестированием 1) Электронная формула кальция. А) 1S 2 2S 2 2Р 6 3S 1 Б) 1S 2 2S 2 2 Р 6 3 S 2 В) 1S 2 2S 2 2 Р 6 3 S 2 3S 6 4S 1 Г) 1S 2 2S 2 2 Р 6 3 S 2 3 Р 6 4 S 2
Задания теста 2 и 3 2) Электронную формулу 1S 2 2S 2 2Р 6 3S 2 3Р 6 4S 2 имеет атом: а) Nа б) Са в) Сu г) Zn 3) Электропроводность, металлический блеск, пластичность, плотность металлов определяются : а) массой атомов б) температурой плавления металлов в) строением атомов металлов г) наличием неспаренных электронов
Задания теста 4 и 5 4) Металлы при взаимодействии с неметаллами проявляют свойства а) окислительные; б) восстановительные; в) и окислительные, и восстановительные; г) не участвуют в окислительно-восстановительных реакциях; 5) В периодической системе типичные металлы расположены в: а) верхней части; б) нижней части; в) правом верхнем углу; г) левом нижнем углу;
Правильные ответы Номер задания Вариант правильного ответа 1 Г 2 Б 3 В 4 Б 5 Г
Презентация по химии по теме: Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства. - презентация
1 Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.
2 Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки). 2. Обобщить и расширить знания о физических свойствах металлов и их классификаций. 3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.
3 МЕДЬ Иду на мелкую монету, В колоколах люблю звенеть, Мне ставят памятник за это И знают: имя мое-….
4 ЖЕЛЕЗО Пахать и строить - все он может, если ему уголек в том поможет…
5 Металлы – это группа веществ с общими свойствами.
6 Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп I группа II группа III группа IV группа V группа VI группа VII группа VIII группа NaMgAlTiVCrMnFe
7 Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He)
8 Положение элемента в ПС отражает строение его атомов ПОЛОЖЕНИЕ ЭЛЕМЕНТА В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ СТРОЕНИЕ ЕГО АТОМОВ Порядковый номер элемента в периодической системе 1. Заряд ядра атома 2. Общее число электронов Номер группы 1. Число электронов на внешнем энергетическом уровне. 2. Высшая валентность элемента, степень окисления Номер периода 1. Число энергетических уровней. 2. Число подуровней на внешнем энергетическом уровне
9 Модель атома натрия
10 Электронное строение атома натрия
11 Задание 2. Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно по примеру с атомом натрия.
12 Вывод: 1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
13 Металлическая химическая связь характеризуется: - делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно связывают множество ядер; - валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален; - металлическая связь не обладает направленностью и насыщенностью.
14 Кристаллические решетки металлов
15 Видеоинформация о кристаллах металлов
16 Свойства металлов определяются строением их атомов. Свойство металла Характеристика свойства твердость Все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло. плотность Металлы делятся на лёгкие (плотность 5 г/см) и тяжелые (плотность больше 5 г/см). плавкость Металлы делятся на легкоплавкие и тугоплавкие электропроводность, теплопроводность Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. металлический блеск Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло пластичность.Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
17 Проверьте усвоение знаний на уроке тестированием 1) Электронная формула кальция. А) 1S 2 2S 2 2Р 6 3S 1 Б) 1S 2 2S 2 2Р 6 3S 2 В) 1S 2 2S 2 2Р 6 3S 2 3S 6 4S 1 Г) 1S 2 2S 2 2Р 6 3S 2 3Р 6 4S 2
18 Задания теста 2 и 3 2) Электронную формулу 1S 2 2S 2 2Р 6 3S 2 3Р 6 4S 2 имеет атом: а) Nа б) Са в) Сu г) Zn 3) Электропроводность, металлический блеск, пластичность, плотность металлов определяются : а) массой атомов б) температурой плавления металлов в) строением атомов металлов г) наличием неспаренных электронов
19 Задания теста 4 и 5 4) Металлы при взаимодействии с неметаллами проявляют свойства а) окислительные; б) восстановительные; в) и окислительные, и восстановительные; г) не участвуют в окислительно- восстановительных реакциях; 5) В периодической системе типичные металлы расположены в: а) верхней части; б) нижней части; в) правом верхнем углу; г) левом нижнем углу;
20 Правильные ответы Номер задания Вариант правильного ответа 1Г 2Б 3В 4Б 5Г
Металлы, их положение в периодической системе химических элементов Д.И. Менделеева, строение атома, химические свойства, применение.
В периодической системе элементов Д.И.Менделеева металлы расположены в левом нижнем углу от диагонали B–At.
Класс металлов образован элементами s-семейства (кроме Н и Не), p-элементы главных подгрупп III (кроме В), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po), все d- и f-элементы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge), обладают двойственным характером. Металлов в периодической системе элементов – большинство (Из 109 элементов только 22 неметаллы).
На наружном электронном уровне находятся 1,2 или 3 электрона, слабо связанных с ядром.
2 8 1 2 8 8 2 2 8 3
1s 2 2s 2 2p 6 3s 1 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 1s 2 2s 2 2p 6 3s 3
В металлах связь металлическая и металлическая кристаллическая решётка чем объясняются физические свойства металлов.
Для главных подгрупп: чем левее и ниже металл, тем большую химическую активность он проявляет. В периодах металлические свойства убывают, а в группах усиливаются (с увеличением порядкового номера), так как изменяется радиус атома.
Для металлов характерны общие физические свойства:
1) твёрдость; 2) электро и теплопровдность; 3) непрозрачность; 4) металлический блеск;
5) ковкость или пластичность (объяснение – металлическая кристаллическая решётка).
Химические свойства: n=1,2,3. (металлы всегда восстановители)
I. С простыми веществами:
1) с кислородом:
а) 2Ca + O2 → 2CaO б) 2Mg + O2 2 ↛
в-ль ок-ль многие металлы покрыты тонкой плёнкой, которая препятствует дальнейшему окислению.
2) с галогенами:
а) 2Na + Cl2 → 2NaCl б) 2Fe + 3Cl23) с серой: Fe + S → FeS
II. Со сложными веществами (ряд активности металлов):
а) (для щелочных и щелочноземельных металлов) 2Na + 2H2O → 2NaOH + H2↑
б) металлы средней активности Mg + H2O 2↑
в) правее водорода Au + H2O ↛
2) с растворами кислот, кроме HNO3
а) Zn + 2HCl → ZnCl2 + H2 б) Cu + HCl ↛
3) с солями: Fe + CuSO4 → FeSO4 + Cu
1) в быту – посуда, бытовые приборы; 2) в технике, в промышленности;
3) в самолёто- и ракетостроении; 4) в медицине и т.д.
Билет №9 (2)
Фенол, его строение, свойства, получение и применение.
Фенол – это производное бензола, в котором один атом водорода замещён на группу ОН.
Взаимное влияние бензольного кольца и ОН-групп:
1) Радикал С6Н5 обладает свойством оттягивать на себя электроны атома кислорода ОН-группы, делая связь О–Н более полярной и атом водорода более подвижным.
2) ОН-группа придаёт большую подвижность атомам водорода в положениях 2,4,6 – бензольного кольца.
Этим взаимовлиянием и определяются свойства фенола.
Фенол – бесцветное, кристаллическое вещество с характерным запахом больницы.
Температура плавления 40,9℃ , хорошо растворим в горячей воде (карболовая кислота).
Фенол – ядовит!
1) В воде диссоциирует на ионы:
2) Проявляет слабые кислотные свойства, реагирует с металлами:
3) Реагирует со щёлочью:
4) Реакции замещения:
В промышленности фенол получают по схеме:
1) 2)
Фенол применяют для производства:
1) полимеров и пластмасс на их основе, красителей;
3) взрывчатых веществ. Водородный раствор фенола используется как дезинфицирующее средство.
Читайте также:
