В состав гемоглобина входит ион металла
Обновлено: 04.10.2024
Структура и функция гемоглобина
Болезни гемоглобинов человека, названные гемоглобинопатиями, занимают уникальную позицию в медицинской генетике. Это наиболее частые моногенные болезни у людей, к тому же вызывающие высокую смертность. По оценке Всемирной организации здравоохранения более 5% человеческой популяции — носители мутаций клинически значимых нарушений гемоглобина.
Кроме того, поскольку гемоглобин был одной из первых исследованных белковых структур, а гены глобина у человека стали первыми клонированными генами, связанными с болезнями, их молекулярная и биохимическая патология изучена лучше, чем в любой другой группе генетических болезней. Глобины также проливают свет на процесс как молекулярной, так и популяционной эволюции и служат моделью действия генов в развитии. Прежде чем подробно обсуждать гемоглобинопатии, опишем вкратце нормальное состояние гена глобина и биологию гемоглобина.
Гемоглобин — переносчик кислорода в эритроцитах позвоночных. Его молекула содержит четыре субъединицы: две а-цепи и две b-цепи. Каждая субъединица формируется цепью полипептида глобина и простетической группой, гемом, железосодержащим пигментом, соединяющимся с кислородом, придавая молекуле способность транспортировать кислород.
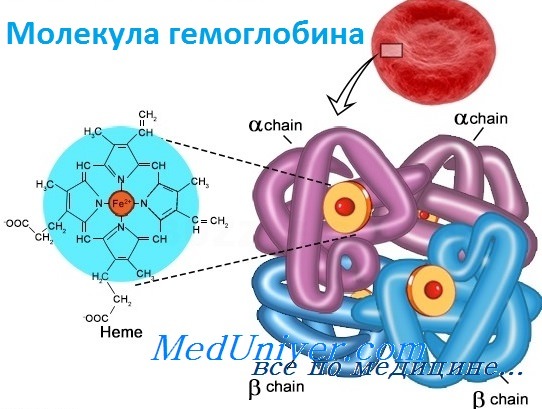
Каждая молекула гемоглобина состоит из двух пар полипептидных цепей разного типа. Цепи глобина в нормальном гемоглобине взрослых, гемоглобине А (НЬА), названы а и b соответственно. Четыре цепи складываются и объединяются, формируя шарообразный тетрамер с молекулярным весом приблизительно 64 500, структуру, обозначаемую для НbА — а2b2. Оба типа цепей почти равны по длине; а-цепь имеет 141 аминокислоту, b-цепь — 146.
Цепи имеют заметное сходство друг с другом в аминокислотной последовательности (первичной структуре) и в трехмерной конфигурации (третичной структуре).
Основные характеристики структуры глобина весьма консервативно сохранялись в ходе эволюции, что стало основой для понимания гемоглобинопатии. Более того, третичная структура полипептида глобина также оказалась в высшей степени консервативной: фактически все изученные глобины имеют семь или восемь извитых участков (в зависимости от цепи). В то же время только две аминокислоты сохраняются во всех глобинах в природе, и неудивительно, что мутации в любом из этих остатков связаны с болезнью.
Исследование структуры гемоглобина позволило предсказать, какие типы мутаций, вероятно, окажутся патогенными. Таким образом, мутации, изменяющие строение глобина, замена высококонсервативной аминокислоты или одного из неполярных остатков, формирующих гидрофобную оболочку, исключающую попадание воды внутрь молекулы, вероятно, вызовут гемоглобинопатию. Как и все белки, глобин имеет «чувствительные области», мутации в которых не могут не влиять на функцию, и «нечувствительные области», мутации в которых переносятся более свободно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гемоглобин
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
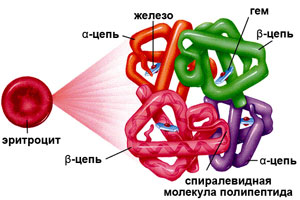
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA - взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) - гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
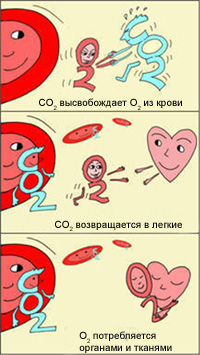
Эффект Бора
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.
Эффект Бора имеет громадное значение для функционирования организма. Ведь если клетки интенсивно работают, выделяют больше СО2, эритроциты могут снабдить их большим количеством кислорода, не допуская кислородного «голодания». Следовательно, эти клетки могут и дальше работать в высоком темпе.

Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.

- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
Другие статьи раздела
Распространенный возбудитель инфекций дыхательных путей (фарингиты, синуситы, отиты, бронхиты и пневмонии). Анализы на антитела используются для диагностики инфекции Chlamydophila pneumoniae при длительных инфекциях дыхательных путей.
Mycoplasma pneumoniae - возбудитель пневмонии человека, острых респираторных заболеваний (ОРЗ), заболеваний верхних дыхательных путей (фарингита, бронхита), а также некоторых нереспираторных заболеваний.
Бактерии – одноклеточные микроорганизмы, некоторые из которых могут вызывать заболевания.
Mycoplasma pneumoniae (микоплазма пневмонии), Chlamydohpila pneumoniae (хламидофила пневмонии, прежнее название Chlamydia pneumoniae)
Гипофиз – непарная железа внутренней секреции, расположенная на основании головного мозга в костном кармане – гипофизарной ямке турецкого седла. Гипофиз вырабатывает гормоны, оказывающие влияние на работу всего организма – рост и развитие, обмен веществ, половую функцию.
Повышенный рост волос (гирсутизм) может быть следствием не только повышенного уровня андрогенов (см. «гиперандрогения»), но и высокой активности 5-альфа-редуказы в коже (фермента волосяных фолликулов, превращающего тестостерон в гораздо более активный дигидротестостерон.
По данным ВОЗ (Всемирная организация здравоохранения) заболеваемость в России составляет более 50 человек на 100 000 населения. Имеет важное значение то, что у женщин значительно чаще чем у мужчин (50-90% против 10%) возможно бессимптомное течение заболевания.
Делеция (ген.) – вид хромосомных мутаций, при котором происходит потеря какого-либо участка хромосомы.
Механизм обратной связи – система, которая используется организмом для контроля некоторых функций и поддержания состояния постоянства организма. Механизм обратной связи использует один из продуктов пути обмена веществ, обычно конечный продукт, для контроля активности пути обмена веществ и регуляции количества этого продукта. Обратная связь может быть отрицательной и положительной.
В состав гемоглобина входит ион металла
Гемоглобин. Роль гемоглобина в транспорте кислорода
Обычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином.
а) Обратимая связь кислорода с гемоглобином. Химический состав гемоглобина представлен в отдельных статьях на сайте, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком PO2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком PO2, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
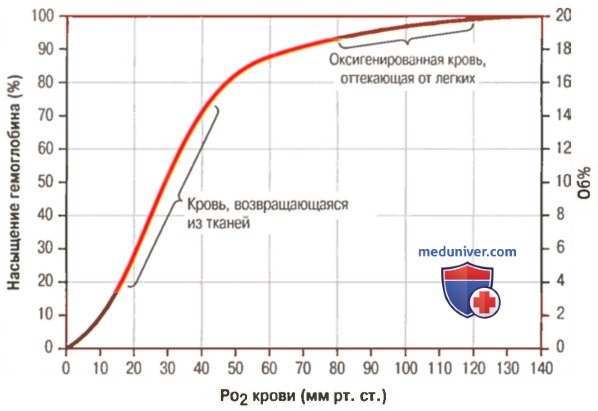
Кривая диссоциации оксигемоглобина
1. Кривая диссоциации оксигемоглобина. На рисунке выше приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении PO2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%.
В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом.
2. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15x1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода.
3. Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови (для облегчения понимания просим вас изучить рисунок ниже). При прохождении через капилляры ткани этот объем снижается до 14,4 мл (PO2 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
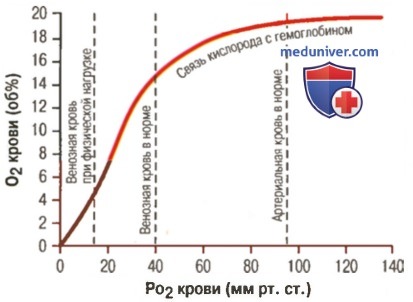
Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови
4. Транспорт кислорода при тяжелой физической нагрузке. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению PO2 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст.
При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 - 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое.
Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение PO2 в мышечной ткани.
Видео физиология газообмена в легких и транспорта газов кровью - профессор, д.м.н. П.Е. Умрюхин
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.

Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Гемоглобин — сложный железосодержащий белок, который находится внутри эритроцитов (красных кровяных телец) и выполняет жизненно важную функцию: доставляет кислород от лёгких к тканям, а обратно в лёгкие уносит углекислый газ.
Гемоглобин: что это такое
Гемоглобин — белок, который содержится в эритроцитах и выполняет жизненно важную функцию: переносит кислород от лёгких в ткани и органы, а обратно в лёгкие транспортирует углекислый газ.
Вместе с эритроцитами гемоглобин образуется в костном мозге и циркулирует в кровотоке в течение всей жизни красных кровяных телец — около 120 дней. Когда эритроциты разрушаются, большая часть гемоглобина выводится из организма вместе с ними. Некоторое количество гемоглобина поступает обратно в кровоток — чтобы присоединиться к новым эритроцитам.
Молекула гемоглобина состоит из двух частей:
- Гем — небелковая часть, соединение порфирина с железом. В каждой молекуле гемоглобина — четыре гема.
- Глобин — белок, составляющий 96% всей массы гемоглобина и состоящий из четырёх цепочек.
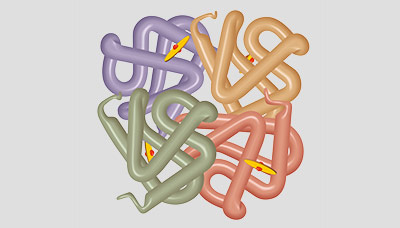
Структура гемоглобина: четыре цепочки глобина и четыре гема, внутри которых находятся атомы железа (на рисунке обозначены жёлтыми дисками с красными центрами).
Гемоглобин, который захватил кислород из лёгких и несёт его к тканям и органам, называется оксигемоглобин. Он находится в артериальной крови, идущей от лёгких, и придаёт ей ярко-алый цвет.
Добравшись до пункта назначения, оксигемоглобин выгружает кислород, а взамен забирает отработанный углекислый газ — так образуется карбгемоглобин.
Карбогемоглобин циркулирует в венозной крови (идёт от тканей и органов к лёгким) и придаёт ей вишнёвую окраску.
Помимо оксигемоглобина и карбогемоглобина, в организме могут обнаруживаться и другие виды гемоглобина:
- Карбоксигемоглобин — соединение гемоглобина и угарного газа. Образуется при вдыхании большого количества CO. В группе риска — работники металлургических предприятий, химических заводов, а также люди, которые занимаются наладкой холодильного оборудования и электросварочными работами. Избыток карбоксигемоглобина может привести к кислородному голоданию, головокружениям, рвоте, тошноте, а иногда даже к смерти.
- Метгемоглобин — гемоглобин, который больше не может переносить кислород из-за того, что железо в нём окислилось. В минимальной концентрации присутствует в крови здорового человека. Метгемоглобин в избыточном количестве может образовываться при острых химических отравлениях, некоторых наследственных заболеваниях (семейная метгемоглобинемия).
- Гликированный гемоглобин — соединение гемоглобина и глюкозы. Если уровень сахара в крови повышается, то молекулы глюкозы начинают склеиваться с молекулами гемоглобина. Это бывает при сахарном диабете, болезнях поджелудочной железы, нарушениях обмена веществ, лечении глюкокортикоидами.
Определение уровня гликированного гемоглобина в крови используется для оценки углеводного обмена, выраженности и давности его нарушений.
Анализ на гликированный гемоглобин можно сдать отдельно или в составе комплексных исследований, оценивающих и другие параметры: уровень глюкозы, индекс инсулинорезистентности HOMA-IR (определение чувствительности клеток к инсулину).
Читайте также:
