Вещества состоящие из атомов металлов и гидроксогрупп
Обновлено: 18.05.2024
Основания являются классом неорганических веществ, применяемым в жизни с давних времен за счет ощущения мылкости. Главное отличие этого класса неорганических веществ от остальных - наличие гидроксогруппы, которая придает особые физические и химические свойства.
Основания бывают растворимыми (щелочи) и нерастворимыми. Растворимые основания мылкие на ощупь. Все основания вступают в реакцию нейтрализации - взаимодействие с кислотой. С развитием химии и изучением физических и химических свойств основания расширили круг своего применения: бытовые моющие средства, промышленные чистящие средства, очистка нефти, строительство, краски, удобрения, батарейки. Также стало широко использоваться одно из химических свойств оснований - взаимодействие с кислотами, которое называется реакцией нейтрализацией. Однако основания таят в себе опасность: с растворами щелочей надо работать аккуратно и осторожно, чтобы не получить химических ожогов.
Определение, номенклатура и классификация оснований
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одним или несколькими гидроксогруппами (-ОН).
Гидроксид-ион(гидроксогруппа) – сложный ион, состоящий из кислорода и водорода и имеющий суммарный заряд 1- : О -2 Н +1 . Валентность гидроксогруппы равна 1.
Общая формула оснований : М(ОН)n, где М – металл, n- число групп ОН - и в то же время численное значение заряда иона (степени окисления) металла.
Слово «гидроксид» (им.падеж) + название металла (род.падеж) + указание степени окисления, если она переменная, римскими цифрами в скобках
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II) (читается «гидроксид железа два»)
Fe(OH)3 – гидроксид железа (III) (читается «гидроксид железа 3»)
Наличие кислорода;Кислородсодержащие;\(KOH, Sr(OH)_<2>\) ;Бескислородные;\(NH_\) как аммиачная вода Кислотность (число групп \(ОН^\) в составе или число присоединяемых \(Н^\));Однокислотные;\(NaOH, TlOH, NH_\) ;Двухкислотные;\(Ca(OH)_<2>, Mg(OH)_<2>\) ;Трёхкислотные;\(La(OH)_, TI(OH)_\) Растворимость в воде;Растворимые (щелочи);\(NaOH, KOH, Ca(OH)_<2>^\), \(Ba(OH)_<2>\) ;Нерастворимые;\(Cr(OH)_<2>, Mn(OH)_<2>\) Степень электролитической диссоциации;Сильные (α→1);\(Щелочи^ LiOH-CsOH\), \(Ca(OH)_<2>-Ra(OH)_<2>\) , \(TlOH\) ;Слабые (α→0);Нерастворимые основания Летучесть;Летучие;\(NH_∙H_<2>O\) ;Нелетучие;Щелочи, нерастворимые основания Стабильность;Стабильные;\(NaOH, Ba(OH)_<2>\) ;Нестабильные;\(NH_∙H_<2>O→ NH_↑+H_<2>O\)
Ca(OH)2 – в таблице растворимости малорастворим (м), но его относят к растворимым основаниям. К малорастворимым веществам относятся вещества, которые растворяются ограниченно – менее 1 г в 100 г воды. Это означает следующее: если в стакан, содержащий 100 г воды, поместить 10 г кристаллического гидроксида кальция, то 1 г вещества растворится, а остальные 9 г – нет. Прозрачная жидкость над осадком будет представлять собой раствор щелочи – гидроксида кальция Ca(OH)2.
Щелочи – растворимые основания. Их образуют элементы-металлы главной подгруппы первой группы (А-группы) периодической системы, а также элементы главной подгруппы второй группы (A-группы): кальций, барий и стронций. Свойства растворимых и нерастворимых оснований существенно различаются.
Получение оснований
Основания получают разными способами. Выбор способа получения зависит от того, к какой группе данное соединение относится, является щёлочью или нерастворимым основанием.
Взаимодействием щелочных и щелочноземельных металлов с водой . Протекает реакция замещения, в ходе которой кроме щёлочи образуется водород. Активные металлы энергично взаимодействуют с водой при обычных условиях.
М + Н2О = Растворимое основание (Щелочь) + Н2↑
Где М – щелочные и щелочноземельные металлы.
Взаимодействием оксидов щелочных и щелочноземельных металлов с водой . При этом протекает реакция соединения. Именно так получают гидроксид кальция в промышленных условиях.
В промышленности гидроксид натрия и калия получают путём электролиза : пропускают постоянный электрический ток через раствор хлорида натрия или калия.
Действием щелочей на растворимые соли металлов.
Раствор щелочи + раствор соли = нерастворимое основание + соль
Свойства основания
Все неорганические основания – твердые вещества (кроме гидроксида аммония NH4OH), которые характеризуются разной растворимостью в воде.
Гидроксиды щелочных металлов при обычных условиях представляют собой твердые белые кристаллические вещества, гигроскопичные, мылкие на ощупь, очень хорошо растворимы в воде (их растворение идет с выделением тепла), легкоплавки.
Гидроксиды щелочноземельных металлов (Ca(OH)2, Ba(OH)2, Sr(OH)2) – белые порошкообразные вещества, гораздо менее растворимые в воде по сравнению с гидроксидами щелочных металлов.
Нерастворимые в воде основания обычно образуются в виде гелеобразных (студенистых) осадков, разлагающихся при хранении.
Нерастворимые в воде основания могут иметь различную окраску, например: гидроксид железа (III) – бурого цвета, гидроксид алюминия - белого цвета, гидроксид меди (II) – голубого цвета.
Урок 29. Понятие об основаниях
В уроке 29 «Понятие об основаниях» из курса «Химия для чайников» познакомимся с новым классом химических веществ — основаниями, а также узнаем о новом типе химических реакций — реакциях обмена.

Как вы уже знаете, при взаимодействии активных металлов и их оксидов с водой образуются основания — соединения, не принадлежащие ни к одному из известных вам до сих пор классов: оксидов, солей или кислот.
Основания как сложные вещества
Испытаем с помощью индикатора раствор, полученный в результате реакции оксида кальция CaO с водой. Для этого прибавим к нему 1—2 капли раствора метилового оранжевого. Окраска раствора изменится с оранжевой на желтую (рис. 111).

Это свидетельствует о том, что в полученном растворе присутствует не кислота, а какое-то новое вещество, изменяющее цвет индикатора. Подобно оксиду кальция, с водой реагируют и некоторые другие оксиды, например оксид натрия Na2O:
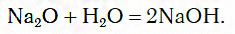
В результате взаимодействия оксидов кальция и натрия с водой образуются вещества Са(ОН)2 и NaОН. Они похожи тем, что в их состав входят атомы металлов и группы ОН, называющиеся гидроксогруппами (от греческого слова «hydor», которое означает «вода»). Такие вещества относятся к классу оснований.
Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
Валентность гидроксогруппы равна единице. Зная это, легко составить формулу любого основания: число групп ОН в формуле основания всегда равно валентности атома металла, например:
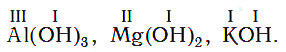
В то же время по формуле основания можно легко определить валентность атомов содержащегося в нем металла — она равна числу гидроксогрупп в формуле данного основания. Например, в формуле основания Fe(OH)2 две гидроксогруппы, следовательно, валентность атома железа в этом веществе равна II, а в основании Cr(OH)3 валентность атомов хрома равна III.
Как же называются основания? Известно, что продукты соединения воды с веществами называются гидратами. Если с водой соединяются оксиды металлов, то образуются гидраты оксидов металлов, или сокращенно гидроксиды металлов. Поэтому вещества Ca(OH)2 и NaOH, образующиеся при взаимодействии оксидов кальция и натрия с водой, называются «гидроксид кальция» и «гидроксид натрия».
По растворимости в воде основания делятся на растворимые и нерастворимые. Растворимые в воде основания называют щелочами. К их числу относятся KOH, NaOH, Ca(OH)2, Ba(OH)2 и некоторые другие.
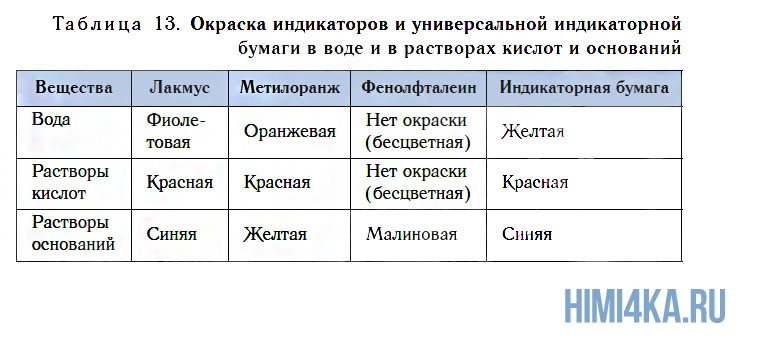
Обнаружить присутствие растворимых в воде оснований (щелочей) можно по изменению окраски индикаторов. Кроме известных вам лакмуса и метилоранжа, для этих целей можно использовать еще один индикатор — фенолфталеин. Он не имеет окраски в воде и в растворе кислоты, но в присутствии щелочей этот индикатор окрашивается в малиновый цвет (см. рис. 111, табл. 13).
Реакция нейтрализации
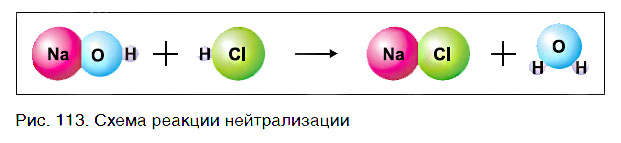
Как было показано, растворимые в воде основания — щёлочи — легко обнаружить с помощью индикаторов. Однако если к раствору гидроксида натрия NaOH прибавить фенолфталеин, а затем хлороводородную кислоту, то появившаяся вначале малиновая окраска после добавления кислоты исчезает (рис. 112).

Это свидетельствует о том, что кислота как бы уничтожила, или нейтрализовала, основание. Реакцию между кислотой и основанием, протекающую в этом случае, называют реакцией нейтрализации:
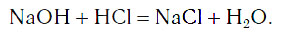
Реакция нейтрализации — это реакция между основанием и кислотой, в результате которой образуются соль и вода.
Реакция нейтрализации не относится ни к одному из известных вам до сих пор типов реакций (разложения, соединения, замещения). Это реакция нового типа — реакция обмена.
Реакциями обмена называются реакции между сложными веществами, в ходе которых они обмениваются своими составными частями.
Основание состоит из атомов металла и гидроксогрупп, а кислота — из атомов водорода и кислотного остатка. В результате реакции исходные вещества обменялись своими составными частями (рис. 113):
Краткие выводы урока:
- Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- Реакция между основанием и кислотой, в ходе которой образуются соль и вода, называется реакцией нейтрализации.
- Реакция обмена — реакция между сложными веществами, в результате которой они обмениваются своими составными частями.
Надеюсь урок 29 «Понятие об основаниях» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекулой называют наименьшую электронейтральную частицу вещества, способную к самостоятельному существованию и обладающую его химическими свойствами. Молекула представляет собой систему взаимодействующих между собой атомов, образующих определённую структуру с помощью химических связей.
Химический элемент — совокупность атомов, характеризующихся одинаковым значением (величиной) заряда ядра.
Ионами называют электрически заряженные частицы, возникающие при потере или присоединении электронов атомами или молекулами.
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
Вещество — любая совокупность атомов и молекул.
Свойства веществ (температуры плавления и кипения, плотность, цвет и т. д.) относятся к совокупности атомов или молекул.
По химическому составу неорганические вещества делят на простые и сложные.
Простыми называют вещества, которые образуют атомы одного и того же химического элемента (например, H2, O2).
Простые вещества делят на металлы и неметаллы.
Металлами называют простые вещества, которые обладают характерными металлическими свойствами, а именно высокой электро- и теплопроводностью и металлическим блеском.
Простые вещества, которые образуют атомы элементов-неметаллов, при нормальных условиях такими свойствами не обладают.
В периодической таблице Д.И. Менделеева неметаллы расположены в главных подгруппах справа вверху от условной диагонали, проведённой через бор и астат. В главных подгруппах слева от этой диагонали и во всех побочных подгруппах располагаются металлы.
Сложными называют вещества, которые состоят из атомов двух и более элементов (например, H2S, NO2).
Для выражения состава вещества используют различные химические формулы. При их написании используют общепринятые символы химических элементов. Символ элемента состоит из первой буквы или первой и одной из последующих букв латинского названия элемента, при этом первая буква всегда прописная, а вторая — строчная.
Названия и обозначения атомов совпадают с символами химических элементов. Например, О — атом кислорода, 2О — два атома кислорода, О2 — молекула кислорода, О3 — молекула озона.
Сложные вещества разделяют на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. В формуле сложного вещества вначале ставят катион, а затем — анион, например KBr, CuSO4. Названия сложного вещества читают справа налево, т. е. вначале называют его электроотрицательную составляющую в именительном падеже, а затем электроположительную в родительном падеже.
Для бинарных, т. е. состоящих из двух элементов соединений, действуют следующие правила. Если соединение состоит из металла и неметалла, то на первом месте всегда ставят металл (как более электроположительный элемент): K2S, BaCl2.
В формулах соединений, состоящих только из неметаллов, на первом месте всегда ставят элемент, находящийся левее в условном ряду неметаллов, построенном по их возрастающей электроотрицательности:
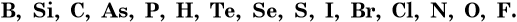
Например, IBr — бромид йода, CS2 — дисульфид углерода.
Формула молекулярная (брутто-формула) включает символы всех химических элементов, входящих в состав соединений. Около каждого символа ставят числовой индекс, показывающий, сколько атомов данного вида входит в состав соединения. Таким образом, молекулярная формула показывает качественный и количественный состав молекулы. Например, формула KNO3 показывает, что вещество состоит из 1 атома калия (индекс, равный 1, не ставится), 1 атома азота и 3 атомов кислорода.
Чтобы правильно прочитать формулу, надо знать как русские, так и латинские обозначения элементов. Называя вещество «вода», мы говорим, что его формула H2O (читается «аш два о»). Данное вещество состоит из двух атомов водорода и одного атома кислорода.
Называя вещество сульфат калия, K2SO4, мы читаем его формулу «калий два эс о четыре». Данное вещество состоит из двух атомов калия, одного атома серы и четырех атомов кислорода.
Если в формуле структурный фрагмент повторяется несколько раз, его заключают в круглые скобки и за скобками ставят числовой индекс, который произносят «дважды», «трижды», например, Ca(NO3)2 читается «кальций эн о три дважды», Mg3(PO4)2 читается «магний три пэ о четыре дважды».
Коэффициент, стоящий перед формулой вещества в уравнении реакции, читают как число, например: 3HNO2 — «три аш эн о два».
Оксидами называют класс химических соединений, состоящий из какого-либо элемента и атома кислорода со степенью окисления –2.
Называют оксиды, руководствуясь следующими правилами:
- Вначале указывают слово оксид, а затем в родительном падеже название второго элемента;
- Если элемент может образовать несколько оксидов, то после названия элемента в скобках указывают его валентность;
- При написании формул оксидов кислород всегда ставят на втором месте.
Примеры: K2O — оксид калия, N2O5 — оксид азота (V), CrO3 — оксид хрома (IV).
Для некоторых распространённых оксидов используют тривиальные названия, например CaO — негашеная известь, N2O — веселящий газ, CO — угарный газ, CO2 — углекислый газ.
Оксиды классифицируют так.
Низшими называют оксиды, в которых элемент проявляет низшую степень окисления, например MnO — оксид марганца (II).
Высшими называют оксиды, в которых элемент проявляет высшую степень окисления, например Mn2O7 — оксид марганца (VII).
Несолеобразующими, или безразличными, называют оксиды, не проявляющие ни основные, ни кислотные свойства, например N2O, NO, CO.
Солеобразующими называют группу кислотных, основных и амфотерных оксидов.
Основные оксиды образуют металлы в низших степенях окисления. Наиболее известные из них: Li2O, Na2O, K2O, Rb2O, Cs2O, MgO, CaO, SrO, BaO, Cu2O, Ag2O, HgO, CrO, FeO.
Амфотерными называют оксиды, которые проявляют как основные, так и кислотные свойства, в зависимости от другого реагента. Наиболее известные амфотерные оксиды Al2O3, Cr2O3, ZnO, BeO, PbO, SnO. Ряд оксидов, например CuО, Fe2O3, проявляет амфотерные свойства с преобладанием основных.
Существует несколько способов получения оксидов.
Реакции простых веществ с кислородом:
При взаимодействии сложных веществ с кислородом часто образуется смесь оксидов элементов:
Оксиды металлов реагируют с химически более активными металлами. При этом образуется новый оксид и новый металл:
Некоторые высшие оксиды получают доокислением низших оксидов, а ряд низших оксидов получают разложением высших оксидов:
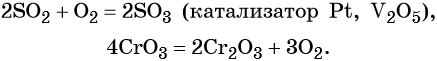
Иногда для получения оксидов используют реакции разложения солей и гидроксидов:
Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы.
Число гидроксильных групп определяет кислотность основания, например: NaOH — однокислотное, Mg(OH)2 — двухкислотное и т. д.
Щелочами называют растворимые в воде основания.
Сильные основания: гидроксиды щелочных и щёлочноземельных металлов LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Слабые основания: все нерастворимые в воде гидроксиды металлов и гидрат аммиака.
Называют основания следующим образом:
- Вначале указывают слово гидроксид, а затем добавляют название металла в родительном падеже;
- Если элемент может образовывать несколько оснований, то после его названия в круглых скобках римской цифрой указывают валентность: KOH — гидроксид калия, Fe(OH)2 — гидроксид железа (II), Fe(OH)3 — гидроксид железа (III);
- При написании формул гидроксидов гидроксильную группу всегда ставят на втором месте.
Для некоторых распространённых гидрокидов используют тривиальные названия, например: Ca(OH)2 — гашёная известь; NaOH — едкий натр, или каустик.
Существуют следующие способы получения оснований:
Реакция основных оксидов с водой:
Взаимодействие некоторых металлов с водой:
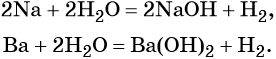
Реакция обмена между солями и основаниями:
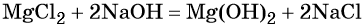
Первые два способа применяют для получения растворимых, а последний — для получения нерастворимых в воде оснований. Существуют и иные способы получения оснований.
Все растворы щелочей имеют pH > 7. При этих значениях pH происходит изменение окраски индикаторов: лакмуса — на синюю, фенолфталеина — на малиновую, метилового оранжевого — на жёлтую, что является качественным методом обнаружения щелочей. Более подробный материал о показателе pH будет изложен в уроке 24.
Кислотами называют класс химических соединений, которые содержат в своём составе один или несколько катионов водорода, способных замещаться на атомы металлов, и анионов кислотных остатков.
Основностью кислоты называют число способных замещаться на металл атомов водорода в её молекуле. По основности кислоты делят на одно-, двух- и трёхосновные, например HBr, H2S и H3PO4 соответственно.
В зависимости от элементного состава кислоты делят на бескислородные и кислородные, например HBr и H2SO3. Кислотный остаток — это структурный элемент молекулы кислоты, который выступает как единое целое в ходе химических реакций.
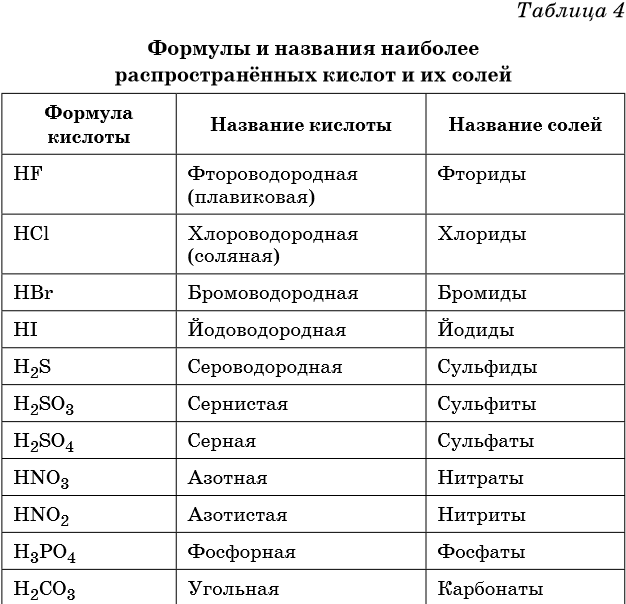
В таблице 4 приведены формулы и названия наиболее распространенных кислот и их солей.

Сильные кислоты: HI, HBr, HCl, HClO3, HClO4, H2SO4, HNO3.
Кислородсодержащие кислоты и основания объединяют в общий класс гидроксидов.
Амфотерными называют гидроксиды, способные реагировать как с кислотами, так и с основаниями. Амфотерные гидроксиды: Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, Sn(OH)2. Некоторые гидроксиды, например Cu(OH)2, Fe(OH)3, проявляют амфотерные свойства с преобладанием основных.
Большинство кислородных кислот получают реакцией соответствующих оксидов с водой:
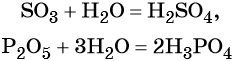
Некоторые кислоты получают из солей путём вытеснения более сильной кислотой, например:
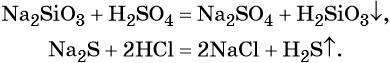
Бескислородные кислоты получают прямым взаимодействием неметалла с водородом либо действием более сильных кислот на соответствующие соли:
Солями называют класс химических соединений, которые представляют собой продукты взаимодействия кислот с основаниями.
По составу соли классифицируют на средние, кислые и основные.
Средними называют соли, которые состоят только из катиона металла или иона аммония и аниона кислотного остатка, например: CsBr, MgSO4.
Кислыми называют соли, которые наряду с катионом металла содержат катионы водорода, способные замещаться на другие катионы в ходе обменных реакций, например: LiHCO3 (гидрокарбонат лития), CaHPO4 (гидрофосфат кальция).
Основными называют соли, которые наряду с анионом кислотного остатка содержат одну или несколько гидроксильных групп, способных замещаться на анионы в ходе реакций обмена, например: Al(OH)2Br, Cu(OH)I.
При написании формул солей на первом месте ставят катион, а при написании названий — анион. Названия солей состоят из названия аниона в именительном падеже и названия катиона в родительном. Например, NaBr — бромид натрия, BaCO3 — карбонат бария. Если металл проявляет различные степени окисления, то в названиях степень окисления указывается римской цифрой: FeCl2 — хлорид железа (II), FeCl3 — хлорид железа (III). Кислые соли называют добавлением к аниону приставки гидро-, а если необходимо, то и соответствующего числительного, например: NaHCO3 — гидрокарбонат натрия, КH2PO4 — дигидрофосфат калия, Al(OH)2Br — дигидроксобромид алюминия, Cu(OH)I — гидроксойодид меди (II).
Основные соли называют добавлением приставки гидроксо- к названию кислотного остатка, указывая, если необходимо, соответствующее числительное: Mg(OH)Cl — гидроксохлорид магния, Al(OH)2Cl — дигидроксохлорид алюминия.
Существует множество путей получения солей. Приведём наиболее важные из них.
Реакция нейтрализации, т. е. взаимодействие кислот и оснований, взаимодействие кислот с основными и амфотерными оксидами и реакция оснований с кислотными оксидами:
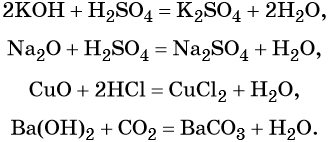
Взаимодействие кислот или щелочей с солями:
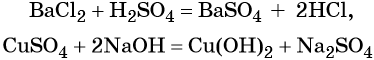
Взаимодействие металлов с неметаллами, кислотами, солями:
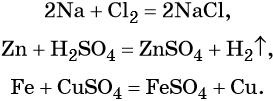
Взаимодействие основных и кислотных оксидов:
По своим физическим свойствам соли — твёрдые кристаллические вещества, часто имеющие высокие температуры плавления. По растворимости в воде соли делятся на растворимые (более 1 г вещества на 100 г воды), малорастворимые (от 0,1 до 1 г вещества на 100 г воды) и нерастворимые (менее 0,1 г вещества на 100 г воды). В воде растворимы все соли азотной и уксусной кислот.
Тренировочные задания
1. Кислотой и амфотерным гидроксидом соответственно являются
2. Основанием и кислотным оксидом соответственно являются
3. Кислой солью и несолеобразующим оксидом соответственно являются
4. Гидроксидом и щёлочью соответственно являются
5. Вещество, химическая формула которого Cr2(SO4)3, имеет название
1) сульфат хрома (III)
2) сульфит хрома (III)
3) сульфат хрома (II)
4) сульфит хрома (II)
6. Вещество, химическая формула которого CaHPO4, называется
1) фосфат кальция
2) гидрофосфат кальция
3) дигидрофосфат кальция
4) фосфид кальция
7. К простым веществам относится
1) поваренная соль
2) кислород
3) оксид кремния
4) пищевая сода
8. К простым веществам относится
1) поташ
2) углекислый газ
3) веселящий газ
4) бром
9. К сложным веществам относится
1) поташ
2) сера
3) озон
4) бром
10. К сложным веществам относится
1) фтор
2) фосфор
3) углекислый газ
4) бром
11. Только основные оксиды приведены в списке
12. Только несолеобразующие оксиды приведены в списке
13. В перечне веществ, формулы которых: А) H2O В) HNO3 Д) CaO Б) N2O Г) H2SO4 Е) NaOH к оксидам относятся
1) АБВ
2) АБД
3) БВД
4) БДЕ
14. В перечне веществ, формулы которых: А) CaO В) Cr2O3 Д) SrO Б) Fe2O3 Г) NO Е) Li2O к основным оксидам относятся
1) АБВ
2) АБД
3) БВД
4) АДЕ
15. В перечне веществ, формулы которых: А) CO2 В) SO2 Д) SrO Б) CrO3 Г) Cr2O3 Е) CrO к кислотным оксидам относятся
16. В перечне веществ, формулы которых: А) CrO В) ZnO Д) Al2O3 Б) CrO3 Г) Cr2O3 Е) NO к амфотерным оксидам относятся
1) АБВ
2) АВД
3) ВГД
4) АДЕ
1) АБВ
2) БВГ
3) БВД
4) АБД
18. В перечне веществ, формулы которых: А) HCl В) (NH4)2HPO4 Д) H3PO4 Б) HNO3 Г) NH4HSO4 Е) Ca(HCO3)2 к кислотам относятся
Основания. Основания Это сложные вещества, состоящие из 1 атом металла и одной или нескольких гидроксогрупп –ОН. - презентация
Презентация на тему: " Основания. Основания Это сложные вещества, состоящие из 1 атом металла и одной или нескольких гидроксогрупп –ОН." — Транскрипт:
2 Основания Это сложные вещества, состоящие из 1 атом металла и одной или нескольких гидроксогрупп –ОН.
3 Классификация оснований. Основания Растворимые (щелочи) Нерастворимые
4 Химические свойства щелочей. Изменение окраски индикатора +кислотный оксид + кислота (реакция нейтрализации)
5 Химические свойства нерастворимых оснований. +кислота (реакция нейтрализации) Разложение при нагревании
Похожие презентации

Оксиды. Оксиды Это сложные вещества, состоящие из 2 элементов, один из которых- кислород. Общая формула XO.

Реакции ионного обмена. Химические свойства оксидов 1)Кислотный или основный оксид + вода 2)Основный оксид + кислота 3)Кислотный оксид + щелочь (или нерастворимое.

ОксидыОксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород. Кислоты Кислоты – это сложные вещества, состоящие из атомов.

Химические свойства Способы получения. Химические свойства Гидроксид – ионы (ОН - ), образующиеся при диссоциации оснований, обуславливают их химические.

Основания Ме(ОН) х -сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими группами атомов ОН. Ме(ОН) х, где х=1,2,3.

Тема урока: Выполнено Романовой В.П. учителем химии первой категории МОУ «Ардинская СОШ»

Основные классы неорганических веществ ОСНОВАНИЯ.

ПРЕЗЕНТАЦИЯ НА ТЕМУ ОСНОВАНИЯ. Основаниями называются сложные неорганические соединения состоящие из атома металла и одной или нескольких гидрооксильных.

Учитель химии МОУ СОШ 14 с. ПОДЪЯПОЛЬСК Шкотовский район Крысь Наталья Семёновна.

Тема урока ОСНОВАНИЯ. Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. Me(OH) n n = валентность металла.

L/O/G/O ОСНОВАНИЯ. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.

Основные классы неорганических соединений Основания.

Неорганическая химия 8 класс г. Азов школа 9 учитель: Карасёв Евгений Владимирович.

Тема урока: Основания в свете ТЭД. NaOH KOH Ca(OH) 2 Fe(OH) 2 Fe(OH) 3 Al(OH) 3 Cu(OH) 2 Гидроксид натрия Основание Название Кислотность Растворимость.
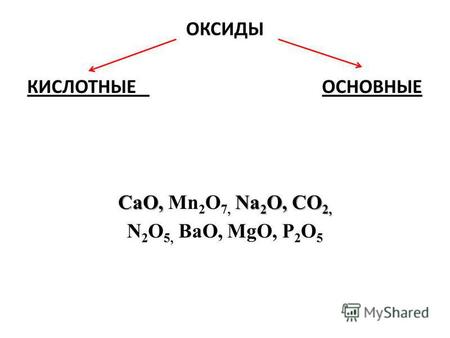
ОКСИДЫ КИСЛОТНЫЕ ОСНОВНЫЕ CaO, Na 2 O, CO 2, CaO, Mn 2 O 7, Na 2 O, CO 2, N 2 O 5, BaO, MgО, P 2 O 5.

Номенклатура оснований Классификация и примеры Получение оснований Химические свойства.

ОСНОВАНИЯ Иванова Г.А. МОУ СОШ 10 города Белово 11 класс, базовый уровень.

1. Сложные вещества 2. Состоят из атомов металла и гидроксогруппы 3. Валентность гидроксогруппы равна (I)

Тема: Важнейшие классы неорганических соединений. Учитель химии: Шохина К.А.

L/O/G/O В мире кислот изучение свойств кислот в свете теории электролитической диссоциации учитель химии Курова О.Г.
Основания

О чем эта статья:
Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «гидроксид».
Указываем название второго химического элемента в родительном падеже.
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оснований:
Ni(OH)2 — гидроксид никеля (II);
Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
Классификация оснований
По растворимости в воде
В зависимости от растворимости в воде выделяют:
щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
однокислотные: KOH, NaOH;
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
Гидроксид лития LiOH
Гидроксид магния Mg(OH)2
Гидроксид кальция Ca(OH)2
Химические свойства оснований
Растворы щелочей изменяют окраску индикатора
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.
Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Кислотный оксид + основание = соль + вода
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
Основание + кислота = соль + вода
Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание оксид металла + вода
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
При сплавлении двух оснований:
Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
Если реакция проводится в растворе:
Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
Взаимодействие металла с водой
Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
Металл + вода = гидроксид металла + водород
Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
Этим способом получают только растворимые в воде основания.
Оксид металла + вода = щелочь
Электролиз
Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Вопросы для самопроверки
Вспомните определение оснований и приведите 2 примера этих веществ.
Какие виды оснований существуют? Чем они отличаются?
К какому виду оснований относится Zn(OH)2?
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
Читайте также:
