Виды коррозии металлических конструкций
Обновлено: 19.05.2024
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная

Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Коррозия металлов. Все виды особенности и факты
Коррозия — разрушительный процесс, который пагубно влияет на металлические конструкции. Процесс может иметь как химические, так и химико-физические причины. Чаще всего причиной возникновения таких проблем является неустойчивость материала к воздействию внешних факторов, чаще всего термодинамического характера.
Чаще всего ржавчина прогрессирует исключительно в верхних слоях материала, но иногда проникает и вглубь.
Виды коррозийных процессов
Коррозия металлов имеет большое количество разновидностей. Но в основном все виды подразделяются на два основных типа:
- Коррозия общего характера. Она называется равномерной, а встречается чаще всего. Причиной возникновения такой коррозии считаются химические и электрохимические реакции. Такая разновидность коррозии приводит к отрицательному воздействию на всю поверхность материала и металлической конструкции. При этом процесс может быть равномерным или неравномерным. При неравномерном распределении ржавчины, она на одном участке разъедает материала быстрее и сильнее, чем на соседнем.
- Местный вид коррозии. Возникает на одном участке, где и развивается.
- Местная пятнами. Возникает на отдельных участках материала.
- Язвенная, ее еще называют питтинг.
- Межкристаллитная — такая коррозия возникает на пограничных областях металлического кристалла. Чаще вспыхивает в тех материалах, которые содержат в составе никель и алюминий. Металл в кратчайшие сроки остается без первоначальных показателей прочности и эластичности.
- Растрескивающая.
- Подповерхностная.
- Коррозия под током — возникает под воздействием блуждающего или постоянного тока.
- Коррозийная кавитация — вариант разрушений, когда помимо ржавчины на металл воздействует и ударная сила.
- Фреттинг-коррозия — одновременное воздействие ржавчины и вибрации, которые совместно приводят к разрушению металлических конструкций. варианты.

Есть еще различия и по механизму воздействия.
Химический вариант разрушения
Это разновидность процесса, при котором рушатся связи металлические, а между атомами веществ материала и окислителей возникает химическая взаимодействие. В такой ситуации не образуется электрический ток между различными областями материала. В свою очередь такой вид разрушения подразделяется еще на два типа:
- Газовый вариант. Получается при воздействии агрессивных азов, а также паров в сочетании с высокими показателями температуры. Если материал относится к активным, то воздействие таких сред может привести к окончательному разрушению материала по всей поверхности. К таким средам относятся: сероводород, диоксид серы, пары воды, кислород. Такой вид разрушительного процесса чаще всего заметен в промышленности и на химическом производстве.
- Жидкостный вариант ржавчины. Случается в неэлектролитических веществах. Если имеется даже небольшое содержание жидкости, то процесс становится электрохимическим.
Важно, что при химической разновидности коррозии металл разрушается со скоростью протекания химической реакции.
Электрохимическая ржавчина
Этот вариант разрушительных процессов возникает в среде электролитов. Процесс сочетается с возникновением тока. В итоге из решетки вещества убирается атом и одновременно протекают два процесса:

- Анодный — вещество материала в качестве ионов входит в раствор.
- Катодный — те вещества, которые получаются в предыдущем процессе, связываются при помощи деполяризатора.
Собственно отвод электродов так и называется — деполяризация, а непосредственно вещества, которые способствуют данному процессу именуются деполяризаторами.
Наиболее часто возможно встретить вариант разрушения с водородной и кислородной деполяризацией.
Разновидность металлов по отношению к коррозии электрохимического вида
Все металлы по отношению к такому виду ржавчины делятся на 4 подтипа:
- Активные вещества или материалы с высокими параметрами термодинамической нестабильности. Это все щелочные виды металлов. Они подвержены влиянию коррозии даже в абсолютно нейтральных средах, где нет кислорода и других окислительных веществ.
- Средние материалы по уровню активности — в таблице Менделеева расположены между кадмием и водородом. Это материалы отличающиеся термодинамической нестабильностью в агрессивных кислых средах.
- Материалы с низкими параметрами активности или вещества с промежуточными параметрами стабильности по термодинамике. Противостоят коррозии в кислых и нейтральных атмосферах, при отсутствии кислорода.
- Благородные разновидности веществ. Это материалы с высокой стабильностью. Они поддаются коррозии только в кислых средах и в присутствии сильнейших окислителей.
Такие типы ржавчины могут разделяться по видам агрессивных сред, в которой она протекает:
- Процесс в электролитных веществах — процесс протекает в жидких кислых, щелочных средах, а также в простой воде.
- Атмосферный вид — любой газовый вариант с наличием влажности. Это очень распространенный вариант электрохимического разрушения металла. Главное, чтобы в данной среде была влажность. Только при таких условиях есть возможность протекания необходимых реакций.
При электрохимической вариации процесса одна часть металла служит анодом, а другая — катодом. Последним становятся те участки металла, куда больше поступает кислорода.
В зависимости от воздействующих сред есть и другие разновидности коррозий:
- Почвенная — протекает с разной степенью интенсивности. Все зависит от агрессивности почвы. В таких условиях происходит подземные разрушительные процессы на трубах и прочих подземных конструкциях.
- Аэрационная — причиной служит неравномерный приток воздуха к разным участкам материала.
- Морская — процесс проходит строго в соленой воде.
- Биокоррозия — результат жизнедеятельности бактерий и микроорганизмов. Они выделяют газы, которые и приводят к возникновению разрушительных процессов.
- Электрокоррозия — является результатом воздействия блуждающего тока.
Кроме того основные виды коррозии могут различаться в зависимости от типа металла, на которых они возникают.
Разрушительные процессы на меди
Медь считается достаточно стабильным металлом. Ее стабильность замечена в следующих средах:
- Атмосфера.
- Морская и пресная вода.
- Галогеновые среды со специальными условиями.
- В кислотах-неокислителях.
При этом медные конструкции отличаются нестабильностью в следующих условиях:
- При контакте с соединениями серы, а также с самой серой в чистом виде.
- При погружении в растворы солей-окислителей.
- В агрессивной воде.
Также часто встречается и атмосферная коррозия меди.
Ржавление железа
Еще один популярный элемент, который часто подвергается действию ржавчины — железо. Чаще всего железо подвергается разрушительным процессам в результате контакта с воздухом или кислотным раствором.
Способы защиты от коррозии металлов
Используется несколько основных методов по защите металлических конструкций от разрушительного воздействия коррозии. При использовании защиты в основном делается упор на то, что ржавчина без внешних повреждений не может проникнуть к металлу.

При этом важно, что защитные покрытия выполняют не только предохраняющую функцию, но и придают металлическим конструкциям симпатичный внешний вид.
Прежде всего, это покрытия, которые разделяются на три типа, по материалам нанесения:
- Металлические.
- Неметаллические.
- Химические.
Каждый из них имеет свои особенности и преимущества.
Металлические покрытия. Это способ, при котором на металлическую конструкцию наносят тонким слоем другой вид металла, который более стабилен к разрушительному действию коррозии при аналогичных условиях.
Покрытие может называться анодным или катодным в зависимости от того более активный или менее активный металл сверху.
Неметаллические покрытия. Они подразделяются на органические и неорганические. Чаще всего используется высокополимерный пластик, стекло и керамика. Из органических известны и популярны лаки, битум, краски, а также резина.
Химические покрытия. Это вариант, при котором на поверхности металлической конструкции при помощи химической обработки, наносится пленка, устойчивая к воздействию коррозии. Таких пленок может быть несколько разновидностей:
- Оксидирование — нанесение оксидных пленок.
- Фосфатирование — получение пленки фосфатов.
- Азотирование — пленка из активного азота.
- Воронение стали.
- Цементация — соединение с углеродом.
Также в качестве защиты используется изменение состава коррозийной среды. Еще один вариант защиты — ввести в металл технические соединения, которые повышают стойкость материала к разрушительным действиям коррозии.
Протекторный вид — вариант электрохимической защиты, при которой к конструкции присоединяются пластины с более активным металлом. При этом протектор — материал с отрицательными параметрами потенциала, а защищаемый материал — катод.
Заключение
Процесс коррозийной порчи материала разнообразный и многосторонний. Нюансы зависят от среды, от вида и активности металла, а также от дополнительных факторов влияния. Поэтому существует много способов защиты металлических конструкций от разрушительного влияния ржавчины и агрессивных сред.
Чаще всего применяются защитные пленки, как металлические, так и неметаллические. В отдельных случаях металл специально подвергают химической обработке. Наиболее стабильны по отношению к коррозии считаются благородные металлы, в том числе золото и платина.
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме +n + n? → Me 0 ; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме 0 - n? → Me + n ; ΔG<0). В результате такого самопроизвольно протекающего коррозионного процесса металлы переходят в оксиды, гидроксиды, карбонаты, сульфиды и другие соединения и теряются безвозвратно.
Итак, коррозию можно определить как самопроизвольно протекающий окислительно-восстановительный процесс (ΔG<0) разрушения металла под воздействием окружающей среды, происходящий с выделением энергии (ΔН<0) и рассеиванием вещества (ΔS>0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную (наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
- электрохимическая (концентрационная, контактная, электрокоррозия);
- особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
- коррозию под влиянием механических напряжений;
- коррозию при трении;
- кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a2O3, ZnO, NiO и т.д.).
При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина). Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
Анодный процесс: Fe 0 - 2? → Fe 2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4? → 4OH - 1 деполяризация
Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3, образующийся Fe(OH)3 при нагревании может терять воду.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.
Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1-0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро - и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е 0 Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е 0 Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn | H2SO4 | Cu (K)
Анодный процесс: Zn 0 - 2? → Zn 2+
Катодный процесс: 2Н + + 2? → Н2 деполяризатор
Суммарное ионное уравнение: Zn + 2H + → Zn 2+ + H2
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al | HCl | Zn (K)
В 0,1 М растворе HCl в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1. Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2. Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3. Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4. Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe 2+ ® Fe3(PO4)2¯ + 4H ( фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
A: Zn 0 - 2? → Zn 2+ 2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
(А) Fe | 2H + | Sn (K)
A: Fe 0 - 2? → Fe 2+ 1
Fe + 2H + → Fe 2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защита заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn 0 – 2 ® Zn 2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4® 4OH - ; E 0 = 0,40 B.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ = 1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5 — NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO3 2- , NO2 - , Cr2O7 2- , а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl - , Br - , F - , SO4 2- , NO3 - .
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Коррозия металлических конструкций. Коррозия каменных конструкций.
По своей природе различают коррозию химическую и электрохимическую. Химическая коррозия возник: в результате непосредственного воздействия на металл aгpeccивных жидкостей или газов. Электрохимическая коррозия вызывается воздействием влаги и атмосферы на поверхностный слой металла. Коррозия приводит к уменьшению поперечного сечения несущей способности элементов конструкций. Скорость коррозии зависит от степени агрессивности окружающей среды и от фор поперечных сечений конструкций. Скопление пыли на поверхности и периодическое ее смачивание увеличивают скорость коррозии
Коррозионное разрушение металла является одной из существенных причин потери работоспособности и снижения долговечности металлических конструкций. Коррозией металлов называется окислительно-восстановительный процесс разрушения металлов и сплавов в результате химического или электрохимического взаимодействия с окружающей средой, происходящий на поверхности раздела фаз. Более всего от коррозии страдают железо и его сплавы, а также алюминий. Металлические конструкции подвержены в основном электрохимической коррозии, возникающей при соприкосновении металлов с электролитами.
При оценке технического состояния конструкций, пораженных коррозией, необходимо прежде всего определить вид коррозии. Это дает возможность сузить интервал поиска основных причин коррозионного повреждения конструкций, более точно определить влияние коррозионного повреждения на несущую способность элементов конструкций, а также разработать наиболее обоснованные мероприятия по восстановлению несущей способности и защите конструкций от коррозии.
По характеру поражения металла различают сплошную (общую) и локальную коррозию.
Сплошная коррозия в свою очередь может быть равномерной и неравномерной в зависимости от глубины поражения на различных участках поверхности. Если при коррозии нарушается одна структурная составляющая сплава (графитизация чугуна) или один из компонентов сплава, то коррозию называют структурно-избирательной (рис. 2.1).
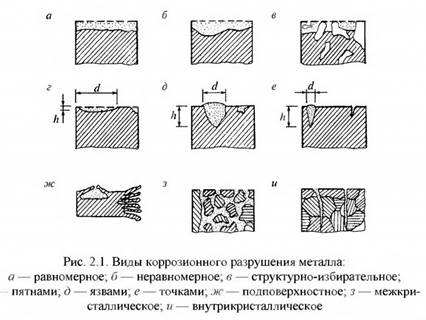
Сплошная коррозия характерна для стали, алюминия, цинковых и алюминиевых защитных покрытий в любых средах, в которых коррозионная стойкость данного материала или металла покрытия недостаточна. Этот вид коррозии характеризуется относительно равномерным по всей поверхности постепенным проникновением вглубь металла, то есть уменьшением толщины сечения элемента или толщины защитного слоя металлического покрытия. При коррозии в нейтральных, слабощелочных и слабокислых средах элементы конструкции покрываются видимым слоем продуктов коррозии, после механического удаления которого до чистого металла поверхность конструкций оказывается шероховатой, но без видимых язв, точек коррозии и трещин. При коррозии в кислых (а для цинка и алюминия и в щелочных) средах видимый слой продуктов коррозии может не образовываться Общей коррозии наиболее подвержены, как правило, поверхности в узких щелях, зазорах и на участках скопления пыли и влаги.
Язвенная коррозия характерна в основном для углеродистой и низколегированной сталей при эксплуатации конструкций в жидких средах и грунтах, в меньшей степени — для алюминия, алюминиевых и цинковых покрытий. Язвенная коррозия низколегированной стали в атмосферных условиях чаще всего связана с неблагоприятной структурой металла, с повышенным количеством неметаллических включений, в первую очередь сульфидов с высоким содержанием марганца. Язвенная коррозия обычно сопровождается образованием толстых слоев продуктов коррозии, покрывающих всю поверхность металла или значительные ее участки вокруг отдельных крупных язв. Коррозионные язвы являются острыми концентраторами напряжений и могут оказаться инициаторами зарождения усталостных трещин и хрупких разрушений.
Наиболее опасны межкристаллитная и транскристаллитная коррозии (рис. 2.1,з, и). Первая проходит по наименее стойким границам зерен, не затрагивая зерен металла. Вторая — рассекает зерна металла, проходя через них трещиной. Межкристаллитной коррозии подвержены многие сплавы: строительные стали, нержавеющие высокохромистые и хромоникелиевые стали, дюралюминиевые сплавы и др. Межкристаллитная коррозия характеризуется относительно равномерным распределением множественных трещин на больших участках поверхности конструкций. Под оптическим микроскопом на поперечных шлифах, изготавливаемых из отобранных проб, видно, что трещины распространяются только по границам зерен металла.
Коррозионное растрескивание — вид квазихрупкого разрушения стали и высокопрочных алюминиевых сплавов при одновременном воздействии статических напряжений растяжения и агрессивных сред. Разрушение характеризуется образованием единичных и множественных трещин, связанных с концентрацией основных и внутренних напряжений. Трещины могут распространяться между кристаллами или по телу зерен. Коррозионное растрескивание характерно для сталей с повышенным содержанием водорода. Коррозионное растрескивание выявляется фрактографическим анализом проб.
Аналогичные признаки имеет коррозионная усталость — вид квазихрупкого разрушения материалов при одновременном воздействии циклических напряжений и жидких агрессивных сред. Об интенсивности коррозионной усталости судят по числу циклов до зарождения трещин или по скорости роста наиболее длинных трещин.
Основным фактором, влияющим на развитие коррозии, служит атмосферная среда. Показателями, определяющими степень агрессивности среды, являются: относительная влажность, температура, возможность образования конденсата, состав и концентрация газов и пыли, туманы агрессивных жидкостей. В зависимости от условий эксплуатации конструкции могут находиться под воздействием общезаводской атмосферы и внутрицеховой. Особенно неблагоприятным фактором является относительная влажность. Наибольшая скорость коррозии реализуется при периодическом выпадении конденсата, однако она резко возрастает уже при достижении так называемой критической влажности — для стали 70. 75 %. При наличии продуктов коррозии на поверхности конструкций критическая влажность снижается до 50. 60 %.
Степень коррозионного износа определяют измерением толщины тщательно очищенного от продуктов коррозии прокатного профиля. Измерения осуществляют с помощью скобы с индикатором часового типа с ценой деления 0,01 мм. Замеры должны быть произведены в 10—20 местах по длине элемента для получения достоверного результата надо сделать около 200 замеров однотипных элементов.
Своевременная защита от коррозии металлических конструкций в процессе эксплуатации — одно из главных условий долговечности и надежности сооружений. Наиболее распространенным и достаточно эффективным средством для защиты металлоконструкций от коррозии являются лакокрасочные (органические) покрытия — высокомолекулярные пленки естественного и искусственного происхождения. Физико-химическую основу лакокрасочных материалов составляют многокомпонентные системы, содержащие пленкообразующие вещества, растворители, пигменты и добавки различного назначения. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать хорошей адгезией и механической прочностью.
В зависимости от рода пленкообразующего вещества лакокрасочные материалы подразделяются на масляные, битумные, глифталевые, перхлорвиниловые, эпоксидные и др. В большинстве случаев материал наносится на предварительные слои грунтовки и шпатлевки, обычно в несколько покрывных слоев. Выбор типа лакокрасочного материала зависит от степени агрессивности эксплуатационной среды и определяется нормативными документами
При восстановлении защитных покрытий большое значение имеет подготовка поверхности элементов под окраску. Перед нанесением покрытия поверхность очищается механическим или химическим способом от ржавчины, старой краски, жировых и других загрязнений до степени 1 (ГОСТ 9.402-80*). К механическим способам относятся пескоструйная и дробеструйная очистка, обработка поверхности механизированным инструментом. При пескоструйной очистке применяется специальный порошок (металлический песок), расход которого примерно в 10 раз меньше по сравнению с обычным кварцевым песком. Запыленность воздуха ниже допустимой по требованиям санитарных норм. Такие же преимущества имеет и дробеструйная очистка. Применяется гидропескоструйный способ очистки, осуществляемый эжектором, подающим струю воды с песком. Для предотвращения коррозии металлической поверхности в воду добавляют -1,6 % замедлителя коррозии (ингибитора). Возможна очистка пневматическими или электрическими инструментами.
· Коррозия каменных конструкций.
Коррозия — это разрушение материалов строительных конструкций под воздействием окружающей среды, сопровождающееся химическими, физико-химическими и электрохимическими процессами.
По механизму протекания различают физическую, химическую и биологическую коррозию. Вид коррозийных процессов зависит от местоположения конструктивного элемента и характера среды. Так, подземные конструкции могут подвергаться всем видам коррозии: надземные – преимущественно физической, реже – химической коррозии.
Химическая коррозия сопровождается необратимыми изменениями материала конструкций в результате взаимодействия с агрессивной средой.
Электрохимическая коррозия возникает в металлических конструкциях в условиях неблагоприятных контактов с атмосферной средой, водой, влажными грунтами, агрессивными газами.
Наибольшее влияние на износ конструкций оказывает водная среда. Поскольку большинство конструкций зданий (фундаменты, стены, перегородки, перекрытия и элементы крыш) выполнены из искусственных материалов с пористо-капиллярной структурой, при контакте с водой они интенсивно увлажняются.
В зависимости от вида связи с материалом различают химически связанную, адсорбционно-связанную, капиллярную и свободную влагу. Последняя заполняет крупные пустоты и поры материала и удерживается в них гидростатическими силами. Такая влага легко удаляется из материала конструкции при высушивании.
Влияние влаги на процесс разрушения конструкций неодинаковое. В одних случаях она как поверхностно-активное вещество ускоряет разрушение, в других, являясь хорошим растворителем, действует в качестве химически активной агрессивной среды.
На начало разрушения каменных конструкций указывают появляющиеся на поверхности конструктивного элемента белые высолы. Они свидетельствуют о том, что в материале происходит растворение солей материала и их вынос наружу в направлении миграции растворов более низких температур. Во многих случаях при отсутствии постоянного увлажнения карбонатная корка СаСО3 выполняет функцию защиты каменных конструкций. Опасны для каменных и бетонных конструкций воды, содержащие химически активные вещества.
Коррозия конструкций из силикатных материалов.
Разрушение пористых силикатных конструкций при наличии сообщающихся пор происходит не только на поверхности, но и в толще материала. В замкнутых, не сообщающихся друг с другом порах (например, в красном кирпиче мокрого прессования) разрушительное влияние агрессивных сред проявляется в более ограниченном масштабе, чем в открытых порах. Силикатные конструкции устойчивы к щелочным агрессивным средам. Благодаря наличию в воздухе и грунтовой воде веществ (оксидов, газов), образующих растворы кислот, во влажной среде силикатные изделия быстро разрушаются.
Разрушение кирпичных стен может происходить при периодическом увлажнении и высыхании, поэтому конструкции из кирпича наиболее интенсивно подвергаются химической и физической коррозии в систематически увлажняемых местах (фундаменты, стены подвалов, стены и кирпичные перегородки влажных помещений, карнизы, сандрики и другие элементы зданий, не защищенные от попадания влаги из атмосферных осадков).
Защита бетонных и железобетонных конструкций от коррозии должна предусматриваться, начиная со стадии проектирования сооружений и конструкций. Создавая проект сооружения, необходимо разработать мероприятия, которые обеспечат требуемую долговечность строительным конструкциям, т. е. необходимо осуществить проектирование защиты конструкций от коррозии. Проектирование защиты бетонных и железобетонных конструкций от коррозии следует начинать .с определения вида агрессивной среды, степени ее агрессивности и длительности воздействия, а затем на основании анализа установить вид защиты, произвести выбор материалов для ее осуществления, выработать конструктивные решения по защите и подобрать требуемые способы ее осуществления.
Различают два вида защиты бетонных и железобетонных конструкций от коррозии: первичная и вторичная.
Первичная защита от коррозии заключается в придании способности бетону и железобетону сопротивляться воздействию агрессивных сред посредством обеспечения оптимального их состава и структуры при изготовлении конструкций.
Вторичная защита от коррозии заключается в создании условий, ограничивающих или исключающих воздействие агрессивных сред на бетонные или железобетонные конструкции после их изготовления.
Первичную защиту следует проектировать путем выбора стойких составляющих бетона и железобетона, необходимых технологических параметров приготовления, уплотнения и твердения бетона, геометрической конфигурации конструкции, препятствующей образованию или уменьшению скопления агрессивных веществ на их поверхности, толщины защитного слоя бетона, обеспечения трещиностойкости конструкции и допустимого раскрытия трещин при эксплуатационных нагрузках. Первичная защита включает также нанесение защитного металлического, пленочного или лакокрасочного покрытия на поверхность арматуры. Металлические покрытия для защиты стальной арматуры, стальных закладных деталей и соединительных элементов железобетонных конструкций должны образовывать слой толщиной от 0,05 до 0,2 мм. В качестве материалов для покрытий следует применять алюминий или цинк. Защитные свойства металлических покрытий могут быть усилены посредством последующего нанесения на них лакокрасочных покрытий или полимерных материалов.
Вторичную защиту от коррозии следует проектировать в зависимости от требуемой химической стойкости, проницаемости, адгезии с защищаемой поверхностью, трещиностоикости и прочности путем выбора вида покрытий для защиты, материалов для защитной обработки или пропитки бетона, способов ее выполнения. Вторичную защиту от коррозии осуществляют путем пропитки бетона или нанесения лакокрасочного, пленочного, облицовочного или футеровочного защитного покрытия на поверхность бетонной или железобетонной конструкции с целью уплотнения поверхностного слоя бетона толщиной от 3 до 30 мм.
Коррозия металлических конструкций и способы борьбы с ней
Один из наиболее существенных недостатков металлических конструкций — коррозия. Ежегодно потерн металла от коррозии составляют около четверти всего произведенного в мире железа.
Коррозия (от латинского corrodere — разъедать) стали является процессом химического или электрохимического разрушения ее. Разрушающей средой может быть кислород воздуха, разные газы и особенно водные растворы — электролиты, находящиеся на стали часто в виде тончайшей водяной пленки.
Таким образом, коррозией называют процесс электрохимического или химического разрушения металла при взаимодействии его с агрессивной средой (например следы ржавчины на поверхности стальных и чугунных изделий).
Коррозия вызывает серьезные экологические и экономические последствия, так как затраты, связанные с ремонтом или заменой приборов и коммуникаций, водопроводных труб, во много раз превышают стоимость металла, из которого они изготовлены, а ее продукты вызывают загрязнение окружающей среды, негативно отражаются на здоровье и жизни людей.
Различают виды коррозии: атмосферную, подземную, контактную, электрохимическую, биологическую (в результате жизнедеятельности микроорганизмов), химическую (при высоких температурах в газах), коррозию блуждающими токами, коррозию в жидкостях, газовую коррозию, радиационную коррозию, коррозионную кавитацию, фреттинг-коррозию, межкристаллитную, коррозия-щелевую.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохимическую коррозию металлов.
Электрохимическая коррозия происходит под действием электролита, причем ионы металла переходят в раствор. В растворе гидраты закиси и окиси железа образуют собственно ржавчину, оседающую на поверхности стали.
Процесс химической коррозии происходит под действием сухих газов или в жидкостях, не проводящих электрического тока. Нередко оба указанных процесса развиваются совместно.
По виду коррозионной среды и условиям протекания различают несколько видов коррозии:
- газовая коррозия — это химическая коррозия металлов в газовой среде при минимальном содержании влаги или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто (например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т. д.);
- контактная коррозия вызвана контактом металлов, имеющих разные стационарные потенциалы в данном электролите;
- коррозия внешним током возникает под воздействием тока от внешнего источника и коррозия блуждающим током под воздействием блуждающего тока;
- радиационная коррозия — это коррозия, обусловленная действием радиоактивного излучения;
- коррозия под напряжением — коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Самый опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки.- Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов;
- коррозионная кавитация — разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды;
- фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т. д.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает одинаковой скоростью по всей поверхности металла, и неравномерной, когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв — разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек, глубоко проникающих в металл.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т. д.
Ржавчина вследствие высокой пористости не образует защитной пленки; наоборот, адсорбируя влагу, она интенсифицирует процесс коррозии. При высоких температурах коррозия протекает быстрее.
Металлические конструкции в большей степени подвержены атмосферной коррозии, потери от которой составляют около 50% всех коррозионных потерь и которая поражает около 70% используемого металла.
Агрессивность атмосферы зависит от ее влажности и загрязненности. Агрессивность среды увеличивается при усилении загрязненности воздуха; например, сернистый газ, растворясь в воде, превращается в серную кислоту, окислы азота образуют азотную и азотистую кислоты и т. д.
Стали, неоднородные по химическому составу и по структуре, подвержены ускоренному процессу коррозии: например, то- масовская и бессемеровская стали более подвержены коррозии, чем мартеновские, а стали кипящие разрушаются быстрее, чем спокойные.
Стойкость сталей в отношении коррозии неодинакова. Например, малоуглеродистые и низколегированные стали необходимо защищать от коррозии. Имеется группа сталей, которые можно использовать без защиты от коррозии. Такие стали называются атмосферостойкими. К ним относятся слаболегированные стали, содержащие медь, никель, хром, фосфор и др. При взаимодействии с атмосферой на поверхности этих сталей образуется естественный защитный слой из продуктов коррозии, препятствующий дальнейшему корродированию.
Алюминиевые сплавы к коррозии в большинстве случаев более устойчивы, так как на открытом воздухе поверхность алюминия и его сплавов покрывается тонкой плотной пленкой окислов, хорошо защищающей металл. При тяжелых условиях эксплуатации алюминиевых сплавов в агрессивных средах требуется дополнительная защита с помощью различных покрытий. Детали из алюминиевых сплавов, соприкасающиеся с бетоном или сталью, должны быть изолированы с помощью специальных прокладок из пластмассы или других материалов или защитных покрытий во избежание образования контактной коррозии.
Потери от коррозии во много раз превышают потери от разрушения стальных конструкций по многим причинам: от недостаточной прочности, устойчивости, выносливости и т. п. Поэтому принимать меры по защите металлических конструкций от коррозии столь же необходимо, как и обеспечивать их прочность и устойчивость. Это особенно относится к стальным конструкциям гидромелиоративного назначения, часть которых постоянно находится в воде, часть — на воздухе, а часть — попеременно то в воде, то на воздухе, т. е. в условиях, наиболее трудных для защиты от коррозии. Меры по борьбе с коррозией нужно предусматривать в процессе проектирования, затем в процессе изготовления и во все время эксплуатации конструкций.
Меры борьбы с коррозией можно разбить на три основных группы: конструктивные, эксплуатационные и специальные защитные.
Конструктивные: правильный выбор марки стали с учетом . реальных условий эксплуатации и опасности коррозии; применение сталей успокоенных плавок; правильный выбор материалов для креплений и деталей, если их изготовляют из других металлов.
В случае повышенной опасности коррозии применяют сплошные конструкции или сквозные, составленные из малого числа крупных сплошных элементов, которые легче осмотреть, проще очистить и окрасить с использованием механизмов.
В конструкциях, подверженных атмосферным осадкам, следует отдавать предпочтение таким сечениям элементов и конструкциям узлов, которые устраняли бы возможность затекания и застоя воды и длительного накопления снега.
В конструкциях, периодически находящихся в воде (а также подверженных переплескиванию волн), следует предусмотреть быстрый сток воды и по возможности уход с этой водой большей части наносов. В горизонтально расположенных корытообразных элементах необходимо устраивать специальные отверстия для стока воды. Все выступающие вверх ребра в таких элементах затрудняют сток воды и очистку от грязи и наносов.
Эксплуатационные: создание и соблюдение такого режима, который уменьшал бы отложение пыли и производственных выделений на элементах конструкций; интенсивное проветривание пространства у конструкций для уменьшения концентрации вредных газов, а также для снижения темперагуры воздуха и конструкций.
Проветривание должно создавать в зоне расположения конструкций осушающий режим, препятствующий конденсации и адсорбции влаги на частях конструкции и способствующий быстрому удалению влаги.
Следует периодически осматривать конструкции для выявления мест повреждения защитных покрытий и мест развития коррозии; очищать и заделывать такие места; периодически полностью возобновлять защитные покрытия конструкций.
Специальные защитные мероприятия. Вода является наиболее распространенной и дешевой технологической жидкостью, применяемой в промышленности. Основными проблемами, связанными с использованием воды в оборудовании, являются ее высокая коррозионная активность и склонность к образованию отложений. При этом снижается эффективность технологических процессов и ускоряется износ оборудования и конструкций. Существенные экономические потери несут предприятия из-за коррозии проката и готовых изделий при их хранении и транспортировке. Вдвойне осложняется борьба с коррозией в отопительных системах промышленных зданий из-за отложения солей жесткости и продуктов коррозии на внутренних стенках труб систем отопления и охлаждения. Солевые отложения и коррозия со временем разрушают трубы, значительно сужая проходное сечение трубопроводов.
Мерой, дающей полную гарантию от коррозии, является введение в состав стали во время плавки легирующих добавок, делающих сталь нержавеющей.
Введение никеля, хрома, меди и других добавок в десятых долях процента от веса стали делает эту сталь значительно более устойчивой против коррозии, чем углеродистые стали обыкновенного качества, и экономически может быть оправдано. При этом необходимо учитывать, что сталь, обладающая достаточной сопротивляемостью коррозии в атмосферных условиях, может оказаться подверженной ей в воде, и наоборот.
Для защиты металлических конструкций от коррозии используют различные типы искусственных покрытий. Они бывают лакокрасочными (из различных материалов) и металлоизоляционными. Для нанесения металлоизоляционных покрытий применяют плакирование (покрытие при горячей прокатке слоем чистого алюминия толщиной около 2% толщины листа), анодирование (покрытие в серной или хромовой кислоте под воздействием постоянного тока), гальванизацию (покрытие слоем цинка или никеля с последующим нанесением слоев меди, кадмия, хрома и др.) и обрызгивание (используют и после монтажа).
Все больше распространяются пластмассовые покрытия из полиэтилена, полиизобутилена, фторопласта, нейлона, поливинилхлорида и др., обладающие высокой водо-, кислото- и щелоче- стойкостью. Многие пластмассы используют как футеровочный материал для химических аппаратов и гальванических ванн (винипласт, фаолит и др.). Эффективно защищают от действия кислот и др. реагентов покрытия на основе каучука (гуммирование). Подземные сооружения, например трубопроводы, защищают от коррозии битумами и асфальтами, а также полимерными лентами и эмалями; от влаги — с помощью дренажа, который отводит ее от конструкции.
Протекторная защита достигается добавлением в материал покрытия порошков более стойких к коррозии металлов, чем защищаемый. Для железа это цинк, магний, алюминий. Под действием агрессивной среды происходит растворение порошка-добавки, а защищаемый металл консервируется и не корродирует.
Широко применяются сегодня ингибиторы коррозии и наки- пеобразования для воды. Ингибиторы коррозии — это вещества, замедляющие коррозию металлов (от лат. «ингибео» — останавливаю, сдерживаю). Ингибиторы кислотной коррозии были известны еще в средневековье. Ингибиторами коррозии могут быть и композиции химических соединений. Содержание ингибиторов в коррозионной среде должно быть небольшим.
Ингибиторы коррозии подразделяются: по механизму своего действия — на катодные, анодные и смешанные; по химической природе — на неорганические, органические и летучие; по сфере своего влияния — в кислой, щелочной и нейтральной среде.
Действие ингибиторов коррозии обусловлено изменением состояния поверхности металла вследствие адсорбции ингибитора или образования с катионами металла труднорастворимых соединений. Защитные слои, создаваемые ингибиторами коррозии, всегда тоньше наносимых покрытий. Ингибиторы коррозии могут действовать двумя путями: уменьшать площадь активной поверхности или изменять энергию активации коррозионного процесса.
Читайте также:
