Влияние внешних и внутренних факторов на химическую коррозию металлов
Обновлено: 01.06.2024
Важнейшими конструкционными материалами являются металлы и их сплавы. В процессе хранения и эксплуатации металлических конструкций происходит их взаимодействие с окружающей и рабочей средами, в результате чего они подвергаются коррозии.
Коррозией металлов называют самопроизвольное разрушение металлических конструкций вследствие их химического или электрохимического взаимодействия с коррозионной средой. Коррозионной может быть как окружающая среда, так и рабочая, в которой находится металл.
Коррозионный процесс протекает на границе двух фаз: металл – коррозионная среда, т.е. является гетерогенным процессом. Коррозия металлов наносит огромный ущерб практически любой отрасли промышленности.
Потери от коррозии можно разделить на две группы: прямые и косвенные.
Прямые потери складываются в основном из потерь непосредственно самого металла вследствие коррозии. Косвенные потери огромны и обусловлены расходами, связанными с отказом в работе оборудования, его простоем, стоимостью ремонта и замены деталей оборудования и т.п.
В разделе «коррозия металлов» изучаются две связанные между собой проблемы:
1) механизмы взаимодействия металлов с окружающей средой и общих закономерностей процессов коррозии;
2) методы защиты металлов от коррозионного разрушения.
1. Общая характеристика и классификация
коррозионных процессов
Металлы, являясь восстановителями, легко отдают валентные электроны, образуя положительно заряженные ионы. Восстановительные свойства металлов различны и определяются их стандартными электродными потенциалами. В табл. 1 приведены стандартные электродные потенциалы металлов и их классификация по активности.
Ряд стандартных электродных потенциалов металлов (В)
и классификация металлов по активности
| Активные | Средней активности | Неактивные | |||
| Li + /Li | -3,04 | Mn 2+ /Mn | -1,18 | Cu 2+ /Cu | +0,34 |
| K + /K | -2,92 | Zn 2+ /Zn | -0,76 | Ag+/Ag | +0,80 |
| Ca 2+ /Ca | -2,87 | Cr 3+ /Cr | -0,74 | Pt 2+ /Pt | +1,20 |
| Na + / Na | -2,71 | Fe 2+ /Fe | -0,44 | Au 3+ /Au | +1,50 |
| Mg 2+ /Mg | -2,38 | Ni 2+ /Ni | -0,25 | ||
| Al 3+ /Al | -1,66 | Sn 2+ /Sn | -0,14 | ||
| Pb 2+ /Pb | -0,13 | ||||
| H + / 1/2H2 | 0,00 |
По своей химической активности и положению в ряду стандартных потенциалов металлы делятся на три группы:
1) активные – от Li до Al включительно – вытесняют водород из воды и растворов кислот;
2) средней активности – от Mn до Pb включительно – вытесняют водород из растворов кислот;
3) неактивные – стоящие в ряду после водорода – не вытесняют водород из растворов кислот.
Основной причиной, вызывающей коррозионное разрушение металлов и сплавов, является протекание на их поверхности электрохимических или химических реакций.
В зависимости от механизма протекания все коррозионные процессы делят на два вида – химические и электрохимические.
Химической коррозией называют процессы, протекающие при непосредственном химическом взаимодействии между металлом и коррозионной средой и не сопровождающиеся возникновением электрического тока.
Электрохимической коррозией называют процессы взаимодействия металлов с водными растворами электролитов, сопровождаю-
щиеся возникновением в системе электрического тока в результате пространственного разделения процессов окисления и восстанов-
ления.
При химической коррозии ее продукты образуются непосредственно на участках поверхности, где происходит разрушение металла. Однако следует учитывать, что такое деление коррозионных процессов несколько условно, так как механизм коррозии может изменяться. Например, электрохимическая коррозия железа в парах воды при повышении температуры переходит в химическую, а в жидкости, являющейся неэлектролитом, химическая коррозия в присутствии влаги переходит в электрохимическую.
По условиям протекания коррозии различают несколько видов коррозии [1]:
1) газовую – коррозию в газах при высоких температурах;
2) атмосферную – коррозию в атмосфере воздуха или влажного газа;
3) жидкостную – коррозию в жидкой среде (в растворах неэлектролитов и электролитов);
4) подземную – коррозию в почвах и грунтах;
5) биокоррозию – коррозию под влиянием жизнедеятельности микроорганизмов;
6) структурную – коррозию, связанную со структурной неоднородностью металла;
7) коррозию блуждающими токами;
8) контактную – электрохимическую коррозию, вызванную контактом металлов, имеющих разные электродные потенциалы в данном электролите;
9) щелевую – коррозию в щелях и зазорах между металлами;
10) коррозию под напряжением – коррозию при одновременном воздействии коррозионной среды и механических напряжений;
11) коррозионную кавитацию – разрушение металла, вызванное одновременным коррозионным и ударным воздействием внешней среды.
По характеру коррозионных разрушений различают следующие виды коррозии:
1) сплошную,или общую, коррозию, охватывающую всю поверхность металла, находящуюся под воздействием коррозионной среды. Она бывает равномерной, неравномерной, избирательной;
2) местную, охватывающую отдельные участки металла. Она бывает точечной (питтинг), сквозной, язвенной и др.
Химическая коррозия
Как отмечалось выше, химической коррозией называется процесс разрушения металлов и сплавов вследствие взаимодействия их с внешней средой, который не сопровождается возникновением электрических токов. По условиям протекания процесса различаются следующие виды химической коррозии:
1) газовая коррозия – коррозия металлов, вызываемая действием паров и газов при высоких температурах при условии, что на поверхности металла не конденсируется пленка жидкости, проводящая электрический ток;
2) жидкостная коррозия – коррозия металлов в жидкостях, не проводящих электрический ток.
Газовая коррозия
Газовая коррозия наиболее часто встречается в процессе эксплуатации металлов. Газовой коррозии подвергаются металлические изделия, детали и аппараты, работающие при повышенных температурах в условиях воздействия агрессивных газов. Это процессы окисления арматуры печей, деталей двигателей внутреннего сгорания, металлов при горячей прокатке, отжиге, закалке и др. Наиболее агрессивными по отношению к большинству металлов являются газы, содержащие серу (H2S, SO2), а также галогены и их соединения (Cl2, F2, I2, Br2, HCl, HF). Кислород также считают агрессивным газом, поскольку известно, что многие металлы при соприкосновении с воздухом образуют на поверхности оксидные соединения, являющиеся продуктами коррозии. Поскольку именно оксиды металлов чаще всего и являются продуктами газовой коррозии, рассмотрим этот вид коррозии на их примере.
Виды оксидных пленок и законы их роста. Даже при комнатной температуре на поверхности многих металлов на воздухе образуется тончайший слой оксидов. Образовавшаяся оксидная пленка может защищать металл от дальнейшего окисления. Чтобы пленка имела защитные свойства, она должна быть сплошной, хорошо сцепленной с основным металлом и иметь близкий к нему коэффициент теплового расширения, а также не должна разрушаться в агрессивной среде.
Толщина пленок, образующихся при взаимодействии металлов с сухим воздухом или другими окислителями, зависит от природы металла, характера среды, температуры и других факторов. По толщине пленки можно разделить на следующие три группы:
1) тонкие, невидимые (толщина менее 40 нм);
2) средней толщины, дающие цвета побежалости (толщина 40…500 нм);
3) толстые, видимые (толщина более 500 нм).
Основным условием предотвращения дальнейшего окисления металла, покрытого оксидной пленкой, является ее беспористость и сплошность. Возможность образования сплошной пленки определяется соотношением объемов образованного оксида и окисленного металла. Условие сплошности пленок было сформулировано Пиллингом и Бэдвордсом и заключается в следующем: если объем химического соединения (например, оксида Vок) меньше, чем объем металла (VМе), образующего это соединение, можно ожидать получения несплошной, пористой пленки, обладающей слабыми защитными свойствами.
При обратном соотношении Vок и VМе можно ожидать образования сплошных пленок, способных защищать металл от коррозии. То есть, если Vок / VМе < 1, пленка не будет сплошной, а если
Vок / VМе > 1, она может быть сплошной.
Величину Vок / VМе > 1 имеют многие металлы: Al, Sn,Ti, Zn, Ni, Cr, Fe и др. Их оксидные пленки тормозят дальнейшее окисление металла. Однако в ряде случаев могут быть отклонения от этой закономерности. Например, в реальных условиях в пленке в процессе ее роста могут возникать разрушающие ее напряжения. Могут также иметь место недостаточная пластичность пленки, летучесть оксидов и т.д.
В зависимости от природы металла рост пленок подчиняется различным закономерностям (рис. 1).
y = Kt,
где y – толщина пленок; t – время окисления; К – постоянная.
Рис. 1. Графики, иллюстрирующие законы окисления металлов
Если пленка обладает защитными свойствами, то по мере ее роста скорость окисления уменьшается. Чем более высокими защитными свойствами обладает пленка, тем меньше скорость диффузии окислителя через нее и меньше скорость ее роста. Возможна параболическая зависимость:
y 2 = Kt.
В некоторых случаях рост пленок идет с сильным затуханием по логарифмической зависимости:
y = ln(Kt).
Пленки, растущие по этому закону, обладают лучшими защитными свойствами, например для меди, никеля и железа в соответствующем интервале температур.
Влияние различных факторов на скорость газовой коррозии. Скорость и характер процесса химической коррозии зависят от многих факторов. Внешними называют факторы, связанные с составом коррозионной среды и условиями коррозии (температура, давление, скорость движения среды и др.), внутренними – факторы, связанные с составом и структурой металла, внутренними напряжениями в металле, характером обработки поверхности и др.
Температура значительно влияет на скорость коррозии: с ее повышением процессы окисления металлов протекают значительно быстрее. С изменением температуры может изменяться даже состав оксидных пленок. Колебания температур, особенно переменные нагрев и охлаждение, увеличивают скорость окисления металлов, так как в оксидной пленке образуются трещины и она может отслаиваться от металла (например, для железа и сталей).
Состав газовой среды очень сильно влияет на скорость окисления наиболее важных конструкционных материалов – железа и стали. Особенно сильно влияние кислорода, соединений серы и водяных паров. Насыщение воздуха парами воды увеличивает скорость коррозии стали в два-три раза. При увеличении скорости движения газовой среды скорость окисления металлов сначала быстро возрастает и в дальнейшем практически не изменяется.
Защитные свойства образующейся пленки продуктов коррозии и, следовательно, коррозионная стойкость металлов находятся в зависимости от ее состава. Что касается сплавов на основе железа, то можно отметить следующие закономерности.
Сера, фосфор, никель и марганец не влияют на окисление железа. Титан, медь, кобальт и бериллий заметно замедляют окисление железа, что связано с повышением защитных свойств образующейся окалины. Хром, алюминий и кремний сильно замедляют окисление железа из-за образования высокозащитных оксидных пленок. Поэтому эти элементы широко применяют для легирования стали. Характер обработки поверхности металла также влияет на скорость газовой коррозии. Чем тщательнее обработана поверхность стали, тем меньше скорость ее окисления. Это обусловлено в основном худшей сохранностью защитных пленок на неровных поверхностях.
Существуют также и особые случаи газовой коррозии металлов, когда агрессивными газами являются не кислород, а оксиды азота, сернистые соединения, хлор, хлористый водород, а также водород и гелий [2].
Для многих металлов характерна карбонильная коррозия за счет их взаимодействия в особых условиях с оксидом углерода (II) с образованием легко возгоняющихся веществ – карбонилов:
Me + nCO = Me(CO)n.
Жидкостная коррозия
Химическая коррозия наблюдается не только в сухих газах, но и в некоторых жидких средах, например в неэлектролитах и жидких металлах. К неэлектролитам, т.е. к жидкостям, не проводящим электрический ток, относятся, например, жидкий бром, расплавленная сера, а также многие органические вещества, в частности органические растворители (бензол, четыреххлористый углерод, хлороформ и др.), жидкое топливо (нефть, керосин, бензин и др.), смазочные масла.
Суммарный процесс химической коррозии в неэлектролитах можно разделить на ряд стадий, каждая из которых определяет скорость процесса:
1) диффузия реагента (окислителя) к поверхности металла;
2) адсорбция реагирующих частиц на металле;
3) химическая реакция реагента с металлом;
4) десорбция продуктов реакции с поверхности металла;
5) диффузия продуктов реакции от металла в объем неэлектролитов.
Электрохимическая коррозия
Как уже отмечалось, электрохимическая коррозия металлов представляет собой самопроизвольное разрушение металлов вследствие их электрохимического взаимодействия с коррозионной средой, проводящей электрический ток, т.е. с электролитом.
Этот тип коррозии более широко распространен, чем химическая коррозия. Он имеет место при взаимодействии металлов с жидкими электролитами (водой, водными растворами солей, кислот и щелочей и т.д.). Примерами такого вида коррозии являются ржавление различных металлических изделий и конструкций в атмосфере (оборудование заводов, стальных мостов, каркасов зданий, транспортных средств и др.), ржавление стальных трубопроводов в земле, коррозия обшивки судов в речной и морской воде, разрушение баков и аппаратов растворами солей, кислот и щелочей на химических и других заводах и т.п.
Электрохимическая коррозия
Влияние внешних и внутренних факторов на химическую коррозию металлов
Скорость и характер процесса химической коррозии металлов зависят от многих факторов.
Внешними называют факторы, связанные с составом коррозионной среды и условиями коррозии (температура, давление, скорость движения среды и др.). Внутренними называют факторы, связанные с составом и структурой сплава, внутренними напряжениями в металле, характером обработки поверхности и др.
Температура
Температура очень сильно влияет на скорость процессов химической коррозии металлов. С повышением температуры процессы окисления металлов протекают значительно быстрее, несмотря на уменьшение их термодинамической возможности. Характер влияния температуры на скорость окисления металлов определяется температурной зависимостью константы скорости химической реакции kc (при кинетическом контроле процесса окисления металлов) или коэффициента диффузии kД (при диффузионном контроле процесса), которая выражается одним и тем же экспоненциальным законом (уравнение Аррениуса), связывающим температуру с относительной долей частиц, обладающих энергией выше некоторого порогового значения.
С повышением температуры скорость окисления железа и стали очень сильно возрастает по закону, близкому к экспоненциальному.
Колебания температуры, особенно попеременные нагрев и охлаждение, увеличивают скорость окисления металлов, например железа и стали, так как в защитной окисной пленке вследствие возникновения в ней термических напряжений образуются трещины и она может отслаиваться от металла.
Состав газовой среды
Влияние состава газовой среды на скорость коррозии металлов велико, специфично для разных металлов и изменяется с температурой.
Состав газовой среды оказывает большое влияние на скорость окисления железа и стали. Особенно сильно влияют кислород, соединения серы и водяные пары.
Насыщение воздуха парами воды увеличивает скорость коррозии стали в два-три раза. При наличии в газовой среде соединений серы железо и сталь часто подвергаются межкристаллитной коррозии, особенно при температурах выше 1000 ˚С.
Если газовой средой являются продукты горения топлива, то газовая коррозия углеродистых и низколегированных сталей тем сильнее, чем выше коэффициент расхода воздуха, с которым сжигается топливо. Присутствие в газовой среде SO2 значительно увеличивает коррозию углеродистых сталей.
Значительное влияние на коррозию сталей и сплавов оказывают продукты горения топлива, содержащие ванадий. При сжигании дешевого загрязненного ванадием жидкого топлива (мазута, погонов нефти) образуется большое количество золы, содержащей V2O5. Зола, налипая на металл, увеличивает скорость его окисления (в несколько раз или даже в десятки раз) и вызывает межкристаллитную коррозию при температуре выше температуры плавления золы.
Таким образом, V2O5, участвуя в процессе окисления металлов, на образование их окислов почти не расходуется. Взаимодействуя с различными окислами железа, никеля и хрома, V2O5 разрушает защитную пленку, образуя в ней поры, по которым относительно легко проникают кислород газовой фазы и жидкая V2O5, окисляющие металл.
Повышение содержания в газовой среде окиси углерода CO сильно понижает скорость коррозии углеродистых и низколегированных сталей, однако при большом количестве CO в газовой фазе может произойти науглероживание поверхности стали.
Различия в скорости коррозии металлов в разных газовых средах в значительной степени определяются защитными свойствами образующихся на металлах пленок продуктов коррозии.
Режим нагрева
Как указывалось выше, колебания температуры при нагреве или эксплуатации металлов при высоких температурах, особенно переменные нагрев и охлаждение, увеличивают скорость окисления металлов, например железа и сталей, так как в защитной окисной пленке вследствие возникновения в ней термических напряжений образуются трещины и она может отслаиваться от металла, т. е. нарушается сохранность защитной пленки в связи с низкой ее термостойкостью. В ряде случаев термостойкость может быть повышена за счет внутреннего окисления сплава, способствующего врастанию образующейся окалины в металл.
Состав сплава
Защитные свойства образующейся пленки продуктов коррозии и, следовательно, коррозионная стойкость сплава находятся в зависимости от его состава.
Применительно к наиболее важному и распространенному металлическому конструкционному материалу – сплавам на железной основе и наиболее распространенному процессу химической коррозии металлов – газовой коррозии – можно отметить следующее.
При высоких температурах (800 ˚С и выше) с увеличением содержания углерода в стали скорость ее окисления, а также видимое и истинное обезуглероживание уменьшаются вследствие более интенсивного образования окиси углерода, что приводит к торможению окисления железа, самоторможению окисления углерода и усилению образования в окалине газовых пузырей.
Сера, фосфор, никель и марганец не влияют на окисление железа.
Титан, медь, кобальт и берилий заметно замедляют окисление железа, что связано с повышением защитных свойств образующейся окалины.
Хром, алюминий и кремний сильно замедляют окисление железа из-за образования высокозащитных окисных пленок.
Изучение влияния внешних и внутренних факторов на химическую коррозию металлов Текст научной статьи по специальности «Химические технологии»
Аннотация научной статьи по химическим технологиям, автор научной работы — Умарова Назира Гафуровна
В этой статьи изучены влияние внешних и внутренних факторов на химическую коррозию металлов нефтегазовых оборудований.
Похожие темы научных работ по химическим технологиям , автор научной работы — Умарова Назира Гафуровна
Текст научной работы на тему «Изучение влияния внешних и внутренних факторов на химическую коррозию металлов»
Изучение влияния внешних и внутренних факторов на химическую коррозию металлов Умарова Н. Г.
Умарова Назира Гафуровна / Ытагоуа Nazira Оа/ыгота - преподаватель, кафедра технологии нефтехимической промышленности, факультет химической технологии, Бухарский инженерно-технологический институт, г. Бухара, Республика Узбекистан
Аннотация: в этой статьи изучены влияние внешних и внутренних факторов на
химическую коррозию металлов нефтегазовых оборудований.
Ключевые слова: коррозия, окисления, защитная пленка, энергия активации.
Скорость и характер процесса химической коррозии металлов зависит от ряда факторов - внешних и внутренних.
Внешними называют факторы, связанные с составом коррозионной среды и условиями коррозии (температура, давление, скорость перемещения коррозионной среды и т.д.).
Внутренними называют факторы, связанные с составом, структурой, внутренними напряжениями в металле, качеством обработки поверхности металла и др.
Температура - это мощный внешний фактор. Характер влияния температуры на скорость окисления металла определяется зависимостью константы скорости реакции окисления (К) и коэффициента диффузии (Б) от температуры - К = /(т) и Д = / (Т) описываются одним и тем же уравнением (уравнение Аррениуса):
К = К0 ■ ехр (- Е /ВТ), (1) где К0 - константа; Е - энергия активации химической реакции.
Д = Д ■ ехр (- Е / ВТ), (2) где Б0 - константа; Е - энергия активации диффузии.
Таким образом, вне зависимости от типа контролирующей стадии процесса окисления, с повышением температуры скорость окисления резко возрастает.
Колебания температуры, особенно переменный нагрев и охлаждение, увеличивают скорость окисления металла, так как в защитной пленке образуются трещины. Влияние состава газовой фазы на скорость коррозии металла велико, специфично и изменяется с температурой. В частности, на скорость окисления железа и стали, особенно сильно влияют кислород, соединения серы, водяные пары [1].
Приведенные ниже данные свидетельствуют о зависимости относительной скорости коррозии стали с 0,17 % С от состава газовой фазы при 900 оС:
чистый воздух. 100%;
чистый воздух + 2%8О2--------------118%;
чистый воздух + 5%Н20-------------134%;
чистый воздух + 5%Б02 + 5%Н20--276%.
Значительное влияние на коррозию сталей и сплавов оказывают продукты горения топлива, содержащие ванадий (например, У205).
Это соединение находится в золе от сжигания дешевого топлива - мазута, нефтепродуктов. Зола, налипая на металл, увеличивает скорость его коррозии в десятки раз. Причина этому - «ванадиевая коррозия», обусловленная легкоплавкостью У205, и его способностью офлюсовывать (переводить в жидкое состояние) химические соединения золы и окалины, что снижает защитные свойства последней, а также участвовать в процессе окисления:
4¥е + 3У205 = 2Ее2О3 + 3У203, (3) У20з + 02 = У2О5, (4)
V2O5 + Ег203 = 2FeVO4. (5) Повышение содержания СО в газовой фазе понижет скорость коррозии углеродистых и низколегированных сталей, но при больших количествах СО в газовой фазе может произойти науглероживание поверхности стали. При этом возможны следующие химические реакции:
2СО + 02 = 2С02, (6) 2СО = Ссаж + СО2. (7) Если бы поверхность металла не была бы покрыта оксидной пленкой, то скорость окисления была бы пропорциональна парциальному давлению окислителя (для
двухатомных газов ~ * р ).
Но так как поверхность металла покрыта слоем оксида, то зависимость скорости окисления от величины парциального давления окисляющей газа может быть различной в зависимости от строения защитной пленки.
Окисление, как гетерогенный процесс, определяется скоростью подвода и отвода реагентов в зону реакции. Поэтому, чем больше скорость движения потока газа, тем больше и скорость окисления металла [2].
Влияние режима нагрева металла может быть рассмотрено в контексте влияния колебаний температуры. То есть переменные нагрев и охлаждение увеличивают скорость окисления ввиду нарушения сохранности защитной пленки.
1. Бондарь В. И. Коррозия и защита материалов / Учеб. пособие для студентов металлургических специальностей. - Мариуполь: ПГТУ, 2009. - 126с.
2. Люблинский Е. Я. Электрохимическая защита от коррозии. - М.: Металлургия, 1987. - 96 с.
Экологические и эксплуатационные свойства синтетических
1 2 Рахимов Б. Р. , Набиев А. А.
1Рахимов Бобомурод Рустамович /КаЫшоу Bobomurod Кт1атоу(сН - преподаватель, кафедра технологии нефтехимической промышленности, факультет химической технологии; 2Набиев Абдулазиз Абдуллоевич / 'ЫаЫуех Abdulaziz Abdulloyevich - преподаватель, Бухарский профессиональный колледж нефтегазовой промышленности, г. Бухара, Республика Узбекистан
Аннотация: в этой статье изучены некоторые экологическые и эксплуатационные свойства синтетического моторного топлива.
Ключевые слова: октановые числа, ароматические углеводороды, сернистые компоненты, оксигенат, риформат, алкилат, бензин.
Важной задачей, решение которой позволит снизить токсичность выхлопных газов бензиновых двигателей, является отказ от свинцовых антидетонаторов при обеспечении необходимого октанового числа товарного бензина с помощью углеводородного состава. В развитых странах мира применение бензинов, содержащих свинец, запрещено. В частности, в Японии использование свинцовых антидетонаторов запрещено с 1986 г., в США полностью прекращено потребление таких бензинов с начала 90-х годов. У нас до сих пор разрешается введение свинца в бензин А-76 в количестве 0,24 г/кг. В настоящее время около 23 % вырабатываемых бензинов содержат свинец.
Тема 2.1. Химическая коррозия металлов
Определение химической коррозии. Условия возможности протекания процесса. Основные стадии. Условие сплошности пленок. Законы роста пленок во времени в зависимости от их толщины и характера контроля процесса. Состав пленок. Изменение закона роста во времени.
Химическая коррозия металлов является самопроизвольным их разрушением вследствие химического взаимодействия с внешней средой. Характерными особенностями химической коррозии являются протекание процессов окисления металлов и восстановления окислителя в одном акте, отсутствие возникновения электрического тока и образование продуктов коррозии непосредственно в зоне реакции взаимодействия металла с внешней средой.
Химическая коррозия является гетерогенной реакцией взаимодействия жидкой или газовой фазы с металлами и делится на 2 вида:
- коррозия в жидких неэлектролитах.
В нефтеперерабатывающей промышленности газовой коррозии подвергаются трубы печей при воздействии продуктов горения топлива, реактор, реакционные колонны и другая аппаратура под воздействием водорода, сероводорода, окиси углерода, азота, кислорода и других газов при высоких температурах. Обычно термин «газовая коррозия» относят к разрушению металлов, вызываемому действием паров и газов при высоких температурах, хотя по существу его можно применять и к более низким температурам при условии, что на металле не конденсируется пленка жидкости, проводящая электрический ток.
Наибольшее значение в практических условиях имеет газовая коррозия при повышенных температурах на границе металла с газовой фазой. Продуктами газовой коррозии обычно являются оксиды металлов, однако в зависимости от условий эксплуатации могут образовываться и другие соединения, например сернистые металлы.
Термодинамика газовой коррозии
Термодинамическая возможность протекания реакции коррозионного процесса определяется по величине изменения свободной энергии системы при протекании коррозионной реакции. В практических условиях, например в процессе газовой коррозии металлов при различных температурах, подобное суждение наиболее просто и удобно может быть сделано на основании сопоставления упругости диссоциации получаемого продукта реакции окисления и парциального давления кислорода в газовой фазе.
Так, химическая реакция окисления
будет находиться в равновесии, если парциальное давление кислорода ( ) станут равны. При > = 0,21 ат ), металл перестает окисляться и становится вполне благородным по отношению к кислороду. Так, например, серебро при температуре 300К термодинамически еще не устойчиво, а при 400К и при всех более высоких температурах упругость диссоциации Ag2O превышает парциальное давление кислорода в воздухе. При температуре 2000К медь тоже становится неокисляемым металлом, однако для таких металлов, как Fе, Zn, Ni и др., даже при этих температурах упругость диссоциации окислов остается еще достаточно низкой и, следовательно, протекание реакции окисления вероятно.
Необходимо учесть, что температурная зависимость для кинетики процесса окисления совершенно иная, чем для термодинамической вероятности окисления. Поэтому нет никакого противоречия в том, что степень термодинамической вероятности окисления металла с повышением температуры падает, а реальная скорость окисления (при условии, что термодинамически этот процесс остается еще возможным) с повышением температуры возрастает.
Пленки на металлах
В большинстве случаев продукты газовой коррозии образуются и остаются на металле в виде пленки. Пленки продуктов коррозии определяют кинетику процесса и в случае наличия защитных свойств могут привести к замедлению коррозионного процесса. Чтобы пленка продуктов коррозии обладала защитными свойствами, она должна быть сплошной, не разрушаться в агрессивной среде, прочно сцепляться с основным металлом и обладать близким к нему коэффициентом теплового расширения. Если пленка пористая, рыхлая и характеризуется плохим сцеплением с основным металлом, то даже при условии инертности в данной агрессивной среде, она не будет обладать защитными свойствами.
Пленки по толщине делятся на три группы:
- тонкие (невидимые), δ < 4000 нм;
- средние (дающие цвета побежалости), δ = от 4000 до 50000 нм;
- толстые (видимые), δ > 50000 нм.
Толщина пленок, образовавшихся при взаимодействии металла с сухим воздухом, различна и зависит от рода металла, температуры и других факторов. Толщина пленок на меде и железе при комнатной температуре составляет 100 – 300 нм, а на алюминии 1000– 1500 нм. При повышении температуры толщина пленки увеличивается и дает цвета побежалости. Так, при нагреве железа до 400 0 C в течение 1 ч на нем образуется желтая пленка толщиной 4600 нм, через 2 ч – красная пленка толщиной 5800 нм, а через 3 ч – синяя пленка толщиной 7200 нм. Примером толстой видимой пленки является окалина на железе или пленка, полученная на алюминии анодированием, имеющая толщину 10 – 15мкм, а в некоторых случаях – до 200 – 500 мкм. Наличие тонких, невидимых пленок было доказано различными способами:
- если сломать стальной образец (иглу, лезвие) под ртутью, то произойдет амальгамирование поверхности; если излом произвести на воздухе, а затем погрузить образец в ртуть, то амальгамирования не произойдет. Это объясняется образованием тончайшей окисной пленки, препятствующей амальгамированию;
- если железную полированную пластину нагреть с одного конца, то вследствие неравномерности толщины пленки, на поверхности пластины появятся цвета побежалости (желтый, красный, пурпурный, фиолетовый, синий).
При нанесении на различные участки поверхности железа капли азотно-кислой меди, можно определить защитные свойства пленки. В местах, где пленка не обладает защитными свойствами, протекает реакция
и под каплей будет происходить выделение меди.
Наибольшими защитными свойствами пленка обладает не у нагретого конца, т.е. где пленка толще, а в преджелтой зоне, где пленка невидима;
Изоляция пленок от поверхности металла является самым наглядным доказательством их существования. Благодаря оптическим эффектам отражения света эти пленки, невидимые на поверхности металла, становятся видимыми. Если поместить металл в среду, которая хорошо растворяет металл, но не растворяет пленку, и нарушить целостность пленки, то металл растворяется, а пленка остается в изолированном виде.
Условия сплошности пленок
Защитными свойствами могут обладать только сплошные, т.е. покрывающие сплошным слоем всю поверхность металла, пленки. Условие сплошности определяется соотношением объемов образованного окисла и исходного металла.
Если объем продуктов коррозии Vок меньше, чем объем металла Vме, образующего это соединение, пленка будет пористой и обладает слабыми защитными свойствами. Наоборот, если объем продуктов коррозии больше, чем объем окислившегося металла, то можно ожидать образования сплошных пленок с повышенной способностью защищать от коррозии.
Соотношение объемов образованного оксида и исходного металла может быть легко подсчитано. Предположим, что окислится 1 грамм-атом металла. Его объем равен
где А – атомная масса металла;
d – плотность металла.
Объем полученного оксида будет равен
где М – молекулярная масса окcида;
D – плотность оксида;
n – число атомов металла в молекуле оксида.
Соотношение между объемом оксида и объемом металла
Щелочные и щелочноземельные металлы, указанное соотношение у которых меньше 1, образуют рыхлые пленки, со слабыми защитными свойствами и характеризуются высокими скоростями окисления. Металлы с соотношением не следует ожидать высоких защитных свойств пленки. Ориентировочно В табл. 2 приведены данные рассчитанного соотношения объемовЭти данные подтверждают условия сплошности пленок. Так, натрий, кальций, барий, магний при окислении не могут образовать сплошных пленок, так как у этих металлов .
Отношение объемов оксида и металла для некоторых металлов
| Металл | Оксид | |
| натрий кальций барий магний кадмий алюминий свинец цинк никель хром железо молибден вольфрам | Na2O CaO BaO MgO CdO Al2O3 PbO ZnO NiO Cr2O3 Fe2O3 MoO3 WO3 | 0,57 0,64 0,74 0,79 1,21 1,24 1,29 1,57 1,60 2,03 2,16 3,45 3,36 |
Механизм окисления металлов
Для большинства случаев окисления основным направлением диффузии является движение металла через пленку наружу и в меньшей степени - диффузия кислорода в обратном направлении.
Так как оксидные и солевые пленки на металлах имеют ионную кристаллическую структуру, обладающую, как правило, ионной и в некоторой степени электронной проводимостью, то можно ожидать диффузию через пленку не непосредственно атомов металла, а ионов металла и самостоятельно электронов. Можно также предполагать возможность диффузии ионов кислорода в противоположном направлении. Ионизация кислорода при этом происходит на внешней поверхности прошедшими через пленку электронами. Естественно, что допущение ионного характера диффузии не исключает возможности параллельного протекания и атомной диффузии.
Ион металла имеет меньший радиус, чем атом. Наоборот, анионы имеют больший радиус, чем атомы соответствующего металлоида. Следовательно, в общем случае можно предполагать, что от металла сквозь пленку двигаются ионы металла, а с поверхности пленки вглубь - атомы кислорода, ионизация которых происходит уже в самой пленке. Из-за большей подвижности при диффузии металлических ионов преимущественный рост пленки происходит вблизи ее внешней поверхности (рис.3).
Законы роста пленок
Исходя из современной теории роста пленок, образование и их дальнейший рост осуществляется взаимной двусторонней диффузией как окислительного реагента к поверхности металла, так и металла к внешней поверхности пленки.
Скорость роста защитной пленки находится в зависимости от диффузии и скорости химического превращения и определяется уравнением, предложенным Эвансом:
где y– толщина пленки;
τ – время ее образования;
Кd – константа диффузии при данных условиях;
Кс – константа скорости химической реакции образования пленки;
Со – концентрация действующей среды на внешней поверхности пленки.
При достаточно толстой пленке величина y 2 /Kd значительно больше чем 2y/Kc. Принебрегая последней, получаем зависимость роста толщины пленки от процесса диффузии:
Заменяя величины 2КdCo через k1, получаем уравнение параболы
В этом случае (при достаточно большой толщине пленки) скорость роста пленки контролируется диффузией.
На рис.4а приведено графическое изображение параболической зависимости для окисления железа на воздухе при различных температурах.
На рис. 4б показано преобразование парабол в прямые линии в логарифмических координатах, при котором
,
где Δm - увеличение массы, прямо пропорциональное толщине пленки у.
При малой толщине пленки влияние y 2 /Kd будет незначительным по сравнению с 2y/Kc и уравнение примет вид
Обозначая КсСоτ через k2, получаем линейное уравнение зависимости толщины пленки от времени
При малой толщине пленки рост ее контролируется только скоростью химического превращения, т.е. коррозионный процесс подчиняется кинетическому контролю.
При смешанном диффузно-кинетическом контроле окисления металлов нельзя пренебречь ни одним из членов уравнения Эванса. Тогда путем приведения к общему знаменателю и умножения левой и правой части уравнения на С0 получим:
Подставляя вместо КсСo=k2 и вместо 2КdCo=k1, получим
Эта зависимость может быть преобразована в прямую линию построением графика τ/ m), при этом k2 = ctgα; 1/k1 = τ при . График этой зависимости от окисления углеродистой стали на воздухе, насыщенном парами воды при 800 о С, приведен на рис. 5а, а на рис. 5б показано преобразование зависимости в прямую линию.
Рост оксидных пленок при диффузно-кинетическом контроле может быть также выражен степенным законом:
где n - показатель степенного закона; причем 1 < n < 2, kn = const. Этот закон пригоден для описания кривой на рис. а, что подтверждается спрямлением ее в логарифмических координатах lg , при котором
n = ctgα; τ = 0.
Рост оксидной пленки по законам 15 и 16 имеет место, если соизмеримы скорости химической реакции окисления и диффузионных процессов в оксидной пленке.
Для ряда металлов установлена логарифмическая зависимость между толщиной пленки и продолжительностью ее роста:
у = ln(kτ) (17)
Логарифмический закон роста пленки установлен, например, для алюминия и цинка в интервалах температур от 25 до 225 о С, железа – до 375 о С, меди – до 100 о С. При изображении логарифмической зависимости в полулогарифмических координатах у – lgτ получается линейная зависимость.
Кинетические кривые процесса окисления имеют большое практическое значение. Они позволяют без проведения длительных испытаний (полгода и более) оценить окалиностойкость металлов и сплавов путем сопоставления показателей и коэффициентов уравнений. Так, для нижеприведенных сталей было показано понижающее влияние добавки марганца на стойкость к высокотемпературному окислению:
Х18Н11С2ГА Х18Н11С2Г2А Х18Н11С2Г3А
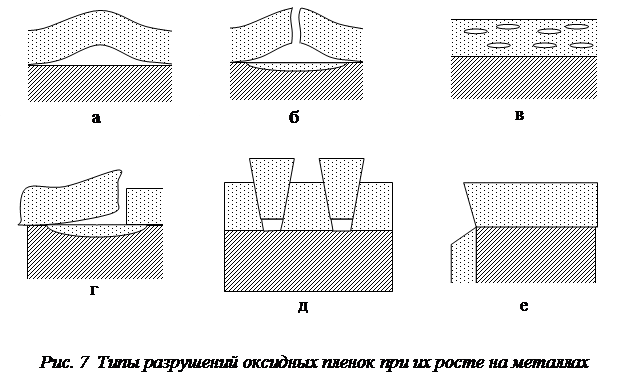 |
Так, внутренние сжимающие напряжения (рис.6,а), появляющиеся при росте толщины пленки, приводят к ее отслаиванию, если прочность пленки на разрыв велика, а ее адгезия к поверхности металла недостаточна (рис. 7,а). Внутренние напряжения сжатия на неровной поверхности (рис. 6,б) способствуют образованию отрывающего усилия. При недостаточной прочности пленки появляются пузыри с разрывом (рис. 7,б). В оксидной пленке возможно возникновение микропузырей (рис. 7,в), которые препятствуют диффузии ионов металла и могут привести к торможению процесса окисления. Разрушение пленок отслаиванием (рис. 7,г) преимущественно происходит на неровностях поверхности, а растрескивание при сдвиге характерно для пленок с меньшей прочностью, чем их адгезия к металлу. Чаще всего начало разрушения оксидной пленки с отслаиванием наблюдается на углах изделий и их крутых изгибах (рис. 7,е).
Разрушение пленок заметно понижает их защитные свойства пленок и может привести к изменению кинетики окисления.
Об изменении защитных свойств пленки свидетельствуют резкие изломы на кинетической кривой окисления (рис.8).
Читайте также:
