Водород в железе и других металлах
Обновлено: 07.05.2024
Системы водород — металл часто являются прототипами при изучении ряда фундаментальных физических свойств. Предельная простота электронных свойств и малая массы атомов водорода позволяют анализировать явления на микроскопическом уровне. Рассматриваются следующие задачи:
- Перестройка электронной плотности вблизи протона в сплаве с малыми концентрациями водорода включая сильное электрон-ионное взаимодействие
- Определение косвенного взаимодействия в металлической матрице через возмущение «электронной жидкости» и деформацию кристаллической решётки.
- При больших концентрациях водорода возникает проблема формирования металлического состояния в сплавах с нестехиометрическим составом.
В последнее время все больше внимания к водороду как к источнику дешевой энергии. С решением проблемы хранения и транспортировки водорода, водородная энергетика в скором будущем, возможно, выйдет на лидирующие позиции. Водород хорошо растворим во многих металлах, лучше всего в палладии Pd (в одном объёме Pd растворяется 850 объёмов водорода). Это свойство позволяет рассматривать систему водород — металл в области техники хранения и транспортировки водорода. Водород можно хранить и транспортировать в виде твердых гидридов металлов и интерметаллических соединениях, способных поглощать и отдавать при нагревании несколько сотен объёмов водорода на единицу своей массы.
Сплавы водород — металл
Водород, локализованный в междоузлиях металлической матрицы слабо искажает кристаллическую решётку. С точки зрения статистической физики реализуется модель взаимодействующего «решёточного газа». Особый интерес представляет исследование термодинамических и кинетических свойств вблизи точек фазового перехода. При низких температурах образуется квантовая подсистема с большой энергией нулевых колебаний и с большой амплитудой смещения. Это позволяет изучать квантовые эффекты при фазовых превращениях. Большая подвижность атомов водорода в металле делает возможным изучение процессов диффузии. Другим направлением исследований являются физика и физхимия поверхностных явлений взаимодействия водорода с металлами: распад молекулы водорода и адсорбция на поверхности атомарного водорода. Особый интерес представляет случай, когда начальное состояние водорода является атомарным, а конечное — молекулярным. Это важно при создании метастабильных металл-водородных систем.
Применение систем водород — металл
- Очистка водорода и водородные фильтры
- Использование металлогидридов в ядерных реакторах в качестве замедлителей, отражателей и т. д.
- Разделение изотопов
- Термоядерные реакторы — извлечение трития из лития
- Устройства для диссоциации воды для топливных элементов и батарей
- Аккумуляция водорода для автомобильных двигателей на базе металлогидридов
- Тепловые насосы на базе металлогидридов, включая кондиционеры для автотранспорта и жилища
- Преобразователи энергии для тепловых электростанций
- Хранение и транспортировка водорода
Интерметаллические металлогидриды
Гидриды интерметаллических соединений нашли широкое применение в промышленности. Основная часть перезаряжаемых батарей и аккумуляторов, например, для сотовых телефонов, переносных компьютеров (ноутбуков), фото- и видеокамер содержит электрод из металлогидрида. Такие аккумуляторы являются экологически чистыми, так как не содержат кадмия.
Водород в железе и других металлах , страница 3
Повышение температуры ускоряет процесс активированной адсорбции и увеличивает количество адсорбированного газа. На рис. 3 представлены изобары адсорбции водорода никелем.
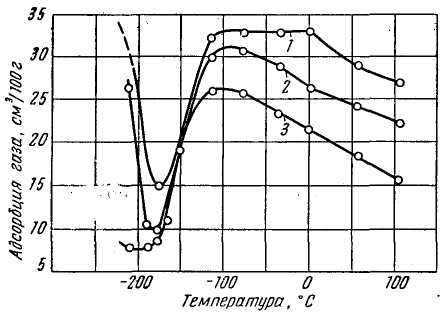
Рис. 3. Изобары адсорбции водорода никелем при
различных давлениях: 1 - 600 мм рт. ст.; 2 - 200 мм рт. ст.; 3 - 25 мм рт. ст.
На рис. 2, где приведена изобара адсорбции водорода железом, кривые В и С можно рассматривать как два вида активированной адсорбции с различной энергией активации. Рисунок показывает, что уже при температуре -80°С процесс взаимодействия водорода с железом представляет собой активированную адсорбцию. Выше 400°С исследование адсорбции осложняется тем, что водород начинает растворяться в железе в измеримых количествах.
Значения теплот активированной адсорбции существенно превышают значения теплот физической адсорбции и приближаются к величинам теплот химических реакций. В табл. 1 приводятся значения теплот активированной адсорбции для некоторых систем водород — металл (экспериментальные или вычисленные).
Таблица 1. Теплоты активированной адсорбции для некоторых систем водород — металл
Теплота адсорбции, кал\моль
Теплота адсорбции, кДж\моль
9000 - 14000 14000
14000 - 17200 18000 - 28000
37,6 - 58,6 58,6 43,6 ± 4,2
58,6 - 71,9 75,4 - 127
Высокие значения теплот активированной адсорбции подтверждают ту точку зрения, что во многих случаях адсорбции этого типа газ диссоциирует и атомы газа соединяются непосредственно с атомами металла на его поверхности. Для систем водород - металл эта точка зрения в настоящее время полностью доказана.
Экспериментально установлено, что способностью к активированной адсорбции на металлах обладают только те газы, которые образуют с металлами химические соединения. Благородные газы, будучи химически инертными при всех температурах, металлами не адсорбируются. Активированная адсорбция водорода металлами представляет собой взаимодействие, в котором принимают участие химические силы; эти силы могут соответствовать по своей природе простым валентным силам или отражать электронную связь компонентов. По величине они значительно превышают слабые ван-дер-ваальсовые силы, обусловливающие физическую адсорбцию. В отдельных случаях процесс активированной адсорбции может заканчиваться образованием соединений, однако это наблюдается далеко не всегда и, по-видимому, не является обязательным.
Количество водорода, адсорбированного путем активированной адсорбции металлическими порошками, может достигать 100 - 1000 сиг 3 /100 г. Миньоле на основании своих расчетов для адсорбции водорода никелем, железом и вольфрамом пришел к выводу, что активированная адсорбция атомов водорода объясняется возбуждением и локализацией электронов зоны проводимости. На основе экспериментальных данных о весьма малой скорости и необратимости активированной адсорбции были высказаны предположения, что процесс активированной адсорбции не ограничивается чисто поверхностным взаимодействием, а представляет собой растворение газа в металле. Бентон и Уайт нашли, что водород, адсорбированный никелем при 0°С, не десорбируется при охлаждении до температуры -180° С. Аналогичные результаты были получены для системы водород—платина и некоторых других систем. Медленную адсорбцию водорода медью Уорд объясняет растворением. Смиттелс считает, что такое объяснение активированной адсорбции трудно согласуется с величинами растворимости газов в металлах, составляющими, как будет показано ниже, около 1 - 10 сиг 3 /100 г. На первый взгляд это возражение может показаться убедительным, однако нужно учитывать, что при исследованиях адсорбции, как правило, используют металлические порошки, которые вследствие сильно развитой поверхности обладают значительной адсорбционной способностью, позволяющей производить измерения с большой степенью точности. В то же время растворимость водорода определяли главным образом на образцах компактного металла. Не исключено, что значительная разница величин адсорбированного и растворенного газа связана в какой-то степени с повышенной адсорбционной способностью порошкообразных металлов. В действительности же процессы активированной адсорбции и растворения весьма близки друг к другу и отличаются лишь степенью интенсивности сил взаимодействия водорода с металлом. Физическая природа этих сил взаимодействия в обоих случаях одинакова. Робертс считает, что обычно измеряемая активированная адсорбция происходит не на чистой поверхности металла, а на поверхности, уже покрытой слоем газа.
Водород в железе и других металлах , страница 2
С увеличением давления физическая адсорбция повышается, приближаясь к некоторому значению, обычно соответствующему мономолекулярному слою газа. В качестве примера на рис. 1 приведены изотермы физической адсорбции водорода железом. В большинстве случаев даже при низких давлениях наблюдается значительная адсорбция водорода металлами, которая возрастает с повышением давления.
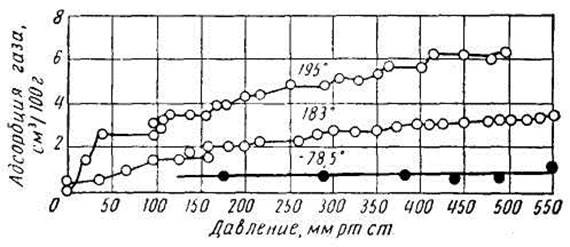
Рис. 1. Изотермы адсорбции водорода железом, восстановленным при 450° С
Однако экспериментальные изотермы адсорбции водорода железом, никелем и медью не укладываются на плавную кривую. Это заставляет предполагать, что при низких температурах адсорбция не является непрерывной функцией давления. С. Ф. Юрьев указал, что непрерывность изотермы адсорбции на поликристаллической поверхности может быть лишь результатом статистического среднего, поскольку поверхность поликристаллического вещества представляет собой сумму граней кристаллов с различной атомной ориентировкой и, следовательно, различным распределением энергетического потенциала в адсорбционном объеме.
С повышением температуры физическая адсорбция понижается. На рис. 2 приведена изобара адсорбции водорода железом при давлении 760 мм рт. ст. Для области низких температур начиная с -200°С характерна физическая адсорбция (кривая А). Аналогичный характер имеют изобары физической адсорбции для других исследованных систем.
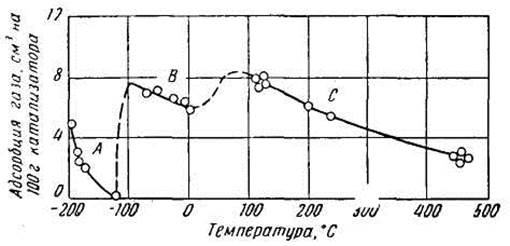
Рис. 2. Изобара адсорбции водорода железом при давлении 760 мм рт. ст.
Тепловой эффект процесса физической адсорбции невелик и обычно не превышает ~ 8,4 - 16,8 кДж/моль (2000 - 4000 кал/моль), что свидетельствует о малой прочности связи газа с металлами. Так, теплота физической адсорбции водорода медью составляет ~ 1,68 - 3,35 кДж/моль (400 - 800 кал/моль) при температуре -183° С, а железом при температуре от -195 до -183° С ~ 8,36 кДж/моль (2000 кал/моль).
С точки зрения современной теории поверхностная физическая адсорбция водорода является результатом межмолекулярного взаимодействия. При низких температурах адсорбированные молекулы водорода удерживаются на поверхности металла слабыми ван-дер-ваальсовыми силами. Существенное значение в этом процессе имеет интенсивность силового поля, возникающего на поверхности металла в результате энергетической неуравновешенности поверхностного слоя атомов кристаллической решетки металла. Атомы, образующие поверхностный слой металла, благодаря асимметричности своего расположения обладают ненасыщенными силами связи. Эти ненасыщенные силы связи удерживают на поверхности молекулы газа. При соударении часть молекул газа задерживается на поверхности кристалла и «испаряется» лишь спустя некоторое время, определяемое интенсивностью поверхностного силового поля. Если поверхностные силы велики, то скорость «испарения» может быть ничтожной и поверхность почти полностью покрывается молекулами газа. Область действия поверхностных сил имеет размеры порядка 10 -8 см, т.е. меньше, чем диаметр газовой молекулы. Поэтому обычно распространение физической адсорбции ограничивается мономолекулярным слоем газа.
Температурный интервал существования физической адсорбции для различных систем различен. Согласно исследованиям Роберте, водород адсорбируется на вольфрамовых нитях даже при -180°С, причем процесс протекает мгновенно и не требует энергии активации.
Поверхностная физическая адсорбция является первоначальной стадией сорбционных процессов для большинства исследованных систем водород — металл в области низких (отрицательных) температур и, как отмечалось выше, не является специфичной. По мере повышения температуры получают развитие процессы так называемой активированной адсорбции или хемосорбции.
Этот вид адсорбции определяется в основном особенностями конкретной системы газ - металл. Так, активированная адсорбция отчетливо проявляется в системах водород - медь, водород — железо, водород — никель, а золото и серебро, по данным не обладают способностью адсорбировать водород в обычном температурном интервале.
Водород в железе и других металлах

Водород обладает способностью взаимодействовать со всеми без исключения элементами периодической системы. При этом его можно встретить в любом из четырех основных видов связи: ионной, ковалентной, металлической и ван-дер-ваальсовой. Очевидно, что характер взаимодействия атомов в кристаллической решетке не является специфической особенностью данного атома, а определяется условиями, в которых этот атом находится, и в первую очередь свойствами окружающих его атомов. Так, атом металла может иметь металлическую связь, если он окружен аналогичными металлическими атомами, ионную, если он взаимодействует с неметаллами, ковалентную — в некоторых сложных металлических фазах. Так же существенным является тот факт, что ни один из основных видов связи не встречается в чистом виде в реальных системах, в том числе и в системах, содержащих водород. Даже самые «крайние» электроположительные и электроотрицательные элементы, например Li и F, образуют с водородом прочные химические соединения со смешанными связями: в молекуле LiН, по расчету Адамова, связь является ионной на 30%, в молекуле НF — на 50% ионной и на 50% ковалентной.
Взаимодействие водорода с металлами (и неметаллами) включает в себя ряд процессов: поверхностную физическую адсорбцию, хемосорбцию, диффузию, растворение и химическое взаимодействие с образованием определенных химических соединений. Будет ли взаимодействие водорода с определенным элементом носить характер химической реакции с образованием соединения ионного, ковалентного или иного типа или же оно выразится в процессах физической межмолекулярной адсорбции и т. д. — это зависит от внешних условий (температуры и давления) и от специфических особенностей взаимодействующего элемента, в первую очередь от его атомной структуры.
В определенных условиях взаимодействие любого элемента с водородом может протекать любым из перечисленных путей. Но можно с полной уверенностью констатировать, что все эти процессы представляют собой различные стадии одного общего процесса. Поверхностная, чисто физическая адсорбция является начальной стадией процесса взаимодействия водорода с другим элементом, конечная его стадия — химическое взаимодействие с образованием нового вещества (химического соединения). Все детальные процессы представляют собой промежуточные стадии, последовательно переходящие друг в друга в соответствии с изменениями условий.
Как способность к гидридообразованию не является особенностью, присущей лишь какой-то определенной группе элементов, так и адсорбция или растворение водорода не являются процессами, свойственными только некоторым металлам. С принципиальной точки зрения любой элемент может пройти последовательно все стадии взаимодействия с водородом, если только имеются необходимые внешние условия, которые будут соответственно изменяться и этим обусловливать переход от одной стадии взаимодействия к другой. Но в реальных условиях взаимодействия эти возможности существуют далеко не всегда, благодаря чему у одних элементов легче обнаруживается склонность к образованию химических соединений с водородом, другие проявляют себя как поверхностно активные, для третьих характерна высокая проницаемость по отношению к водороду и т. д.
1.2 Адсорбция
Различают два рода поверхностной адсорбции: физическую адсорбцию и активированную адсорбцию или хемосорбцию.
Поверхностная физическая адсорбция не является специфичной для какого-нибудь газа. Все газы адсорбируются приблизительно в одинаковой степени, и адсорбция зависит главным образом от природы поверхности адсорбента. Процесс физической адсорбции протекает с большой скоростью и полностью обратим.
Автор: Карпов В.Ю.
Рассмотрены процессы взаимодействия водорода с твердыми и жидкими металлами. Доказано, что насыщенный газом жидкий металл при кристаллизации образует литую пористую структуру (газар). Размером пор и пористостью можно управлять, изменяя параметры процесса. Рассмотрены основные факторы, которые влияют на вид и форму пор. Показано влияние пористой структуры на некоторые механические свойства металлов. Отмечено, что при термоциклическом воздействии на полиморфные металлы в области полиморфного превращения с ними происходит ряд изменений. Некоторые металлы взаимодействуют с водородом с эффектом снижения их прочности на несколько порядков, либо интенсивно растрескиваются при образовании в них гидридов. На некоторые металлы термоциклирование не оказывает видимого эффекта. Было определено при каких условиях проявляется снижение прочности некоторых металлов. Предложен механизм снижения прочности металлов.
Ключевые слова: расплав; насыщение водородом; пористость; полиморфные металлы; Н-слой; водородистый мартенсит; предел прочности.
УДК 620.193.55.001.5.; 669.017:62-405.
Металлы и водород
Карпов Владимир Юрьевич
Доктор технических наук, профессор.
Национальная металлургическая академия Украины,
Днепропетровск
Процесс взаимодействия водорода с металлами — один из интереснейших вопросов современного металловедения и физики твердого тела. Это связано с необычным поведением этого элемента в конденсированных фазах и возникшей практической необходимостью объяснения давно известного сильного негативного влияния водорода на свойства большинства металлов и сплавов 3.
В настоящее время в лаборатории ведутся работы, связанные с водородом, по нескольким направлениям:
- получение легких пористых материалов – газаров и изучение их свойств с целью дальнейшего внедрения в промышленность;
- исследования по изучению влияния термоциклической обработки и водорода на свойства полиморфных металлов.
Одним из интенсивно развиваемых направлений исследований в лаборатории является получение легких пористых материалов на базе литой матрицы – газаров.
Научной основой получения газаров является газо-эвтектическая реакция (распад жидкости одновременно на твердую и газообразную фазы) 4, имеющая место при кристаллизации металлов и сплавов, насыщенных газом до определенной концентрации. Термодинамическим фундаментом этой реакции является особый тип диаграммы состояния систем металл (керамика) – газ. Сущность технологического процесса заключается в том, что заданный материал (металл, сплав, керамика) расплавляют в атмосфере водорода (или другого «активного» газа) при определенном давлении. При переходе расплава, насыщенного водородом, в кристаллическое состояние растворимость в нем водорода скачкообразно уменьшается на величину, равную разности между содержанием водорода в жидкости и растворимостью его в кристаллах. Этот объем будет выделяться в виде газовых пузырьков непосредственно на фронте кристаллизации. Так как образование пористой структуры идет по аналогии с эвтектической кристаллизацией, поры всегда ориентированы перпендикулярно фронту кристаллизации.
Устройства для получения газаров должны гарантировать несколько главных параметров, определяющих степень пористости, форму и размеры пор:
- парциальное давление активного газа в период насыщения;
- температура и время насыщения;
- температура металла перед разливкой;
- скорость и низкая турбулентность заливки металла в кристаллизатор;
- контролируемая скорость кристаллизации;
- контролируемое давление газа во время кристаллизации;
- уровень исходной влажности и вакуума в установке перед ее наполнением активным газом (водород и другие газы).
Получаемая поровая структура газаров чрезвычайно разнообразна как по форме пор (рис.1), так и по всем другим морфологическим характеристикам [11]:
- размер пор в диаметре от 10μ до 10 мм, по длине от 10μ до 500 мм;
- пористость от 5 до 75%;
- ориентация пор: изотропная, радиальная, параллельная, комбинированная;
- проницаемость: от полностью герметичной до полностью проницаемой;
- поверхность пор чаще всего зеркально чистая и гладкая, свободная от примесей;
- возможно получение чередующихся пористых и монолитных слоев в одном изделии;
- поверхность отливки может иметь открытые поры или полностью монолитную корочку контролируемой толщины.
Для получения газаров были разработаны и изготовлены разнообразные устройства отличающиеся принципами разливки металла и его кристаллизации (рис.2).

Интересны механические свойства газаров. Поскольку структура газаров формируется из жидкого состояния и базовый материал не содержит вспенивающих добавок, резко снижающих механические свойства, то прочность газаров намного превосходит прочность других пористых материалов, в частности спеченных (рис.3).
Особенно поражает тот факт, что при сравнительно высокой пористости (до 30%) и размерах пор до 150 микрон, прочность газара превосходит прочность монолитного материала, полученного в аналогичных условиях. Пока этот факт не нашел глубокого теоретического объяснения.
Можно только предположить, что данное явление является следствием своеобразного макроструктурного упрочнения. Иными словами, в
а б
Рис. 2. Установка с поворотом на 1800 с печью сопротивления (а), установка с поворотом на 900 с индукционной печью (б)
результате естественных процессов при кристаллизации газаров формируется арочная структура (подобная ажурной структуре мостов и башен), приводящая к оптимальному варианту распределения напряжений в макро образце.
Кроме этой существует гипотеза, что при малом диаметре пор стенки между ними настолько тонкие, что ведут себя подобно металлическим усам с малым содержанием дефектов, которые деформируются при значительно больших нагрузках.
Газары могут применяться, благодаря своим свойствам, как легкие и прочные конструкционные материалы, прежде всего в авиационной и космической технике, а также в автомобилестроении. Кроме того, они


а б
Рис.3. Прочностные характеристики газаров и некоторых пористых материалов: относительная прочность (а) (1 – газар на основе меди, предел текучести; 2 – газар на основе меди, предел прочности; 3 – спеченные медные волокна, предел прочности; 4 – спеченные никелевые волокна, предел прочности; 5 – спеченный железный порошок, предел прочности; 6 – спеченный порошок вольфрама; 7 – предел текучести медного газара по монолитному сечению; 8 – предел прочности медного газара по монолитному сечению); предел прочности (б) (1– газар на основе стали мартенситного класса; 2 – эта же пористая сталь, полученная спеканием порошка; 3 – газар на основе титанового сплава; 4 – тот же сплав, полученный спеканием порошка)
могут частично заменить традиционные пористые материалы функционального назначения (подшипники, фильтры, распылители жидкости и др.). Возможно также применение газаров для изготовления композиционных материалов, в частности легкой брони для летательных аппаратов, высоко емких резервуаров сжатого газа, тормозных элементов колес скоростных самолетов, автомобилей, железнодорожного транспорта.
Но пока в технологии их получения имеются серьезные проблемы:
- необходимость использования аппаратуры повышенного давления и водорода как главного порообразователя;
- сложность получения больших объемов газаров, имеющих равномерно распределенные структуру и свойства;
- получение газаров с заданной структурой на основе многокомпонентных сплавов, поскольку именно они необходимы для их успешного внедрения в различные сферы деятельности человека.
Решение этих проблем обеспечит широкое использование газаров в современной технике и промышленности.
Иное развиваемое направление работ в лаборатории - развитие теории процесса взаимодействия водорода с твердыми металлами при их термоциклировании.
Ранее проведенные опыты в НМетАУ по измерению электросопротивления образцов металлов (Ni, Co, Fe) в водороде при циклически изменяющейся температуре показали, что происходит интенсивная деформация образцов из фольги железа. После экспериментов изменились их геометрические размеры, гладкая поверхность приобрела вид апельсиновой корки. Для образцов из других исследуемых металлов (Ni, Co) изменений размеров и вида поверхности не было. Такой неожиданное поведение фольги из железа послужило основанием для детального изучения обнаруженного эффекта.
Исходя из этих положений обнаруженный эффект деформации образцов из железной фольги был изучен и для массивных образцов [12]. Так, в результате ТЦО цилиндрических образцов железа наблюдалась их деформация: они «текли» подобно вязкой жидкости (рис.4). Отмечено, что обнаруженное явление наблюдалось только при ТЦО, включающей прохождение температуры полиморфного α – γ превращения. При ТЦО выше или ниже этой температуры эффект не наблюдался. Исследования эффекта самопроизвольной деформации при других параметрах ТЦО показали неизменность его проявления с различной степенью интенсивности.
В результате серии экспериментов было установлено, что основными факторами, влияющими на процесс самопроизвольной деформации железа, являются:
- интервал циклирования в водороде при его давлениях не ниже 0,001МПа, включающий температуру полиморфного α – γ превращения железа (1183K);
- скорость охлаждения образца должна находиться в интервале температур 0,1-5К/с;
- ширина диапазона термоциклирования образцов в пределах ±25÷±100К от температуры полиморфизма.
Первоочередной задачей исследования было выяснение роли водорода. Для этого провели эксперименты при давлениях водорода в установке в интервале 0,005 ÷ 100 МПа.
Установлено, что атмосфера водорода оказывает основное влияние на процесс деформации железа при α – γ превращении.
Ранее авторы 14 обнаружили, что при проявлении динамической сверхпластичности предел текучести железа σт снижался до уровня порядка
а б
Рис.4. Вид самопроизвольно деформировавшегося цилиндрического (а) и шарообразного образца (б) железа после ТЦО в водороде
0,1 МПа. Проведенные нами эксперименты показали, что при полиморфном превращении в железе в присутствии водорода, начиная с давления 0,02 МПа, происходит снижение предела текучести σт до уровня 0,0001МПа (рис.5) [12]. Предел текучести железа уменьшался, более чем на четыре порядка.

Рис.5. Изменение σт железа при
α – γ превращении в атмосфере водорода
Для проверки обнаруженного эффекта самопроизвольной пластической деформации железа были исследованы другие полиморфные металлы – марганец, кобальт, титан и цирконий.
При термоциклировании образцов марганца вокруг температуры α-β превращения (943 – 1093К) происходила их заметная деформация. Однако эффект в марганце проявлялся слабее, чем в железе.
При исследовании кобальта эффект деформации не отмечался.
Образцы из гидридобразующих металлов - титана, циркония и их сплавов при ТЦО в водороде интенсивно растрескивались за счет образования гидридов вокруг и внутри зерен металлов.
Выяснено, что принципиальным отличием между железом и марганцем с одной стороны и кобальтом с другой стороны является разница в механизмах полиморфного превращения. Для железа и марганца полиморфное превращение протекает нормальным диффузионным путем. У кобальта полиморфное превращение осуществляется по мартенситному механизму. У титана и циркония происходит интенсивное образование гидридов, что приводит к растрескиванию образцов.
Из литературных данных 14 известно, что в γ-фазе железа растворяется водорода в 1,4 раза больше, чем в α-фазе. Избыточный водород концентрируется вблизи межфазной границы. Таким образом, на межфазной границе α – γ превращения в образце создается зона с очень высокой концентрацией водорода, которая была названа Н-слоем. По расчетам толщина Н—слоя и концентрация водорода в нем зависит от скорости движения фронта α – γ превращения и может достигать толщины 0,1-0,001мм и соответственно концентрации водорода до десятков атомных процентов. Очевидно с этим и связан эффект самопроизвольной деформации железа и марганца в присутствии водорода.
Для фиксации новой фазы (Н-слоя) была применена закалка образцов из промежуточного состояния в процессе термоциклирования. Исследование микрошлифов показало наличие водородистого мартенсита, который ранее получали только путем закалки железа из жидкого состояния при высоких давлениях водорода (более 30МПа) (рис.6). На видимой поверхности микрошлифов площадь Н-мартенсита составляла 30 - 50%. Вид участков водородистого мартенсита отличался друг от друга, что говорит о дискретности Н-слоя на границе двух фаз и большой скорости диффузии водорода при этих температурах и концентрациях.
а х 20 б х300
Рис.6. Вид зоны водородистого мартенсита (а) и отдельных его участков (б)
Вид микроструктуры термоциклированных в водороде образцов показал сильное увеличение размера зерен, которое наблюдается буквально с первых циклов. Это связано со снижением количества дефектов в α-фазе и трудностями ее зарождения.
Исследования показали, что в зависимости от условий ТЦО наблюдаются изменение многих физико-механических параметров металлов. Результаты этих исследований были оценены как научное открытие №313 в области металлургии.
Читайте также:
