Восстановление металлов из их солей в водных растворах
Обновлено: 11.05.2024
Химическое восстановление металлов из водных растворов их солей является одним из распространенных способов нанесения проводящего слоя. Наиболее широко применяются пленки серебра и меди. В качестве восстановителя используют растворы формалина, глюкозы, сегнетовой соли и др. Химическое серебрение ведут при температуре 10 - 20 С. При этом скорость восстановления металла замедляется, но покрытие получается более плотным и мелкокристаллическим. [1]
Химическое восстановление металлов является автокаталитическим процессом осаждения компактных металлических покрытий на поверхности изделия путем взаимодействия находящихся в растворе ионов металла и восстановителя, являющегося донором электронов. [2]
Химическим восстановлением металлов из растворов их соединений получают порошки Си, Ni, Co, Ag и их смеси. Восстановителем служит водород или диоксид углерода. Исходное сырье - сульфатные водные или аммиачные растворы соответствующих металлов. [3]
Реакции химического восстановления металлов являются реакциями автокаталитическими, так как металл образовавшийся в результате химического осаждения, катализирует дальнейшую реакцию восстановления этого же металла. Для начального же периода восстановления металла необходимо на поверхности диэлектрика получить каталитически активные участки, на которых начинается процесс химического восстановления металла. [4]
Распространению процесса химического восстановления металлов способствуют три его особенности. [5]
Окислительно-восстановительный процесс химического восстановления металлов протекает между катализатором и водным раствором, содержащим восстановитель, соли восстанавливаемых металлов, комплексообра-зователь и буферную систему. [6]
Для проведения процесса химического восстановления металлов весьма существенным является подбор материала ванны. Материал должен отвечать следующим требованиям: быть химически стойким к растворам с кислотностью в пределах рН 3 - 11 и выдерживать температуру до 100 С без изменения физико-химических и механических свойств. [7]
Для более полной характеристики процессов химического восстановления металлов необходимо применять электрохимические методы исследования. Потенциал фт в общем случае не имеет простой связи со скоростью осаждения металла, но может служить показателем протекания процесса восстановления, а его изменения могут дать информацию об изменениях в растворе и состоянии поверхности катализатора. [8]
Для более полной характеристики процессов химического восстановления металлов необходимо применять электрохимические методы исследования. Потенциал Ем в общем случае не имеет простой связи со скоростью осаждения металла, но может служить показателем протекания процесса восстановления, а его изменения могут дать информацию об изменениях в растворе и состоянии поверхности катализатора. [9]
Катодное травление происходит за счет химического восстановления металла из окисла и механического отрывания окислов бурно выделяющимся водородом. [10]
Катодное травление происходит в результате химического восстановления металла из окисла и механического отрывания окислоп бурно выделяющимся водородом. Продолжительность травления от 3 до 15 мин. [11]
В настоящее время разработаны способы химического восстановления металлов из их соединений для получения пленок серебра, меди, золота, платины, никеля, кобальта и сурьмы. [12]
Еще одним методом получения покрытий является химическое восстановление металлов из растворов их солей. При этом образуется покрытие, прочно сцепленное с основным металлом. Процесс получения никелевых покрытий такого рода называется химическим никелированием. [13]
Проведенные ранее исследования в области механизма процесса химического восстановления металлов с использованием гипофосфита натрия 6 выявили роль металла как передатчика электронов; использование электрохимических методов описания процессов на электроде позволило более детально охарактеризовать природу каталитических этапов реакций, лимитирующих скорость суммарного процесса. Несмотря на то, что к настоящему времени мы еще далеки от полного понимания всей совокупности явлений, происходящих в ходе формирования покрытий, обобщение проделанных в этом направлении работ должно содействовать выбору более целесообразных путей дальнейшего изучения процесса. [14]
Рассмотрены основные вопросы химической металлизации: подготовка поверхности, химическое восстановление металлов в растворах и технологические процессы меднения, никелирования, кобальтирования, нанесения покрытий на основе сплавов и благородных металлов. Приведены физико-химические основы процессов, даны конкретные указания по выполнению отдельных операций. [15]
§ 45.1. Получение металлов электролизом водных растворов солей
В § 45 вы познакомились с электрохимическим методом промышленного получения металлов, который основан на электролизе, — электрометаллургией.
У этого метода есть две разновидности. Первая — это проведение электролиза расплава соединений металлов. Особенности этого способа вы рассмотрели на примере электролиза расплава хлорида магния.
Вторая разновидность электрохимического метода, называемая гидроэлектрометаллургией, основана на электролизе водных растворов солей металлов. Преимущество этого метода, по сравнению с электролизом расплавов, заключается в том, что он не требует энергетических затрат на расплавление вещества. Ограничение электролитического метода извлечения металлов из водных растворов состоит в том, что он пригоден лишь для металлов, стоящих в ряду активности металлов правее алюминия.
Особенность проведения электролиза водных растворов солей заключается в том, что наряду с процессами восстановления ионов металла на катоде и окисления анионов соли на аноде протекает конкурирующий процесс электролиза молекул воды. В результате на катоде может выделяться водород, а на аноде — кислород.
Процессы на катоде:
2Н + + 2е – = Н2↑ при рН < 7;
Процессы на аноде:
2Н2О – 4е – = О2↑ + 4Н + при рН ≤ 7;
4ОН – – 4е – = О2↑ + 2Н2О при рН > 7.
Процессы на катоде
Способность металлов восстанавливаться на катоде при электролизе водного раствора солей определяется положением металла в ряду активности.
Катионы металлов в левой части ряда активности, заканчивая алюминием (Li + , Na + , K + , . Аl 3+ ), при электролизе не восстанавливаются. Вместо них восстанавливается водород из молекул воды:
Катионы металлов, расположенных в ряду активности правее водорода (Cu 2+ , Ag + , Hg 2+ , Pt 2+ , Au 3+ ), при электролизе восстанавливаются на катоде до металла:
Cu 2+ + 2е – = Cu 0 ;
Au 3+ + 3е – = Au 0 .
Этот процесс доминирует, но если электролит имеет сильно кислую среду, то одновременно с ионами металла могут восстанавливаться ионы водорода:
Катионы металлов, расположенных в ряду активности между алюминием и водородом (Mn 2+ , Zn 2+ , Сr 3+ , Fe 2+ , . Pb), при электролизе восстанавливаются на катоде одновременно с водородом из воды:
Ni 2+ + 2e – = Ni 0 ;
При электролизе водных растворов солей металлов следует учитывать возможность протекания процессов гидролиза, который ускоряется в результате образования гидроксид-ионов в электролите вблизи катода. В результате на поверхности катода могут образовываться нерастворимые основные соли и основания:
Электропроводность электрода уменьшается, и процесс электролиза замедляется или прекращается. Один из способов борьбы с таким явлением — подкисление электролитов.
Процессы на аноде
На аноде протекают процессы окисления компонентов электролита. В процессе окисления может участвовать и материал самого анода. Различают процессы электролиза в растворах с активным и инертным анодами.
Инертные аноды не окисляются под действием электрического тока и не реагируют с веществами раствора. При электролизе они служат лишь передатчиками электронов. Инертными являются электроды из графита, платины, платинированного титана.
К активным относятся аноды, изготовленные из Сu, Ag, Fe, Ni, Sn, Zn. Металл активных анодов в процессе электролиза разрушается и переходит в раствор в виде ионов. Активные аноды обычно применяют в промышленности при получении покрытий путём электрохимического восстановления металлов из растворов, поскольку растворение металлического анода в процессе электролиза восполняет убыль ионов восстанавливаемого металла из электролита. При этом они обеспечивают постоянство состава раствора, скорости процесса электролиза, состава и свойств получаемых металлических покрытий.
Рассмотрим подробнее процессы, протекающие при электролизе растворов на инертных анодах. Можно выделить следующие закономерности (табл. 31.1):
• в растворах бескислородных кислот и их солей (кроме HF и фторидов) на аноде окисляются анионы, например:
• в растворах кислородсодержащих кислот и их солей в случае максимальной степени окисления атомов неметалла в анионе ( , ) окисляются атомы кислорода в молекулах воды с выделением газообразного кислорода:
• в растворах кислородсодержащих кислот и их солей, в анионах которых содержатся атомы неметалла в промежуточной степени окисления ( , ), окисляются именно эти атомы в составе анионов, например:
Таблица 31.1. Способность к окислению на аноде анионов при электролизе водных растворов солей
В водном растворе не окисляются; окислению подвергаются молекулы воды с выделением кислорода:
В водном растворе легко окисляются, например:
В специально созданных условиях в водных растворах может идти процесс окисления и кислородсодержащих анионов с максимальной степенью окисления неметалла. Например, электролизом концентрированного раствора гидросульфата калия получают сильный окислитель — пероксодисульфат калия:
Примеры использования электролиза водных растворов солей металлов в промышленности и в лаборатории
При разработке условий электролиза следует учитывать, что продукты электролиза могут вступать в химические реакции с электродами и водными растворами или между собой.
Промышленный электролиз водного раствора NaCl. Процесс используют для получения водорода, хлора и каустической соды (NaOH). При этом на катоде выделяется водород:
а в растворе накапливается каустическая сода:
Если не разделить продукты электролиза, то между образовавшимися газами произойдёт химическая реакция.
В растворе также возможно взаимодействие хлора со щёлочью:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для того чтобы между продуктами электролиза не происходило взаимодействие, катодное и анодное пространство разделяют мембраной (рис. 108.2).
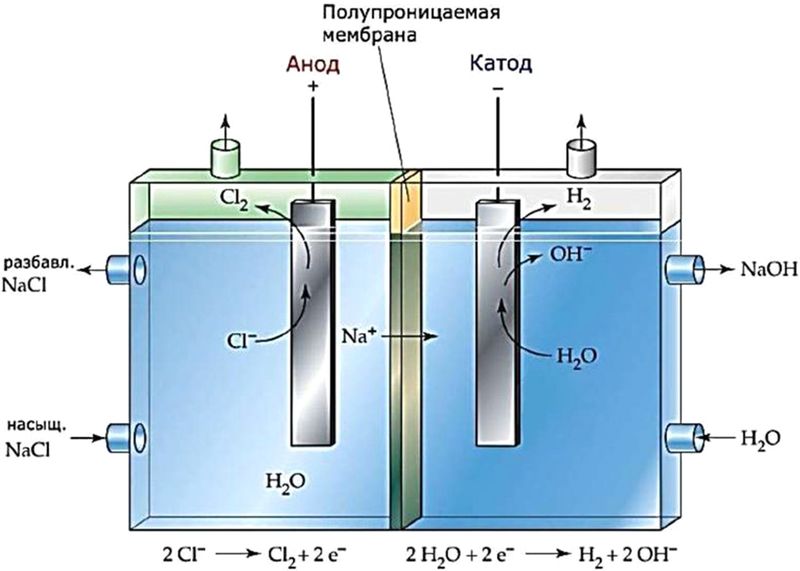
Рис. 108.2. Схема электролизёра с ионообменной мембраной для электролиза раствора хлорида натрия. Мембрана пропускает ионы Na + , но не пропускает ионы Cl – и OH –
С 2015 года в ОАО «Беларуськалий» функционирует цех мембранного электролиза. Продукцией цеха являются: водный раствор гидроксида калия (с массовой долей KOH 46−54 % ); твёрдый гидроксид калия (с массовой долей KOH 9 0−95 % ); соляная кислота (с массовой долей HCl 28−35 % ); гипохлорит натрия NaClO.
Электролиз растворов солей в лаборатории.
Для наглядности при рассмотрении особенностей электролиза водных растворов солей обратимся к химическому эксперименту.
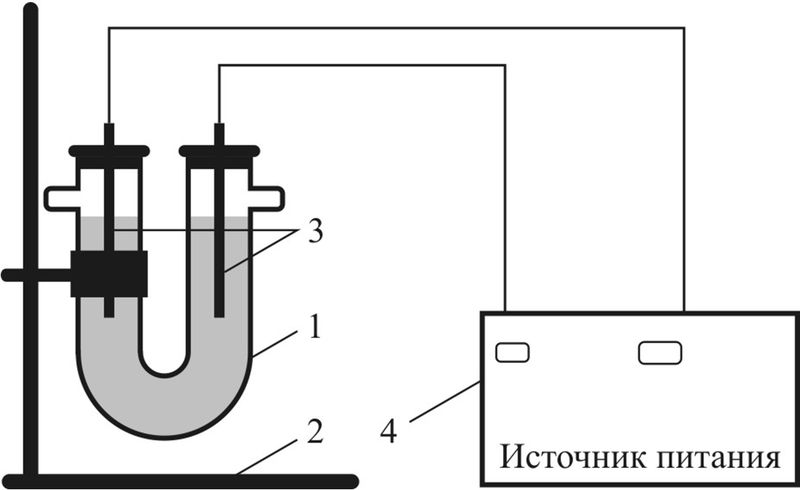
Рис. 108.3. Схема прибора для электролиза:
1 — U-образная трубка (электролизёр);
2 — штатив;
3 — электроды (графитовые стержни);
4 — источник питания постоянного тока
Опыт 1. Проведём электролиз водного раствора CuSO4. Для этого соберём прибор по схеме, представленной на рис. 108.3. В U-образную трубку нальём раствор сульфата меди(II) и опустим два графитовых стержня, закреплённых в резиновых пробках. Стержни с помощью проводов присоединим к источнику тока, на котором поддерживается напряжение постоянного тока до 12 В.
Рис. 108.4. Осаждённая медь на графитовом электроде после проведения электролиза раствора сульфата меди(II)
При пропускании электрического тока через раствор CuSO4 на стержне, присоединённом к положительному полюсу источника тока (анод), можно наблюдать выделение пузырьков газа (это кислород), а на стержне, присоединённом к отрицательному полюсу (катод), — появление красного налёта (это восстановленная медь) (рис. 108.4).
Объяснить наблюдаемое явление можно следующими процессами.
В растворе сульфата меди происходит диссоциация:
При подключении электродов к источнику тока в растворе электролита происходит направленное движение ионов к электродам, имеющим противоположные заряды.
На катоде происходит восстановление меди, которая образует красный налёт на электроде:
Сu 2+ + 2e – = Сu 0
На аноде (положительно заряженном электроде) происходит окисление молекул воды с выделением кислорода:
Суммарное уравнение процессов на электродах в молекулярной форме:
Опыт 2. Проведите электролиз водного раствора йодида калия.
Для проведения электролиза раствора KI воспользуемся установкой из примера 1 (рис. 108.3).
В U-образную трубку нальём раствор KI и пропустим через него электрический ток. Через 3–5 минут, отключив ток и достав электроды, в катодное пространство добавим 2−3 капли фенолфталеина, а в анодное пространство прильём крахмальный клейстер.

Рис. 108.5. Электролизёр после проведения электролиза раствора йодида калия и добавления раствора фенолфталеина (катодное пространство) и крахмального клейстера (анодное пространство)
Раствор в катодном пространстве окрашивается в малиновый цвет, что свидетельствует о щелочной среде. В анодном пространстве наблюдается выделение жёлто-бурого вещества, при добавлении к которому 2–3 капель крахмального клейстера происходит посинение раствора, что указывает на присутствие в растворе йода (рис. 108.5).
Таким образом, продуктами электролиза водного раствора йодида калия являются I2 и щёлочь.
Наблюдаемые явления свидетельствуют о протекании на электродах следующих реакций:
2Н2О + 2e – = Н2↑ + 2ОН – на катоде;
2I – – 2e – = I2 на аноде.
Суммарное уравнение процесса электролиза в молекулярной форме:
Электролиз с активными анодами в промышленности. Помимо электрохимического осаждения металлических покрытий и получения порошков металлов, этот метод применяют для извлечения металлов из растворов, а также для очистки (рафинирования) металлов от содержащихся в них примесей. Так получают чистое золото, медь и многие другие металлы.
Например, при очистке (рафинировании) меди исходный металл, содержащий нежелательные примеси, служит анодом. Анод погружают в раствор сульфата меди(II). При пропускании тока медь на аноде окисляется, её ионы переходят в раствор, перемещаются к катоду и на нём восстанавливаются. Примеси в этом процессе не участвуют из-за их малой концентрации, и поэтому на катоде образуется слой чистой меди.
Процессы электролиза с активными анодами используют для получения покрытий из оксидов металлов. Так, при проведении электролиза с анодом из алюминия его поверхность окисляется, покрываясь слоем оксида. Такой процесс специального наращивания оксида на поверхности металла называют электрохимическим оксидированием (или анодированием). Анодирование применяют для защиты металла от коррозии, придания его поверхности декоративного внешнего вида, повышенной твёрдости.
Методом электролиза растворов солей на поверхность различных изделий наносят покрытия из металлов и их сплавов, композитов с неметаллами, что придаёт изделиям нужные свойства (повышенная коррозионная стойкость, декоративная отделка, электропроводность и др.). К распространённым промышленным процессам относятся цинкование, никелирование, меднение, хромирование, оловянирование, золочение и серебрение.
В НИИ физико-химических проблем Белорусского государственного университета разработаны и внедрены в промышленность процессы электрохимического осаждения покрытий из сплавов металлов и композиционных покрытий металл — оксид металла, например: Ni—B , Ni—P , Ni—Sn , Au—Co , Сu—CuO—Cu2O , Ni — алмаз (алмаз в виде тонко измельчённого порошка). Такие покрытия более твёрдые, износо- и коррозионностойкие, чем покрытия из индивидуальных металлов, обладают декоративным внешним видом (рис. 108.6).
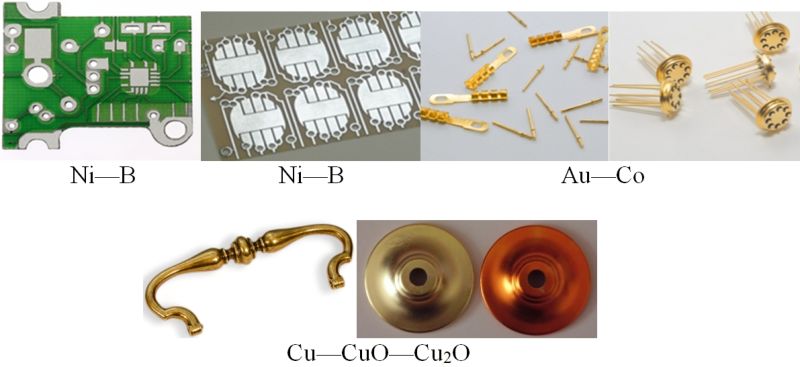
Рис. 108.6. Покрытия на часовых платах, платах кредитных карточек, корпусах транзисторов, фурнитурных изделиях
Электролиз водных растворов используется также в синтезе различных неорганических веществ, в обработке поверхностей металлов (азотирование, борирование, электрополировка, очистка), в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Электролизом получают кислород и водород.
При электролизе водных растворов солей на катоде восстанавливаются катионы металлов, расположенных в ряду активности после водорода.
На катоде не восстанавливаются катионы металлов IA- и IIA-групп , расположенных в начале ряда активности, а также алюминий, вместо них восстанавливается водород из молекул воды.
На катоде одновременно с водородом из воды восстанавливаются катионы металлов, расположенных в ряду активности между алюминием и водородом.
На аноде в растворах солей бескислородных кислот окисляются анионы (кроме фторид-ионов).
На аноде в растворах солей кислородсодержащих кислот с максимальной степенью окисления неметалла ( , ) окисляются молекулы воды с выделением кислорода.
Вопросы, задания, задачи
1. Какие из веществ — каменная соль, сахар, медный купорос, глицерин, серная кислота — могут подвергнуться электролизу в водном растворе?
2. Объясните, почему алюминий нельзя получить электролизом водного раствора его хлорида.
3. Приведите уравнения реакций на электродах при электролизе водного раствора сульфата никеля(II).
4. Сравните продукты электролиза расплава и водного раствора хлоридов натрия, никеля(II) и меди(II). Приведите соответствующие уравнения химических реакций.
5. При электролизе водного раствора хлорида натрия без разделения электродных пространств можно получить гипохлорит натрия. Приведите возможные уравнения электродных процессов и химических реакций в растворе.
6. Продукцией цеха мембранного электролиза ОАО «Беларуськалий» являются водный раствор гидроксида калия и соляная кислота. Приведите уравнения реакций, которые лежат в основе получения этих веществ.
7. Как изменится концентрация катионов и анионов в водных растворах CuCl2, Na2SO4, KI, NaOH, HCl при электролизе? Приведите соответствующие уравнения реакций.
8. В качестве лабораторного способа дезинфекции воды используется электролиз водного раствора хлорида натрия в портативных электролизёрах. Объясните процессы, на которых основан этот способ дезинфекции воды.
9. Сырьём для получения цинка является руда, содержащая цинковую обманку (ZnS). Продукт её обжига растворяют в серной кислоте и после нескольких стадий очистки от примесей (Cu 2+ , Fe 2+ , Fe 3+ и др.) подвергают электролизу. Приведите уравнения химических реакций, иллюстрирующих все основные стадии получения цинка.
10. Оксид марганца(IV) получают электролизом раствора сульфата марганца(II) в присутствии серной кислоты. Предположите, какие процессы протекают на электродах и приведите уравнения соответствующих реакций.
Самоконтроль
1. При электролизе водных растворов солей восстанавливаются ионы:
- а) Li + ;
- б) Mg 2+ ;
- в) Ni 2+ ;
- г) Au 3+ .
2. При электролизе водных растворов солей не восстанавливаются ионы:
- а) K + ;
- б) Са 2+ ;
- в) Cu 2+ ;
- г) Ag + .
3. Продуктами электролиза водного раствора калийной соли являются:
4. На катоде могут протекать процессы:
- а) 2Н2О + 2e – = Н2↑ + 2ОН – ;
- б) 2Н2О – 4e – = О2↑ + 4Н + ;
- в) 2Н + + 2e – = Н2↑;
- г) Ni 2+ + 2e – = Ni 0 .
5. При электролизе водного раствора хлорида натрия выделился водород объёмом 2,24 дм 3 (н. у.). Число электронов, отданных при этом ионами хлора, равно:
Восстановление металлов из их солей в водных растворах
Исследования применимости сернистого газа и окиси углерода для автоклавного восстановления металлов из растворов начались сравнительно недавно, но полученные результаты свидетельствуют о перспективности некоторых из разрабатываемых способов.
Для восстановления меди из сульфатного раствора сернистый газ применен впервые Ван-Арсдалем. Соответствующая суммарная реакция, выраженная уравнением

в расчете на единицу восстановленной меди обусловливает образование вдвое большего количества серной кислоты, чем при водородном процессе. Поскольку восстановительный потенциал сернистого газа в растворе быстро уменьшается с ростом кислотности последнего, реакцию (51) трудно осуществить с приемлемой полнотой, особенно при концентрированных по меди исходных растворах. По данным лабораторных опытов, при температуре 100° и рSO2 всего в 3,4 ат восстанавливалось около 60—70% меди и получались растворы, содержащие до 15% серной кислоты.
Более перспективным восстановителем будет, по-видимому, окись углерода, применение которой в некоторых случаях позволяет устранить отдельные технологические трудности, выявившиеся при водородном процессе.
Окись углерода — сильный реагент, хорошо восстанавливающий медь и другие металлы из аммиачных растворов. Реакция протекает в несколько ступеней. Она начинается с абсорбции окиси углерода раствором и последующего включения ее в состав комплексного катиона по схеме

Образовавшийся двухвалентный катион восстанавливается вводимой в раствор металлической медью до одновалентного, реагирующего далее с окисью углерода по уравнению

В 1952 г. на заводе компании «Вейтекер Металс Ко» (США) в опытно-промышленном масштабе организована переработка латунного и другого медного скрапа. Скрап этот обрабатывают в специальной башне аммиачно-карбонатным раствором меди в присутствии кислорода при небольшом нагревании и атмосферном давлении, причем медь (и цинк) растворяется по схеме

Полученный раствор обрабатывают в автоклаве окисью углерода под давлением 50—65 ат при температуре 150—160°. В течение одного часа медь выделяется в виде очень чистого порошка (см. табл. 3). Маточный раствор, содержащий углеаммонийную соль цинка, свободный аммиак и углекислый аммоний, подвергают дистилляции; аммиак и углекислоту улавливают в водяном скруббере и возвращают в процесс, а цинк, осаждающийся при этом в виде чистого карбоната, является товарной продукцией. Извлечение меди и цинка составляет 99%. Производительность установки — около 1300 г медного порошка в год.
На основе имеющегося опыта в основных промышленных районах США, являющихся источниками получения медного скрапа, предполагается построить до десятка подобных установок с ежегодной производительностью от 10 до 25 тыс. т меди каждая. По данным О’Коннора, строительство завода, перерабатывающего в сутки 50 г скрапа, содержащего 75% Си и 25% Zn, будет стоить около 2 миллионов долларов. Невысокие расходы по переделу, составляющие 4,5 цента на 1 кг меди, в сочетании с низкой стоимостью сырья (главным образом за счет уменьшения расходов по его транспортировке к месту переработки) обеспечивают прибыльность производства.
Наряду с технологией, описанной выше, в некоторых случаях окись углерода может быть использована для образования карбонильных соединений. В 1941 г. Шустер и Келлер в Германии, а в 1951 г. Сузуки, Ито и другие в Японии показали возможность получения карбонила никеля из аммиачных растворов при обработке последних окисью углерода под давлением и при нагреве. Условия восстановления никеля и кобальта этим методом детально разработаны Г.Н. Доброхотовым с сотрудниками в Гипроникеле.
Реакция получения карбонила никеля может быть выражена суммарным уравнением

Процесс протекает при температуре 140—175° и pCO = 50—100 ат. Скорость восстановления никеля в растворах, содержащих его в форме тетрамминного комплекса, характеризуется уравнением

Карбонил никеля выделяется в газообразном состоянии; в таком виде его выводят из процесса, конденсируют и изолируют. Дальнейшая переработка его на высококачественный металлический никель, сопровождающаяся регенерацией части окиси углерода, осуществляется обычными приемами карбонильной технологии.
Восстановление кобальта протекает с образованием малорастворимого и малоустойчивого осадка гексаамминкарбонилата кобальта:


Возможности реализации этого метода в промышленных условиях не исследованы.
Подводя итоги сказанному выше, отметим, что у метода восстановления металлов из растворов их солей окисью углерода имеется ряд несомненных достоинств. Но вместе с тем при организации соответствующего производства следует иметь в виду осложнения, связанные с высокой токсичностью окиси углерода и протеканием вредной побочной реакции образования муравьиной кислоты
Возможность восстановления металлов в водных растворах их солей водородом под давлением была открыта значительно раньше, чем автоклавное выщелачивание. Пионером в этой области был Н.Н. Бекетов, около ста лет тому назад начавший в Харьковском университете исследования «над явлениями вытеснения одних элементов другими». Свои опыты Бекетов производил в небольших запаянных стеклянных трубках с растворами солей различных металлов; внутри трубок специальными приемами создавалось высокое давление водорода — до 110 ат. Результаты этих исследований впервые были сообщены в 1859 г., а в 1865 г. обобщены в докторской диссертации. Бекетов сделал ряд важных наблюдений и дал им теоретическое обоснование, на существе которого мы остановимся ниже.
Из кислых растворов солей ртути, серебра, меди, палладия, платины, свинца и некоторых других элементов Бекетову удалось восстановить металлы, более электроположительные, чем водород. Для усиления действия водорода Бекетов нагревал трубки, а иногда помешал в них кусочки платины или серебра. Обобщая результаты экспериментов, Бекетов пришел к следующим выводам;
1) водород в газообразном состоянии или в растворе может выделять некоторые металлы из их растворов в кислотах;
2) восстановительное действие водорода зависит от давления газа и концентрации соли;
3) действие металлической платины как бы увеличивает давление водорода.
Уточняя свои взгляды на сущность процесса взаимодействия водорода с солями металлов в растворе, Н.Н. Бекетов выдвинул идею о его электрохимической природе; «В сущности, всякое восстановление одного металла другим (Бекетов относил водород по его химическим свойствам к металлам) совершается в виде электролиза», писал он, и далее; «Водород в восстанавливающем ряду занимает место после свинца и восстанавливает следующие за ним металлы: медь, ртуть, серебро, палладий, золото и платиновые металлы».
Бекетов объяснил причину, почему водород восстанавливает одни и не восстанавливает другие металлы из растворов их солей. Так были открыты важнейшие факторы, управляющие процессами восстановления металлов водородом из водных растворов их солей.
Известно несколько попыток вывести уравнения, позволяющие представить количественную взаимосвязь между основными параметрами процесса восстановления. Если исключить неудачную попытку Г. Таммана и В. Нернста, не учитывавших в предложенном ими уравнении ни температуры, ни основных электрохимических факторов, все последующие авторы шли по пути, намеченному Бекетовым. Решающий шаг в этом направлении сделал В.В. Ипатьев, впервые в 1931 г. применивший уравнение электродных потенциалов Нернста к расчетам вытеснения водородом металлов V группы периодической системы из растворов их хлористых солей. Но хотя в отдельных случаях были получены близкие к экспериментальным расчетные данные, строгие количественные расчеты по уравнению Нернста для высоких температур в настоящее время все еще невозможны вследствие отсутствия части необходимых исходных данных. Получение их — одна из важнейших задач в области теории процессов восстановления металлов из растворов солей под давлением газов. Однако рассмотрение отдельных вопросов теории с качественной стороны и ориентировочные расчеты уже теперь дают много ценного для понимания основных направлений в решении прикладных задач и дальнейшего развития технологии.
Возможность вытеснения металла из раствора его соли водородом,

определяется условием, чтобы действительный потенциал водорода был электроотрицательнее действительного потенциала ионов металла относительно электрода из этого металла, т. е.


Из последнего условия может быть рассчитана равновесная концентрация ионов металла в растворе.
Рассмотрим, как меняются и в связи с изменением отдельных факторов.
Действительный потенциал водорода определяется уравнением


из которого видно, что наиболее сильным фактором, позволяющим изменять в широких пределах потенциал водорода в водных растворах, является регулирование pH: увеличение парциального давления водорода в 100 раз сдвигает потенциал водорода так же, как и увеличение pH раствора на единицу.
Действительный потенциал металлического электрода в растворе его простой соли выражается уравнением

В процессе восстановления концентрация ионов металла уменьшается, что приводит к сдвигу потенциала εМе в сторону более электроотрицательных значений. Следовательно, для того чтобы произвести восстановление, оставив в растворе определенную конечную концентрацию металла, необходимо создать в растворе соответствующий потенциал водорода, т. е., другими словами, необходимо поддерживать соответствующую величину pH раствора; без выполнения этого условия восстановления не происходит. Как видно из рис. 17, значение этого условия особенно велико при восстановлении металлов, нормальные потенциалы которых меньше нормального потенциала водорода.
Следует, однако, подчеркнуть, что природа явлений автоклавного, восстановления металлов водородом на самом деле много сложнее, вследствие чего соотношения, приведенные на рис. 17, имеют в известной мере формальный характер. Они не учитывают, в частности, изменений, вносимых явлениями перенапряжения водорода (поляризации) на потенциалы выделения металлов из раствора, гидролиза солей, комплексообразования, а также изменений, вносимых температурой, в результате влияния ее на перечисленные выше три фактора. Соответственно расчетные и фактические результаты процесса иногда совпадают довольно близко, иногда же заметно расходятся, как это убедительно иллюстрируется рис. 18.
Примеры, приведенные в табл. 2, свидетельствуют, что восстановление металлов из растворов простых солей происходит очень слабо: как только начинается восстановление по реакции (41), образуется эквивалентное количество кислоты, снижающее pH раствора до такой величины, при которой восстановление прекращается. Введение в раствор веществ, обладающих буферными свойствами, позволяет удерживать pH раствора на достаточно высоком уровне, что создает возможность восстановления большего количества металла. Комплексообразователи играют в процессе восстановления двоякую роль: те из них, которые повышают pH среды, но при высоких температурах связывают в комплексы небольшую часть простых ионов (как например, аммиак), позволяют восстанавливать металл весьма полно; вещества же, создающие благоприятный pH среды, но образующие прочные комплексные ионы (как например, цианистые соли), столь резко понижают концентрацию простых ионов металла, что делают невозможным восстановление последнего.

Когда в растворе присутствуют соли различных металлов, то порядок вытеснения их водородом определяется соотношением величин равновесных потенциалов реакций. Как показали В.В. Ипатьев и В.П. Теодорович, при значительной разнице в равновесных потенциалах двух возможных реакций сначала происходит вытеснение металла с большим потенциалом (например, количественное отделение мышьяка от сурьмы и висмута). При малом различии потенциалов вытеснение металлов происходит одновременно (например, сурьма и висмут). Эти закономерности наблюдаются при восстановлении металлов платиновой группы и в ряде других случаев (рис, 19). Селективное выделение металлов можно иллюстрировать примером восстановления никеля и кобальта в аммиачных средах: при указанном на графике (рис. 19) начальном соотношении содержаний этих металлов сначала выделяется около 95% никеля, осаждение же кобальта начинается лишь тогда, когда остаточная концентрация никеля снижается с 41 г/л примерно до 1,5—2 г/л.

При восстановлении многовалентных ионов иногда не удается получить металл в качестве конечного продукта. Это возможно, если в данных условиях потенциал водорода мал и восстановление заканчивается, образованием соединений промежуточной валентности или если соль металла низшей валентности неустойчива в данном растворителе и разлагается с образованием осадка низших окислов. Такие явления наблюдались при восстановлении ванадия из карбонатных растворов ванадата натрия, молибдена и вольфрама из раствора их аммонийных и натриевых солей, а также урана из карбонатных растворов.
В первом случае процесс протекает в две стадии:

Во втором случае восстановление каждого из металлов также оказывается многостадийным. Вначале выпадает черный осадок с валовой формулой МоО2. После частичного осаждения молибдена начинается со-осаждение голубовато-серого осадка с валовой формулой WO2. Фазовый и рентгеноструктурный анализ указывают на присутствие в каждом из этих осадков различных окислов, в частности при восстановлении молибдена в осадке помимо МоО2 констатированы также М04О11 и другие промежуточные окислы типа xМоО3*МоО2. Восстановление урана из содовых растворов протекает с образованием нерастворимого U3О8.
Интересные явления наблюдаются при восстановлении меди: в кислых растворах установлено одновременное присутствие в соизмеримых концентрациях ионов Сu+ и Сu2+ и в осадке металлической меди. При аммиачных растворах двухвалентный комплекс сначала полностью восстанавливается до одновалентного и только тогда начинается выделение металла.
Наконец, заслуживает внимания установленная ориентировочными термодинамическими расчетами принципиальная возможность получения некоторых трудновосстановимых металлов из растворов их окислов в расплавленных щелочах по общей схеме:

Все сказанное выше относится к статике процессов восстановления, металлов из растворов их солей при участии газов. Но процессы эти требуют обычно более жестких условий, чем процессы выщелачивания. Вот почему в данном случае особо существенны кинетика и механизм реакций восстановления, детальные исследования которых осуществлены в последнее время. Они выявили возможные пути снижения параметров процесса при сохранении высокой его скорости.
Изучение кинетики реакций восстановления водородом ванадия и урана из содовых растворов, меди в аммиачных средах и другие показали, что при энергичном перемешивании раствора, когда полностью устраняется диффузионный фактор, реакция восстановления имеет нулевой порядок и выражается общей формулой

Из этого уравнения видно, что реакция имеет ясно выраженный гетерогенный характер, причем в контролирующей скорость процесса стадии всегда участвует атомарный водород.
Как показали Халперн и другие, активация водорода происходит, как правило, не в растворе, а на твердых поверхностях, адсорбирующих молекулярный водород из раствора. Этим объясняется тот факт, что первые порции металла всегда выделяются на стенках, мешалке и других металлических частях автоклава, погруженных в раствор, поскольку твердые поверхности представляют собой своеобразные катализаторы. Чем больше размер поверхности, на которой происходит адсорбция и активация водорода (Н2⇔2Н), тем быстрее идет восстановление. Поэтому в промышленных условиях в растворы перед восстановлением вводят соответствующие твердые составляющие, обычно в виде тонкого порошка того металла, который подлежит восстановлению из данного раствора. Эффективность этого приема убедительно иллюстрируется рис. 20, показывающим, как улучшаются параметры процесса восстановления меди водородом из аммиачных растворов по мере увеличения количества введенного в раствор (перед восстановлением) порошка металлической меди при условии, что медь восстанавливается не менее чем на 98%.
Очевидно, что при подобном протекании процесса вновь восстановленный металл наращивается на металлических частичках, являющихся концентрами кристаллизации. В силу этого частички катализатора постепенно увеличиваются в размерах, особенно в тех случаях, когда один и тот же порошок участвует в нескольких последовательных операциях (рис. 21). Например, на заводе «Шерритт Гордон» частички никеля за 20—30 циклов восстановления вырастают с 1—3 до 70—150 мк.
Металлический катализатор в некоторых случаях уместно применять и при осаждении окислов.

Так, для ускорения восстановления ванадия и урана можно вводить в раствор никелевый порошок, эффективному использованию которого способствует то, что при трении частичек друг о друга, о стенки автоклава и мешалку отложившиеся окислы счищаются с поверхности никеля, освобождая ее для осаждения новых порций окислов. Выгруженную из автоклава пульпу пропускают через магнитный сепаратор: катализатор возвращают в процесс, а осадок низших окислов ванадия или урана фильтруют, промывают, сушат и направляют на дальнейшую переработку.
Переходя к вопросу о взаимосвязи между скоростью восстановления и составом раствора, следует отметить, что в общем случае увеличение концентрации солей снижает растворимость водорода, что приводит к снижению скорости восстановления. Но, как было отмечено выше, соли, имеющие буферные свойства, сдвигая равновесие реакции в нужном направлении, позволяют увеличивать степень восстановления металла. Таково, например, действие сульфата аммония в растворе медного купороса при восстановлении из него меди. Недавно было установлено, что присутствующие в аммиачных растворах ионы двухвалентного железа каталитически ускоряют восстановление никеля водородом и т. д.

Остается отметить своеобразие протекания процесса восстановления свинца из его сульфида, сульфата и окислов в водных растворах хлоридов или едкой щелочи. Сравнительно невысокая температура плавления свинца (327°) дает возможность проводить процесс при температуре 330—340° и общем давлении 150—170 ат (в том числе давлении водорода около 30 ат) и получать металл в жидком виде; при этом свинец хорошо отделяется от твердой фазы и собирается слоем на дне автоклава. Процесс протекает в две стадии, поскольку восстановлению свинца должно предшествовать растворение его твердых соединений. Низкий расход водорода (около 0,01 г на 1 г свинца) и указанные выше параметры чрезвычайно способствуют протеканию процесса, длительность которого составляет лишь десятки секунд. Концентрация свинца в растворе в ходе процесса не превышает десятых долей грамма в литре, почему обычные для гидрометаллургических процессов требования к соотношению жидкого и твердого здесь не играют существенной роли.
Презентация по химии "Электрохимическое и химическое восстановление металлов из растворов"

ЦЕЛЬ: получение покрытия из других металлов на
токопроводящих предметах электрическим током
и контактным вытеснением металлов из растворов
их солей более активными металлами
ЗАДАЧИ: 1) изучение условий проведения электролиза и их влияния
на процесс;
определение природы растворимых электродов;
демонстрация тесной межпредметной связи между химией
и физикой;
2) сопоставление окислительно-восстановительной
активности металлов в водных растворах и расположение
их в ряд активности;
3) ознакомление с практическим значением химических
процессов восстановления металлов

АКТУАЛЬНОСТЬ ВЫБРАННОЙ ТЕМЫ: методами химического и электрохимического восстановления осаждают защитные, декоративные, жаростойкие, коррозийно-устойчивые, износостойкие, токопроводящие покрытия, получают готовые изделия нужной формы (процесс гальванопластики), извлекают металлы из растворов, регенерируя таким образом металлы, получают порошки для последующего формирования из них металлоизделий или восстановления изношенных деталей
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ: подготовка и выступление на
научно-проектной конференции. Использовать материалы
работы на уроках химии в качестве дидактического материала при
изучении темы: Электролиз
МЕТОДЫ, ПРИМЕНЯЕМЫЕ ПРИ ВЫПОЛНЕНИИ РАБОТЫ:
изучение литературы по данной теме;
практическое применении различных способов получения покрытий
металлами на поверхности токопроводящих предметов;
наблюдение за результатами химических процессов на каждом
этапе, фотографирование с последующим описанием;
объяснение и обобщение результатов проведенных опытов

ПЛАН:
1. I ЧАСТЬ: ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ
1.1. Покрытие стального токопроводящего предмета (монеты)
слоем меди электрическим током с погружением в раствор
электролита
1.2. Нанесение на алюминиевый предмет (ложку) слоя меди
электрическим током без погружения в раствор электролита
1.3. Установление природы металлических стержней
1.4. Нанесение слоя цинка на стальную пластинку электрическим
током
2. II ЧАСТЬ: КОНТАКТНОЕ ВЫТЕСНЕНИЕ МЕДИ ИЗ РАСТВОРА
ПРИ ИСПОЛЬЗОВАНИИ РАЗЛИЧНЫХ ВОССТАНОВИТЕЛЕЙ
3. III ЧАСТЬ: ПРИМЕНЕНИЕ ПРОЦЕССОВ ВОССТАНОВЛЕНИЯ
МЕТАЛЛОВ
4. ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА

1. I ЧАСТЬ: ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ
1.1. Покрытие стального токопроводящего предмета (монеты) слоем меди электрическим током с погружением в раствор электролита
Электролиз - (от электро. и греч. lysis - разложение, растворение, распад), совокупность процессов электрохимического окисления-восстановления на погруженных в электролит электродах при прохождении через него электрического тока.
Анод – положительный электрод
Катод – отрицательный электрод
Особенность электролиза - пространственное разделение процессов окисления и восстановления: электрохимическое окисление происходит на аноде, восстановление - на катоде.

Электролиз может быть легко
осуществим при растворении в
воде солей, диссоциирующих на
ионы
CuSO4 → Cu²+ + SO4²‾.
Процессы окисления-
восстановления в растворах
проходят глубже, если среда
раствора кислая. Для повышения
рН раствора необходимо
добавить серную кислоту.
В качестве гальванической
ванны можно использовать
любую стеклянную емкость
такого размера, чтобы
покрываемый металлом
предмет свободно размещался в
ней и при этом не находился
вблизи от анода.

полюсу
Источника
питания. Монета
– катод. Медный
провод
соединен с
положительным
полюсом
источника
питания и
является в
настоящей цепи
анодом.
К
А
_
+
CuSO4
В качестве источника электропитания можно использовать как стационарный источник постоянного тока, так и электрическую батарейку, которая дает напряжение 4 – 10 В.
Монета с помощью проволоки присоединена к отрицательному

При проведении
электролиза электроды
должны быть погружены в
растворы, содержащие
ионы, т. е. в электролиты.
К
А

Площадь анода необходимо увеличить, наматывая на него
спиралью медную проволоку. Расстояние между электродами – не

Процессы, протекающие на электродах при электролизе растворов

А
К
Cu²+
Cu²+
На катоде в результате электролиза происходит восстановление ионов электролита. Катионы принимают электроны и превращаются в атомы К: Cu2+ + 2ē → Cu0
На аноде в результате электролиза происходит окисление молекул, принадлежащих материалу анода (анод растворяется)
А: Cu0 → Cu2+ + 2ē

Электролиз сводится к
переносу меди с анода на
катод
Cu2+ + Cu0 → Cu0 + Cu2+
Изменение окраски на
катоде протекает быстро: от
нескольких секунд до
нескольких минут.

В результате электролиза поверхность катода покрывается
пленкой осаждающегося металла: меняется ее цвет, увеличивается масса
катода в соответствии с 1-ым законом Фарадея: m = k • I • t
(масса вещества, которая выделилась при электролизе на катоде
прямо пропорциональна тому электричеству, который прошел сквозь
электролит в единицу времени t).

1.2. Нанесение на алюминиевый предмет (ложку) слоя меди электрическим током без погружения в раствор электролита

Поверхность алюминиевой ложки необходимо очистить от оксидной пленки наждачной бумагой и обезжирить раствором соды технической, затем ложку поместить в пустую стеклянную емкость и присоединить
К
проводом к отрицательному полюсу источника питания.

Медный провод необходимо распределить между щетинками
зубной щетки и другим концом соединить с «+» источника питания.
Необходимо приготовить насыщенный подкисленный раствор
медного купороса.

Между поверхностью обрабатываемой детали (катода) и медным
проводом (анода) всегда должен быть слой электролита, поэтому
импровизированную кисть необходимо помещать в раствор электролита
постоянно.

Во время работы медный провод не должен касаться ложки,
замыкать электрическую цепь должен раствор электролита.

Процесс детального покрытия ложки медью длился несколько минут. Избирательное нанесение медного покрытия применяется в дизайнерских проектах.

1.3. Определение природы металлических стержней

Необходимо
приготовить насыщенный
раствор электролита из
поваренной соли.
NaCl

Металлические
стержни необходимо
погрузить в раствор
электролита и подключить
к источнику питания.
А
К

Наблюдаю бурное выделение газа на катоде и небольшое
изменение цвета на аноде.
К
А

При дальнейшем проведении электролиза наблюдаю бурную
реакцию с выделением газа на электродах и все более
интенсивную серо-зеленую окраску вблизи анодной области.
К
А

В растворе без подкисления образуется зеленоватый
гелеобразный осадок.

При дальнейшем воздействии электрического тока осадок меняет цвет на коричневый.
Наблюдаемыми свойствами – придавать электролиту зеленый цвет вблизи анода – обладают ионы железа:
А: Fe0 → Fe2+ + 2ē
Fe(OH)2 при дальнейшем электролизе окисляется до Fe(OH)3
бурого цвета: А: Fe2+ → Fe3+ + ē
Т.к. в растворе присутствуют ионы хлора (NaCl → Na+ + Cl-),
параллельно с образованием осадка выделяется газ Cl2 со
специфической окраской и запахом: А: 2Cl- + 2ē → Cl2↑
На катоде в результате электролиза происходит восстановление
ионов электролита с образованием новых продуктов. Катионы принимают
электроны и превращаются в ионы более низкой степени окисления
К: Fe3+ + ē → Fe2+ (катод принял цвет осадка – серо-зеленый)
и 2H+ + 2ē → H2↑ из воды (выделение газа).

Вывод: данные стержни из стали - сплава на основе железа.
Сопутствующие выводы: масса анода уменьшилась, анод стал
тоньше, на его поверхности рыхлый слой Fe(OH)3 коричневого цвета из
раствора, я оставила его для более наглядного восприятия;
масса катода увеличилась, катод принял зеленовато-серый цвет
осадившегося Fe(OH)2 . Процесс длился два часа.
Краткое описание документа:
Презентация является приложением к исследовательской работе "Электрохимическое и химическое восстановление металлов из растворов". В ней содержится вся практическая часть проведенной работы и необходимая теоретическая. Презентация разделена на две части из-за большого объема и невозможности размещения на сайте.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
