Восстановление металлов угарным газом
Обновлено: 16.05.2024
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Понятие о металлургии: общие способы получения металловМеталлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию. Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.). Цветная металлургия — производство остальных металлов и их сплавов. Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь. Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора. Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов. Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность. Основные стадии металлургических процессов:
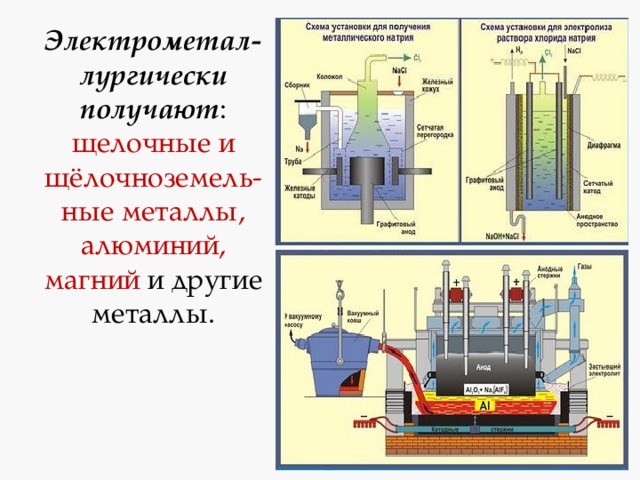
1. Нахождение металлов в природеБольшинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы. 2. Получение активных металловАктивные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами. Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях. Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция: 2NaCl = 2Na + Cl2 Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С: KCl + Na = K↑ + NaCl Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси): 2LiCl = 2Li + Cl2 Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция: Са + 2CsCl = 2Cs + CaCl2 Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С: Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция: Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C: 4BaO+ 2Al = 3Ba + Ba(AlO2)2 Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6: 3. Получение малоактивных и неактивных металловМеталлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают. 3.1. Обжиг сульфидовПри обжиге сульфидов металлов образуются оксиды: 2ZnS + 3O2 → 2ZnO + 2SO2 Металлы получают дальнейшим восстановлением оксидов. 3.2. Восстановление металлов углемЧистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия. Например , железо получают восстановлением из оксида углем: 2Fe2O3 + 6C → 2Fe + 6CO ZnO + C → Zn + CO Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов: CaO + 3C → CaC2 + CO 3.3. Восстановление металлов угарным газомОксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия. Например , железо можно получить восстановлением из оксида с помощью угарного газа: 3.4. Восстановление металлов более активными металламиБолее активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов: Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними. Алюмотермия – это восстановление металлов из оксидов алюминием. Например : алюминий восстанавливает оксид меди (II) из оксида: 3CuO + 2Al = Al2O3 + 3Cu Магниетермия – это восстановление металлов из оксидов магнием. CuO + Mg = Cu + MgO Железо можно вытеснить из оксида с помощью алюминия: При алюмотермии образуется очень чистый, свободный от примесей углерода металл. Активные металлы вытесняют менее активные из растворов их солей. Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция: 2AgNO3 + Cu = Cu(NO3)2 + 2Ag Медь покроется белыми кристаллами серебра. При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди: CuSO4 + Fe = FeSO4 + Cu При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца: 3.5. Восстановление металлов из оксидов водородомВодород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании. CuO + H2 = Cu + H2O 4. Производство чугунаЧугун получают из железной руды в доменных печах. Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар. В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее. Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю. Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает. Шихта — это железная руда, смешанная с флюсами. Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает: Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II): CO2 + С = 2CO Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III): Последовательность восстановления оксида железа (III): FeO + CO → Fe + CO2 Суммарное уравнение протекающих процессов: При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе. Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании: и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси: Химические свойства основных оксидов
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь. 1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении. CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид) 2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль: основный оксид + кислота = соль + вода основный оксид + кислотный оксид = соль При взаимодействии основных оксидов с кислотами и их оксидами работает правило: Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота). Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
3. Взаимодействие с амфотерными оксидами и гидроксидами. При взаимодействии основных оксидов с амфотерными образуются соли: основный оксид + амфотерный оксид = соль С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток. CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид) (чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.). Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут. 4. Взаимодействие оксидов металлов с восстановителями. При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ). Более подробно про окислительно-восстановительные реакции можно прочитать здесь. Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0. 4.1. Восстановление углем или угарным газом. Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании. FeO + C = Fe + CO
Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ: CaO + 3C = CaC2 + CO Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду: CuO + CO = Cu + CO2
4.2. Восстановление водородом . Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла) При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании. Например , оксид цинка взаимодействует с алюминием: 3ZnO + 2Al = Al2O3 + 3Zn но не взаимодействует с медью: ZnO + Cu ≠ Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
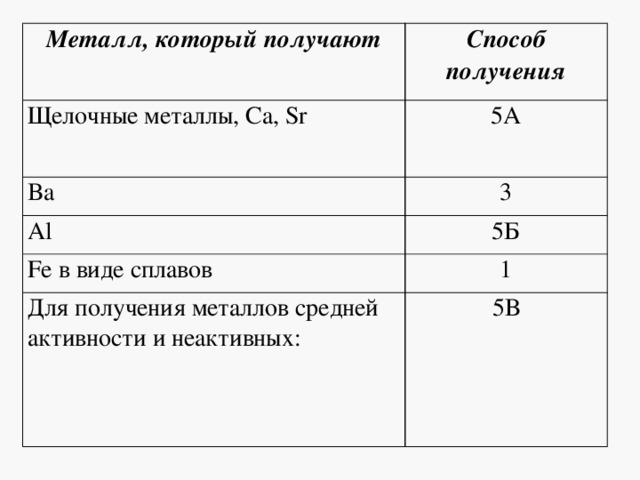
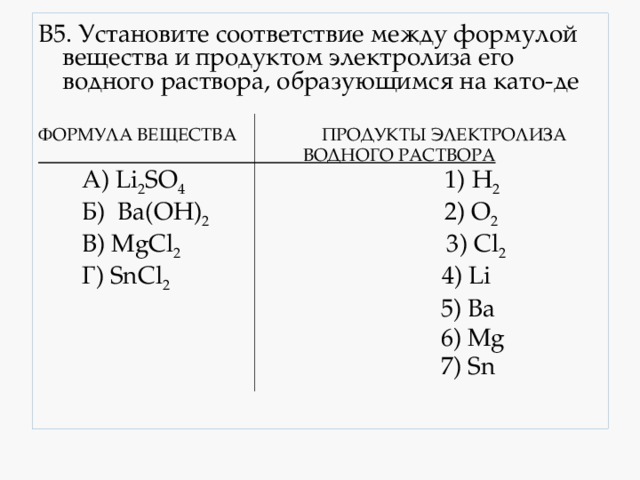
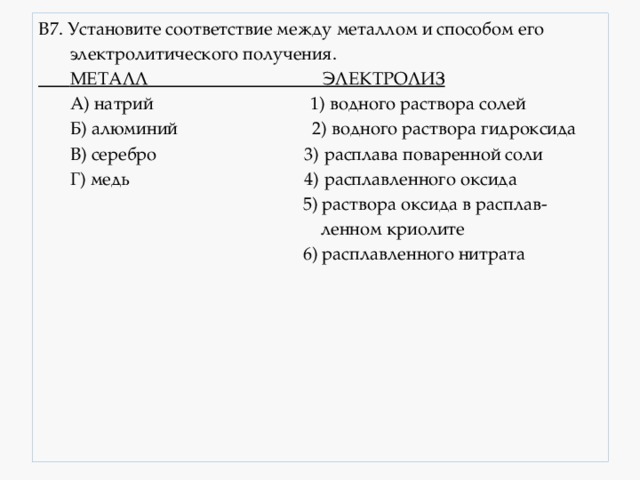
4.4. Восстановление аммиаком. Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре. Например , аммиак восстанавливает оксид меди (II): 3CuO + 2NH3 = 3Cu + 3H2O + N2 5. Взаимодействие оксидов металлов с окислителями. Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей. Например , оксид железа (II) можно окислить кислородом до оксида железа (III): Основные способы получения металлов электрометаллургические - электролиз раствора или расплава. Пирометал-лургически получают : чугун, сталь, медь, свинец, никель, хром и другие металлы. получение стали и чугуна Гидрометаллургически получают : золото, цинк, никель и некоторые другие металлы. Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др. Электрометал-лургически получают : щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы. Общие способы получения металлов 1. Восстановление металлов из оксидов углем или угарным газом Mе x O y + C = CO 2 + Me, 1. ZnO y + C t = CO + Zn Mе x O y + C = CO + Me, 2. Fe 3 O 4 + 4CO t = 4CO 2 + 3Fe 3. MgO + C t = Mg + CO Mе x O y + CO = CO 2 + Me Не подходит для металлов, образующих карбиды с углём. получают : Fe, Cu, Pb, Sn, Cd, Zn 2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид) 1 стадия – Mе x S y +O 2 = Mе x O y +SO 2 1. 2ZnS + 3O 2 t = 2ZnO + 2SO 2 ↑ 2 стадия – Mе x O y + C = CO 2 + Me или 2. MgCO 3 t = MgO + CO 2 ↑ 3 Алюмотермия ( в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида ) 1. 4SrO + 2Al t = Sr(AlO 2 ) 2 + 3Sr Mе x O y + Al = Al 2 O 3 + Me получают: Mn, Cr, Ti, Mo, W, V и др 2. 3MnO 2 + 4Al t = 3Mn + 2Al 2 O 3 3. 2Al + 3BaO t = 3Ba + Al 2 O 3 (получают барий высокой чистоты) 4. Водородотермия - для получения металлов особой чистоты 1. WO 3 + 3H 2 t = W + 3H 2 O↑ Mе x O y + H 2 = H 2 O + Me 2. MoO 3 + 3H 2 t = Mo + 3H 2 O↑ Получают металлы большей чистоты : Cu, Ni, W, Fe, Mo, Cd, Pb Восстановление металлов электрическим током (электролиз) А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей ( хлоридов ): 2NaCl расплав, электр. ток. 2 Na + Cl 2 ↑ CaCl 2 расплав, электр. ток. Ca + Cl 2 ↑ расплавов гидроксидов : 4NaOH расплав, электр. ток. 4Na + O 2 ↑ + 2H 2 O (. используют изредка для Na) Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов): 2Al 2 O 3 расплав в криолите, электр. ток. 4Al + 3 O 2 ↑ В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных: 2CuSO 4 +2H 2 O раствор, электр. ток. 2Cu + O 2 + 2H 2 SO 4 Металл, который получают Способ получения Щелочные металлы, Ca, Sr Fe в виде сплавов Для получения металлов средней активности и неактивных: Примеры заданий по теме : «Общие способы получение металлов» Задания с выбором ответа ( А10, А24, А29). А1. Реакция возможна между 1) Ag и K 2 SO 4 (р-р) 3) Mg и SnCl 2 (р-р) 4) Ag и CuSO 4 (р-р) А2. Какой из металлов вытесняет железо из сульфата железа (II)? 1) Cu 2) Zn 3) Sn 4) Hg A3. Какой из металлов вытесняет медь из сульфата меди (II)? 1) Zn 2) Ag 3) Hg 4) Au A4. Формула вещества, восстанавливающего оксид меди (II) - это 1) CO 2 2) H 2 3) HNO 3 4) Cl 2 A5. Формула вещества, не восстанавливающего оксид железа (III) - 1) HCl 2) Al 3) H 2 4) C А6. Для осуществления превращений в соответствии со схемой: Al(OH) 3 → AlCl 3 → Al необходимо последовательно использовать 1) хлор и водород 2) хлорид натрия и водород 3) хлороводород и цинк 4) соляную кислоту и калий А7. Пирометаллургический метод получения металлов отражает реакция: 1) HgS + O 2 → Hg + SO 2 2) CuSO 4 + Fe → FeSO 4 + Cu 3) 2NaCl (ток)→ 2Na + Cl 2 4) CuSO 4 + Zn → ZnSO 4 + Cu А8. Гидрометаллургический метод получения металлов отражает реакция: 4) AlCl 3 + 3K → Al + 3KCl А9. В качестве восстановителя при выплавке железа в промышленности наиболее часто используют А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с 1) N 2 2) H 2 S 3) Fe 4) Fe 2 O 3 Задания с кратким ответом (В3) В1. При электролизе раствора AgNO 3 на катоде выделяется 3) серебро и водород 4) кислород и водород В2. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА Б) NaNO 3 2) Ag, O 2 , HF B) Pb(NO 3 ) 2 3) H 2 , O 2 Г) NaF 4) Pb, O 2 , HNO 3 5) H 2 , NO 2 , O 2 6) NaOH, H 2 , F 2 В3. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРА А) HgCl 2 1) металл, хлор Б) AlCl 3 2) водород, хлор, гидроксид В) Hg(ClO 4 ) 2 металла Г) Na 2 SO 3 3) водород, кислород 4) металл, кислород, кислота 5) металл, сернистый газ 6) водород, сернистый газ В4. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора А) нитрат цинка 1) цинк, кислород, азотная кислота Б) бромид цинка 2) водород, кислород В) бромид калия 3) водород, оксид азота (IV) Г) нитрат калия 4) цинк, бром 5) водород, бром, гидроксид калия 7) калий, оксид азота (IV) В5. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, образующимся на като-де А) Li 2 SO 4 1) H 2 В) MgCl 2 3) Cl 2 В6. Верны ли следующие суждения о промышленных способах получения металлов? А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах. Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны В7. Установите соответствие между металлом и способом его А) натрий 1) водного раствора солей Б) алюминий 2) водного раствора гидроксида В) серебро 3) расплава поваренной соли Г) медь 4) расплавленного оксида 5) раствора оксида в расплав- 6) расплавленного нитрата В8. Установите соответствие между металлом и способом его электролитического получения. А) калий 1) расплавленного нитрата Б) магний 2) водного раствора гидроксида В) медь 3) расплава хлорида Г) свинец 4) расплавленного оксида 5) раствора оксида в расплавленном криолите 6) водного раствора солей В9. Установите соответствие между металлом и способом его электролитического получения. А) хром 1) водного раствора солей В) литий 3) расплава соли Г) барий 4) расплавленного оксида Задания с развёрнутым ответом (С2) С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Cu → Cu(NO 3 ) 2 → Cu(OH) 2 → Х → Сu → CuSO 4 Укажите условия протекания реакций. C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота. AcetylЧитайте также:
|