Восстановление водорода из воды металлами
Обновлено: 02.07.2024
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
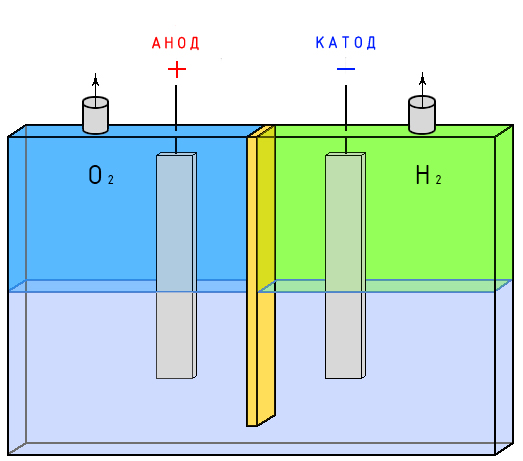
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
На аноде окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Получение водорода в промышленности и в лаборатории
Задача 785.
Почему в периодической системе элементов водород относят как к I, так и к VII группе?
Решение:
Атом водорода содержит один электрон, его электронная конфигурация имеет вид: 1s 2 . Поэтому атом водорода способен как отдавать, так и присоединять по одному электрону. Таким образом, образом водород проявляет двойственную химическую природу, как окислительную, так и восстановительную способность. В большинстве реакций водород выступает в качестве восстановителя, образуя соединения, в которых степень его окисленности равна +1. в реакциях с активными металлами водород выступает в качестве окислителя, степень окисленности его при этом равна -1. Итак, водород, отдавая электрон, проявляет сходство с металлами I-й группы главной подгруппы периодической системы химических элементов, а, присоединяя электрон, - с неметаллами VII-й группы главной подгруппы. Поэтому водород в периодической системе обычно помещают в главной подгруппе I-й группы и, в тоже время, в скобках, помещают в главной подгруппе VII-й группы.
Задача 786.
Как получают водород в промышленности и в лаборатории? Привести уравнения реакций.
Решение:
а) Получение водорода в промышленности:
1. Получение синтез-газа:
3. Электролиз водного раствора едкого натра или едкого калия. Используют 25% NaOH или 34% КОН. Электроды изготавливают из листового никеля. При этом на катоде выделяется водород, а на аноде – кислород:
Катодный процесс: 2Н2О + 2 = Н2 + 2ОН - ;
Анодный процесс: 4ОН - - 4 = О2 + 4Н + .
4. Вытеснение водорода из воды различными металлами. Метод основан на том, что активные металлы вытесняют водород из воды, например, натрий и кальций разлагают воду при обычных условиях, магний – при нагревании, цинк – при накаливании с водяным паром, железо – при нагревании около 700 о C . Чаще всего используют в промышленности для получения водорода так называемый железо-паровой метод:
5. Получение водорода из природного газа. В промышленности по этому методу природный газ смешивают с кислородом и водяным паром при нагревании данной смеси до 800-900 0 С в присутствии катализатора (пароводяная и кислородная конверсия):
6. Метод выделения водорода из коксового газа или из газов переработки нефти. Метод основан на глубоко охлаждении газовой смеси, при котором все газы кроме водорода сжижаются – водород остаётся в газовой фазе, которую под давлением собирают в баллоны.
7. Метод получения водорода при получении сажи из природного газа:
8. Метод получения водорода при пропускании паров воды над раскалённым углем при температуре 10000 о C (водяной газ, содержащий до 86% угарного газа и водорода):
б) Получение водорода в лабораторных условиях:
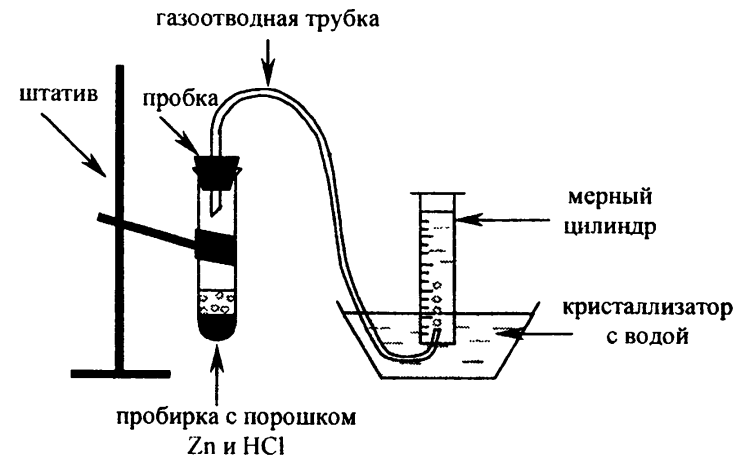
1. Метод растворения цинка в холодной соляной кислоте или в разбавленной серной кислоте:
2. Растворение алюминия с сильными щелочами:
3. Электролиз раствора КОН (электроды из листового никеля):
4. Действие порошком алюминия на кипящую воду в присутствии нескольких капель разбавленного перманганата калия:
5. В полевых условиях водород получают из смеси (порошок ферросилиция с сухим Са(ОН)2 и NaOH). При поджигании данной смеси сначала она начинает тлеть, а затем наблюдается выделение водорода:
Смесь называется гидрогенит.
Задача 787.
Можно ли для электролитического получения водорода использовать в качестве электролита водные растворы H2SO4, K2,SO4 KCl, CuSO4, NaOH? Ответ обосновать.
Решение:
Электродные потенциалы калия, натрия и меди соответственно равны -2,92 В, -2,714 В и +0,337 В, а водородного электрода в кислой в щелочной и в нейтральной средах соответственно равен 0,00 В, -0,83 В и -0,41 В. При этом на катоде происходит электрохимическое выделение водорода в зависимости от условий среды:
Катодный процесс:
В кислой среде: 2H + + 2 = Н2 ↑ ;
В щелочной или нейтральной среде: 2Н2О + 22 = H2 + 2ОН - .
Следовательно, при электролизе H2SO4 будет разряжаться ионы водорода и выделяться газообразный водород.
При электролизе K2SO4 и KCl происходит электрохимическое восстановление воды, результатом которого будет выделение водорода и гидроксид-ионов, потому что электродный потенциал калия (-2,92 В) значительно электроотрицательнее, чем потенциалы -0,41В и -0,83 В.
При электролизе раствора CuSO4 будет происходить разряд ионов меди и, при этом на катоде выделится металлическая медь, потому что электродный потенциал меди значительно положительнее, чем потенциал водородного электрода.
При электролизе NaOH происходит электрохимическое восстановление воды, результатом которого будет выделение водорода и гидроксид-ионов, потому что электродный потенциал натрия (-2,714 В) значительно электроотрицательнее, чем потенциалы -0,41 В и -0,83 В.
Таким образом, для электрохимического получения водорода можно использовать растворы H2SO4, K2SO4 KCl и NaOH.
Задача 788.
Железо-паровой метод получения водорода основан на обратимой реакции:
Fe + 4H2O = Fe3O4 + 4H2 ↑ . В каких условиях следует осуществлять этот процесс, чтобы реакция протекала до практически полного окисления железа?
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции следует, что из четырёх молекул парообразной воды образуется четыре молекулы газообразного водорода, т.е. реакция протекает без изменения числа молей газообразных веществ, поэтому равновесие системы не нарушается при изменении давления. В данном случае при удалении продукта реакции водорода из реакционной зоны равновесие системы согласно принципу Ле Шателье сместится вправо, в сторону увеличения образования водорода. Но лучше всего выводить из реакционной системы твёрдый продукт Fe3O4, что будет способствовать смещению равновесия вправо, если железную окалину направлять на регенерацию, допустим посредством накаливания окалины в струе паровоздушной смеси и, затем, возвратить образуемое металлическое железо в реакционную зону. Избыток металлического железа будет способствовать ускорению реакции и, следовательно, увеличению продукта реакции. Таким образом, отведение водорода и регенерация железа способствуют протеканию реакции до практически полного окисления металлического железа.
Водород: химия водорода и его соединений
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1sАтом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
вода H2O и др. летучие водородные соединения (HCl, HBr)
кислые соли (NaHCO3 и др.)
основания NaOH, Cu(OH)2
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Добыча водорода из воды: методы и получение в домашних условиях

Очистка воды
Наука настолько быстро развивается, что ученые уже научились разными способами получать такой химический элемент как водород. В первую очередь, это делается для хорошей альтернативы в топливе для машин в будущем, чтобы автомобили больше не заправлять бензином. «H» станет отличной альтернативой для всего, если эта сфера поднимется на более высокий уровень.
Его преимущество в экологичности!

На данный момент существует несколько способов по добыче этого элемента. Ниже будут рассмотрены все эти методы получения, а так же как добыть водород в домашних условиях.

Способы получения водорода
Методы получения веществ бывают промышленными и лабораторными. В промышленности их получают в больших объемах, а в лабораторных в небольших.
Электролизный метод
К промышленному методу относится электролиз воды. Электролиз, если объяснять просто — это разложение веществ под действием электрического тока. Сам процесс достаточно сложный.

Стоит знать, что такое электролиз, чтобы можно было разбираться дальше в этой теме. Это окислительно-восстановительный процесс, протекающий, который протекает на электродах (катиона и аниона), протекающий под действием электрического тока. Окислительно-восстановительный процесс предполагает, что после реакции несколько химических элементов из положительных станут отрицательными (анионами), и наоборот (катионами).
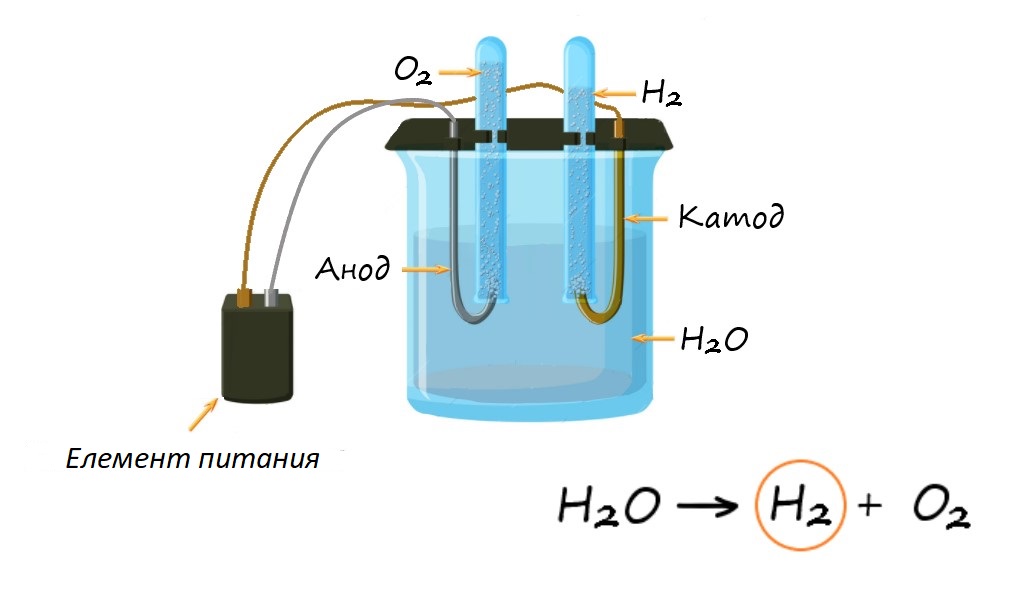
Разобравшись со значением названия, теперь нужно понять, как получают водород! Электролиз — 1 из самых простых способов.
Берется емкость. В нее заливается сода с водой. Внутрь кладутся 2 электрических элемента. 1 должен быть анодом (плюс), а второй (минус). Затем через содовый раствор пропускается электрический ток. Под действием тока водород отправляется к катоду, а вода (Н2О) к аноду.

Восстановление водяного пара металлами
Что происходит в этом случае? Металл взаимодействует с водой при нагревании. Чтобы жидкость превратилась в пар ее нужно нагреть минимум до 100 градусов. Металл+вода = реакция замещения. Образуется оксид и газообразный водород. Но вступать в такие реакции для образования впоследствии водорода могут далеко не все элементы металлов. Существует химическая таблица, в которой химические вещества расположены друг за другом в порядке уменьшения концентрации (слева направо). Все вещества, находящиеся после водорода (Н) не могут вступать в реакции замещения и, соответственно, не имеют возможности впоследствии образовывать газообразный водород.
Как получить нужный элемент?
Выделение водорода происходит следующим образом (с научной точки зрения):
Zn + H2O = ZnO + H2.

В начале был цинк и вода. Этот металл может участвовать в реакциях, т.к. он активнее водорода (находится левее). В результате Zn вытеснил Н из Н2О, встав на его место. Водород же остался «одиноким», простым веществом, выделившись в газообразном состоянии.
Точно такой же пример можно привести с магнием:
Mg + H2O = MgO + H2.

Видео по теме:
Из метана
Метан — органическое соединение (главный компонент природного газа). При окислении метана при наличии кислорода и воды при нагревании образуется углекислый газ(2СО2) и газ-водород (6Н2). Оба газа на выходе бесцветные, не имеющие вкуса и запаха.
Такую смесь необходимо разделить на отдельные компоненты (очистить водород от примесей углекислого газа). Для этого 2СО2 пропускают через известковую воду Са(ОН)2. Углекислый газ пропускают через бесцветную жидкость. В результате образуется нерастворимый остаток карбоната кальция. Н пройдет через воду без изменений. После пропускания известковая жидкость мутнеет. Это происходит из-за остаточных явления после 2СО2.
Восстановление водяного пара коксом
Кокс — это уголь (С). При взаимодействии кокса с водяным паром (с водой при нагревании) образуется оксид угарного газа и газообразный водород. Этот метод, в первую очередь, используется для получения Н. Этот способ используется для синтеза многих других веществ. Такую реакцию называют синтез-газ, т.е. получение 2-х газообразных элементов.

Мембранная сепарация
Тоже очень интересный метод выведения газообразного неметалла. Процесс довольно простой в описании.
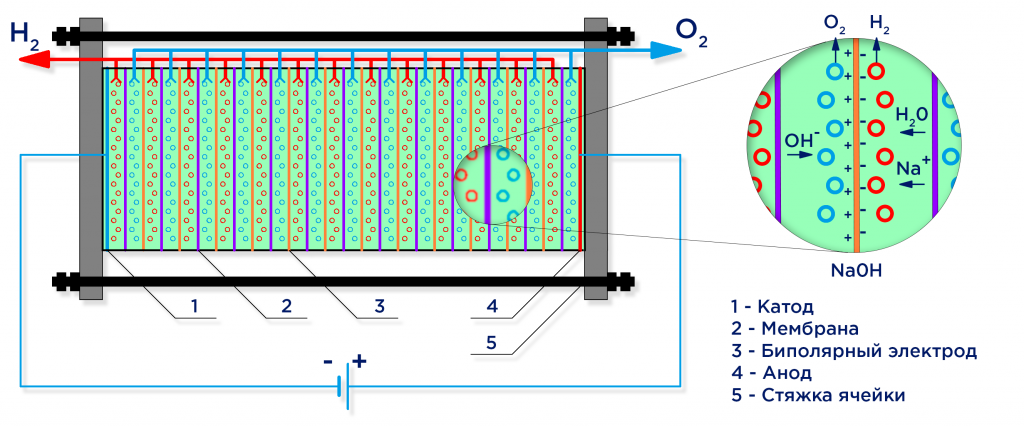
СО (угарный газ), Н2О(воду) и СО2 (углекислый газ) пропускают через палладиевые решетки. Они состоят палладиево-серебряного сплава. Только 3 элемента могут пройти сквозь решетку. На выходе ученые получают 99% долгожданный водород.
Способ адсорбции
Для него в работу берутся твердые вещества (всем привычный активированный уголь). Его задача поглотить собой газовые смеси, чтобы на выходе получить Н2. Конечно, в работе также используют циклические адсорбенты (молекулярные сита), позволяющие в дальнейшем выделиться нужному веществу.

Свое название метод получил из-за адсорбентов — тех самых твердых веществ.
Взаимодействие металлов с разбавленными кислотами
Данный метод уже относится к лабораторному, т.е. на выходе уже не получится такого большого количества водорода.
Все та же реакция замещения. Металл может вступать в реакцию замещения, образуя соль кислоты и образуется газообразный Н. Отличия в том, что на место воды в химической формуле стоят кислоты (разбавленные):
Zn +HCl = ZnCl + H2

Mg + H2SO4 (серная кислота разбавленная) = MgSO4 + H2
Чаще всего в лаборатории используют цинк и магний, поэтому именно эта химическая формула наиболее популярна.
Электролиз воды
Последний способ, которым добывают водород — электролиз воды. Реакция происходит очень просто. Вода под действием электрического тока расщепляется на отдельные простые элементы воды и водорода. Отсюда и название (электролиз):

Это все способы получения водорода! Далее вы узнаете, как можно самостоятельно, своими руками создать настоящий прибор-генератор для получения Н2.
Добыча водорода в условиях домашнего хозяйства
Хоть получение водорода и кажется чем-то нереальным, его можно получить у себя дома на кухне. Но для этого вам понадобится электролизер. Без него никак! Ниже представлена инструкция, как его сделать!
P.S. В самом конце, когда вы уже запустите свое устройство — водород будет выделяться в воде в виде пузырьков, скапливающихся на ее поверхности!
Выбор электролизера
Электрозер — это емкость, в которую заливается содовый раствор и помещаются 2 электрода. Т.е. это основа, где в будущем будут получать водород. Для домашнего эксперимента нет смысла рассматривать сложные конструкции, требующие наличие разных инструментов, у большинства людей которых просто нет.

Также, на кухне мало у кого найдутся колбы для перемещения воды по ним, металлические крюки и прочие материалы. Поэтому ниже будет представлен способ, как можно собрать настоящий электролизер из простых инструментов, продающихся в стройматериалах. Перед началом работы ознакомьтесь с техникой безопасности!
Изготовление аппарата своими руками
Самый легкий и примитивный способ, как можно получить водород в домашних условиях — это с помощью электролиза. Чтобы создать генератор — ничего особенного не понадобится. Следуйте пошаговой инструкции.

- В качестве электродов (катиона и аниона) используйте лезвия.

- Чтобы произошло разделение электродов — нарежьте пластиковую трубку с помощью канцелярского ножа на кусочки.


- Внутри, где есть отверстие в само металлическое изделие проденьте болт, предварительно закрутив на нем изолятор.


- С другой стороны лезвия точно также закрутите еще 1 болт. Возьмите пару болтиков и закрепите выходные контакты из медной проволоки к электродам.

- Контакты крепко закрепите, поставив их в вертикальное положение. С помощью изоляции для проводов изолируйте медную проволоку.

- Зажгите спичку и подержите контакты с изоляцией над огнем, чтобы их стенки соединились друг с другом.

- В крышке из-под банки проделайте 2 отверстия дрелью (наметьте карандашом, где нужны дырочки, поставив на крышку сверху концы от проволоки электрода).


- Проденьте проволоку с изоляцией как можно глубже в крышку, зафиксировав и в таком виде с помощью горячего клея.

- Закрутите крышку на банке. Основная часть генератора уже готова.

- Просверлите в банке еще 1 отверстие для выхода водорода.

- Отрежьте от медицинского шприца переднюю часть и закрепите ее на 3-ем отверстие.

- Закрепите пластиковый кончик на горячий клей.

- Налейте в банку воду и крепко закрутите крышку.

- Возьмите еще 1 новый шприц со смещенным центром. На его верхушке просверлите отверстие.


- Закройте снизу шприц заглушкой, накрепко приклеенной.

- Саму деталь (водяной затвор) от генератора приклейте на скотч на банку.

- Возьмите пластиковую трубку и соедините выход водорода с водяным затвором.

- Далее понадобится вольтметр с «крокодилами», цепляющимися за контакты.

- При питании в 33 В начинает вырабатываться водород.
- Разряд можно поднять до 50 В, чтобы процесс получения водорода из воды протекал быстрее.

Теперь вы знаете, как сделать устройство для получения Н.
Но стоит помнить о технике безопасности!

В квартире
Наука настолько быстро развивается, что ученые уже научились разными способами получать такой химический элемент как водород. В первую очередь, это делается для хорошей альтернативы в топливе для машин в будущем, чтобы автомобили больше не заправлять бензином. «H» станет отличной альтернативой для всего, если эта сфера поднимется на более высокий уровень. Его преимущество в экологичности!
На данный момент существует несколько способов по добыче этого элемента. Ниже будут рассмотрены все эти методы получения, а так же как добыть водород в домашних условиях.

К промышленному методу относится электролиз воды. Электролиз, если объяснять просто — это разложение веществ под действием электрического тока. Сам процесс достаточно сложный.
Разобравшись со значением названия, теперь нужно понять, как получают водород! Электролиз — 1 из самых простых способов.

P.S. В самом конце, когда вы уже запустите свое устройство — водород будет выделяться в воде в виде пузырьков, скапливающихся на ее поверхности!
Электролизер — это емкость, в которую заливается содовый раствор и помещаются 2 электрода. Т.е. это основа, где в будущем будут получать водород. Для домашнего эксперимента нет смысла рассматривать сложные конструкции, требующие наличие разных инструментов, у большинства людей которых просто нет.
Самый легкий и примитивный способ, как можно получить водород в домашних условиях — это с помощью электролиза. Чтобы создать генератор — ничего особенного не понадобится.
Следуйте пошаговой инструкции.

- С другой стороны лезвия точно также закрутите еще 1 болт.
- Возьмите пару болтиков и закрепите выходные контакты из медной проволоки к электродам.

- Контакты крепко закрепите, поставив их в вертикальное положение.
- С помощью изоляции для проводов изолируйте медную проволоку.
- Возьмите еще 1 новый шприц со смещенным центром.

Теперь вы знаете, как сделать устройство для получения Н. Но стоит помнить о технике безопасности!
Читайте также:
