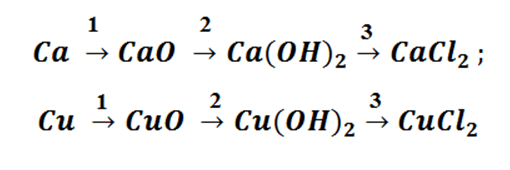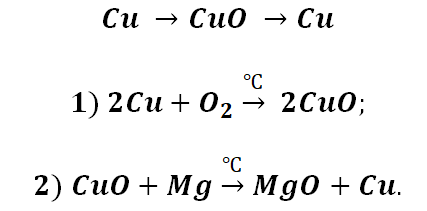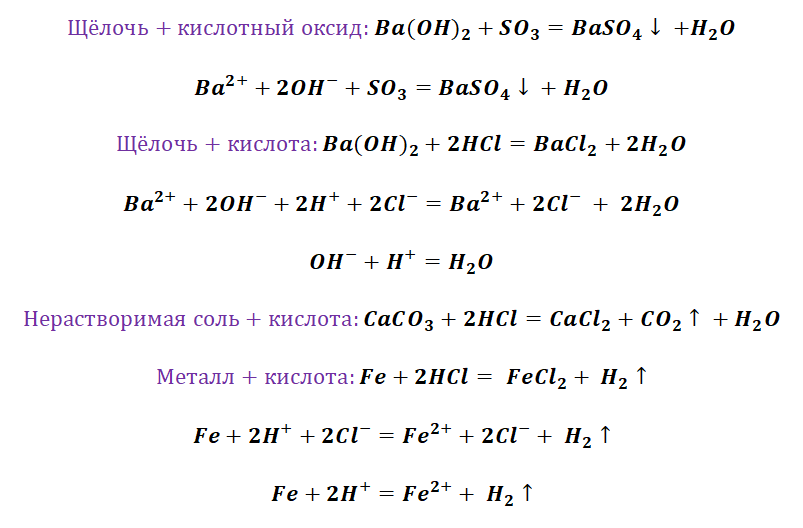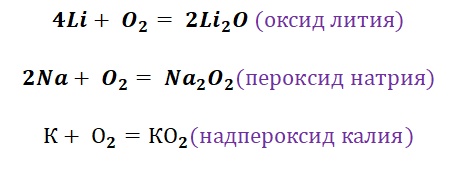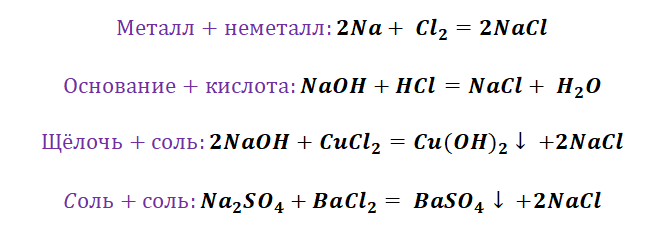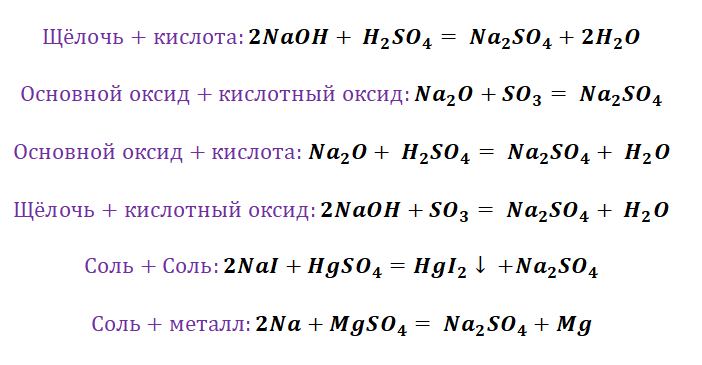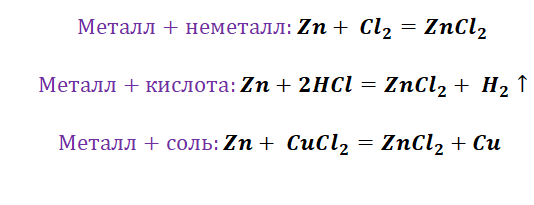Все цепочки превращений металлов
Обновлено: 19.05.2024
2. Краткая история открытия и происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Важнейшие соединения: оксиды, пероксиды, гидроксиды, соли.
6. Качественные реакции на катионы щелочных металлов.
7. Нахождение в природе.
8. Основные методы получения.
П о л о ж е н и е в т а б л и ц е Д. И. М е н д е л е е в а,
с т р о е н и е а т о м а
К щелочным металлам относят элементы Ia группы периодической системы Д.И.Менделеева: литий, натрий, калий, рубидий, цезий, франций. Свое название эти металлы получили потому, что при взаимодействии с водой они и их оксиды образуют щелочи. Щелочные металлы относятся к s-элементам и имеют один валентный электрон на внешнем уровне (ns 1 ). Сверху вниз в подгруппе радиус атома увеличивается, энергия ионизации уменьшается, способность отдавать валентный электрон увеличивается, поэтому восстановительная способность также увеличивается. Самым активным из щелочных металлов является франций (радиоактивен). Все щелочные металлы хранят под слоем керосина или минерального масла из-за их высокой реакционной способности. В соединениях щелочные металлы всегда проявляют степень окисления +1, преобладающий тип связи – ионная.
К р а т к а я и с т о р и я о т к р ы т и я
и п р о и с х о ж д е н и е н а з в а н и я
Название лития произошло от греческого слова «камень», поскольку впервые он был обнаружен в виде гидроксида в составе минерала (камня). Название натрия происходит от древнеегипетского «натрон», так называли любую щелочь. Название калия происходит от арабского названия щелочей – «алкали», ранее калий называли «поташ», но это название не прижилось. Рубидий получил свое название из-за цвета спектральных линий (лат. «рубидус» – красный). Цезий также обязан своим названием цвету линии спектра – латинским словом «цезиус» (голубой, светло-серый) в древности обозначали голубизну ясного неба. Франций был назван французской исследовательницей М.Перей, открывшей этот элемент, в честь ее родины.
Ф и з и ч е с к и е с в о й с т в а
Все щелочные металлы – мягкие серебристые вещества с характерным блеском на свежесрезанной поверхности. Они имеют низкие температуры плавления и кипения, хорошо проводят тепло и электрический ток. Литий, натрий и калий легче воды. Сверху вниз по подгруппе плотность металлов увеличивается, а температуры плавления уменьшаются.
Х и м и ч е с к и е с в о й с т в а
Все щелочные металлы отличаются высокой реакционной способностью. Они реагируют с водородом, кислородом и другими неметаллами:
Щелочные металлы реагируют с водой, образуя щелочи:
Натрий и другие щелочные металлы вытесняют водород из кислот-неокислителей:
2Na + 2HCl = 2NaCl + H2.
C кислотами-окислителями образуются другие продукты восстановления:
Металлический натрий вытесняет калий из расплава KCl при 450 °С:
KCl + Na = NaCl + K.
О к с и д ы щ е л о ч н ы х м е т а л л о в – твердые вещества белого (оксиды лития и натрия), желтого (оксиды калия и рубидия) и оранжевого (оксид цезия) цвета. Они обладают ярко выраженными основными свойствами. Эти оксиды реагируют с водой, кислотами, амфотерными и кислотными оксидами, кислородом:
Оксид лития получают прямым взаимодействием простых веществ, остальные оксиды получают другими способами – при нагревании смеси гидроксида, пероксида и надпероксида с избытком соответствующего металла в отсутствие кислорода, например:
П е р о к с и д ы щ е л о ч н ы х м е т а л л о в – желтовато-белые порошки. Они реагируют с водой, неметаллами, кислотами, угарным и углекислым газами. В ОВР пероксиды проявляют окислительно-восстановительную двойственность, например:
Г и д р о к с и д ы щ е л о ч н ы х м е т а л л о в – твердые белые вещества, хорошо растворимые в воде. Щелочи проявляют ярко выраженные основные свойства. При движении вниз по подгруппе от Li к Fr растворимость в воде их щелочей и сила оснований увеличиваются. Эти гидроксиды являются сильными электролитами, реагируют с кислотами, кислотными оксидами, некоторыми неметаллами, амфотерными оксидами и гидроксидами, солями:
Все гидроксиды щелочных металлов, кроме гидроксида лития, термически устойчивы. Гидроксид лития при прокаливании разлагается на оксид и воду:
Гидроксиды щелочных металлов можно получить электролизом водных растворов хлоридов, взаимодействием металла или его оксида с водой или некоторыми обменными реакциями:
Большинство с о л е й щ е л о ч н ы х м е т а л л о в хорошо растворимы в воде, исключение составляют некоторые соли лития. Растворы солей щелочных металлов, образованных слабыми кислотами, имеют щелочную реакцию среды вследствие гидролиза. Cоли, образованные сильными кислотами, не гидролизуются, например:
Соли и другие соединения щелочных металлов изменяют окраску пламени, что используется в химическом анализе. Ионы лития окрашивают пламя в карминово-красный цвет, ионы калия – в фиолетовый, ионы натрия – в желтый, ионы рубидия – в беловато-розовый, ионы цезия – в фиолетово-красный цвет.
В п р и р о д е щелочные металлы встречаются только в виде соединений вследствие своей высокой химической активности. Важнейшие соединения: поваренная соль NaCl, сильвинит NaCl•KCl, мирабилит, или глауберова соль, Na2SO4•10H2O, селитры – NaNO3, KNO3.
Щ е л о ч н ы е м е т а л л ы п о л у ч а ю т электролизом расплавов солей (чаще хлоридов) или щелочей, например:
Тривиальные названия распространенных солей: поваренная (каменная) соль NaCl, кальцинированная сода Na2CO3, каустическая сода NaOH, кристаллическая сода Na2CO3•10H2O, питьевая сода NaHCO3; марганцовка KMnO4, бертолетова соль KClO3, глауберова соль Na2SO4•10H2O, калийная селитра KNO3, поташ K2CO3, растворимое стекло или силикатный клей – смесь силикатов натрия, калия.
Тест по теме «щелочные металлы»
В промышленности металлический натрий может быть получен:
а) взаимодействием раствора хлорида натрия с металлическим калием;
б) электролизом расплава гидроксида натрия;
в) восстановлением оксида натрия водородом;
г) электролизом раствора гидроксида натрия.
2. Какой металл может плавать на поверхности воды? (возможно более одного варианта ответа.)
а) Осмий; б) алюминий;
в) литий; г) калий.
3. Из перечисленных солей выберите ту, которая гидролизуется с образованием раствора, имеющего рН > 7:
а) сульфид свинца; б) нитрит свинца;
в) йодид натрия; г) сульфид калия.
4. Ионы калия придают окраске пламени цвет:
а) желтый; б) фиолетовый;
в) карминово-красный; г) оранжевый.
5. При электролизе раствора фосфата калия образуются следующие продукты реакции:
а) на катоде – водород, на аноде – кислород, в растворе – фосфат калия;
б) на катоде – калий, на аноде – фосфорная кислота, в растворе – вода;
в) на катоде – водород, на аноде – фосфорная кислота, в растворе – гидроксид калия;
г) на катоде – калий и водород, на аноде – кислород, в растворе – фосфорная кислота.
6. Какой объем раствора хлорида натрия с молярной концентрацией 3 моль/л и плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей поваренной соли 10%?
а) 56,7 мл; б) 200 мл; в) 94,2 мл; г) 315 мл.
7. Сумма коэффициентов в реакции взаимодействия калия с избытком сильно разбавленного раствора азотной кислоты равна:
а) 30; б) 29; в) 7; г) 12.
8. При растворении 10,8 г гидрида щелочного металла в воде выделяется 10,08 л газа (н.у.). Металл, входящий в состав гидрида, – это:
а) литий; б) натрий;
в) калий; г) рубидий.
9. Коэффициент перед восстановителем в ОВР между нитритом калия и дихроматом калия в сернокислом растворе равен:
а) 1; б) 2; в) 3; г) 4.
10. Какое вещество является природным источником калия?
а) надпероксид калия; б) гидроксид калия;
в) нитрат калия; г) гидрид калия.
Ключ к тесту
Задачи и упражнения по теме «Щелочные металлы»
Хлорид натрия карбонат натрия хлорид натрия гидроксид натрия натрий сульфат натрия хлорид натрия.
2. Калий гидроксид калия гидрокарбонат калия карбонат калия сульфат калия хлорид калия гидросульфат калия.
3. Хлорид натрия гидроксид натрия карбонат натрия гидрокарбонат натрия нитрат натрия.
4. Хлорид натрия гидроксид натрия карбонат натрия гидроксид натрия натрий нитрат натрия.
5. Гидроксид калия хлорид калия нитрат калия нитрит калия хлорид калия.
6. Натрий пероксид натрия оксид натрия гидроксид натрия хлорат натрия хлорид натрия нитрат натрия нитрит натрия.
7. Хлорид натрия натрий гидрид натрия гидроксид натрия гидросульфит натрия.
У р о в е н ь А
1. Образец бинарного соединения натрия с элементом пятой группы содержит 4,14 г натрия и 4,5 г другого элемента. Назовите это соединение.
Ответ. Арсенид натрия Na3As.
2. При действии избытка воды на 1,38 г металла выделился газ, занимающий при н.у. объем 672 мл. Определите металл.
По закону эквивалентов:
где газ – водород, Э(М) – эквивалент металла.
Если валентность металла I, то Ar(M) = 23, металл – натрий Na.
Если валентность металла II, то Ar(M) = 46, такого металла нет.
3. Найдите массу соли, образующейся при сжигании 11,2 г лития в 20 л хлора (н.у.).
4. Через склянку, содержащую раствор гидроксида натрия массой 80 г, пропустили избыток углекислого газа, в результате чего масса раствора увеличилась на 8,8 г. Найдите массовую долю гидроксида натрия в исходном растворе.
5. Какая масса 40%-го раствора гидроксида натрия необходима для получения 212 г карбоната натрия, если доля выхода продукта реакции составляет 80% от теоретически возможного?
6. При электролизе 400 г 20%-го раствора хлорида калия получен раствор гидроксида калия. Через этот раствор пропустили избыток углекислого газа. Найдите массу соли, образовавшейся в растворе, если доли выхода продуктов описанных реакций составляют 80% и 75% от теоретически возможного.
У р о в е н ь Б
1. Масса щелочного металла, необходимого для получения его бромида, в 1,395 раза больше, чем масса этого металла, необходимая для получения его йодида. Определите металл, если известно, что массы полученных галогенидов одинаковы.
2. Образец натрия массой 2,3 г опустили в 5%-й раствор гидроксида натрия. После окончания реакции массовая доля гидроксида натрия в растворе стала равна 10%. Найдите массу 5%-го раствора гидроксида натрия.
3. При добавлении смеси лития с гидридом лития к 200 г 5%-го раствора гидроксида лития образовался 10%-й раствор гидроксида лития. Найдите массу смеси лития с гидридом лития, если известно, что количества веществ ее компонентов одинаковы.
200 г 5%-го раствора LiOH содержат m0(LiOH) = 10 г и 190 г H2O.
Уравнения протекающих реакций:
Обозначим (Li) = (LiH) за x моль.
Массовая доля полученного раствора 1(р-ра) = 10%, или 0,1; 1(р-ра) = m1(LiOH)/ m0(р-ра).
Общая масса гидроксида лития: m1(LiOH) = m0(LiOH) (10 г) + ma(LiOH) (в реакции а, 24х г) +
+ mб(LiOH) (в реакции б, 24х г).
Масса нового раствора: m1(р-ра) = m(Li) (7х г) + m(LiH) (8х г) + m0(р-ра) (200 г) – m(Н2)
(в реакции а, 0,5х г) – m(Н2) (в реакции б, 0,5х г).
Отсюда х = 0,2146 моль.
m(Li) = •M(Li) = 0,2146•7 = 1,5 г,
m(LiH) = •M(LiH) = 0,2146•8 = 1,7 г.
Масса исходной смеси Li и LiH:
4. При действии избытка углекислого газа на 32,9 г неизвестного соединения металла с кислородом образовалось твердое вещество А и выделился газ В. Вещество А растворили в воде и добавили избыток раствора нитрата бария, при этом выпало 27,58 г осадка. Газ В пропустили через трубку с раскаленной медью, масса трубки при этом увеличилась на 6,72 г. Установите формулу исходного соединения.
1. В четырех пробирках находятся водные растворы сульфида, сульфита, сульфата и силиката натрия. Как с помощью одного реактива можно распознать содержимое каждой пробирки? Ответ подтвердите уравнениями реакций.
Ответ. Реактив – кислота HCl.
2. Простое вещество, газ А желто-зеленого цвета с резким запахом реагирует с серебристо-белым металлом В, плотность которого меньше плотности воды. В результате образуется вещество С, окрашивающее пламя в коричнево-красный цвет. При действии на твердое вещество С концентрированной серной кислотой при нагревании выделяется бесцветный газ D с резким запахом, хорошо растворимый в воде. Определите вещества А, В, С, D, напишите уравнения перечисленных реакций.
Ответ. А – Cl2, B – Li, C – LiCl, D – HCl.
3. В четырех пробирках находятся растворы веществ: техническая сода, растворимое стекло (или силикатный клей), каустическая сода, серная кислота. Предложите наиболее рациональный путь определения каждого из этих веществ.
Ответ. Определить среду растворов универсальным бумажным индикатором,
а затем к щелочным растворам добавить кислоту HCl.
4. С какими из данных веществ будет взаимодействовать оксид калия: сернистый газ, вода, ортофосфорная кислота, гидроксид натрия, сульфат железа(III), йодоводородная кислота. Напишите уравнения возможных реакций.
5. Вещество А – мягкий серебристо-белый металл, легче воды. При взаимодействии вещества А с простым веществом В образуется соединение С, растворимое в воде с образованием щелочного раствора. При обработке вещества С соляной кислотой выделяется газ D с неприятным запахом и образуется соль, окрашивающая пламя горелки в фиолетовый цвет. Идентифицируйте вещества, напишите уравнения реакций.
Все цепочки превращений металлов

Для удобства пользователей и возможности быстрого нахождения реакций.
Кроме того, реакции и цепочки превращений, относящиеся к определенному разделу химии (ОВР, кислоты-соли-основания, комплексные соединения. ) частично находятся в этих темах.
Всем успеха!
Задача 1
Cl2 → ClF → ClF3 → ClF5 → HClO3 → КClO3 → KClO4 → Cl(-) → Cl2
Cl2 + ClF3 → 3 ClF
ClF + F2 → ClF3
ClF3 + F2 → ClF5
ClF5 + 3 H2O → HClO3 + 5 НF
HClO3 + КОН (разб.) → КClO3 + H2O
KClO3 + H2O -(электролиз)→ KClO4 + Н2↑
KClO4 -(600°С)→ KCl + 2O2↑ , KCl -(растворение в воде)→ Cl(-) + К(+)
2Cl(-) + F2 → Cl2 + 2F(-)
Задача 2
MnO2+HCl → A(газ при t=0°)+Ca(OH)2 → Б+CO2 → A+KI → В+KOH(при t) → Г+AgNO3 → Д(осадок)
Решение:
MnO2 + 4 HCl (конц.) → MnCl2 + Cl2↑ [A] + 2 H2O
2 Cl2 + 2 Ca(OH)2 (хол.) → Ca(ClO)2 [Б] + CaCl2 + 2 H2O
Ca(ClO)2 + CO2 + 2 H2O → СаСО3 + 2 HClO - в этой реакции хлор [A] в одну стадию не получится, для этого нужно к полученной HClO добавить конц. сильную кислоту, напр., HCl или H2SO4:
HClO + HCl (конц.) → Cl2↑ [A] + H2O
Или сразу к Ca(ClO)2 вместо СО2 добавить конц. сильную кислоту:
Ca(ClO)2(тв) + 4 HCl (конц.) → CaCl2 + 2 Cl2↑ + 2 H2O
Cl2 + 2 KI → I2 [В] + КCl
3 I2 + 6 KOH (конц, гор) → KIO3 + 5KI [Г] + 3H2O
KI + AgNO3 → AgI↓ [Д] + КNO3
Задача 4
Какие оксиды можно получить при термическом разложении каждого из веществ: Fe(OH)2, H2SO4, Ca(OH)2 ? Напишите уравнение реакции.
Решение:
Fe(OH)2 → FeO + Н2О
H2SO4(безводн.) → H2O + SO3
Ca(OH)2 → CaO + Н2О
Задача 5
Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Записать уравнения.
Решение:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
NaAlO2 + CO2 + 2 H2O → Al(OH)3↓ + NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
Al2O3 + Na2CO3 → 2NaAlO2 + CO2↑
Задача 6
Be →Be(NO3)2→ Be(OH)2→K2BeO2→BeSO4
Решение:
3Be + 8HNO3 = 3Be(NO3)2 + 2NO↑ + 4H2O
Be(NO3)2 + 2KOH = Be(OH)2↓ + 2KNO3
Be(OH)2 + 2KOH = K2BeO2 + 2H2O
K2BeO2 + 2H2SO4 = BeSO4↓ + K2SO4 + 2H2O
Задача 7
Cl2 → HClO → NaClO → NaClO3 → KClO3 → KClO4 → HClO4 → Cl2O7
Решение:
Cl + 2NaOH (хол.) → NaCl + NaClO + H2O
HClO + NaOH (разб.) → NaClO + H2O
3NaClO -(30-50°С)→ NaClO3 + 2NaCl
NaClO3 + KOH -(0°С)→ KClO3 + NaOH
KClO3 + H2O -(электролиз)→ KClO4 + Н2↑
KClO4 + H2SO4 (конц.) → НClO4↑ + К2SO4
3НClO4 (безводн.) -(0-20°С)→ Cl2O7 + НClO4∙H2O↓
Задача 9
MgCO3 → MgCl2 → Mg(OH)2 → MgSО4
Задача 10
CuSO4 → Cu(OH)2 → CuO → Cu
Задача 11
ZnCl2 → Zn(OH)2 → ZnCl2
Zn(OH)2 → Na2ZnO2
Задача 12
N2H2 что за вещество?
Ответ:
а-3, б-1, в-4, г-2
сполучення (соединения) - из нескольких веществ получается только одно,
розкладу (разложения) - из одного получается несколько,
замiщення (замещения) - из простого и сложного - другие простое и сложное,
обмiну (обмена) - из двух сложных - другие два сложных.
Задача 14
Ланцюжок
кальцій сульфід→каліцій нітрат→кальцій нітрит→кальцій сульфат
Решение:
CaS → Ca(NO3)3 → Ca(NO2)3 → CaSO4
1. CaS + 4НNO3 (конц.) → Ca(NO3)3 + S↓ + 2NO2↑ + 2H2O
2. Ca(NO3)2 -(400-500°C) → Ca(NO2)2 + O2↑
3. Ca(NO2)2 (насыщ.) + H2SO4 (конц.) → CaSO4↓ + NO2↑ + NO↑ + H2O
Задача 15
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
алюминий → нитрат алюминия → алюминат натрия → гидроксид алюминия → оксид алюминия → метаалюминат магния;
Решение:
Al + 6 HNO3(конц.) → Al(NO3)3 + 3 NO2↑ + 3 H2O
Al(NO3)3 (тв.) + 4NaOH (тв.) → NaAlO2 + 3NaNO3 + 2H2O (при сплавлении, ок. 1000°C)
NaAlO2 + 2H2O(гор.) → NaOH + Al(OH)3↓
2Al(OH)3 → Al2O3 + 3H2O (ок. 600°C)
MgO + Al2O3 → Mg(AlO2)2
Задача 16
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
силикат кальция → оксид кремния (IV) → силикат натрия → кремний → тетрафторид кремния.
Решение:
Есть несколько силикатов кальция с общей формулой хCaO∙уSiO2, в школе, как правило, обозначается как метасиликат CaSiO3.
CaSiO3 + 2HCl → CaCl2 + SiO2 + H2O (при нагревании)
SiO2+2NaOH(расплав или гор. конц.) → Na2SiO3+H2O
Na2SiO3 → Si ?? не знаю такой реакции, но можно в 2 стадии:
1) Na2SiO3 + 2HCl → NaCl + SiO2↓ + H2O
2) SiO2 + 2Mg → Si + 2MgO (ок. 1000°C без доступа воздуха)
Si + 2F2 (г) → SiF4 (горение кремния во фторе)
Ответ:
Замещение, ОВР, экзотермическая, гетерогенная.
Задача 18
Как из образца медного купороса, содержащего радиоактивный изотоп серы S35, получить меченый этой серой сульфид железа (II), не загрязняя его другими изотопами? Написать уравнения реакций.
Решение:
Чтобы не загрязнить меченый сульфид железа (II) другими изотопами серы, нельзя применять никакие серосодержащие реагенты, кроме имеющегося медного купороса.
Поэтому реакции типа CuSO4 + Н2S не подойдут - Н2S содержит высокий процент распространенного в природе изотопа серы S32 и др. изотопы.
Можно так, например:
CuSO4 + ВаСl2 = ВаSO4↓ + CuСl2
ВаSO4 + 4CО = ВаS + 4СО2↑ (600°С)
ВаS +2НСl = ВаСl2 + Н2S↑
H2S + FeO = FeS + H2O (500°C)
Задача 19
Сколько простых веществ указано в следующим перечне:
озон, азот, вода, пирит, сажа, графит, карбин, карбид?
A)1. Б)5, В)3, Г)2
Взаимопревращения между классами веществ
Наверняка у каждого из Вас есть семейный альбом, где есть фото родителей, бабушек, дедушек, прабабушек. А возможно у кого-то есть сведения о предках не одного поколения, и это всё отображается в виде генетического дерева. Правомерный вопрос, к чему эти сведения и химия? Однако и в химии есть, так называемые, прародители (металлы и неметаллы), с которых путём химических превращений, были получены новые классы соединений и между ними существует генетическая связь.
План урока:
Почему связь между классами веществ считается генетической
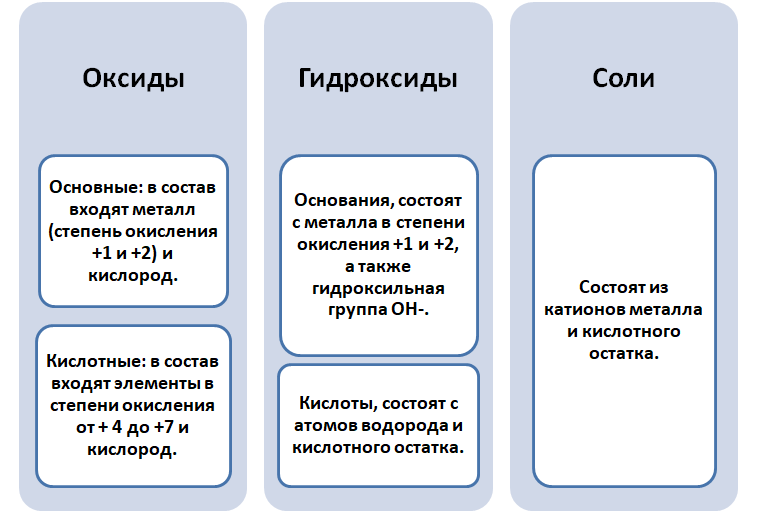
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
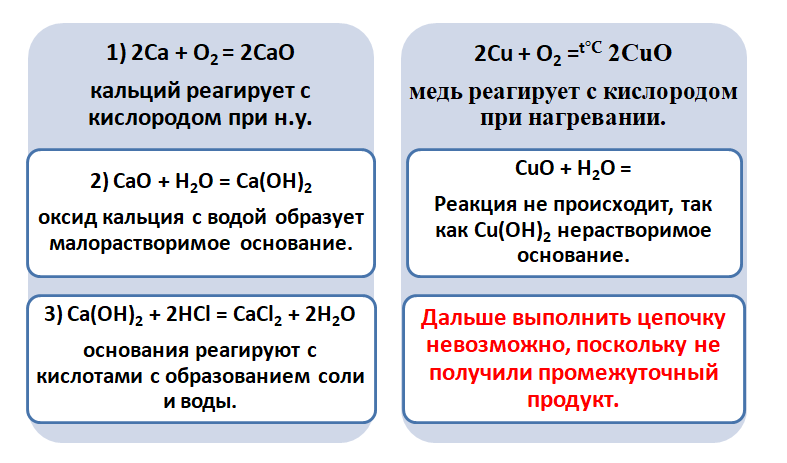
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
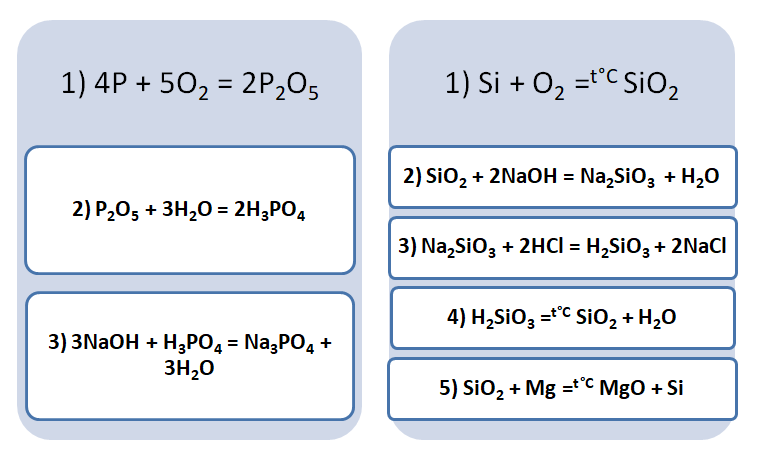
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
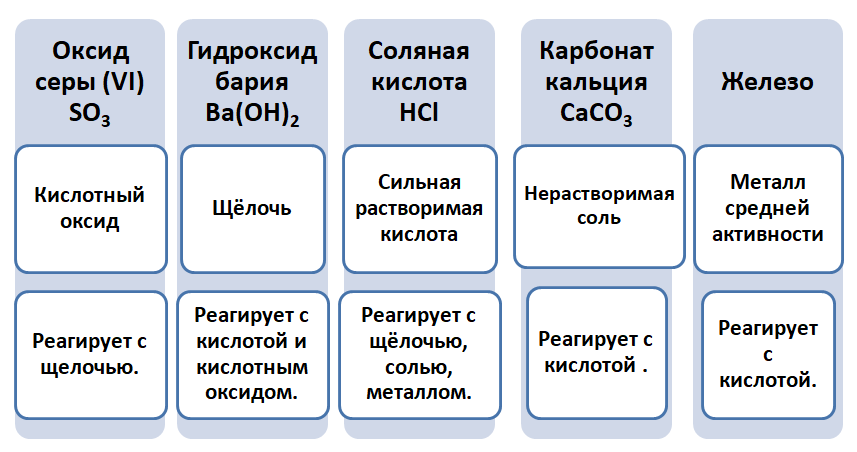
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
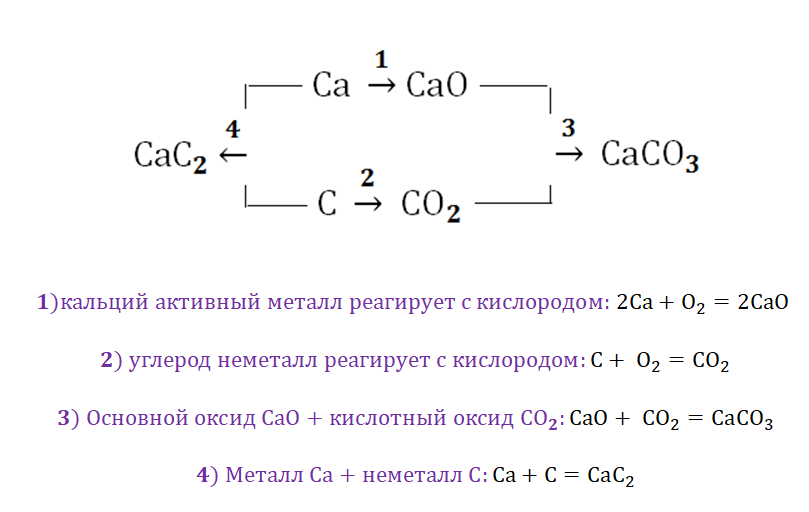
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
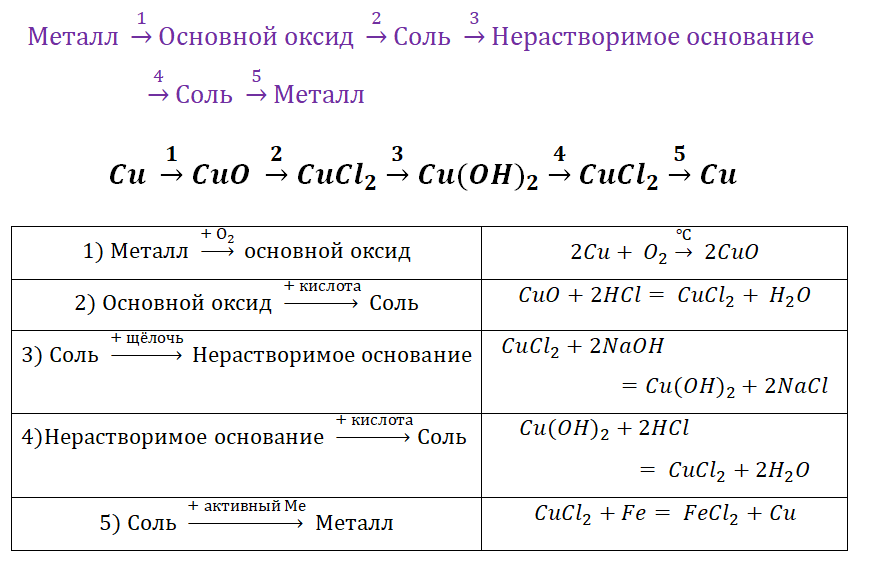
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Читайте также: