Все металлы имеют кристаллическое строение
Обновлено: 17.05.2024
В технике под металлами понимают вещества, обладающие комплексов металлических свойств: характерным металлическим блеском, высокой электропроводностью, хорошей теплопроводностью, высокой пластичностью.
Кристаллические решетки. Все вещества в твердом состоянии могут иметь кристаллическое или аморфное строение. В аморфном веществе атомы расположены хаотично, а в кристаллическом — в строго определенном порядке. Все металлы в твердом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой,
На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток. В кубической объемно-центрированной решетке (рис. 2, а) атомы расположены в ушах ячейки и один атом в центре куба.
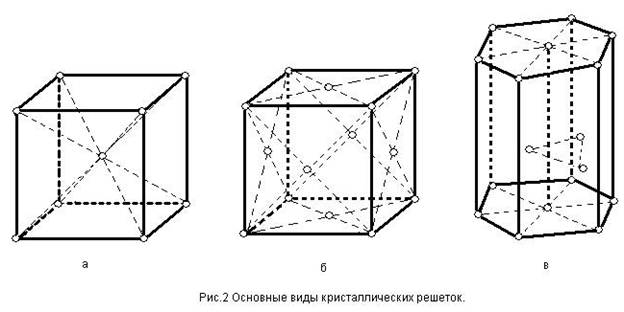
Такую решетку имеют хром, вольфрам, молибден и др. В кубической гранецентрированной решетке (рис. 2, б) атомы расположены в вершинах куба и в центре каждой грани. Эту решетку имеют алюминий, медь, никель и другие металлы. В гексагональной плотноупакованной решетке (рис. 2, в) атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома в середине призмы. Такой тип решетки имеют магний, цинк и некоторые другие металлы.
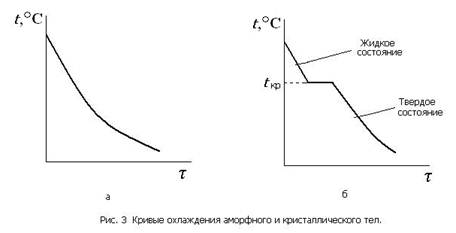
Кристаллизация металлов. Процесс образования в металлах кристаллической решетки называется кристаллизацией. Для изучения процесса кристаллизации строят кривые охлаждения металлов, которые показывают изменение температуры (t) во времени (τ). На рис. 3 приведены кривые охлаждения аморфного и кристаллического веществ. Затвердевание аморфного вещества (рис. 3, а) происходит постепенно, без резко выраженной границы между жидким и твердым состоянием- На кривой охлаждения кристаллического вещества (рис. 3, б) имеется горизонтальный участок с температурой tкр, называемой температурой кристаллизации. Наличие этого участка говорит о том, что процесс сопровождается выделением скрытой теплоты кристаллизации. Длина горизонтального участка — это время кристаллизации.
Кристаллизация металла происходит постепенно. Она объединяет два процесса, происходящих одновременно: возникновение центров кристаллизации и рост кристаллов. В процессе кристаллизации когда растущий кристалл окружен жидкостью, он имеет правильную геометрическую форму. При столкновении растущих кристаллов их правильная форма нарушается (рис. 4). После окончания кристаллизации образуются кристаллы неправильной
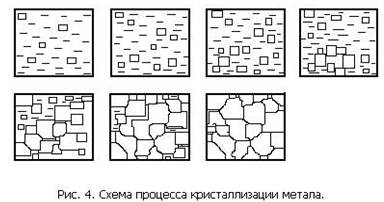
формы, которые называются зернами или кристаллитами. Внутри каждого зерна имеется определенная ориентация кристаллической решетки, отличающаяся от ориентации решеток соседних зерен.
Полиморфизм. Некоторые металлы в зависимости от температуры могут существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением. Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре. Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Важное значение имеет полиморфизм железа. На рис. 5 изображена кривая охлаждения железа.
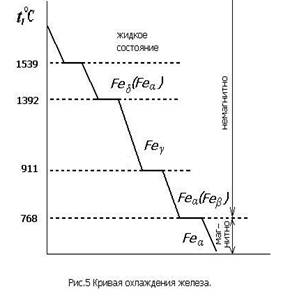
Полиморфные превращения характеризуются горизонтальными участками на кривой охлаждения, так как при них происходит полная перекристаллизация металла. До 911°С устойчиво Feα, имеющее кубическую объемноцептрированную решетку. В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ. Остановка на кривой охлаждения при 768 °С связана не с полиморфным превращением, а с изменением магнитных свойств. До 768 °С железо магнитно, а выше — немагнитно.
Дефекты кристаллического строения. Реальный металлический кристалл всегда имеет дефекты кристаллического строения. Они подразделяются на точечные, линейные и поверхностные (рис. 6).
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а), а также замещенные атомы примеси (рис. 6, б) и внедренные атомы (рис. 6, в) которые могут быть как примесными, так и атомами основного металла.
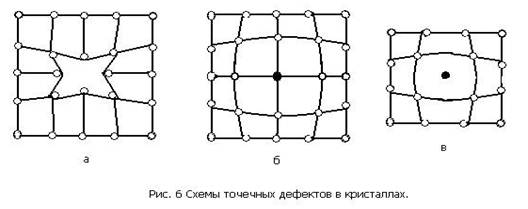
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями. Краевая дислокация (рис. 7) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости.
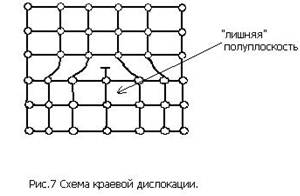
Поверхностные дефекты малы только в одном измерении. К ним относятся, например, границы между отдельными зернами или группами зерен.
Наклеп и рекристаллизация. При пластической деформации изменяется не только форма и размеры металла, но также его внутреннее строение и механические свойства. Зерна разворачиваются, деформируются и сплющиваются, вытягиваясь в направлении деформации. Образуется волокнистая структура. При этом прочность и твердость металла повышаются, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом.
Волокнистое строение и наклеп могут быть устранены при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве (до 300…400 °С для железа). Но волокнистая структура при этом сохраняется. При нагреве до более высокой температуры в металле происходит образование новых равноосных зерен. Этот процесс называется рекристаллизацией. Наклеп при этом снимается полностью.
Температура, при которой начинается процесс рекристаллизации называется температурой рекристаллизации. Абсолютная температура рекристаллизации Тp связана с абсолютной температурой плавления простой зависимостью:
где а — коэффициент, зависящий от состава и структуры металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3…0,4, для сплавов а = 0,5…0,6.
Если деформирование металла происходит при температуре, которая выше температуры рекристаллизации, то наклеп после деформации не возникает. Такая деформация называется горячей. При горячей деформации идут одновременно процессы упрочнения и рекристаллизации. Деформация, которая происходит ниже температуры рекристаллизации называется холодной.
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
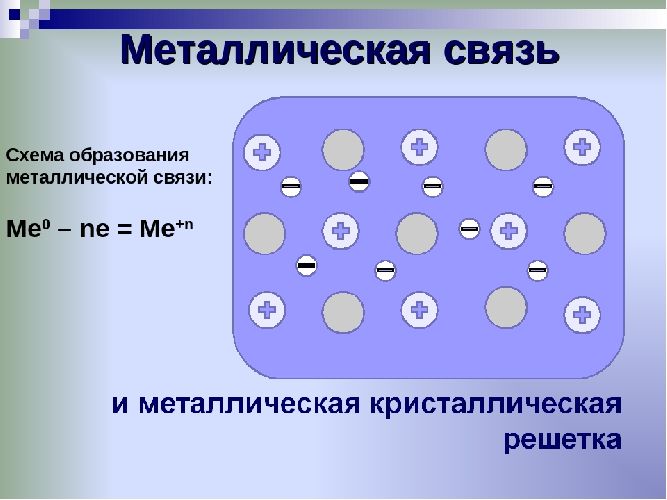
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
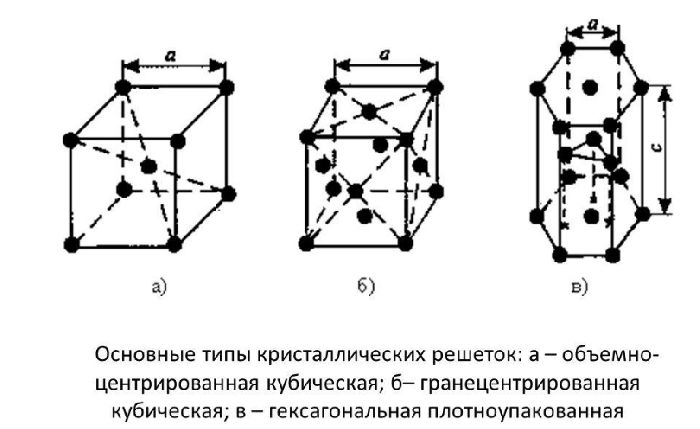
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
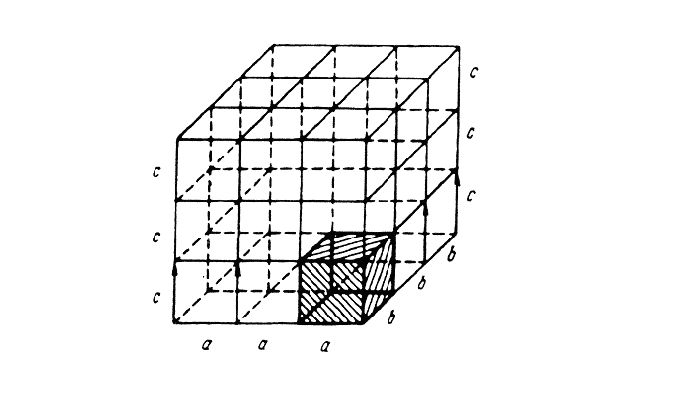
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Металлы — один из самых распространенных веществ в материальной культуре человека. Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений. В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.

В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники. В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций. Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.

Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец
Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платина Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий Сканидий Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.

Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.

Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.

Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.

Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.

Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму. Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны. Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;

Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
Все металлы в твердом состоянии имеют кристаллическое строение. Атомы в твердом металле расположены упорядочение и образуют кристаллические решетки (рис. 1).
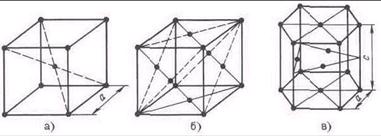
Рис. 1. Схемы кристаллических решеток: а – объемно-центрированная кубическая; б –гранецентрированная; в – гексагональная плотноупакованная
Кристаллическая решетка представляет собой наименьший объем кристалла, дающий полное представление об атомной структуре металла, и носит название элементарной ячейки.
Для металлов характерны кристаллические решетки трех видов: кубическая объемно-центрированная (ОЦК), в которой атомы расположены по вершинам элементарной ячейки и один в ее центре; кубическая гранецентрированная (ГЦК), в которой атомы расположены по вершинам элементарной ячейки и в центрах ее граней; гексагональная плотноупакованная (ГПУ), представляющая собой шестигранную призму, в которой атомы расположены в три слоя.
Свойства материала зависят от вида кристаллическ4ой решетки и параметров, ее характеризующих:
1) межатомное расстояние, измеряется в ангстремах 1А°=10 -8 см
2) плотность упаковки (базис решетки – число частиц, приходящихся на одну элементарную ячейку). Кубическая простая – Б1, ОЦК – Б2, ГЦК – Б4, ГПУ – Б6.
3) координационное число (КЧ) – максимальное количество атомов равноудаленных и находящихся на ближайшем расстоянии от атома, взятоого за точку отсчета. Кубическая простая – КЧ=6, ОЦК – КЧ=8, ГЦК – КЧ=12, ГПУ – КЧ=12.
Свойства материала, определенные в направлении передней плоскости и диагональной плоскости, отличаются – это явление называется анизотропия, т. е. неравномерность свойств в различных направлениях. Этим свойством обладают все металлические материалы. Аморфные тела обладают свойством изотропии, т.е. имеют одинаковые свойства во всех направлениях.
Кристаллические решетки могут иметь различные структурные несовершенства, существенно изменяющие свойства материала. Реальный единичный кристалл всегда имеет свободную (наружную) поверхность, на которой уже вследствие поверхностного натяжения решетка искажена.
Дефекты внутреннего строения подразделяют на точечные, линейные и плоскостные.
К точечным дефектам относятся вакансии (когда отдельные узлы кристаллической решетки не заняты атомами); дислоцированные атомы (если отдельные атомы оказываются в междоузлиях) или примесные атомы, количество которых даже в чистых металлах весьма велико. Около таких дефектов решетка будет упруго искаженной на расстоянии одного-двух периодов (рис. 2, а).
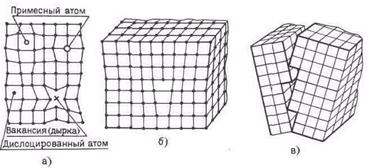
Рис. 2. Дефекты кристаллической решетки: а - точечные; б - линейные; в - плоскостные
Линейные дефекты малы в двух измерениях и достаточно велики в третьем. К таким дефектам относятся смещение атомных плоскостей или дислокации и цепочки вакансий (рис. 2,б). Важнейшим свойством таких дефектов являются их подвижность внутри кристалла и активное взаимодействие между собой и с другими дефектами.
Изменение кристаллической решетки материала возможно под воздействием внешних факторов, а именно температуры и давления. Некоторые металлы в твердом состоянии в различных температурных интервалах приобретают разные кристаллические решетки, что всегда приводит к изменению их физико-химических свойств.
Существование одного и того же металла в нескольких кристаллических формах носит название полиморфизма. Температура, при которой происходит изменение кристаллической решетки – называется температурой полиморфного превращения. На этом явлении основаны все процессы термической обработки. Полиморфные модификации обозначают греческими буквами (a, b, g и другими, которые в виде индекса добавляют к символу элемента).
Все металлы и металлические сплавы за редким исключением в твердом состоянии – тела кристаллические, атомы (ионы) расположены в металлах упорядоченно друг относительно друга на определенных расстояниях в зависимости от природы металла. Эти расстояния называются параметрами кристаллической решетки.
В аморфных телах атомы расположены не упорядоченно, а хаотично.
Металлы если их кристаллизуют обычным способом – поликристаллические тела, состоящие из большого числа мелких, различимых только в микроскоп зерен (10 -1 –10 -6 см), различно ориентированных по отношению друг к другу.
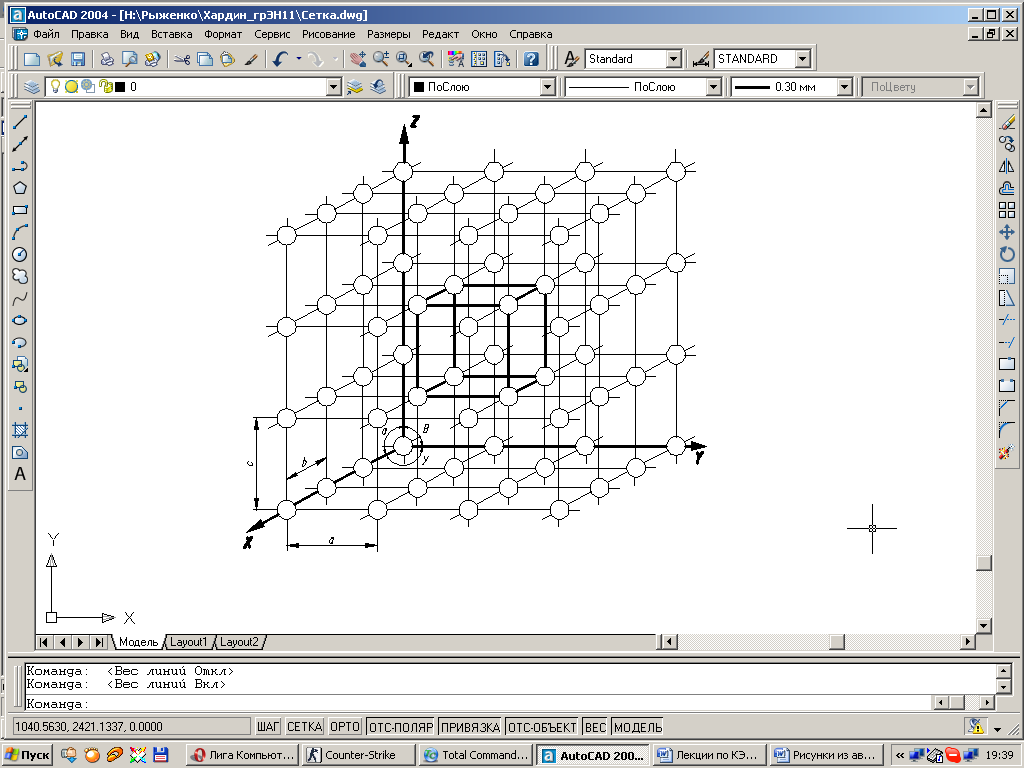
Ближайшие друг к другу атомы образуют контур какой-нибудь геометрической фигуры, например куба (рис. 1.1).
Следовательно, каждое зерно металла состоит из множества таких геометрических тел, называемых элементарными ячейками. В соседних зернах металла эти ячейки ориентированы по-другому.
| Рис. 1.1. Схема кристаллической решетки. |
Что же удерживает атомы в узлах кристаллической решетки, сохраняя природу твердого состояния материала и его прочность.
Известно, что атом любого металла состоит из окружающих его несколько электронных оболочек, несущих отрицательный заряд. Каждая оболочка заполнена строго определенным количеством сильно связанных с атомом электронов и только на последней оболочке, находятся несколько слабосвязанных электронов с атомом. Их число равно валентности металла. С помощью этих электронов атомы в металле устанавливают связи друг с другом. Связь атомов между собой с помощью валентных электронов называется металлической.
Но не все электроны внешней оболочки участвуют в образовании металлической межатомной связи. Часть электронов, покидая ядра своих атомов, уходит в межузельное пространство, образуя электронный «газ», т.е. становятся коллективизированными.
Благодаря коллективизированным электронам металлы обладают электро- и теплопроводностью, металлическим блеском, сверхпроводимостью, термоэлектронной эмиссией, пластической деформацией и другими металлическими свойствами.
Сила связи в металлах определяется силами отталкивания и притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна.
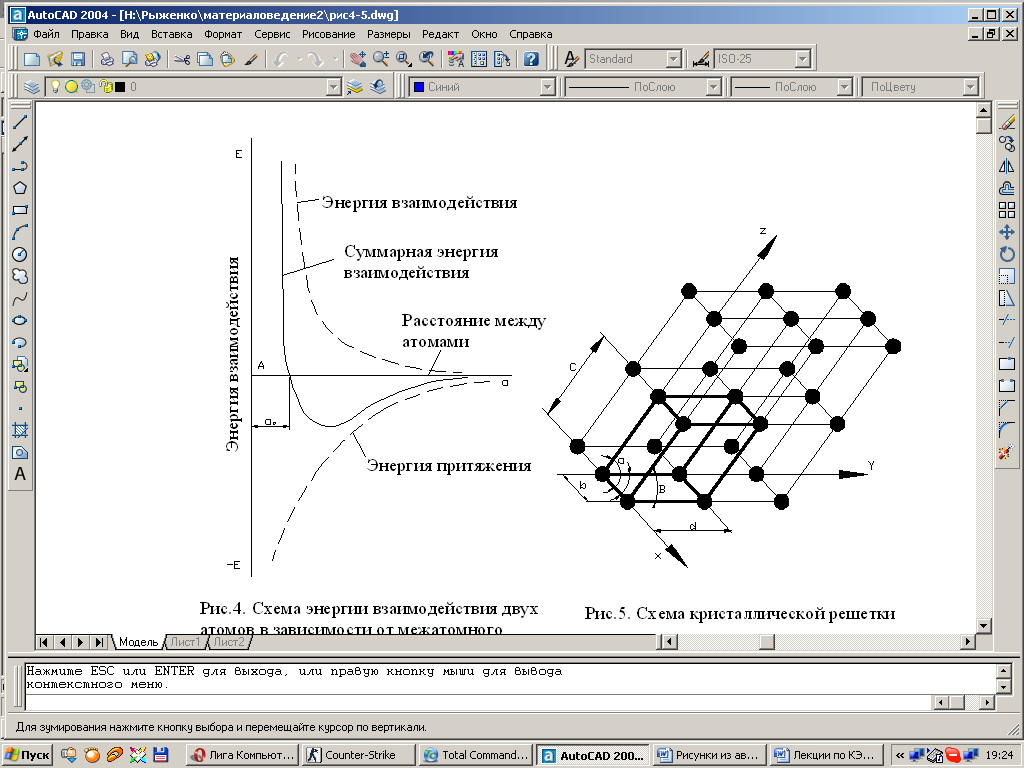
Как видно из рис. 1.2 этому положению соответствует равновесное расстояние a0. Сближение атомов или удаление их на расстояния меньше или больше a0,осуществимо лишь при осуществлении определенной работы против силы отталкивания или притяжения. Поэтому атомы в металле располагаются равномерно, образуя правильную кристаллическую решетку.
Большинство металлов образуют одну из следующих высокосимметричных решеток с
| Рис. 1.2. Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния. |
а, б) кубическую объемную центрированную (ОЦК) – решетку имеют железо при обычных температурных условиях, хром, вольфрам, ванадий, молибден, калий, натрий;
в) кубическую гранецентрированную (ГЦК) – решетку имеют никель, медь, алюминий, свинец, серебро, железо при температурах 911-1392°С и др. металлы;
г) гексагональную плотно упакованную (ГПУ) – решетку имеют магний, цинк, кобальт, цирконий и титан при комнатной температуре.
Для однозначной характеристики элементарной кристаллической решетки, т.е. её параметров, необходимо знать: три ребра (a, b и c) и
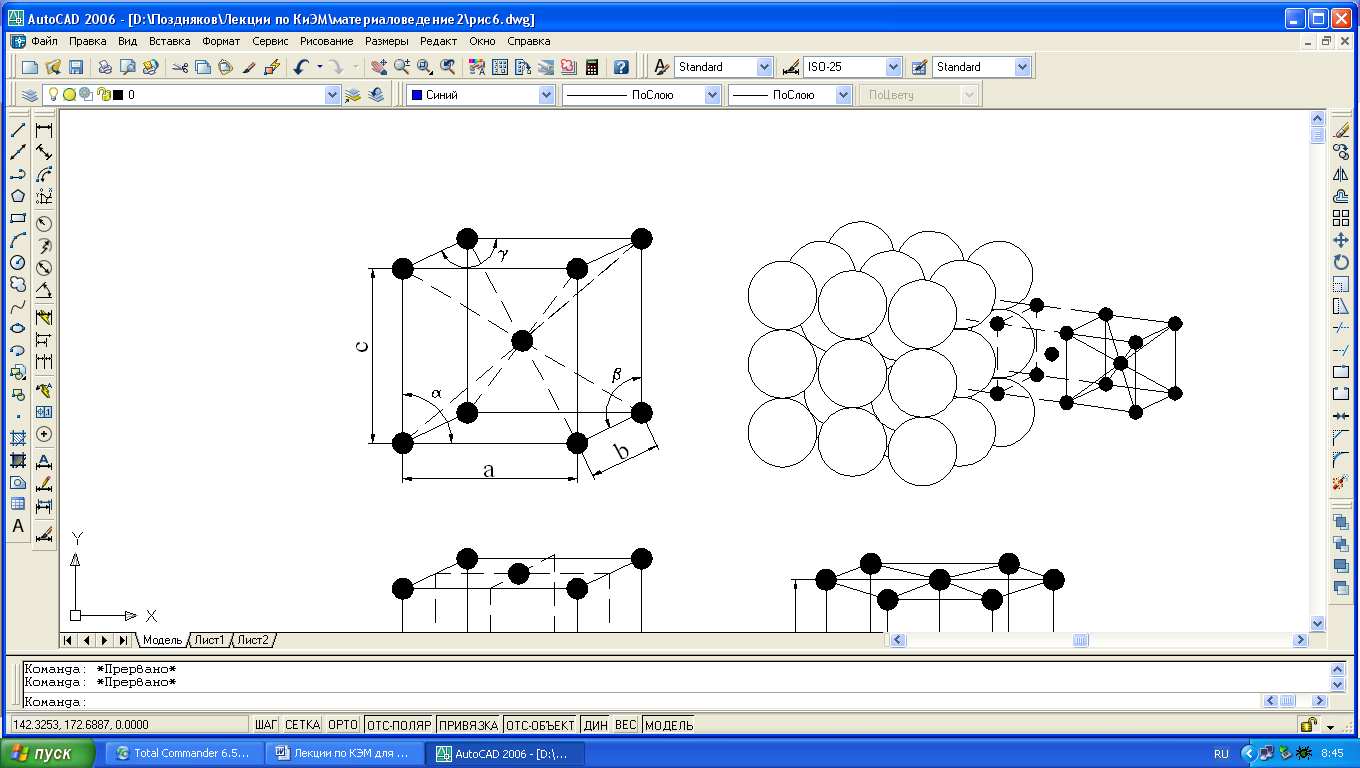
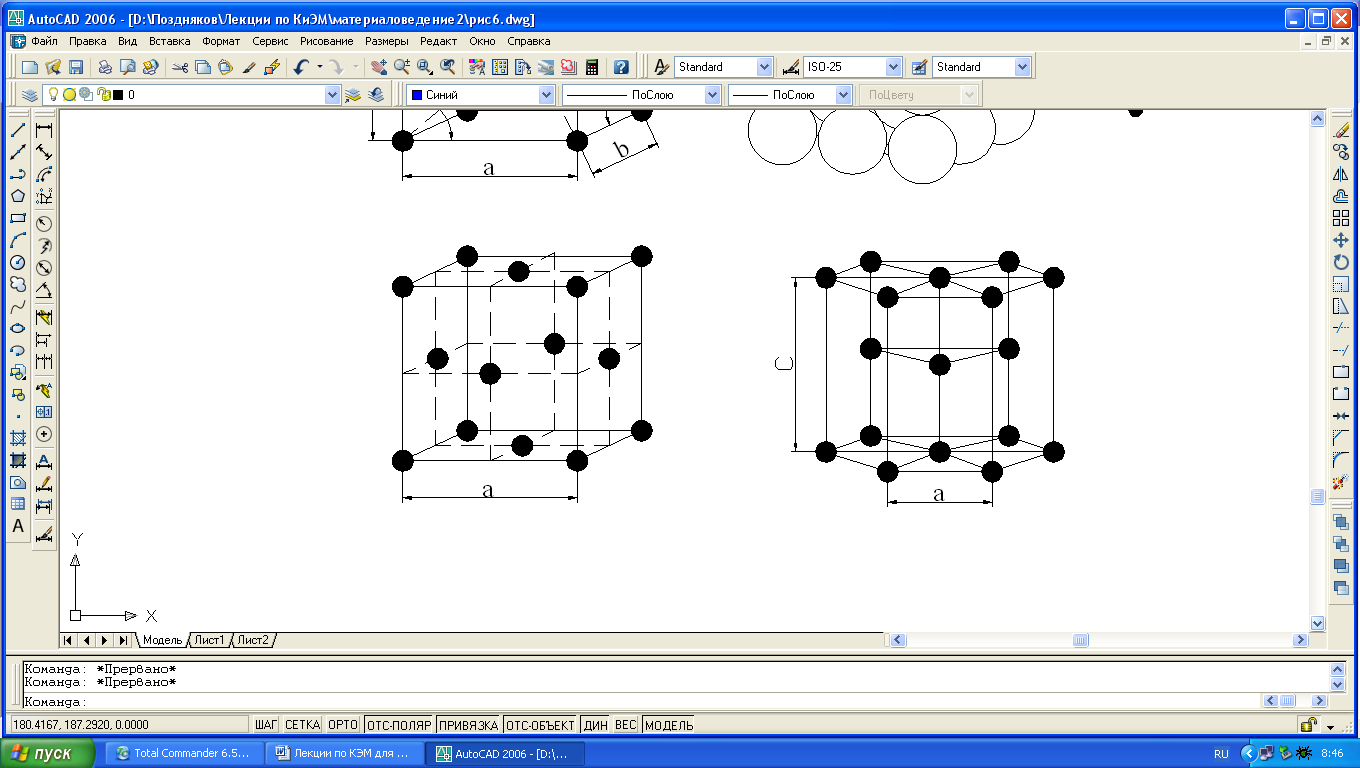
Рис. 1.3. Кристаллические решетки металлов: а и б – кубическая объемноцентрированная (ОЦК); в – кубическая гранецентрированная (ГЦК); г – гексагональная плотноупакованная.
три угла между осями (α, β и γ) (см. рис.1.1). Параметры – расстояния между центрами соседних атомов по избранному направлению и измеряются в нанометрах или Ангстремах А°, причем 1нм=10А°=10 -9 м.
Как видно, что некоторые металлы в зависимости от температурных условий существуют с различными кристаллическими решетками. Например, железо при температурах до 911°С имеет ОЦК-решетку, выше 911°С и до 1392°С имеет ГЦК-решетку и далее свыше 1392°С вплоть до температуры плавления 1539°С принимает форму ОЦК-решетки.
Способность металла изменять тип кристаллической решетки в зависимости от температуры называется аллотропией или полиморфизмом.
Полиморфные превращения имеют важные значения в технике, благодаря им, оказывается возможным производить термическую обработку сталей и других металлов.
Нетрудно видеть, что плотность атомов в кристаллической решетке по различным плоскостям неодинакова (рис. 1.4).
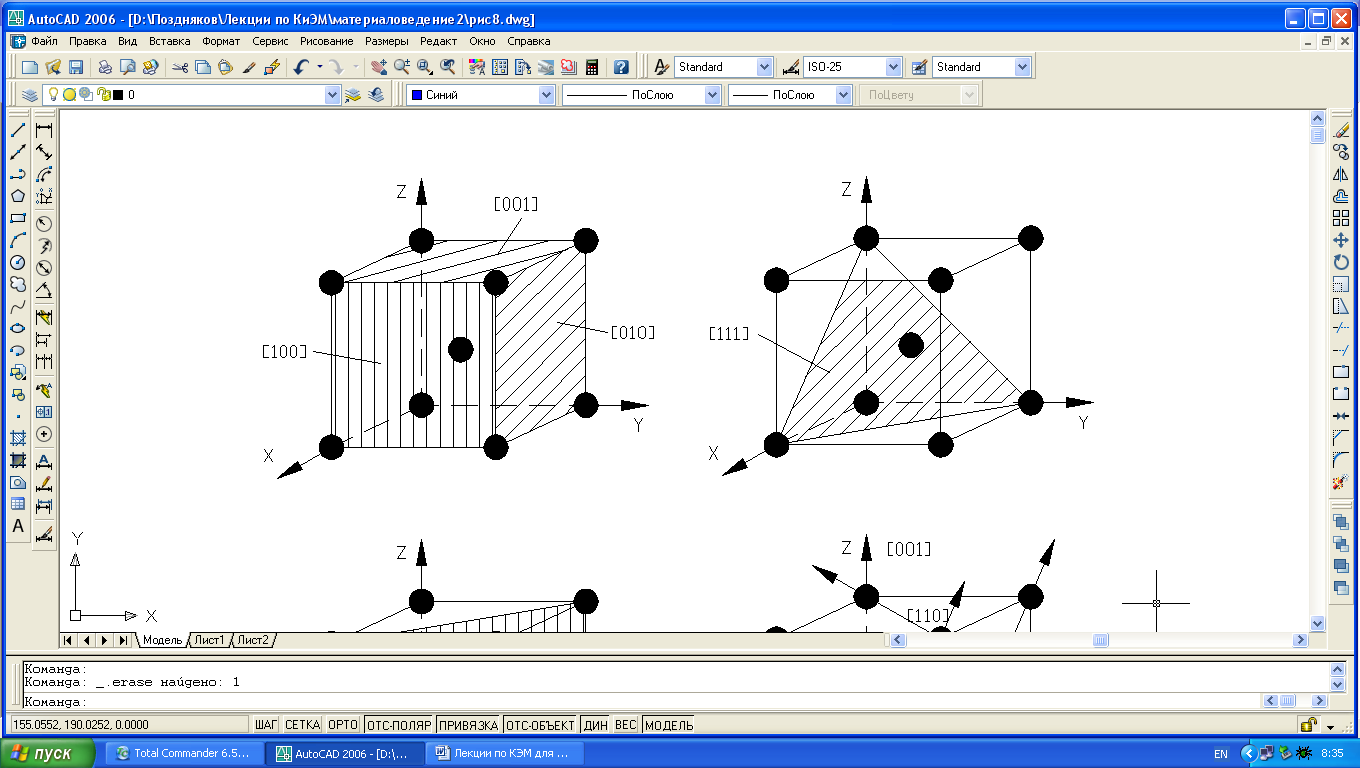
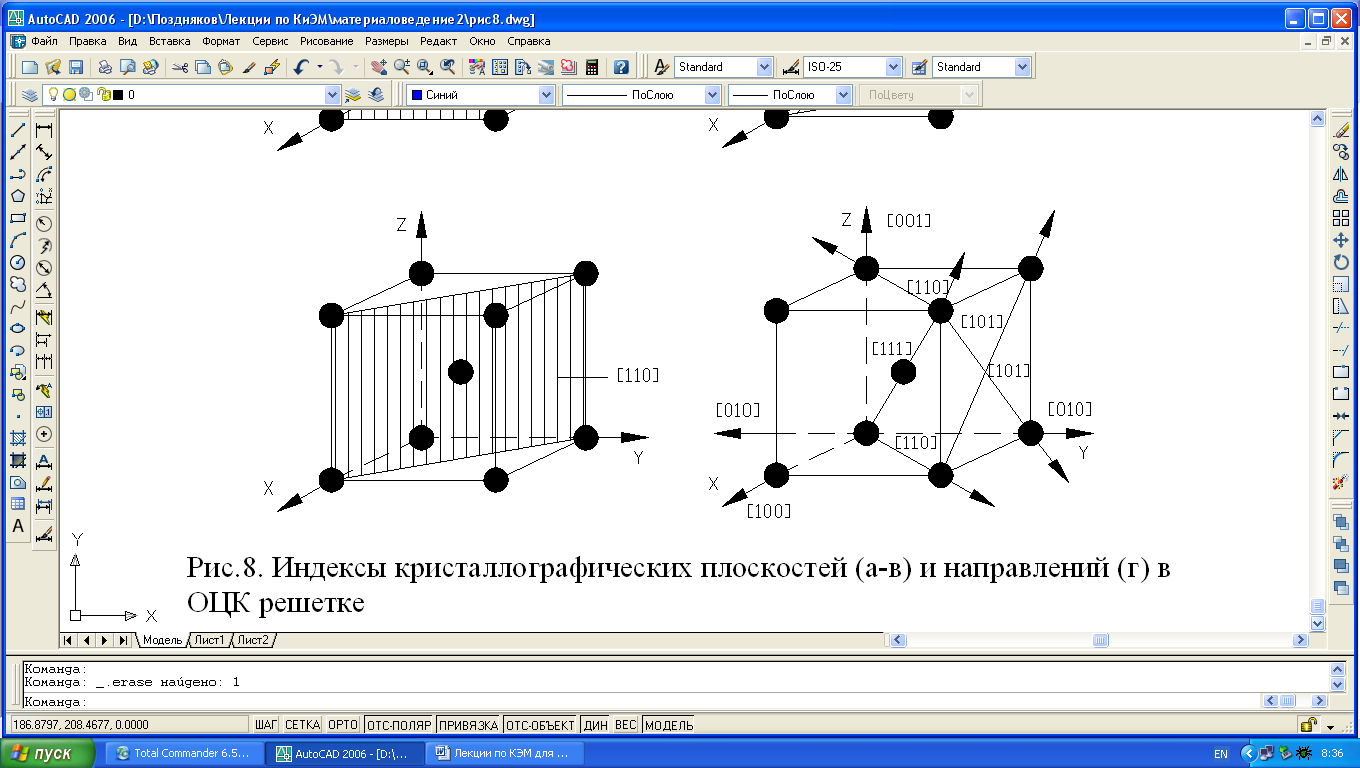
Рис. 1.4. Индексы кристаллографических плоскостей (а-в) и направлений (г) в ОЦК-решетке.
Так плоскость(100) в ОЦК-решетке принадлежит один атом (1/4х4=1), плоскости (110) – 2 атома (1/4х4+1=2), то вследствие неодинаковой плотности в различных плоскостях и направлениях решетки, свойства (химические, физические, механические) каждого монокристалла будут неодинаковы и это называется анизотропией. Следовательно кристалл – тело анизотропное.
Технические металлы – поликристаллические тела, т.е. состоят из большого числа анизотропных кристаллов, которые в большинстве случаев неупорядоченно ориентированы друг к другу. Поэтому свойства во всех направлениях более или менее одинаковы, т.е. поликристаллическое тело псевдоизотропно. Такая мнимая изотропность металла не будет наблюдаться при направленной кристаллизации и значительной холодной деформации.
Читайте также:
