Все металлы при комнатной температуре являются твердыми
Обновлено: 04.10.2024
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.

Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.

Видео
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.

Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая — ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная — имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.

Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.

Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим — расчётные методы квантовой химии.
Типы химической связи
- Металлическая — расположенные в узлах кристаллических решеток ядра атомов металла объединены единым массивом электронов.
- Водородная — обусловлена возможностью атома водорода формировать при смещении от него электронной плотности дополнительные связи.
- Ионная — носит электрическую сущность. Она высоко поляризована. Формируется за счет присоединения ионов, которые несут противоположный заряд.
- Ковалентная — бывает как полярной, так и неполярной. Она состоит из пары электронов, которые принадлежат двум атомам. Данная связь примечательна наивысшей стабильностью и энергетической ёмкостью.
Связи обозначаются нижеуказанными признаками:
- длина — степень, в которой ядра атомов, образовавших связь, удаляются друг от друга;
- энергия — величина силы, приложенной к разрыву соединения;
- полярность — сдвиг облака электронов в сторону одного из атомов;
- порядок или кратность — число электронных пар, которые образовали связь.
Структура молекул может быть представлена графически (структурной формулой). Главные взаимосвязи атомов в формуле обозначаются штрихами. В подобных структурах связи формируют целостную цепь и демонстрируют валентность элементов (атомов), которые их образовывали.

Структурные формулы также демонстрируют, каков внешний вид молекулы (линейный, циклический, наличие радикалов и т.д.).
В настоящее время интенсивно изучается структура частицы вещества. С этой целью применяются различные эксперименты и теоретические методы. Экспериментальные методы включают рентгеновский структурный анализ, спектроскопию, масс-спектрометрию и др. Теоретические методы включают методы расчета квантовой химии.
Что такое молекула в химии
Для химической дисциплины изучение молекул играет одну из самых важных ролей. Благодаря химическим исследованиям была получена важнейшая информация о составе и характеристиках этой крошечной единицы материи.
- наименьшей частью одного вещества;
- наименьшим электрически нейтральным множеством атомов, которые образуют определенную структуру посредством химических связей;
- может представлять собой один, несколько или множество, как одинаковых, так и разнообразных атомов.
Когда молекулы проходят через химические превращения, они обмениваются атомами и распадаются. Именно поэтому знания о строении и состоянии данных частиц являются основой для изучения химии веществ и их преобразования.
Основываясь на имеющихся знаниях о происходящих химических реакциях, мы имеем возможность прогнозировать структуру молекул задействованных в них веществ. Верен и обратный вывод: на основании знаний о структуре молекулы вещества вполне реально прогнозировать его поведенческие характеристики в ходе химической реакции.
Из чего состоит молекула?

Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» – атомов химических элементов. Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: H2O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.

Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода. Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.

Сканирующий туннельный микроскоп
Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.
Урок 3. Молекулы и простые вещества
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.

Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
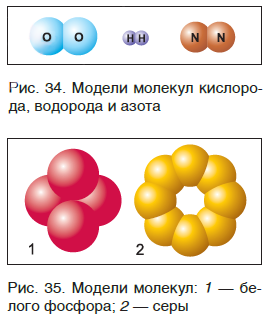
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
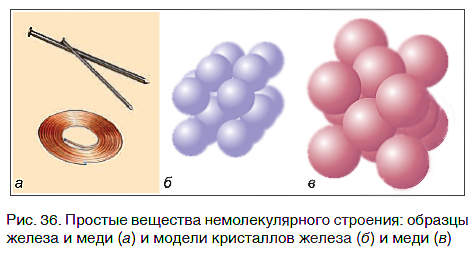
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы

Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.

Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
- Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
- Простые вещества состоят из атомов одного химического элемента.
- Простые вещества имеют молекулярное или немолекулярное строение.
- Простые вещества делят на металлы и неметаллы.
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Может ли металл быть газом?

Да, металлы могут быть газами, в зависимости от того, насколько высока их температура кипения. Но действительно ли газообразные металлы считаются металлами?
Закройте на мгновение глаза и позвольте слову "металл" всплыть в вашей голове. А теперь ответьте: какой первый образ приходит вам на ум, когда вы думаете о "металле"?
Большинство из вас увидят твердый, блестящий твердый предмет - может быть, блестящий меч, гладкую машину или чистую посуду?
Слово "металл" ассоциируется у нас с твердыми объектами, потому что большинство металлов вокруг нас - это твердые тела. Но ограничиваются ли металлы только твердым телом? Могут ли они быть газом?
Да, конечно! Хотя металлы обычно находятся в твердом состоянии при комнатной температуре (вероятно, поэтому мы ассоциируем слово "металл" с твердыми объектами), металлы также могут быть газами.
Дело в том, что состояния вещества универсальны: металл может быть твердым, жидким или газообразным. Но это состояние определяется на основе правильных условий температуры и давления.
Например, металл, скажем, свинец, имеет температуру кипения 1740 градусов по Цельсию. Теперь вы знаете, что свинец в своем «естественном состоянии» представляет собой твердое вещество. Но когда вы начнете его нагревать, он сначала превратится в жидкость при 327 градусах Цельсия, а если вы продолжите подавать больше тепла, он превратится в газ при 1740 градусах Цельсия.

Свинец превращается в пар при 1740 градусах Цельсия.
Другой отличный пример - ртуть. Фактически, это металл с самой низкой температурой кипения (356,7 °C), что означает, что из всех металлов он превращается в газ при относительно более низкой температуре.
Но учтите, что пары ртути очень вредны. По данным Всемирной организации здравоохранения, "вдыхание паров ртути может оказывать вредное воздействие на нервную, пищеварительную и иммунную системы, легкие и почки и может быть фатальным. Неорганические соли ртути разъедают кожу, глаза и желудочно-кишечный тракт, а при попадании внутрь могут вызывать токсическое воздействие на почки".

Ртуть весьма примечательна - это металл, который существует в жидком виде при комнатной температуре, а затем закипает при небольшой температуре.
А теперь давайте обсудим еще один аспект этой саги о превращении металла в газ.
Остается ли металл металлом, когда он превращается в газ?
Мы установили, что металлы могут превращаться в газы, если их нагреть до точки кипения. Но если металл нагревается до точки кипения и становится газом, остается ли он металлом? Другими словами, может ли металл находиться в газообразном состоянии и при этом оставаться металлом?
Газообразные металлы не сохраняют свойств своих твердых аналогов, включая металлические связи, металлическую проводимость, пластичность, блеск или другие металлические свойства. Вот почему металлы больше не считаются металлами, когда они переходят в газообразное состояние - это просто газ с определенными характерными свойствами "родительского" элемента. (тогда чем же они считаются? - В ЭТОЙ ТОЧКЕ ОНИ ЯВЛЯЮТСЯ ПРОСТО ГАЗОМ. РТУТЬ ЯВЛЯЕТСЯ МЕТАЛЛОМ, НО КОГДА ОНА КИПИТСЯ, ЕЕ ПАР НАЗЫВАЕТСЯ РТУТНЫМ ГАЗОМ/ПАРАМИ)
Но почему металлы твердые? Что в них такого особенного, что делает их твердыми?
Почему металлы вообще твердые?
Металлы твердые при комнатной температуре из-за того, как их последовательные атомы упаковываются внутри.
Видите ли, вся материя состоит из атомов. Состояние вещества зависит от того, насколько близко или далеко друг от друга находятся эти атомы.
Если составляющие атомы вещества находятся далеко друг от друга, то это вещество будет существовать в виде газа при комнатной температуре. Атомы в жидком состоянии относительно ближе друг к другу, но в твердых телах атомы упакованы вместе в плотные кристаллы.
Из-за сильных сил, которые удерживают эти атомы близко друг к другу, твердые тела жесткие и имеют определенную форму и размер (в отличие от жидкости и газа).
Металлы твердые при комнатной температуре, потому что входящие в их состав атомы металлов упаковываются близко друг к другу, придавая им жесткий или "затвердевший" внешний вид. Это также является причиной того, что металлы имеют высокую температуру плавления и не существуют в жидком состоянии при комнатной температуре.
В целом, металлы могут превращаться в газ, но как только они превращаются в газ, они не сохраняют своих металлических свойств.
Кристаллическое строение металлов. Кристаллическая решетка металлов. Металлы в периодической системе Менделеева

Из школьного курса химии известно, что все элементы, которые сгруппированы по определенным правилам в периодическую таблицу Менделеева, можно условно разделить на металлы и неметаллы. В этой статье будет рассказано о кристаллическом строении металлов, их физико-химических свойствах, а также о дефектах на атомном уровне, которые в них присутствуют.
Периодическая таблица и металлы
В XIX веке благодаря своему блестящему уму и многим годам труда Дмитрий Иванович Менделеев составил таблицу, собрав в нее все известные на то время химические элементы. Каждому из них в таблице отведено определенное положение в соответствии с числом протонов в атомном ядре. Вся таблица делится на 7 периодов (горизонтальные строки) и 8 групп (вертикальные строки). Чем больше период, тем больше радиус атома соответствующего элемента, и тем на более высоких орбиталях расположены его валентные электроны. Наоборот, чем старше группа (движение по таблице слева направо), тем больше валентных электронов находится на последней орбитали и тем меньше радиус атома.
Любой элемент таблицы можно условно отнести либо к металлам, либо к неметаллам. Металлы расположены по левую сторону от диагонали бор (B) - полоний (Po). Если взглянуть на таблицу, то можно сразу понять, что количество металлов в несколько раз превышает число неметаллов.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 o C.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 o C). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким - литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Какие металлы бывают?
Металлы в периодической системе Менделеева делятся на несколько групп. Перечислим и кратко охарактеризуем их:
- Щелочные. Эти металлы имеют всего 1 валентный электрон, они чрезвычайно химически активны, имеют низкую плотность и являются отличными проводниками тепла и электричества. Примерами их являются литий, натрий и калий.
- Щелочноземельные. К ним относятся кальций, магний, стронций. Эти металлы имеют 2 валентных электрона, поэтому они также являются химически активными.
- Переходные. Это металлы с переменной валентностью, которые имеют пустые или полупустые орбитали d и f типа. Это самая многочисленная группа металлов. К ним относятся титан, ванадий, хром, никель, вольфрам, осмий, золото и многие другие.
- Лантаноиды и актиноиды. Большая часть этих элементов является нестабильными и проявляет различную степень радиоактивности.
- Постпереходные. Это те элементы, после которых по периоду идут металлоиды, а затем неметаллы. Самыми известными из них являются свинец, алюминий и олово.
Черные и цветные металлы
Выше была приведена классификация рассматриваемых элементов в соответствии с их электронным строением и положением в периодической системе. Помимо нее, существует еще одно разделение, которое не связано с атомным строением - это понятие о черных и цветных металлах.
Черным является железо и все сплавы с его участием. Примеры цветных металлов - это алюминий, золото, серебро, медь и другие, а также сплавы, которые не содержат железа. Причина такого разделения проста, черные металлы являются дешевыми и недолговечными (разрушаются в результате коррозии, ржавеют). Наоборот, цветные металлы характеризуются способностью образовывать пленки оксидные, которые предотвращают основную массу материала от дальнейшего химического разрушения.
Металлическая связь
Изучая атомно-кристаллическое строение металлов, следует сказать несколько слов об особенностях химической связи между рассматриваемыми элементами. Поскольку электроотрицательность металлов низкая, то, объединяясь в кристаллическую решетку, каждый атом отдает один или несколько валентных электронов. Эти электроны слабо связаны с ядром, поэтому они легко от него отрываются уже при комнатных температурах.
Совокупность валентных электронов, которые свободно движутся в пространстве между ионными остовами в кристаллической решетке металлов, называется электронным газом. Благодаря ему кусок металла легко проводит тепло и электричество.
Электрическое поле положительно заряженных ионных остовов компенсируется отрицательным полем "размазанного" по объему металла электронного газа. Такая связь называется металлической. Она кардинальным образом отличается от других типов химической связи. Например, в ковалентной атомы не отдают электроны в межатомное пространство, они становятся общими только для двух атомов. Наоборот, в ионной связи один атом полностью лишает второго валентных электронов, присоединяя их к себе, и приобретая отрицательный заряд.
Кристаллическое строение металлов. Типы кристаллических решеток
Когда металл образует твердую структуру, то все его атомы стремятся занять такие положения в пространстве относительно друг друга, чтобы они соответствовали минимуму потенциальной энергии. Этому минимуму соответствует кристаллическая решетка.
Под кристаллической решеткой понимают такую пространственную атомную структуру, которая может быть получена, если известны координаты ограниченного числа ее атомов и вектора их трансляции в пространстве. Указанное число атомов называется базисом решетки, а их положения образуют так называемую элементарную ячейку.
Все металлы кристаллизуются в трех основных типах решеток:
- гранецентрированная кубическая (ГЦК);
- объемно-центрированная кубическая (ОЦК);
- гексагональная плотноупакованная (ГПУ).
Благодаря кристаллическому строению металлы обладают такими свойствами, как пластичностью, упругостью и металлическим блеском.
Решетки ГЦК, ОЦК, ГПУ
Изучая кристаллическое строение металлов, охарактеризуем подробнее каждый тип кристаллической решетки. Начнем с ГЦК. Она показана ниже на рисунке.
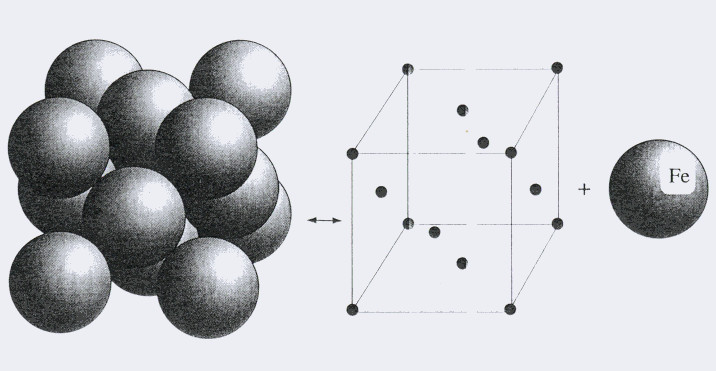
Как видно, это решетка представляет собой кубик, в котором атомы расположены в его вершинах и в центрах всех шести граней. Применяя методы кристаллографии, несложно показать, что для получения такой решетки в пространстве достаточно всего четырех атомов и векторов трансляций, совпадающих с ребрами куба.
Примерами металлов, которые кристаллизуются в ГЦК, являются алюминий, медь, золото и серебро. Железо образует ГЦК решетку только при высоких температурах.
ОЦК решетка показана ниже.
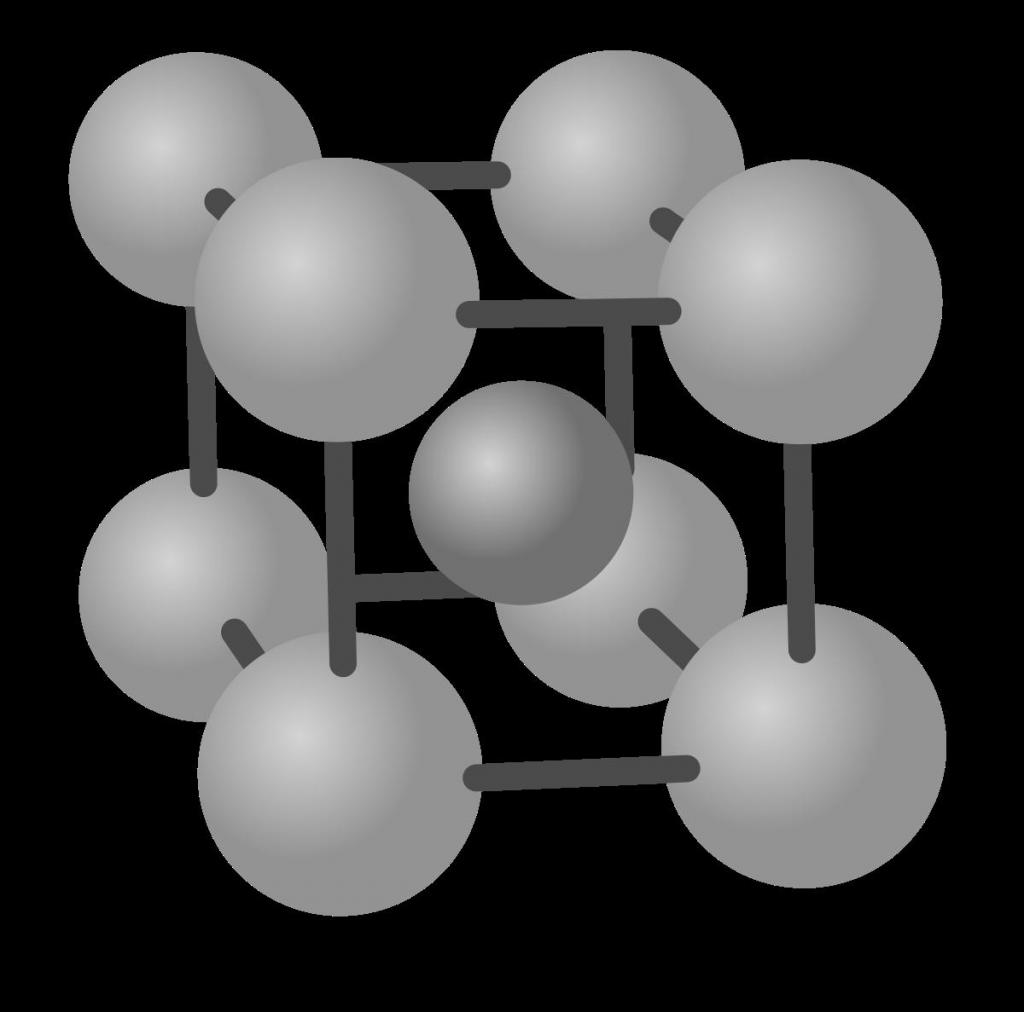
Мы видим, что она соответствует кубику, в вершинах и в центре которого находится атом. Всего два атома необходимо, чтобы в прямоугольных декартовых координатах построить ОЦК решетку. Такие металлы, как ванадий, тантал, ниобий, вольфрам имеют именно эту кристаллическую структуру.
Наконец, ГПУ решетка. Она представлена ниже на рисунке.
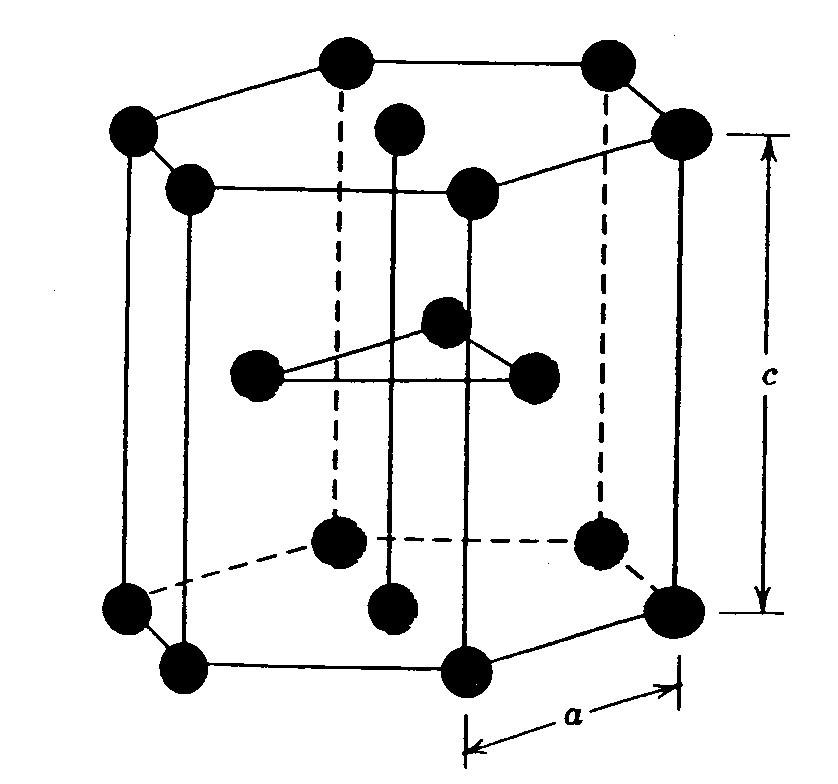
Эта кристаллическая решетка металлов отличается от двух предыдущих тем, что она в пространстве образует не куб, а правильную шестиугольную призму, которая состоит из шести атомов. В данной структуре кристаллизуются такие элементы, как титан, цирконий, магний и кобальт.
Понятие об индексах Миллера
Чтобы удобно было описывать численно показанные выше пространственные решетки, в кристаллографии используют так называемые индексы Миллера. Они представляют собой наборы чисел, которые позволяют точно определить положение в пространстве данного атомного ряда или атомной плоскости. По этим числам судят о поверхностных энергиях, о способности металлов проявлять пластические свойства. Например, в ГЦК решетке краевые дислокации движутся по плоскостям (1,1,1) (эти плоскости являются максимально плотноупакованными, нормалью к ним будут диагонали куба).
Дефекты в металлах
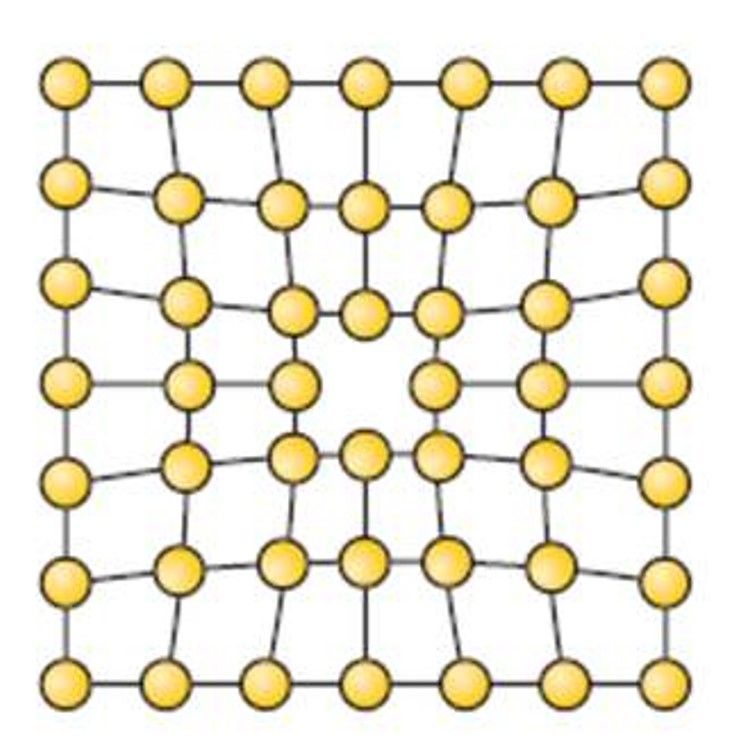
Выше мы показали идеальную ситуацию, когда все атомы находятся на своих местах, и пространственную структуру всего металлического куска можно получить с помощью простых трансляций элементарной ячейки. В действительности же существуют множество несовершенств кристаллического строения металлов. Они называются дефектами.
Все дефекты можно по геометрическому признаку отнести к одному из четырех типов:
- Точечные. Вакансии, межузельные атомы, наличие внедренных атомов других элементов, создающих микроскопические локальные напряжения.
- Линейные. Дислокации - обрывы кристаллических плоскостей, которые обеспечивают пластичность всех металлов.
- Плоские - границы зерен. Любой металл состоит из множества монокристаллов, которые друг с другом соединены в различной ориентации через межзеренные границы.
- Объемные. Поры, различные фазовые включения, которые упрочняют металл и снижают его пластичность.
Влияние дефектов на свойства
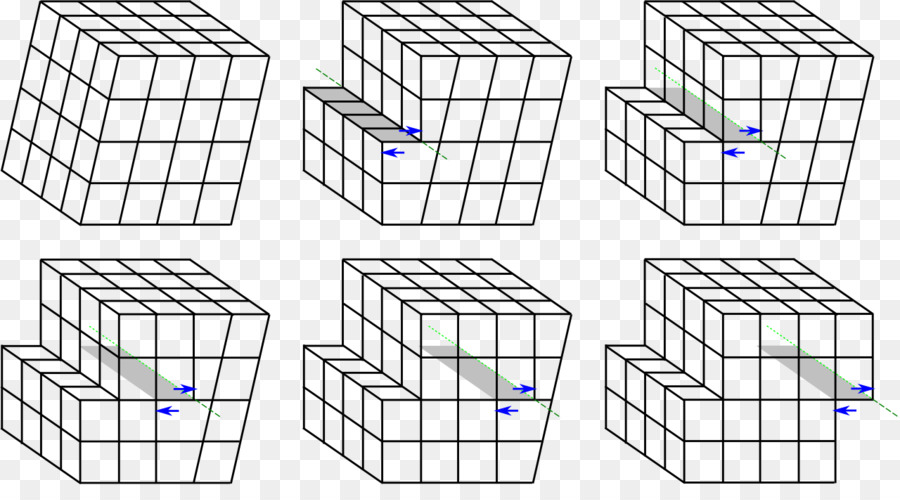
Как правило, дефекты кристаллического строения металлов приводят к снижению их теплопроводности и электропроводности, материал становится более прочным и менее пластичным. Ярким примером является сталь, которая за счет междоузельных атомов углерода и наличия разных фаз (цементита, графита) в кристаллической решетке железа, значительно прочнее, чем чистый металл.
С развитием нанотехнологий влияние дефектов на свойства металлов может быть неоднозначным. Так, с уменьшением размера зерна может наблюдаться увеличение пластичности материала, что связано с появлением совершенно иного механизма пластической деформации - зернограничного проскальзывания, которое по своей сути отличается от дислокационного.
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
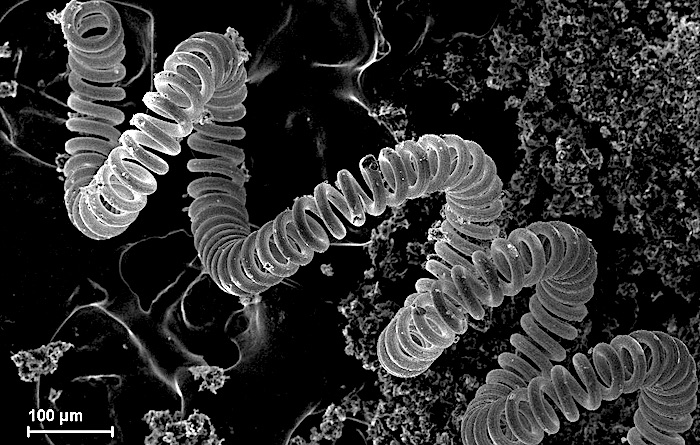
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
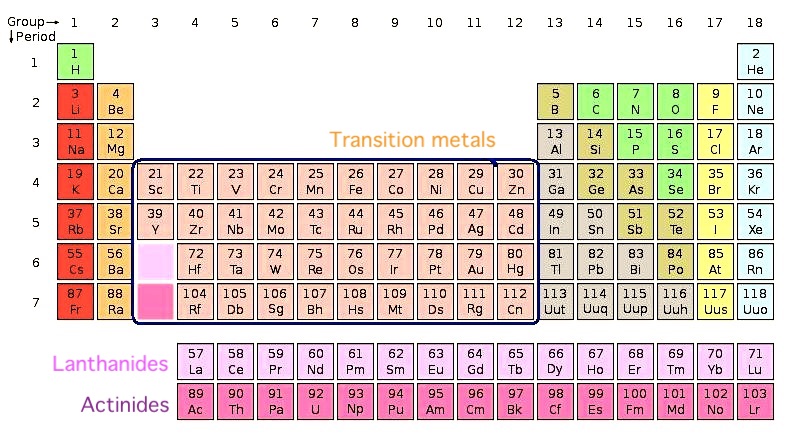
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Читайте также:
