Все периоды начинаются щелочным металлом и заканчиваются инертным газом
Обновлено: 30.06.2024
Для вывода информации об элементе в центральном окне необдходимо кликнуть на соответствующую ячейку периодической таблицы представленной ниже.
Периодическая система элементов
Периодическая система элементов состоит из горизонтальных рядов - периодов и вертикальных столбцов - групп. Существующие в природе и синтезированные учеными элементы расположены в 7 периодах.
называется горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным газом. Исключение из этого правила представляет самый короткий I период, начинающийся водородом. Период это последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns 1 до ns 2 np 6 (или до ns 2 у первого периода). Периоды начинаются с s- элемента и заканчиваются p- элементом (у первого периода s- элементом). Малые периоды содержат 2 и 8 элементов, большие периоды - 18 и 32 элемента.
объединяет элементы, имеющие одинаковую высшую валентность (валентность по кислороду). Высшая валентность равна номеру группы (исключения: O, F; Cu, Ag, Au; Fe, Co, Ni и некоторые другие элементы). Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы - аналоги). К главным подгруппам (подгруппам А) относятся подгруппы элементов второго периода: Li, Be, B, C, N, O, F и подгруппа благородных газов. К побочным подгруппам (подгруппам В) принадлежат d- и f- элементы. Первые шесть d- элементов от (Se до Fe) начинают соответствующие подгруппы от подгруппы III (Se) до подгруппы VIII (Fe). В подгруппу VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги - платиновые металлы. Медь и ее аналоги, имеющие во внешней s- подоболочке по одному электрону, образуют первую побочную подгруппу. Лантоноиды и актиноиды (f- элементы) находятся в III подгруппе в соответствие с особенностями их электронных конфигураций.
называется вертикальный ряд элементов, имеющих сходное строение внешнего электронного слоя и близкие химические свойства. Главные подгруппы содержат элементы малых и больших периодов. Побочные подгруппы содержат элементы только больших периодов.
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от зарядов их ядер (порядковых номеров элементов в периодической системе).
Закономерности в периодической системе
В периодической системе строго соблюдается ряд закономерностей, связанных со строением электронных оболочек атомов. Эти закономерности таковы:
- Число электронных слоев в атоме элемента равно номеру периода, в котором данный элемент находится. Например, у атома H и He всего один электронный слой, у атома C - два электронных слоя, у атома Cl - три, у атома Fr - семь и т.д.
Электроны (1-7) незавершенного внешнего слоя участвуют в образовании химических связей и являются валентными.
В побочных подгруппах распределение валентных электронов более сложное, чем в главных подгруппах. Общее число подвижных валентных электронов также равно номеру группы, но только 2 (реже 1) из них находятся во внешнем слое, а остальные помещаются в предпоследний слой.
Группа — это вертикальный ряд элементов
В настоящее время известно 109 химических элементов. Последние элементы получены в количестве всего нескольких атомов и практического значения не имеют. Тем не менее, периодическая система может быть расширена и дальше.
Формы графического изображения периодической системы (периодической таблицы) могут быть разными; основные из них две: длинная и короткая.
В длинной форме таблицы каждый период записан в один ряд. В учебных целях обычно используют короткую форму таблицы, в которой длинные периоды записаны в два ряда.
Периодическая система состоит из семи периодов, расположенных в таблице горизонтально, и восьми групп, расположенных вертикально.
Период — это горизонтальный ряд элементов, начинающийся (за исключением 1-го периода) щелочным металлом и заканчивающийся инертным (благородным) газом.
1-й период содержит 2 элемента, 2-й и 3-й периоды - по 8 элементов. Первый, второй и третий периоды называются малыми (короткими) периодами. 4-й и 5-й периоды содержат по 18 элементов, 6-й период - 32 элемента, 7-й период содержит элементы с 87-го и далее, вплоть до последнего из известных на настоящее время элементов - 109-го. Четвертый, пятый, шестой и седьмой периоды называются большими (длинными) периодами.
Каждая группа периодической системы состоит из двух подгрупп: главной подгруппы (А) и побочной подгруппы (В). Главная подгруппа содержит элементы малых и больших периодов (металлы и неметаллы). Побочная подгруппа содержит элементы только больших периодов (только металлы).
Например, главную подгруппу I группы составляют элементы литий, натрий, калий, рубидий, цезий и франций, а побочную подгруппу I группы составляют элементы медь, серебро и золото. Главную подгруппу VIII группы образуют инертные газы, а побочную подгруппу - металлы железо, кобальт, никель, рутений, родий, палладий, осмий, иридий, платина, хасий и мейтнерий.
Свойства простых веществ и соединений элементов изменяются монотоннов каждом периоде и скачкообразнона границах периодов. Такой характер изменения свойств составляет смысл периодической зависимости.
В периодах слева направо неметаллические свойства элементов монотонно усиливаются, а металлические — ослабевают. Например, во втором периоде литий - очень активный металл, берилий — металл, образующий амфотерный оксид и, соответственно, амфотерный гидроксид, В, С, N, О - типичные неметаллы, фтор - самый активный неметалл, неон - инертный газ. Таким образом, на границах периода свойства изменяются скачкообразно: период начинается щелочным металлом, а заканчивается инертным газом.
В периодах слева направо кислотные свойства оксидов элементов и их гидратов усиливаются, а основные — ослабевают. Например, в третьем периоде оксид натрия - основный оксид, оксид магния - основный, оксид алюминия - амфотерный, а оксиды кремния, фосфора, серы и хлора - кислотные оксиды. Гидроксид натрия - сильное основание (щелочь), гидроксид магния -слабое нерастворимое основание, А1(ОН)з — нерастворимый амфотерный гидроксид, кремниевая кислота - очень слабая кислота, Н3РО4 -кислота средней силы, серная - сильная кислота, НСlО4 (хлорная) - самая сильная кислота из этого ряда.
В главных подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические - ослабевают. Например, в подгруппе 4А: углерод и кремний- неметаллы, германий, олово, свинец— металлы, причем олово, свинец - более типичные металлы, чем германий. В подгруппе 1А все элементы - металлы, но по химическим свойствам также можно проследить усиление металлических свойств от лития к цезию и францию.
В результате металлические свойства в наибольшей степени выражены у цезия и франция, а неметаллические — у фтора.
В главных подгруппах сверху вниз основные свойства оксидов и их гидратов усиливаются, а кислотные - ослабевают. Например, в подгруппе 3А: В2О3 - кислотный оксид, а Т12О3 - основный. Их гидраты: Н3ВО3 - кислота, а Т1(ОН)3 - основание.
Строение атома. Электрон и его характеристики (гл. кантовое число, орбитальное, магнитное)
В 1911 году английский физик резерфорд предложил ядерную (планетарную) модель атома, где атом состоит из положительно-заряженного ядра, а вокруг него вращаются электроны. Сам атом электронейтральный. Вращаются электроны с определенной энергией, которая меняется скачкообразно(дескретно), допустимые уровни энергии электрона определяются значением целого числа N и назвали это число – квантовое число, квант-порция энергии.
Квантовые числа n – определяет энергию электрона и размеры электронных облаков. Электронное облако – траектория движение электрона. Энергия электрона зависит от расстояния электрона от ядра, чем ближе к ядру, тем меньше его энергия. Электрон находится на наиболее удаленном от ядра уровне обладает max энергией, поэтому при переходе электрона с более удаленного на более близкий выделяются порции энергии (кванты).
l – орбитальное квантовое число.
Согласно квантово механическим расчетам электронные облака отличаются не только размерами, но и формой, различная форма электронных облаков обуславливает изменение энергии электронов в предыдущем одного энергетического уровня, если n=1, тоl=0. Таким значением l характер электронного облака, имеющие шаровуюсиметрию. Такие электроны называются s – электронами.
если l=1, то электроны называются p – электроны
Li 1s 2 2s 1 2p 0
n=3, l=0,1,2, электроны называются d - электронами
Электроны, обладающие l=2, называютсяd – электронами.
Магнитное квантовое число ml – характеризует пространственную ориентацию электронных облаков.
ms – спиновое квантовое число.
Электрон, двигаясь в поле ядра атома, обладает собственным магнитным моментом, т.к. сам электрон вращается вокруг собственной оси.
Спиновое число может принимать значению +1/2 и -1/2.
+ и – связана с направлением его вращения, т.к. спин – это величина векторная, то принято электроны всегда обозначать стрелками.
3. Размещение электронов в атомах. Принцип Паули. Правило ХундаРазмещение электронов на энергетических уровнях.
Если атом находится не возбужденном состоянии, то его электроны занимают самые низкие по энергиям орбитали.
Принцип Паули (шведский химик). Он вывел в 1925 г принцип запрета – в атоме не может быть 2х электронов, у которых были бы одинаковыми все 4 квантовых числа. Согласно этому принципу на одной орбитали могут находиться только 2 электрона, имеющие 3 одинаковых квантовых числа, но различные спины.
Правило Хунда (Х~В). При заполнении электроном энергетических уровней существует следующая закономерность: на данном уровне электроны стремятся занять энергетический уровень таким образом, чтобы суммарный спин был максимальным.
С 1s 2 2s 2 2p 2
4. Периодический закон и периодическая система элементов Д.И. Менделеева (s,p,d – элементы, периоды и группы, электронное строение атомов)Периодическая система элементов.
Исследуя изменения химсв-в элементов в зависимости от величины их относительной массы. Менделеев 1869 г. открыл закон периодичности этих веществ.свойства элементов и потому и свойства образуемых ими простых или сложных тел стоят в периодической зависимости от атомных весов элементов. Физическая основа периодического закона была установлена в 1922 г. Нельеом Бором, в результате он представил классификацию элементов находящихся в таблице с точки зрения числа электронов в нейтральном атоме, которая равна заряду ядра атома. При образовании хим связи, электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому со временем формулировка периодического закона гласит след образом, свойства элементов находящихся в периодической зависимости от зарядов ядер их атомов. Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов.
Период – это горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа, таких периодов 7, второй и последний период начинается щелочным элементом и заканчивается инертным газом. По вертикали периодическая система подразделяется на 8 групп, причем каждая группа делится на главную подгруппу (sи p элементы) и побочную подгруппу (d – элементы) . элементы главной подгруппы содержать на внешнем уровне одинаковое число электронов, которое равно номеру группы.
Na (11) 1s 2 2s 2 2p 6 3s 1 3p 0 3d 0
Сходство элементов внутри каждой группы наиболее важная закономерность в периодической системе. Все периоды начинаются с щелочных металлов и все периоды заканчиваются инертными газом, путь которых заполнен внешними электронами.
5. Основные свойства атомов (энергия ионизации, электроотрицательность, сродство к электрону, валентность, степень окисления )Все атомы находящиеся в периодической системе было принято характеризовать определенным числом свойств: размер атомов, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления. Все перечисленные свойства связаны с электрической конфигурацией атома. Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов, в расчетах пользуются так называемыми эффективными и кажущимися радиусами. Эти радиусы шарообразных атомов сближенных между собой при образовании кристаллов. Чем больше атомный радиус, тем слабее удерживаются внешние электроны и наоборот. В периоде атомный радиус увеличивается слева направо, а в группе сверху вниз. Энергия ионизации обозначается как (J) – это энергия необходимая для отрыва наиболее слабо связанного электрона от атома, измеряется в электровольтах. Атомы могут не только отдавать, но и присоединять электроны, при этом образуя соответствующий анион. Выделившая при этом процессе энергия называется сродством к электрону (Е) – измеряется так же в электровольтах и наибольшее …… в конце периода.
Электроотрицательность. Определение электроотрицательности (Х) дал в 1932 г знаменитый ученый Полинг – это способность атома в молекуле притягивать к себе электроны. Для количественной характеристики предложено считать меры электроотрицательности энергию, равную арифметической сумме энергии ионизации атома и энергии сродства к электрону ( Х=J+Е).самое большое значение имеет фтор (21,4 эл.вольта), а электроотрицательность литий (1 эВ) и сравнивают электроотрицательностью значения других элементов.
6. Химическая связь. Типы химической связи (ковалентная – полярная и неполярная, ионная, металлическая, водородная, межмолекулярная)
образование соединения из атомов и ионов кристаллических и аморфных веществ сопровождается уменьшением энергии по сравнению с не взаимно действующими атомами. При этом минимальная энергия соответствует определение расположения атомов друг относительно друга и при этом происходит существенное перераспределение электронной плотности. Силы, удерживающие aтомы в новых образованиях получили обобщенное название химической связи.важнейшие и виды химической связи следующие:
Согласно электронной теории валентности химическая связь возникает за счет
за счет перераспределения электронов валентные орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа.
1) насчет образования ионов
2) образование общих электронных пар
Химическая связь характеризуется энергией и длиной.мерой прочности связи служит энергия, затрачиваемая на разрушение связи или выигрыш в энергии при образовании соединения из отдельных атомов.
Есв – энергия связи
длина связи - это расстояние между ядрами в том или ином соединении.
химическая связь обычно изображается черточками соединяющими взаимоотносительные атомы.каждая черточка эквивалентна обобщенный паре электронов. если соединить содержащие больше двух атомов, то важной характеристикой является валентный угол образуемый химическими связями молекул и отражение его геометрически. полярность молекулы определяется разностью электроотрицательности атомов, образующих двух центров связь, геометрических молекул, а также наличием не поделённых электронных пар не участвующих в образовании связи. полярность связи выражается через смешение электронной пары к более электроотрицательному атому и может быть выражено через дополнительный момент. ( )
1) Ковалентная связь – это наиболее общий вид химической связи. Возникает за счет обобществления электронной пары посредством двух механизмов:
- обменный механизм, когда каждый из взаимных атомов поставляет по одному электрону.
- донорно-акцепторный, в этом случае у одного атома имеется избыток пары электронов, которые передаются в общее пользование, этот атом называется донором другому атому, у которого имеются свободные или вакантные орбитали и это называется акцептор.
существуют два вида ковалентной связи: неполярная( наблюдается у гомо ядерных молекул); полярная связь (наблюдается у гетеро ядерных молекул, так какэлектроотрицательность атомов таких молекул различные).
2) ионная - это частный случай ковалентной связи и здесь образуется электронная пара полностью принадлежащая более электро отрицательному атому, который становится анионом. Раз этот атом становится анионом .
соединение с такой связи можно описывать в электростатическом приближении, считая, что ионная связь обусловлена притяжением положительных и отрицательных ионов.
взаимоотношения ионов противоположного знака не зависит от направления, а электростатический силы не обладаютсвойствами насыщаемости.для ионной связи характерно образование кристаллической решетки, тоесть ионом кристалле нет молекул. каждый ион окружен определенным числом ионов другого знака.
3) металлическая связь возникает результате частичной делаколизации валентных электронов, которые свободно движутся решетки металлов.при этом они взаимодействуют с положительно заряженными ионами металла, находящимся в узлах решетки.
4) водородная связь.образование такого вида связи обусловлена тем, что результате сильного смещение электронной пары электроотрицательному атому, атом водорода обладает эффективным положительным зарядом может легко взаимодействовать другим электро отрицательным атомом.
5) межмолекулярная химическая связь осуществляется между молекулами за счет бан-дер-вальсевых сил, тоесть слабые электростатические силы.
7. Три основных свойства ковалентной связи1)кроме поляризуемости ковалентная связь обладает свойством насыщаемости, то есть это способность атома образовывать столько ковалентных связей сколько у него имеется энергетический доступных атомных орбиталей.
3) свойства-направленность. ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей реагирующих атомов.
2) свойство – поляризуемость.
8. Образование π- и σ- связей (показать графически)
Алгебраическая сумма и линейная комбинация 2-х S-орбиталей
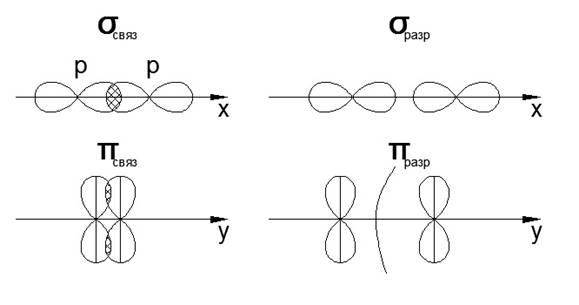
Алгебраическая сумма и линейная комбинация 2-х P-орбиталей
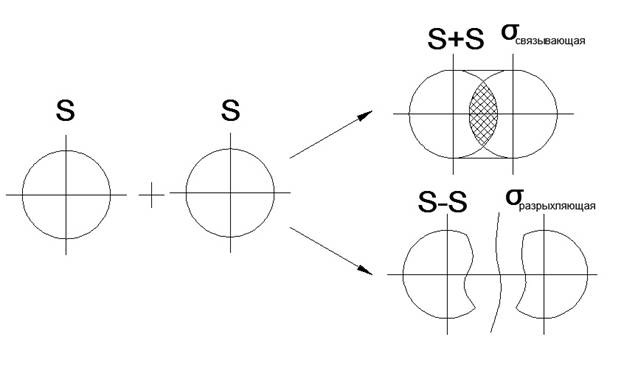
Распределение электронов по молекулярным орбиталям происходит в соответствии с принципом «минимум энергии», т.е. электронами заполняются орбитали, которые имеют минимум энергии и которые являются очень прочными (связывающие орбитали)
Переход электронов на молекулярные орбитали всегда способствует повышению энергии, и этот энергетический выигрыш равен энергии связи между атомами в молекуле
9. Метод молекулярных орбиталей.
ММО позволяет представить как происходит распределение электронов по молекулярным орбиталям.
В основе этого метода лежит представление о том, что все электроны данной молекулы или иона распределены по соответствующим молекулярным орбиталям. Описать молекулы по теории молекулярных орбиталей – это значит определить ее орбитали, их энергию и выяснить характер распределения электронов по орбиталям в порядке возрастания их энергии. Распределение электронов происходит в соответствии с принципом Паули и правилом Хунда, все молекулярные орбитали представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей.
Периодическая система в свете теории строения атома.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц, и периодический закон это подтверждает.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
Графическим изображением закона является периодическая система химических элементов.
Основные принципы построения периодической системы.
| Признак сравнения | Д.И.Менделеев | Современное состояние |
| 1. Как устанавливается последовательность элементов по номерам? (Что положено в основу п.с?) 2. Принцип объединения элементов в группы. 3. Принцип объединения элементов в периоды. | Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения. Качественный признак. Сходство свойств простых веществ и однотипных сложных. Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого. | Элементы расставлены по мере роста заряда ядер их атомов. Исключений нет. Количественный признак. Сходство строения внешней оболочки. Периодическая повторяемость структуры внешней оболочки обусловливает сходство химических свойств. Каждый новый период начинается с появления нового электронного слоя с одним электроном. А это всегда щелочной металл. |
Периодический закон в свете теории строения атомов.
| Понятие | физ. смысл | характеристика понятия |
| Заряд ядра Периодичность | Равен порядковому номеру элемента | Основная характеристика элемента, определяет химические свойства, так как с ростом заряда ядра увеличивается количество электронов в атоме, в том числе и на внешнем уровне. Следовательно, изменяются свойства С увеличением заряда ядра наблюдается периодическая повторяемость строения внешнего уровня, следовательно, периодически изменяются свойства. (Внешние электроны – валентные) |
Периодическая система в свете теории строения атома.
| Понятие | Физ. смысл | Характеристика понятия |
| Равен числу протонов в ядре. Равен числу электронов в атоме. Номер периода равен числу электронных оболочек Номер группы равен числу электронов на внешнем уровне (для элементов главных подгрупп) | Горизонтальный ряд элементов. 1,2,3 – малые; 4,5,6 – большие; 7 – незавершенный. В 1 периоде всего два элемента и больше быть не может. Это определяется формулой N = 2n 2 Каждый период начинается щелочным металлом и заканчивается инертным газом. Первые два элемента любого периода s - элементы, последние шесть р – элементы, между ними d - и f – элементы. В периоде слева направо: относит. атомная масса – увеличивается заряд ядра – увеличивается количество энерг. уровней – постоянно кол-во электронов на внеш.уровне - увеличивается радиус атомов – уменьшается электроотрицательность – увеличивается Следовательно, внешние электроны удерживаются сильнее, и металлические свойства ослабевают, а неметаллические усиливаются В малых периодах этот переход происходит через 8 элементов, в больших – через 18 или 32. В малых периодах валентность увеличивается от 1 до 7 один раз, в больших – два раза. В том месте, где происходит скачок в изменении высшей валентности, период делится на два рядя. От периода к периоду происходит резкий скачок в изменении свойств элементов, так как появляется новый энергетический уровень. Вертикальный ряд элементов. Каждая группа делится на две подгруппы: главную и побочную. Главную подгруппу составляют s – и р – элементы, побочную - d - и f – элементы. Подгруппы объединяют наиболее сходные между собой элементы. В группе, в главной подгруппе сверху вниз: относит. атомная масса – увеличивается число электронов на внеш. уровне – постоянно заряд ядра – увеличивается кол – во энерг. уровней – увеличивается радиус атомов - увеличивается электроотрицательность – уменьшается. Следовательно, внешние электроны удерживаются слабее, и металлические свойства элементов усиливаются, неметаллические - ослабевают. Элементы некоторых подгрупп имеют названия: 1а группа – щелочные металлы 2а – щелочноземельные металлы 6а – халькогены 7а – галогены 8а –инертные газы |
Выводы:
1. Чем меньше электронов на внешнем уровне и больше радиус атома, тем меньше электроотрицательность и легче отдавать внешние электроны, следовательно, тем сильнее выражены металлические свойства
2. Чем больше электронов на внешнем уровне и меньше радиус атома, тем больше электроотрицательность и тем легче принимать электроны, следовательно, тем сильнее неметаллические свойства.
3. Для металлов характерна отдача электронов, для неметаллов – прием.
Особое положение водорода в периодической системе.
Водород в периодической системе занимает две клетки (в одной из них заключен в скобки) – в 1 группе и в 7 – ой.
В первой группе водород стоит потому, что у него, как и у элементов первой группы, на внешнем уровне один электрон.
В седьмой группе водород стоит потому, что у него, как и у элементов седьмой группы, до завершения энергетического уровня не хватает одного электрона.
Все периоды начинаются щелочным металлом и заканчиваются инертным газом
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
.jpg)
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов

На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
.jpg)
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.

Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
.jpg)
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
.jpg)
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
.jpg)
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
.jpg)
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
.jpg)
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
.jpg)
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода

Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота

Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода

Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены

Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы

Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Попробовать бесплатно
Читайте также:
