Все щелочноземельные металлы горят в атмосфере кислорода образуя
Обновлено: 07.07.2024
Цель: дать общую характеристику металлов главной подгруппы II группы и рассмотреть их основные физические и химические свойства.
Образовательная: организовать деятельность учащихся по изучению строения, нахождения в природе, свойств, применению и биологической роли элементов II группы для организма человека.
Развивающая: создать условия для развития умений наблюдать химический эксперимент, анализировать, делать выводы; развитие познавательной активности и самостоятельности учащихся.
Воспитательная: создать условия для воспитания ценностного отношения к своему здоровью, развитие коммуникативных навыков.
Тип урока: Урок изучения нового материала.
Вид урока: комбинированный.
Формы организации учебной деятельности: фронтальная, индивидуальная работа.
Методы: объяснение материала, фронтальный опрос, демонстрация опытов, работа с таблицей и учебником. выполнение теста, самостоятельная работа, проблемный вопрос.
Оборудование: ПСХЭ Д.И.Менделеева, ИКТ, хим. стаканы, пробирки, штатив, лоток.
Вещества: Мg, Ca, H2 O , HCl (раствор), фенолфталеин.
I. Организационный момент
Здравствуйте ребята! Я очень рада видеть вас на уроке. Давайте мысленно друг другу пожелаем удачи. Перед вами лежит лист самооценки ( приложение 1), в котором на каждом этапе урока вы будете ставить себе баллы.
II . Актуализация знаний
Мы продолжаем с вами изучать тему "Металлы" и сегодня я хочу начать урок со слов
Эпиграф " Чем больше узнаешь, тем лучше понимаешь, как много тебе еще нужно узнать. "
Прежде, чем перейти к новой теме, давайте вспомним ( фронтальная работа с классом)
1.Элементы какой группы мы изучили? Как они называются и почему? Перечислите данные элементы.
2. Почему элементы I группы хранят как "кощееву смерть"?
3. Какими физическими свойствами обладают металлы I группы?
4. Все ли металлы I группы главной подгруппы вступают с кислородом в реакцию одинаково? Напишите уравнения реакций(работа у доски).
III . Переход к изучению нового материала
А теперь прослушайте стихотворение и ответьте: об элементах какой группы пойдет сегодня речь?
Мы идем за первой следом,
И валентность наша два,
Без стесненья, скажем смело-
О нас добрая молва.
Средь химического братства
Народ мы очень дружный.
С нами трудно состязаться,
Каждый из нас в жизни архиважный,
Каждый из нас в жизни архинужный!
Итак, тема нашего урока" Металлы II группы главной подгруппы". (Постановка целей и задач урока).
Как еще можно назвать элементы данной группы?
Все ли элементы II группы главной подгруппы являются щелочноземельными металлами? Почему?
IV. Изучение нового материала
Самостоятельная работа по ПСХЭ Д.И.Менделеева и учебнику.
Дайте характеристику элементам II группы по положению в ПСХЭ(перечисляют элементы главной подгруппы, строение внешнего энергетического уровня, высшая валентность ,изменение металлических свойств по группе, ЭО, радиус атома). А теперь проверьте себя по учебнику (стр.60 учебник Химия 9 класс О.С.Габриелян).
Как вы думаете, в природе данные металлы находятся в виде соединений или простых веществ? (только в соединениях, так как являются активными и поэтому их хранят также как и элементы I группы, кроме магния).

Слайд 1. Физические свойства металлов II группы
Видео: Окрашивание пламени ( DVD - диск " Металлы II группы главной подгруппы").
Живет обычно в керосине
И бегает он по воде
В природе, в комнате - отныне
Свободным нет его нигде
В солях открыть его возможно
Желтеет пламя от него
И получить из соли можно
Как Дэви получил его (Натрий )
Горит лиловым в кислороде
Свободным нет его в природе
Но соль находит примененье
Как для растений удобренья (Калий)
Металл я легкий, серебристый.
Сгораю даже очень быстро,
Сверкаю вспышкою огня.
(Фотограф раньше знал меня). (Магний)
Я, поверьте, не пустяк:
Без меня ни мел, ни мрамор
Не обходятся никак
Я построю вам скелет
Без меня опоры нет. (Кальций)
(учащиеся по ходу записывают уравнения реакций)
1. Горение магния на воздухе ( видео DVD - диск " Металлы II группы главной подгруппы").
2 Mg + O 2 =2 MgO (составление ОВР)
2. Взаимодействие с водой(дем. опыта)
Ве- практически не взаимодействует с водой, М g - реагирует медленно, остальные бурно. Поэтому Ве и М g не являются щелочноземельными металлами.
3. Взаимодействие с кислотами (дем. опыта)
4. Взаимодействие с неметаллами ( при обычной темпер.- О2, С l 2 , при температуре - S , N 2 , при повышенной темпер.- Н2)
5. Являются восстановителями редких металлов (магниетермия)
2 Mg + TiO 2 =2 MgO + Ti
А теперь поговорим с вами о здоровье. Здоровье человека зависит от наличия или отсутствия в организме некоторых металлов. В крови человека найдено 76 хим.элементов из них 62 металла.
К металлам - "элементам жизни" относятся 10 хим.элементов- K, Na, Mg, Ca , Fe , Mn , Co , Cu , Zn , Mo .
Выполнение теста ( у каждого учащегося)
"Щелочноземельные металлы"
Задание: выберите правильный ответ
1) Все элементы II группы главной подгруппы периодической системы относятся к.
а) типичным окислителям
б) переходным элементам
2) Атомы щелочноземельных элементов имеют.
а) по 1 электрону на внешнем уровне
б) по 2 электрону на внешнем уровне
в) полностью заполненный внешний уровень
3) Атомы щелочноземельных элементов имеют.
а) возможность терять два внешних электрона, образуя катион со степенью окисления +2
б) возможность терять единственный внешний электрон, образуя катион со степенью окисления +1
в) возможность приобретать один электрон на внешний уровень, образуя анион со степенью окисления -1
4) Радий, завершающий II группу, является.
а) очень твердым
б) самым распространенным в земной коре
5) Все s -металлы очень активны и поэтому.
а) хранятся в открытых банках
б) хранятся в воде
в) хранятся в керосине
6) Поскольку внешние электроны s - металлов легко переходят к другим элементам, все эти металлы являются.
а) типичными изоляторами
б) сильными восстановителями
7) Все щелочноземельные металлы горят в атмосфере кислорода, образуя.
а) оксиды состава МеО
б) гидроксиды состава Ме(ОН)2
в) оксиды состава Ме2О
8) При взаимодействии щелочноземельных металлов с водой образуются.
а) гидриды и кислород
б) гидроксиды и водород
в) пероксиды и водород
(самопроверка или взаимопроверка по готовым ответам)
VI . Подведение итога урока (ответы на поставленные учащимися цели и задачи урока).
Задание на дом: п.12 с.60-62 упр.5 с.67(объяснение)(слайд)
Дополнительное задание "Нигде нет покоя"
Когда Магний пришел в бар, там уже сидели: Кислород, Сера, Хлорид натрия в растворе, разбавленная Серная кислота и Гидроксид Меди( II ). Присутствие каких веществ испортило ему настроение? Почему? Подтвердите свой ответ уравнениями соответствующих реакций.
VII .Заполнение листа самооценки. Рефлексия "Выбор" (слайд).
Хочется закончить свой урок словами Веры Захаровой(слайд)
И у природы есть всему свой срок
И осени пора, и бурного цветенья
Но химии не кончится урок
Жизнь будет ее вечным продолжением!
Приложение 1
Лист самооценки деятельности учащегося
5 баллов - понимаю, выполняю все правильно, активно участвую в обсуждении вопросов;
4 балла - иногда затрудняюсь, допускаю ошибки, принимаю участие в обсуждении вопросов;
Тренажер задания 31 ЕГЭ по химии щелочноземельных металлов
Тренажер задания 31 из ЕГЭ по химии щелочноземельных металлов, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии щелочноземельных металлов с текстовыми решениями и ответами.
1. К нерастворимой в воде соли белого цвета, которая встречается в природе в виде широко используемого в строительстве и архитектуре минерала, прилили раствор соляной кислоты, в результате соль растворилась, и выделился газ, при пропускании которого через известковую воду выпал осадок белого цвета; осадок растворился при дальнейшем пропускании газа. При кипячении полученного раствора выпадает осадок. Напишите уравнения описанных реакций.
2. Кальций растворили в воде. При пропускании через полученный раствор сернистого газа образуется осадок белого цвета, который растворяется при пропускании избытка газа. Добавление к полученному раствору щелочи приводит к образованию осадка белого цвета. Напишите уравнения описанных реакций.
3. Раствор, полученный при пропускании сернистого газа через бромную воду, нейтрализовали гидроксидом бария. Выпавший осадок отделили, смешали с коксом и прокалили. При обработке продукта прокаливания хлороводородной кислотой выделился газ с запахом тухлых яиц. Напишите уравнения описанных реакций.
4. Кальций нагрели в атмосфере водорода. Продукт реакции обработали водой, выделяющийся газ пропустили над нагретым оксидом цинка, а в раствор добавили кальцинированную соду. Напишите уравнения описанных реакций.
5. Через баритовую воду пропускали углекислый газ. В полученный раствор добавили гидроксид бария, продукт реакции отделили и растворили в ортофосфорной кислоте.
Напишите уравнения описанных реакций.
6. Через раствор, полученный при гашении извести, пропустили газ, который образуется при получении негашеной извести из известняка; в результате выделяется белый осадок. При действии уксусной кислоты на полученный осадок выделяется тот же газ, который образуется при прокаливании карбоната кальция. Напишите уравнения описанных реакций.
7. Негашеную известь «погасили» водой. В полученный раствор пропустили газ, который выделяется при кальцинировании гидрокарбоната натрия, при этом наблюдали образование и последующее растворение осадка. Напишите уравнения описанных реакций.

8. Вещество, образующееся при сплавлении магния с кремнием, обработали водой, в результате образовался осадок и выделился бесцветный газ. Осадок растворили в соляной кислоте, а газ пропустили через раствор перманганата калия, при этом образовались два нерастворимых в воде бинарных вещества. Напишите уравнения описанных реакций.
9. Магниевую стружку нагрели в атмосфере азота и продукт реакции последовательно обработали кипящей водой, растворами серной кислоты и нитрата бария. Напишите уравнения описанных реакций
10. Негашеную известь прокалили с избытком кокса. Продукт реакции после обработки водой используется для поглощения сернистого и углекислого газов. Напишите уравнения описанных реакций.
CaO + 3C = CaC2 + CO
11. Магний нагрели в сосуде, наполненном газообразным аммиаком. Образовавшееся вещество растворили в концентрированном растворе бромоводородной кислоты, раствор выпарили и остаток нагрели до появления запаха, после чего добавили раствор щелочи. Напишите уравнения описанных реакций.

12. Магниевый порошок смешали с кремнием и нагрели. Продукт реакции обработали холодной водой и выделяющийся газ пропустили через горячую воду. Образовавшийся осадок отделили, смешали с едким натром и нагрели до плавления. Напишите уравнения описанных реакций.

13. Простое вещество, полученное при нагревании фосфата кальция с коксом и оксидом кремния, сплавили с металлическим кальцием. Продукт реакции обработали водой, а выделяющийся газ собрали и сожгли в избытке кислорода. Напишите уравнения описанных реакций.

14. Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.

15) Металлический кальций прокалили в атмосфере азота. Продукт реакции обработали водой, выделившийся при этом газ пропустили в раствор нитрата хрома (III). Выпавший в ходе процесса серо-зеленый осадок обработали щелочным раствором пероксида водорода. Напишите уравнения описанных реакций.
16) Смесь порошков нитрита калия и хлорида аммония растворили в воде и раствор осторожно нагрели. Выделившийся газ прореагировал с магнием. Продукт реакции внесли в избыток раствора соляной кислоты, при этом выделение газа не наблюдалось. Полученную магниевую соль в растворе обработали карбонатом натрия. Напишите уравнения описанных реакций.

17) Магний растворили в разбавленной азотной кислоте, причем выделение газа не наблюдалось. получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде. Напишите уравнения описанных реакций.

18) Нитрат натрия сплавили с оксидом хрома (III) в присутствии карбоната натрия. Выделившийся при этом газ прореагировал с избытком гидроксида кальция с выпадением осадка белого цвета. Осадок растворили в избытке раствора бромоводородной кислоты и в полученный раствор добавили раствор нитрата серебра до прекращения выпадения осад-ка. Напишите уравнения описанных реакций.
19) Фосфид кальция обработали соляной кислотой. Выделившийся газ сожгли в закрытом сосуде, продукт горения полностью нейтрализовали раствором гидроксида калия. К полученному раствору прилили раствор нитрата серебра. Напишите уравнения описанных реакций.
20) Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твердый продукт сжигания растворили в концентрированном растворе гидроксида цезия. Напишите уравнения описанных реакций.
SiO2 + 2Mg = 2MgO + Si
2Mg + Si = Mg2Si или
21) Магний нагрели в атмосфере азота. При добавлении к полученному веществу воды выделился газ, который пропустили над нагретым оксидом свинца (II). Полученное твердое вещество темного цвета растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
22) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ сначала пропустили над нагретым оксидом меди (II), а полученный газ пропустили через раствор гидроксида кальция до тех пор, пока первоначально выпавший осадок не растворился. Напишите уравнения описанных реакций.

CO + CuO = Cu + CO2
23) Барий растворили в воде. К полученному раствору добавили сульфат калия, выпавший осадок отфильтровали, после чего через горячий фильтрат пропустили газообразный хлор. Реакционную массу выпарили, а затем прокалили до образования одной соли. Напишите уравнения описанных реакций.
24) Магний растворили в разбавленной азотной кислоте. К полученному раствору последовательно добавили гидроксид натрия, бромоводородную кислоту, фосфат натрия. Напишите уравнения описанных реакций.
25) Барий растворили в разбавленной азотной кислоте, при этом выделился бесцветный газ – несолеобразующий оксид. Полученный раствор разделили на три части. Первую выпарили досуха, полученный осадок прокалили. Ко второй части добавили раствор сульфата натрия до прекращения выделения осадка; к третьей добавили раствор карбоната натрия. Напишите уравнения описанных реакций.
26) Сульфат бария сплавили с коксом. Твердый остаток растворили в соляной кислоте, выделившийся газ вступил в реакцию оксидом серы (IV), а раствор – с сульфитом натрия. Напишите уравнения описанных реакций.
Кислород: химия кислорода
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 2pАтом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
Оксиды металлов и неметаллов Na2O, SO2 и др.
Соли кислородсодержащих кислот
Кислородсодержащие органические вещества
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Все щелочноземельные металлы горят в атмосфере кислорода образуя
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
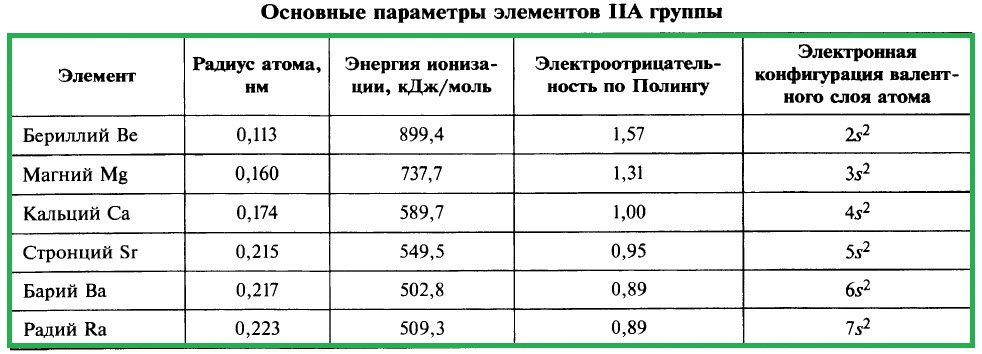
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.

- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
Природные соединения
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.

Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.

Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
